甘草酸对巨噬细胞抗绵羊肺炎支原体感染的调控作用研究
2019-06-25高力扬王巧辉裴佳瑞马泽华
高力扬,张 凯,王巧辉,裴佳瑞,马泽华,李 敏*
1宁夏大学生命科学学院 宁夏大学西部特色生物资源保护与利用教育部重点实验室;2宁夏大学新华学院,银川750021
绵羊肺炎支原体(Mycoplasmaovipneumoniae,MO)是引起绵羊、山羊传染性胸膜肺炎及增生性间质性肺炎的病原体,对宁夏滩羊养殖业危害较大。大环内酯类抗生素、泰乐菌素、红霉素及阿奇霉素等对绵羊支原体肺炎具有减缓病情的作用,但无法根治该病,而且易产生耐药性。以往研究发现支原体对机体有免疫抑制作用,主要体现在:促进巨噬细胞凋亡[1,2],影响炎症因子表达[3,4],抑制巨噬细胞自噬[5]。甘草酸提取于甘草根部,是甘草中最主要的活性成分,可溶于水,分子式为C42H62O16,可以水解为2分子葡萄糖醛酸和1分子甘草次酸。目前研究显示甘草提取物有抑菌能力[6,7],增强鸡巨噬细胞吞噬和清除胞内沙门氏菌的能力[8],对治疗病毒性肝炎[9]、抑制铜绿假单胞菌[10]、鸡混合艾美耳球虫感染的免疫调节有一定作用[11],而且可以抑制猪嗜血支原体对红细胞的黏附[12]。然而甘草酸对天然免疫细胞的影响尚不明确,因此本研究聚焦甘草酸在巨噬细胞抗MO感染中发挥的作用,为利用增强天然免疫的方式来预防绵羊支原体肺炎提供研究基础。
1 材料与方法
1.1 实验材料与仪器
胎牛血清购自全式金公司,高糖DMEM、胰酶、PBS购自Hyclone公司;青霉素-链霉素双抗、马血清购自Solarbio公司;CCK-8细胞活性检测试剂盒、细胞周期与细胞凋亡检测试剂盒购自碧云天公司;mRNA提取试剂盒购自OMEGA公司;凋亡及自噬相关基因引物由Sangon Biotech公司合成;Real-time PCR相关试剂盒购自TaKaRa公司;Bad抗体、Bax抗体、肿瘤坏死因子(TNF-α)ELISA检测试剂盒、Western Blot显色剂、DMSO、NanoDrop 8000设备、QuantStudio 5设备购自Thermo Fisher公司;GAPDH购自北京义翘神州科技有限公司;支原体培养基基础、支原体肉汤培养基购自青岛海博生物技术有限公司;甘草酸使用PBS配制为12、1.2、120、12 μM浓度。全波段酶标仪购自美国BIO-RAD公司;CO2细胞培养箱购自日本SANYO公司;多模式微孔板检测仪购自PerkinElmer公司;流式细胞仪购自德国Sysmex公司。
1.2 甘草酸的配制
称取甘草酸粉末溶于温PBS中,涡旋震荡溶解后用0.22 μm的过滤器过滤,配制成终浓度为120 mM的甘草酸储存液,4 ℃保存。
1.3 实验分组
本实验一共分为对照组、甘草酸处理组、MO感染组、甘草酸/MO感染组。其中对照组及MO感染组分别加入与甘草酸处理组、甘草酸/MO感染组稀释前甘草酸储存液相同体积的PBS缓冲液作为参照。
1.4 细胞培养
小鼠腹腔巨噬细胞RAW264.7采用含10%胎牛血清和1%青霉素/链霉素混合液的高糖DMEM培养液于37 ℃,5% CO2培养箱中培养。1~2天进行传代处理,取生长状态良好的细胞进行后续实验。
1.5 CCK-8细胞活性检测
接种2 000~5 000个细胞悬浮于100 μL培养基中,接种于96孔板中,置于37 ℃,5% CO2培养箱中培养24 h,每孔加入10 μL CCK-8检测试剂,于培养箱内孵育1~4 h后用全波段酶标仪450 nm波长处测定吸光值。
1.6 Western blot
将各个分组中细胞裂解后采用BCA蛋白定量检测试剂盒检测蛋白浓度,配平后加入蛋白上样缓冲液金属浴100 ℃保持5 min。Bad、Bax、GAPDH一抗1∶1 000稀释,4 ℃下孵育12 h,二抗1∶10 000稀释后室温下孵育2 h后上机检测。
1.7 Real-time PCR
将各个分组中细胞裂解后采用mRNA提取试剂盒对细胞mRNA进行提取, NanoDrop 8 000进行浓度测定后利用反转录试剂盒反转录获取cDNA,按照TaKaRa Real-time PCR试剂盒说明利用QuantStudio 5设备对凋亡及自噬相关基因表达量进行测定。
1.8 ELISA
取各个分组细胞培养上清用于ELISA检测,TNF-α检测步骤参照试剂盒内说明书,酶标仪读取450 nm处OD值。
1.9 细胞周期检测
实验分为2组,分别为对照组和甘草酸处理组,培养24 h后收集细胞于1 mL预冷的70%乙醇中-20 ℃固定一夜。采用细胞周期与细胞凋亡检测试剂盒处理两组细胞,然后用流式细胞仪检测细胞周期。

表1 Real-time qPCR引物序列Table 1 The Real-time qPCR primer sequences
1.10 MO培养
支原体培养基基础33 g溶解于1 L蒸馏水中,高压后冷却至室温,加入20%马血清、80万单位氨苄青霉素、1%醋酸铊10 mL,充分混匀后分装于50 mL离心管中,置于-20 ℃冰箱保存。Y98标准株培养于37 ℃,5% CO2培养箱中,待培养基颜色由红色变为橙黄色(pH6.8)左右时1∶5传代培养。MO浓度采用颜色变化单位测定法(colour change unit,CCU)计算,即十倍梯度稀释MO菌液后观察MO培养基颜色变化,以最后发生颜色改变的稀释倍数为待检的MO菌液的CCU。
1.11 甘草酸处理RAW264.7
将预先配置好的甘草酸储存液用新鲜的细胞培养液稀释到合适浓度,然后用稀释好的甘草酸对待处理细胞进行换液处理,空白对照组将所用甘草酸储存液相应体积的PBS用新鲜培养液进行同比稀释处理并对待处理细胞进行换液。
1.12 MO侵染RAW264.7
RAW264.7细胞对数生长时,以5×106的密度接种于10 cm细胞培养皿中,待细胞贴壁且生长状态良好,12 000 rpm,10 min离心收集MO并用新鲜细胞培养液将MO重悬后按感染复数MOI=10∶1加入待感染的细胞,并置于37 ℃,5% CO2培养箱中培养24 h后分别提取各个分组细胞的总蛋白及总mRNA进行后续实验。
1.13 统计学分析
统计学软件采用GraphPad Prism 7.04,两组数据之间采用T tests非参数检验法统计,三组及三组以上数据采用单因素方差分析法进行统计学分析。
2 结果
2.1 甘草酸对巨噬细胞RAW264.7的毒性检测
为了验证不同浓度甘草酸对巨噬细胞活性的影响,我们采用12、1.2、120、12 μM浓度的甘草酸-PBS溶液处理RAW264.7细胞,培养24 h后用CCK-8法检测细胞活性(图1)。结果显示与对照组相比浓度为120、12 μM的甘草酸显著提高RAW 264.7巨噬细胞活性(P<0.000 1,P=0.012 9);而12、1.2 mM高浓度甘草酸与对照组相比显著抑制RAW264.7巨噬细胞存活(P<0.000 1)。因此本实验采用最小浓度12 μM甘草酸溶液处理细胞。
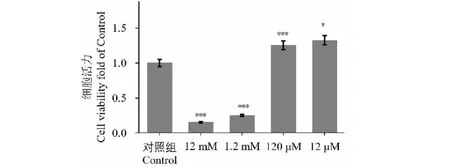
图1 筛选适合RAW264.7巨噬细胞的甘草酸处理浓度Fig.1 Optimal concentation for glycyrrhizic acid to treat RAW264.7 macrophages.注:(120 μmol/L)*** P <0.000 1 vs对照组;(12 μmol/L) * P=0.012 9 vs对照组;(12 mmol/L、1.2 mmol/L) *** P <0.000 1 vs对照组。Note:(120 μmol/L)*** P <0.000 1 vs Control;(12 μmol/L) * P=0.012 9 vs Control;(12 mmol/L、1.2 mmol/L) *** P <0.000 1 vs Control.
2.2 甘草酸对RAW 264.7巨噬细胞细胞周期的影响
图2为流式细胞仪检测甘草酸处理前后RAW264.7巨噬细胞周期,结果显示:与未处理组相比甘草酸处理后,处于G1期的细胞数量减少,S期细胞数量减少,G2期细胞数量增加。
2.3 甘草酸对受MO感染的RAW 264.7巨噬细胞细胞活性的影响
取CCU浓度为1×107生长良好的MO,按照 MOI值为10∶1感染RAW264.7细胞。实验分为无感染对照组,MO感染组,经甘草酸处理的MO感染组,分别培养24 h后检测细胞活性。结果显示与对照组相比24 h内MO没有显著抑制RAW264.7的生长(P=0.659 4),加入甘草酸组中RAW264.7巨噬细胞增殖显著增加(P=0.021 7,图3)。
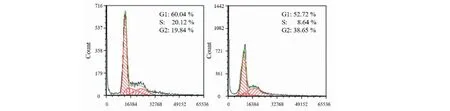
图2 甘草酸处理前后巨噬细胞周期。Fig.2 Cell cycle in non-treated and glycyrrhizic acid treated macrophages注:左侧为未处理组,右侧为甘草酸处理组。Note:The left side is the untreated group,and the right side is the glycyrrhizic acid treated group.
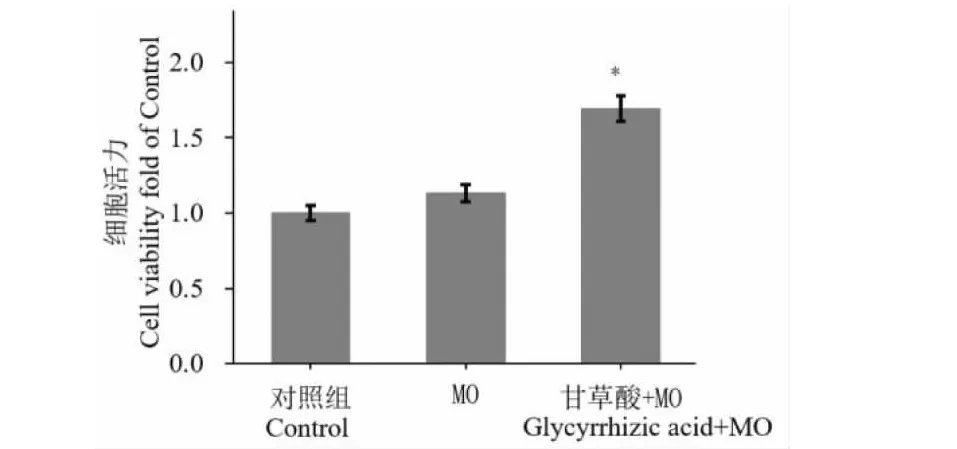
图3 甘草酸对受MO感染的RAW264.7巨噬细胞活性的影响。Fig.3 Effect of glycyrrhizic acid on cell viability of MO-infected RAW264.7 macrophages注:P=0.659 4 MO感染组 vs对照组; *P=0.021 7 甘草酸+MO组vs对照组。Note:P=0.659 4 MO treated vs Control; *P=0.021 7 glycyrrhizic acid+MO treated vs Control.
2.4 甘草酸调控MO感染后巨噬细胞中TNF-α的分泌
为了验证甘草酸对巨噬细胞炎症因子分泌的影响,本实验采用ELISA分析巨噬细胞上清液中的TNF-α的表达量(图4)。结果显示与对照组相比MO感染后巨噬细胞TNF-α的表达量显著下降(P<0.000 1),而正常巨噬细胞在甘草酸处理后TNF-α的表达量也会显著降低(P=0.009 7),但加入甘草酸的巨噬细胞被MO感染后,细胞上清中TNF-α表达量有所上升(P<0.05)。
2.5 甘草酸对受MO感染后巨噬细胞凋亡相关基因的表达的影响
为了研究MO对巨噬细胞凋亡的影响,以及甘草酸在此过程中的作用,本实验采用Real-time PCR法检测凋亡相关基因caspase 3、caspase 8、caspase 9的表达情况(图5)。结果显示,与Control组相比巨噬细胞中凋亡相关基因caspase 3的表达在MO感染后上调(P<0.000 1),caspase 8无显著变化(P=0.347 9),caspase 9表达量下调(P<0.000 1)。与MO组相比受MO感染的巨噬细胞中经甘草酸处理后caspase 3、caspase 8的表达量均显著下调(P<0.000 1),caspase 9则无显著变化(P=0.424 6)。
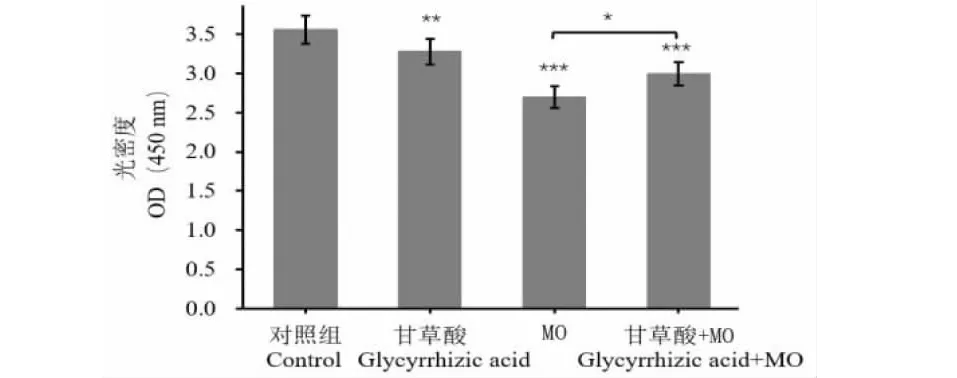
图4 巨噬细胞培养上清中TNF-α的分泌Fig.4 Secretion of TNF-α in macrophage culture supernatant注: ***P <0.000 1 MO感染组 vs对照组;**P =0.009 7甘 草酸组 vs对照组;*P <0.05 MO感染组vs甘草酸+MO组。Note: ***P <0.000 1 MO treated vs Control;**P =0.009 7 glycyrrhizic acid treated vs Control; *P <0.05 MO treated vs glycyrrhizic acid+MO treated.
2.6 甘草酸对受MO感染后巨噬细胞凋亡相关蛋白的表达的影响
为了进一步研究MO对巨噬细胞凋亡的影响,以及甘草酸在此过程中的作用,本实验采用Western blot法检测凋亡蛋白Bax、Bad的表达情况(图6)。结果显示,与对照组相比巨噬细胞中促凋亡蛋白Bax的表达在MO感染后上调,而加入甘草酸处理不会引起正常巨噬细胞Bax蛋白的表达,但在受MO感染的巨噬细胞中,甘草酸不能改善MO引起的巨噬细胞Bax蛋白表达(P= 0.076 3)。Bad蛋白在正常巨噬细胞中弱表达,在MO处理组中无表达,但甘草酸处理组表达量较高(P<0.000 1)。

图5 凋亡相关基因在巨噬细胞中的表达情况。Fig.5 Expression of apoptosis-related genes in macrophages.注:(Caspase 3)***P <0.000 1;(Caspase 8)P =0.347 9;(Caspase 9)****P <0.000 1 MO组vs Control。 (Caspase 3、Caspase 8)****P <0.000 1;(Caspase 9)P =0.424 6 MO/甘草组vs MO组。Note:(Caspase 3)***P <0.000 1;(Caspase 8)P =0.347 9;(Caspase 9)****P <0.000 1 MO treated vs Control.(Caspase 3、Caspase 8)****P <0.000 1;(Caspase 9)P =0.424 6 MO/ glycyrrhizic acid treated vs MO treated.
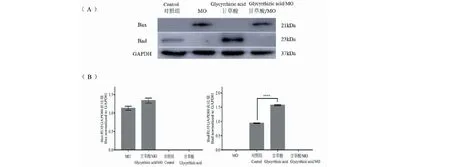
图6 促凋亡因子在巨噬细胞中的表达情况。Fig.6 Expression of pro-apoptotic factors in macrophages.(A) images of Western blot results.(B) quanlitative analysis of bands by ImageJ software.注:(Bax)P = 0.076 3 MO组 vs甘草酸/MO组;(Bad)****P <0.000 1 对照组vs甘草酸。Note:(Bax)P = 0.076 3 MO treated vs MO/ glycyrrhizic acid treated;(Bad)****P <0.000 1 Control vs glycyrrhizic acid treated.
2.7 甘草酸对受MO感染后巨噬细胞自噬相关基因的表达的影响
为了研究MO对巨噬细胞自噬的影响,以及甘草酸在此过程中的作用,本实验采用Real-time PCR法检测自噬相关基因Atg 7、Beclin 1的表达情况(图7)。结果显示,与Control组相比受MO感染的巨噬细胞中经甘草酸处理后自噬相关基因Atg 7的表达量显著上调(P<0.000 1),Beclin 1表达量显著上调(P=0.001 6);与MO组相比MO/甘草酸组自噬相关基因Atg 7、Beclin 1的表达量均显著上调(P<0.000 1)。
3 讨论
研究结果显示,高浓度甘草酸溶液对细胞有抑制作用,但12 μmol/L甘草酸溶液可以促进RAW264.7巨噬细胞增殖。以往研究发现支原体感染可使巨噬细胞活力下降,感染后期巨噬细胞凋亡,从而破坏宿主免疫系统对原发感染和继发感染的控制,使得炎症得以扩散和蔓延[13]。甘草酸处理后细胞周期G1期、S期细胞数量减少,而进入G2期的细胞数量增加,结合细胞增殖检测,提示甘草酸可能通过调节细胞周期来促进巨噬细胞的细胞增殖,从而对巨噬细胞抗MO感染有一定积极作用。在细胞凋亡方面,caspase半胱氨酸蛋白酶家族引发的级联反应是介导细胞凋亡的中心环节,通过选择性地切割某些蛋白质使靶蛋白活化或失活,从而介导下游的细胞凋亡过程[14,15]。本实验验证了caspase家族的重要成员caspase 3,caspase 8,caspase 9在甘草酸参与的巨噬细胞应对MO感染中的作用。实验发现甘草酸可以抑制凋亡基因caspase 3、caspase 8、caspase 9在正常巨噬细胞中的表达。 蛋白检测发现促凋亡因子Bax表达在正常组和甘草酸处理组均无明显表达,而在MO处理后表达量明显升高,提示MO感染可能会引起巨噬细胞凋亡。实验结果提示甘草酸处理可以减少巨噬细胞凋亡因子的表达,从而增加MO处理后的巨噬细胞活性。

图7 自噬相关基因在巨噬细胞中的表达情况Fig.7 Expression of autophagy-related genes in macrophages注:(Atg 7)****P<0.000 1;(Beclin 1)**P =0.001 6 MO/甘草酸组 vs Control。(Atg 7、Beclin 1) ****P<0.000 1 MO/甘草酸组 vs MO组。Note:(Atg 7)****P<0.000 1;(Beclin 1)**P =0.001 6 MO/ glycyrrhizic acid treated vs Control.(Atg 7、Beclin 1) ****P<0.000 1 MO/ glycyrrhizic acid treated vs MO treated.
本课题组前期研究发现,MO可能通过抑制巨噬细胞自噬而减少巨噬细胞对MO的清除[5]。Bad蛋白在促凋亡和激活自噬中均发挥作用,本实验中Bad在正常组中表达,在甘草酸处理组中高表达,而在MO感染组中均无表达,提示甘草酸可能在激活巨噬细胞自噬中发挥作用。因此本实验对自噬相关基因进行验证。自噬基因Beclin 1 和Atg 7表达变化说明,正常情况下甘草酸处理和甘草酸处理后经MO感染情况下,都可以引起自噬相关蛋白编码基因的高表达,结果提示甘草酸可能对巨噬细胞自噬有一定正向调控作用。
巨噬细胞可吞噬病原微生物,放大炎症信号,并通过抗原递呈调节T细胞应答参与获得性免疫应答[16,17]。 TNF-α主要由活化的巨噬细胞产生,可以诱导T细胞及NK细胞增殖活化[18,19],及促进单核细胞白血病细胞U937向巨噬细胞分化[20],而且TNF-α能有效刺激肺泡上皮细胞A549产生过度炎症反应[21]。本实验发现MO可以抑制巨噬细胞分泌TNF-α,可能是MO对巨噬细胞免疫抑制的一个体现。然而甘草酸处理过的巨噬细胞在受到MO感染后,其TNF-α分泌量显著回升。
综上所述,甘草酸可以抑制受MO感染后巨噬细胞的凋亡,并且可以增加巨噬细胞增殖,而且甘草酸可以促进受MO感染的巨噬细胞分泌炎症因子TNF-α,除此之外,甘草酸可能通过对巨噬细胞自噬产生激活作用,从而在消除MO感染中发挥作用。
