长春西汀注射液减轻脂多糖诱导的大鼠急性肺损伤*
2017-08-07叶永顺
叶永顺, 刘 华
(广东药科大学附属第一医院内二科, 广东 广州 510080)
长春西汀注射液减轻脂多糖诱导的大鼠急性肺损伤*
叶永顺, 刘 华△
(广东药科大学附属第一医院内二科, 广东 广州 510080)
目的: 观察长春西汀注射液对脂多糖(lipopolysaccharide,LPS)诱导大鼠急性肺损伤(acute lung injury,ALI)的作用,并研究初步的作用机制。方法:雄性Wistar大鼠50只,随机分为正常对照组(control)、模型组(ALI组)以及长春西汀低剂量组、中剂量组和高剂量组,每组10只。正常对照组股静脉注射0.9%氯化钠注射液(5 mL/kg);模型组股静脉注射LPS 10 mg/kg;长春西汀低、中和高剂量组股静脉注射LPS 10 mg/kg,30 min后分别腹腔注射长春西汀注射液0.2 mg/kg、0.7 mg/kg和1.2 mg/kg。伊红染色观察肺部组织病理学切片,TUNEL法检测肺组织的细胞凋亡,分光光度法检测并计算肺组织髓过氧化物酶(MPO)活性,Western blot法检测肺组织中NF-κB、ICAM-1、VCAM-1、Bax与Bcl-2的蛋白水平。结果:与模型组相比,采用长春西汀给药后,明显减轻急性肺损伤的肺组织结构损伤与炎性细胞浸润,降低肺组织凋亡的细胞数与MPO活性,下调细胞中NF-κB、ICAM-1、VCAM-1与Bax的蛋白表达水平,上调Bcl-2的蛋白表达水平。结论:长春西汀注射液对急性肺损伤大鼠的肺组织具有保护作用,可能与降低肺组织中MPO活性,以及调控NF-κB、ICAM-1、VCAM-1、Bax与Bcl-2蛋白表达水平有关。
长春西汀注射液; 脂多糖; 急性肺损伤
急性肺损伤(acute lung injury,ALI)是急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的早期阶段,是由直接或间接原因导致的肺泡上皮细胞和内皮细胞的损伤[1]。临床上主要表现为严重呼吸窘迫和低氧血症,死亡率高达30%~40%[2]。目前主要的治疗策略包括遏制全身炎症反应,呼吸支持治疗与糖皮质激素等,但未能有效地降低死亡率。因此,需要进一步研究能有效降低急性肺损伤死亡率的治疗方法与有效药物。
长春西汀(vinpocetine,Vin),也称为阿朴长春胺酸乙酯,由Gedeon Richter研发,目前主要的临床应用是治疗缺血性中风和其它由脑血管病变引起的疾病[3]。国外学者研究发现,长春西汀具有抗炎作用,能抑制血管平滑肌细胞、内皮细胞、巨噬细胞和上皮细胞中肿瘤坏死因子α诱导的核因子κB(nuclear factor-κB, NF-κB)活化,进一步抑制炎症因子的活化等[4]。由此,我们通过用注射脂多糖建立急性肺损伤大鼠模型,观察长春西汀注射液对急性肺损伤大鼠的肺组织保护作用,并探讨其初步机制。
材 料 和 方 法
健康雄性Wistar大鼠50只,SPF级,体重180~220 g,购自南方医科大学实验动物中心,实验动物许可证号为SCXK 粤2014-0012,进行适应性饲养1周,术前12 h禁食,不禁水。
长春西汀注射液购自河南润弘制药股份有限公司;TUNEL试剂盒购自Sigma-Aldrich;抗NF-κB、细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)与血管细胞黏附分子1(vascular cellular adhesion molecule-1,VCAM-1)抗体购自Santa Cruz;抗Bax与Bcl-2抗体购自碧云天技术公司。
2 实验方法
2.1 实验动物的分组与建模 将大鼠随机分为5组(每组10只):正常对照(control)组、模型组(ALI组)以及长春西汀低剂量组(Vin-L组)、中剂量组(Vin-M组)和高剂量组(Vin-H组)。腹腔注射3%戊巴比妥钠麻醉(50 mg/kg),正常对照组股静脉注射0.9%氯化钠注射液(5 mL/kg);模型组股静脉注射LPS 10 mg/kg;长春西汀低、中和高剂量组股静脉注射LPS 10 mg/kg,30 min后分别腹腔注射长春西汀注射液0.2 mg/kg、0.7 mg/kg和1.2 mg/kg。若实验大鼠出现呼吸频率加快,皮肤发绀,提示脂多糖诱导的急性肺损伤模型建立成功[5]。
2.2 标本采集 给药6 h后,经颈部正中切开皮肤,暴露右颈总动脉,颈动脉放血处死,开胸,取出左肺立刻置于液氮中低温保存,取出右肺中叶用10%多聚甲醛固定,备用。
2.3 病理学检查 将右肺中叶固定后,用石蜡包埋后切片,厚度约4 μm,分别加入二甲苯I、II,再依次浸入梯度乙醇,蒸馏水浸洗5 min×2次,甩干水分,用苏木精染色15 min,自来水冲洗,1%盐酸乙醇分化,蒸馏水冲洗,1%伊红溶液染色3 min,梯度乙醇浸洗,二甲苯I、II液各5 min,中性树胶封片,显微镜下观察。
2.4 TUNEL法检测细胞凋亡 将右肺中叶依次放入二甲苯I、II液各15 min,依次放入梯度乙醇各5 min,水化,PBS浸泡3 min,加入蛋白酶K处理30 min,洗涤,浸泡于3%双氧水甲醇溶液,PBS洗涤,滴加TUNEL染色液1与2混合液反应30 min,置于荧光显微镜下观察。
2.5 肺组织髓过氧化物酶(myeloperoxidase,MPO)活性的检测 冻存的肺组织100 mg,加入4 mL磷酸钾缓冲液,冰浴中匀浆,4 ℃、12 000 r/min离心30 min,沉淀加入4 mL含0.5% HTAB的磷酸钾缓冲液,重悬,超声,60 ℃水浴1 h,4 ℃、18 000 r/min离心10 min,取0.1 mL上清液,加入含盐酸邻联茴香胺与过氧化氢的磷酸钾缓冲液2.9 mL,25 ℃、460 nm波长下分光光度计测吸光度变化值,计算MPO活性。
采用马铃薯培养基[19],分别接种10-5、 10-6、10-7、10-8四个稀释梯度的悬浮液,将接种好的培养皿于25 ℃培养72 h后进行霉菌计数。计数时选取培养基上菌丝细长,菌落疏松呈绒毛状面絮状的菌落进行计数。
2.6 Western blot法检测蛋白的表达 取冻存的肺组织,用干净剪刀剪碎,玻璃匀浆器冰上匀浆,加入裂解液裂解30 min,将裂解液移至离心管中,4 ℃、12 000 r/min离心5 min,取上清液进行蛋白定量,进行SDS-PAGE分离蛋白,电泳完成后,转移至硝酸纤维素膜,加入封闭液中室温孵育1 h,加入 I 抗4 ℃孵育过夜,TBST洗涤2次,加入相应 II 抗室温孵育1 h,TBST洗涤2次,化学发光法显色,将胶片进行扫描,用凝胶图像处理系统分析目标条带。
3 统计学处理
计量资料以均数±标准差(mean±SD)表示,用SPSS 15.0统计软件进行分析,多组间差异采用单因素方差分析(one-way ANOVA),各组均数间的多重比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 肺组织病理学检查
正常对照组大鼠的肺组织结构完整,肺泡间隔无水肿,无炎性细胞浸润;模型组和长春西汀低、中、高剂量组大鼠的肺组织均出现明显的损伤;模型组大鼠的肺组织损伤明显,出现大量炎性细胞浸润,肺泡结构不完整;采用长春西汀给药后,肺泡结构略显完整,并随药物浓度升高,炎性细胞浸润逐渐减少,见图1。
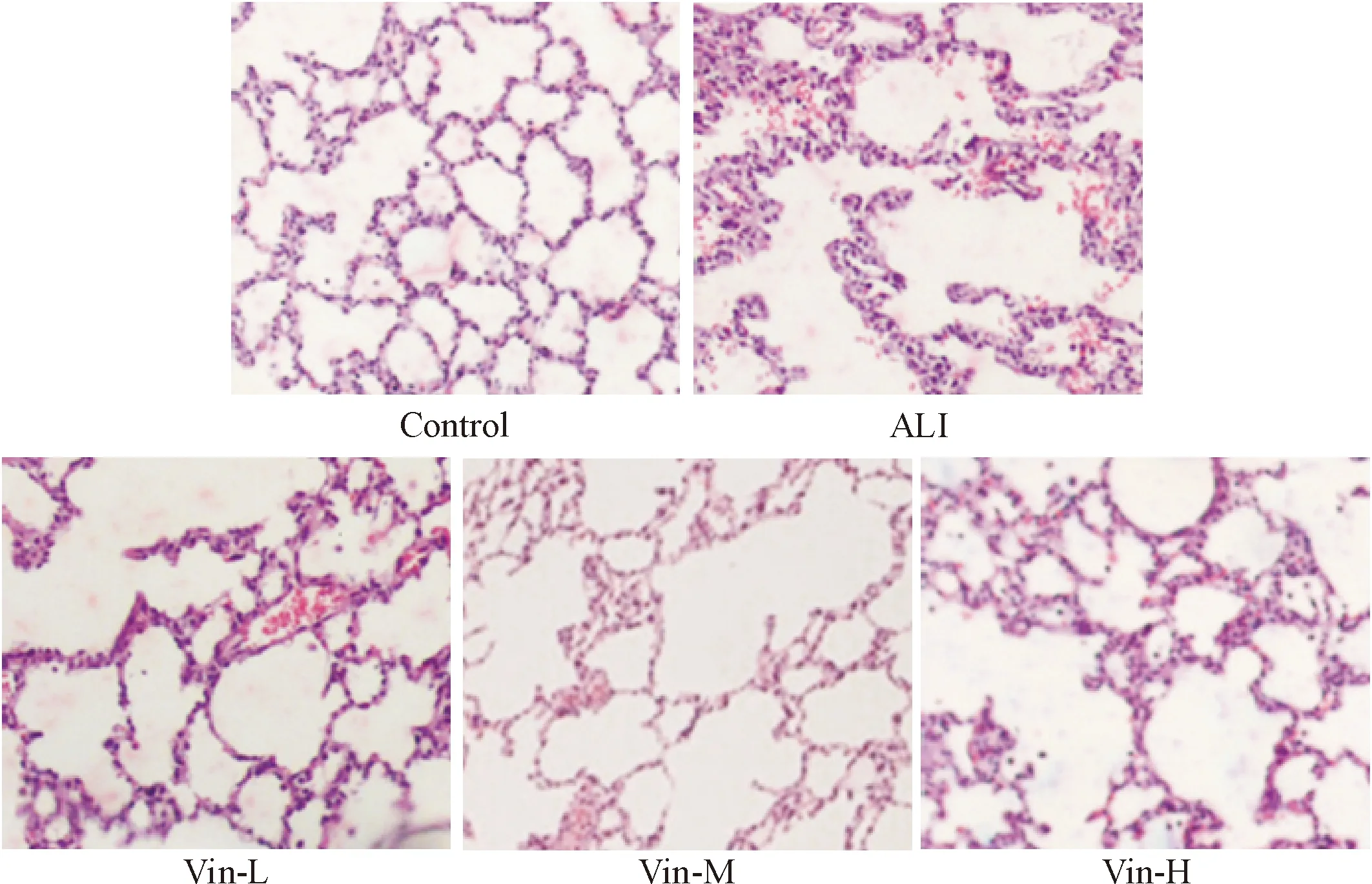
Figure 1.The effect of vinpocetine on the pathological changes of the lung tissues from the rats with ALI (HE staining, ×200).
图1 长春西汀对急性肺损伤肺组织的病理学影响
2 肺组织中细胞的凋亡检测
与正常对照组相比,在脂多糖的刺激下,模型组大鼠肺组织可见明显的凋亡细胞;与模型组相比,长春西汀给药组的肺组织凋亡细胞数随药物浓度升高而逐渐下降,见图2。
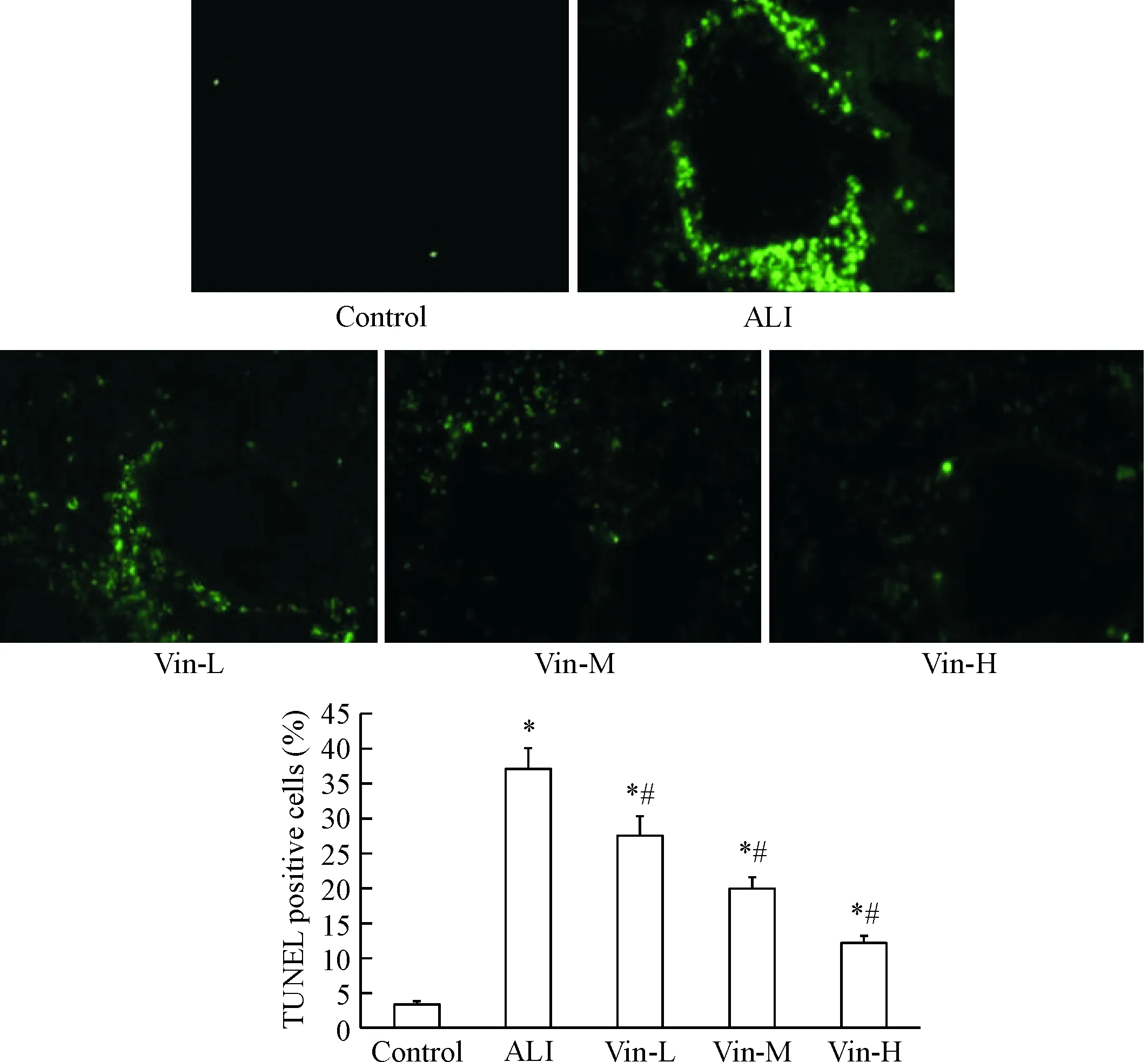
Figure 2.The effect of vinpocetine on the cell apoptosis in the lung tissues (TUNEL staining, ×400). Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsALI group.
图2 长春西汀对肺组织细胞凋亡的影响
3 肺组织中MPO活性的检测
与正常对照组相比,模型组大鼠肺组织中MPO活性明显增加(P<0.05);与模型组相比,长春西汀低、中与高剂量组的肺组织中MPO活性明显降低(P<0.05),见图3。
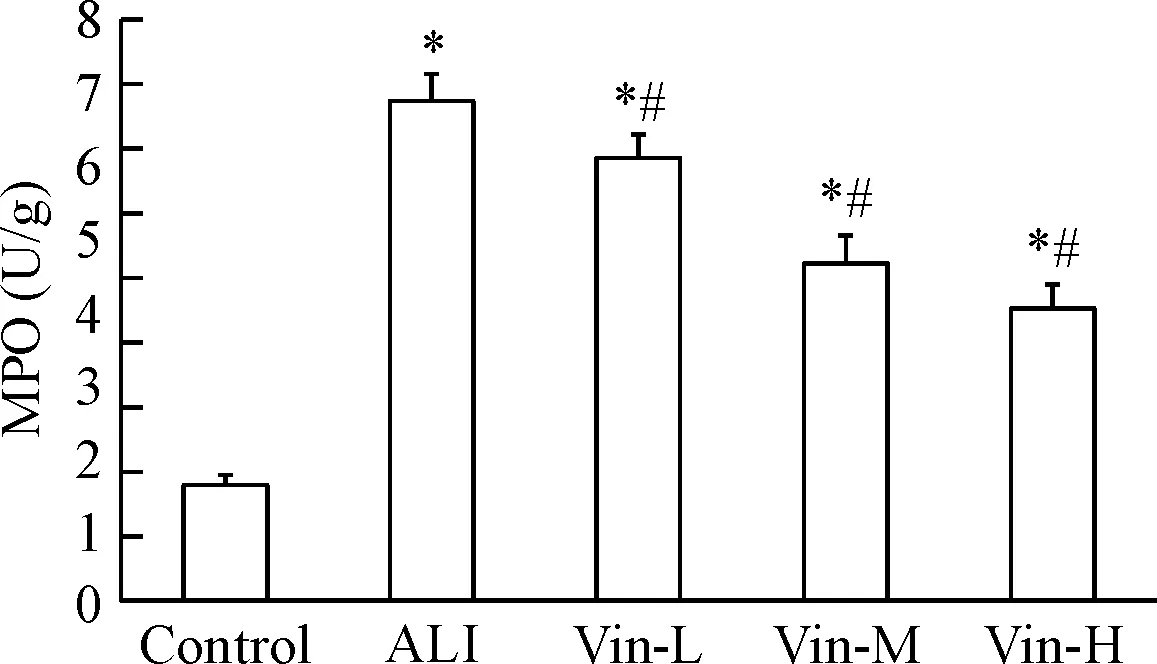
Figure 3.The effect of vinpocetine on the MPO activity in the lung tissues. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsALI group.
图3 长春西汀对肺组织中MPO活性的影响
4 肺组织中NF-κB、ICAM-1和VCAM-1蛋白表达的变化
与正常对照组相比,模型组的NF-κB、ICAM-1与VCAM-1的蛋白表达显著上升(P<0.05),与模型组相比,采用长春西汀给药后,肺组织中NF-κB、ICAM-1与VCAM-1的蛋白表达明显下降,随药物浓度上升而下降幅度增大,见图4。
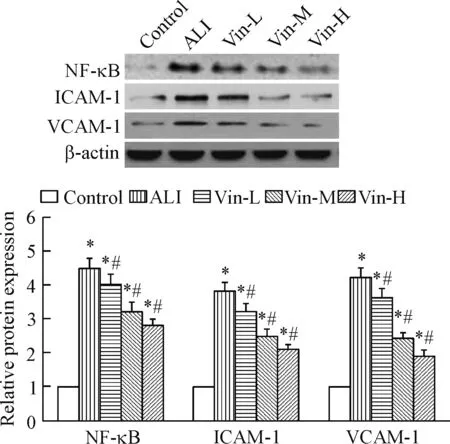
Figure 4.The effect of vinpocetine on the protein expression of NF-κB, ICAM-1 and VCAM-1 in the lung tissues. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsALI group.
图4 长春西汀对肺组织中NF-κB、ICAM-1和VCAM-1蛋白表达的影响
5 Bax与Bcl-2蛋白表达的变化
与正常对照组相比,模型组的Bcl-2蛋白表达显著下降,Bax蛋白表达显著升高(P<0.05);与模型组相比,采用长春西汀给药后,Bcl-2的蛋白表达明显升高,Bax的表达明显下降(P<0.05),高剂量组的变化幅度最大(P<0.05),见图5。
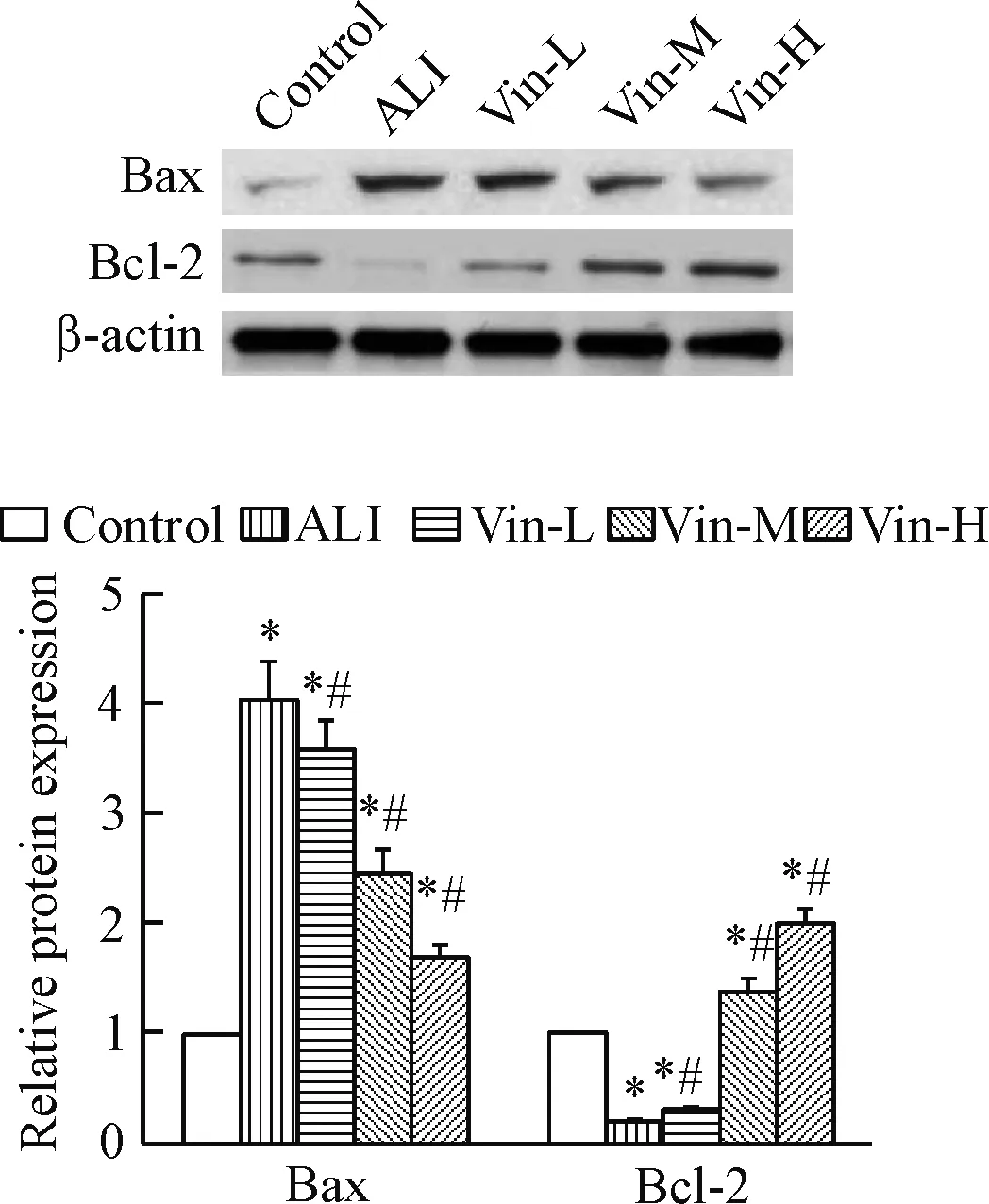
Figure 5.The effect of vinpocetine on the protein expression of Bax and Bcl-2 in the lung tissues. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsALI group.
图5 长春西汀对肺组织中Bax与Bcl-2蛋白表达的影响
讨 论
肺组织炎症和肺水肿是急性肺损伤的主要病理特征,病理学主要显示为肺泡结构破坏,肺泡腔中出现大量炎性细胞浸润,本实验结果提示长春西汀能够改善急性肺损伤的肺泡结构损伤,并降低炎性细胞的浸润。中性粒细胞被激活后,释放活性氧簇(reactive oxygen species,ROS)、花生四烯酸代谢产物等有毒物质,使肺毛细血管内皮和肺泡上皮实质细胞损伤[6-7],研究表明降低中性粒细胞含量后,能够改善急性肺损伤的肺损伤程度[8-9]。MPO是中性粒细胞溶酶体的特征酶,测定MPO的活性可以间接反映中性粒细胞在组织中的聚集程度,本实验结果显示急性肺损伤大鼠肺组织中MPO活性较高,而采用长春西汀给药的大鼠肺组织中MPO活性显著下降,提示长春西汀能够降低中性粒细胞在肺组织的聚集。
NF-κB是广泛存在于细胞的一种转录因子,在炎症反应和细胞凋亡中发挥非常重要的作用。当细胞受到刺激时,如细菌脂多糖等,NF-κB进入细胞核内,与下游的细胞因子和炎症介质基因的识别位点结合,进一步调控细胞因子和炎症介质基因的表达[10]。黏附分子存在于细胞表面,作为介导细胞与细胞间、细胞与基质相互结合的细胞表面受体,主要参与细胞的识别、活化和信号转导,在免疫应答和炎症发生等方面具有重要作用[11]。VCAM-1通过调控单核细胞、淋巴细胞和嗜酸性粒细胞黏附至血管内皮表面,从而促使白细胞向炎症部位聚集,导致血管内皮细胞受损。ICAM-1介导细胞间的黏附,促使相关抗原阳性白细胞黏附于ICAM-1阳性内皮细胞表面,进一步到达炎症组织,促进炎症细胞的迁移和趋化[12]。本实验结果显示,采用长春西汀给药能够降低脂多糖引起的急性肺损伤肺组织中NF-κB、ICAM-1和VCAM-1蛋白表达水平,提示长春西汀抑制NF-κB蛋白的表达,进而抑制黏附因子ICAM-1和VCAM-1蛋白的表达,可能与急性肺损伤的肺组织炎症反应和细胞凋亡有关。
抗凋亡蛋白Bcl-2与促凋亡蛋白Bax作为细胞内源性线粒体通路的重要调节因子,二者的蛋白表达比例对线粒体的完整性具有非常重要的作用。当Bcl-2蛋白表达下降而Bax蛋白表达上升,会促使线粒体中的凋亡因子释放至细胞质基质中,引起细胞凋亡[13]。本实验结果显示,急性肺损伤大鼠肺组织中凋亡细胞数显著高于正常对照组,采用长春西汀给药后明显降低凋亡细胞数,Bax蛋白表达下降,Bcl-2蛋白表达上升。提示长春西汀通过调节Bax与Bcl-2蛋白表达与急性肺损伤肺组织细胞凋亡有关。
[1] Price LC, McAuley DF, Marino PS, et al. Pathophysiology of pulmonary hypertension in acute lung injury[J]. Am J Physiol Lung Cell Mol Physiol, 2012, 302(9):L803-L815.
[2] Levitt JE, Matthay MA. Early treatment of acute lung injury: paradigm shift toward prevention and treatment prior to respiratory failure[J]. Crit Care, 2012, 16(3):223.
[3] 任 骞, 张 杰. 长春西汀药理作用机制研究进展[J]. 中草药, 2013, 44(11):1517-1520.
[4] Jeon KI, Xu XB, Aizawa T, et al. Vinpocetine inhibits NF-κB-dependent inflammation via an IKK-dependent but PDE-independent mechanism[J]. Proc Natl Acad Sci U S A, 2010, 107(21):9795-9800.
[5] Kristof AS, Goldberg P, Laubach V, et al. Role of inducible nitric oxide synthase in endotoxin-induced acute lung injury[J]. Am J Respir Crit Care Med, 1998, 158(6):1883-1889.
[6] Bruns B, Hönle T, Kellermann P, et al. Divergent effects of neutrophils on Fas-induced pulmonary inflammation, apoptosis, and lung damage[J]. Shock, 2017, 47(2):225-235.
[7] Paris AJ, Liu Y, Mei J, et al. Neutrophils promote alveolar epithelial regeneration by enhancing type II pneumocyte proliferation in a model of acid-induced acute lung injury[J]. Am J Physiol Lung Cell Mol Physiol, 2016, 311(6):L1062-L1075.
[8] Abraham E, Carmody A, Shenkar R, et al. Neutrophils as early immunologic effectors in hemorrhage- or endoto-xemia-induced acute lung injury[J]. Am J Physiol Lung Cell Mol Physiol, 2000, 279(6):L1137-L1145.
[9] Grommes J, Soehnlein O. Contribution of neutrophils to acute lung injury[J]. Mol Med, 2011, 17(3-4): 293-307.
[10]Lentsch AB, Czemak BI, Bless NM, et al. NF-κB activation during IgG immune complex-induced lung injury[J]. Am J Pathol, 1998, 152(2):1327-1336.
[11]章黎苹, 朱建华, 黄元伟. 肺炎衣原体对血管内皮细胞的感染及其对ICAM-1表达的影响[J]. 中国病理生理杂志, 2004, 20(8):1402-1406.
[12]Kim SY, Ryu HM, Yang JH, et al. Matemal serum levels of VCAM-1, ICAM-1 and E-selectin in preeclampsia[J]. J Korean Med Sci, 2004, 19(5):688-692.
[13]Savitskaya MA, Onishchenko GE. Mechanisms of apoptosis[J]. Biochemistry (Mosc), 2015, 80(11):1393-1417.
(责任编辑: 林白霜, 罗 森)
Vinpocetine injection attenuates lipopolysaccharide-induced acute lung injury in rats
YE Yong-shun, LIU Hua
(TheSecondDepartmentofMedicine,FirstAffiliatedHospitalofGuangdongPharmaceuticalUniversity,Guangzhou510080,China.E-mail:Liuhuagy63@163.com)
AIM: To observe the inhibitory effects of vinpocetine injection on lipopolysaccharide (LPS)-induced acute lung injury (ALI) in the rats and to explore the underlying mechanisms. METHODS: Male Wistar rats (n=50) were randomly divided into 5 groups: control group, ALI model group, and low, medium and high doses of vinpocetine treatment groups. The rats in control group were injected with 0.9% NaCl at 5 mL/kg through femoral vein. The rats in ALI model group
LPS at 10 mg/kg through femoral vein. After injected with LPS, the rats in vinpocetine treatment groups received vinpocetine at 0.2 mg/kg, 0.7 mg/kg or 1.2 mg/kg via intraperitoneal injection. The pathological changes of the lung tissues were observed under microscope with HE staining. The cell apoptosis in the lung tissues was detected by TUNEL staining. Myeloperoxidase (MPO) activity was measured by the method of spectrophotometry. The protein expression of NF-κB, ICAM-1, VCAM-1, Bax and Bcl-2 was determined by Western blot. RESULTS: Compared with ALI group, administration of vinpocetine significantly attenuated the structural injury of the lung and the infiltration of inflammatory cells. Moreover, vinpocetine decreased cell apoptosis and MPO activity in the lung tissues of ALI rats. In addition, the protein expression of NF-κB, ICAM-1, VCAM-1 and Bax was inhibited after vinpocetin treatment, whereas Bcl-2 expression was increased. CONCLUSION: Vinpocetine attenuates LPS-lung injury by reducing MPO activity and regulating NF-κB, ICAM-1, VCAM-1, Bax and Bcl-2 protein expression.
Vinpocetine injection; Lipopolysaccharide; Acute lung injury
1000- 4718(2017)07- 1278- 05
2016- 11- 08
2017- 02- 16
广东省财政技术研究开发与推广应用项目(No. 2060403)
R965; R363.2
A
10.3969/j.issn.1000- 4718.2017.07.020
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 020-61321847; E-mail: Liuhuagy63@163.com
