颈内动脉刺破法制作大鼠蛛网膜下腔出血模型
2017-08-07刘振刚高建亮孙林林庞智寅付爱军李建民田景瑞
刘振刚,高建亮,孙林林,郭 鑫,王 萌,庞智寅,付爱军,李建民,田景瑞
(1.华北理工大学附属医院神经外科,河北 唐山 063000;2.遵化市人民医院神经外科,河北 遵化 064200;3.华北理工大学附属医院神经内科,河北 唐山 063000;4.华北理工大学基础医学院,河北省慢性疾病重点实验室,唐山市慢性病临床基础研究重点实验室,河北 唐山 063000)
颈内动脉刺破法制作大鼠蛛网膜下腔出血模型
刘振刚1,高建亮2,孙林林1,郭 鑫3,王 萌3,庞智寅1,付爱军1,李建民1,田景瑞4
(1.华北理工大学附属医院神经外科,河北 唐山 063000;2.遵化市人民医院神经外科,河北 遵化 064200;3.华北理工大学附属医院神经内科,河北 唐山 063000;4.华北理工大学基础医学院,河北省慢性疾病重点实验室,唐山市慢性病临床基础研究重点实验室,河北 唐山 063000)
目的 通过图文结合的形式,详细介绍大鼠蛛网膜下腔出血模型的制作方法及过程;改进并创新模型,使其能更好的模拟临床动脉瘤破裂所致蛛网膜下腔出血。方法 选取SD雄性大鼠,采用颈内动脉颅外段穿入颈内段法,建立SD雄性大鼠蛛网膜下腔出血模型,用呼吸、瞳孔、大小便及留置纤芯解剖大鼠头颈等方法对模型进行验证。通过观察死亡率和临床表现,探讨模型的可控性、可重复性。结果 实现了刺破血管造成蛛网膜下腔出血,且纤芯到达的位置能准确的刺破所需要的血管。结论 此法制作模型稳定,方法通俗易懂,操作精巧灵活,可重复性强,理解后短时间内就可造模成功,且成功造模所形成的蛛网膜下腔出血,能更好地模拟临床动脉瘤突然破裂出血,非常适用于蛛网膜下腔出血早期脑损害及其血管痉挛的研究。
蛛网膜下腔出血;血管穿刺法;模型,大鼠;纤芯
蛛网膜下腔出血(subaraclmoid hemorrhage,SAH)为神经外科常见疾病,因其有较高的致残及致死率[1],并且常常会使患者遗留有明显的神经功能及认知障碍,为临床医生所高度关注。但因当今技术条件所限,对其病理、生理机制变化的研究仍未有较完整而清晰的诠释,其中可能的原因之一是制作的动物模型不能理想的模拟动脉瘤突然破裂所形成的蛛网膜下腔出血[2]。笔者反复尝试,通过对材料与技术不断改良与创新,较为科学合理的制作出能够稳定重复呈现大鼠SAH模型,此法技术思路完善,理解通俗易懂、易学,希望能够给研究蛛网膜下腔出血的同行提供便利。
1 材料和方法
1.1 实验动物
清洁级SD雄性大鼠120只,体重(320~330) g,2~3月龄。购于中国人民解放军军事医学科学院卫生学环境医学研究所动物实验中心【SCXK(军)2014-0001】,无菌手术在华北理工大学屏障环境动物实验中心进行【SYXK(冀)2015-0038】;动物饲养单元温度控制在(23~25)℃,相对湿度55%~60%[7];并按实验动物使用的“3R”原则给予人道的关怀:尽可能地减少了所用动物的数量;采用腹腔给药全身麻醉减少动物的精神紧张与痛苦;尽可能采用模拟统计分析的方法,少用活体动物。
1.2 动物分组
将SD大鼠平均分成4组,每组30只,分别在造模后的6 h、24 h、72 h对存活模型大鼠腹主动脉取血后,心脏灌注甲醛固定液后取脑;同时对死亡大鼠及时进行解剖,探查寻找死亡原因,其中在术中部分为造模后,瞳孔散大,呼吸、心跳骤停死亡,部分为纤芯刺破颈内动脉在颅外段的分杈处,出血压迫颈部重要组织而死;另有些发现为解剖异常,颈内动脉在颈总分杈处同时也分杈,当结扎其中一支时,大鼠突然死亡;复苏3 h内死亡的大鼠,可能为颅内出血过多,颅压过高而死;其它时间段大鼠清醒后死亡的,考虑为颅内出血后,严重影响了大鼠的饮食及饮水等基本生活,当然可能存在其它未知原因如手法不熟练致手术时间过长等。
1.3 主要材料及工具
普通光纤、指甲油、无菌纱布块、棉棒、自配10%水合氯醛、2%葡萄糖酸氯已定醇皮肤消毒液、5-0与3-0缝合线、1/2弧度皮内与皮肤缝合针。
高精度游标卡尺、剃毛器(备皮刀)、光纤剥纤钳、徕卡显微系统(上海)贸易有限公司产Leica M320手术显微镜、张家港市奥斯卡医疗器械有限公司产显微外科手术器械包等(见图1 A~D)。

注:(A)无菌操作;(B)纤芯制作;(C)纤芯标记;(D)物品准备。图1 术前准备Note.(A)Aseptic operation;(B)Core make up;(C)Core marking;(D)Item preparation.Fig.1 Preoperative preparation of surgical instruments
1.4 模型的制作
1.4.1 大鼠固定:10%的水合氯醛(0.3~0.4 mL/100 g)腹腔麻醉成功后,大鼠呈仰卧位,四肢及头颅(门牙)以橡皮筋或细绳固定于大鼠固定台(图2 A,B)。
1.4.2 手术区备皮、消毒与皮层剪开:打开大鼠手术体温控制仪及Leica手术显微镜,设定温度为38℃[3],将温度探头插入大鼠肛门内,用生理盐水浸湿大鼠颈部皮毛,防止剃毛时毛发乱飞,确定手术区域大小范围约为3×2 cm,剃毛器剃去手术区域皮毛,用棉棒蘸取2%葡萄糖酸氯已定醇皮肤消毒液依次消毒手术皮肤区域三次,离颈部正中线偏右侧做斜切口长度约2 cm,以利于右侧血管的分离,切口远心端至大鼠下颏(皮肤标志为米粒大小淡红色皮丘),眼科剪剪开皮肤及皮下组织(图2 C,D)。
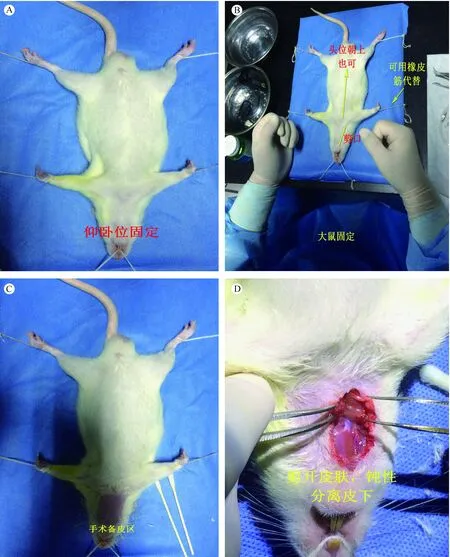
注:(A)体位固定;(B)术前准备;(C)术区备皮;(D)皮肤剪开。图2 手术体位与分离皮下组织Note.(A)Suping position fixed;(B)Preoperative preparation;(C)Preoperative skin preparation;(D)Skin incision.Fig.2 Surgical position and separation of subcutaneous tissue
1.4.3 钝性分离皮下组织、血管:眼科镊钝性分离颈阔肌可见大舌下腺、淋巴结及颌下腺,依二腹肌前后腹连接处(显白色腱膜)为起点,沿二腹肌后腹向颈部钝性分离深筋膜,可见胸锁乳突肌、胸骨舌骨肌、锁骨舌骨肌及胸骨甲状腺肌,顺以上肌肉(胸锁乳突肌、二腹肌后腹与胸骨舌骨肌等)间形成的类似向头胸两端拉长的大于号(>)样的自然沟壑钝性分离以上肌肉及其筋膜,可见颈总动脉鞘,鞘外布满滋养血管及回流小静脉,鞘内的颈总动脉及迷走神经清晰可变,迷走神经紧贴颈总动脉背侧,用小弯钳夹住同侧胸锁乳突肌,充分暴露手术视野,慎重用弯钳夹持胸骨舌骨肌、胸骨甲状腺肌及锁骨舌骨肌等,防止长时间压迫气管,小心仔细钝性分离颈总动脉鞘,用眼科镊细致的把迷走神经从颈总动脉上分离出,颈总动脉直径大约1 mm,钝性分离出颈总动脉和迷走神经,长度大约1 cm,在二腹肌后腹的下1/3处可见颈总动脉分杈:颈内动脉与颈外动脉,钝性分离颈外动脉远心端及颈丛神经,显露颈外动脉分支甲状腺上动脉,在颈外动脉与甲状腺上动脉连接根部穿双线(5-0号线)(图3 A,B)。
1.4.4 颈外动脉结扎与临时夹闭颈总动脉及颈内动脉:用其中一根结扎颈外动脉,注意剥离下压颈丛神经,防止一起被结扎,为颈外动脉第二结,保留一定长度线,做为牵引线,同时也结扎了同侧甲状腺上动脉,剪断甲状腺上动脉,第二根线沿颈外动脉向远心端游离上行,离第二结大约3 mm左右再次结扎颈外动脉,为颈外动脉第三结,在离第二结2 mm左右处(离第三结1 mm)用神经外科显微剪剪断颈外动脉,可防止第二结在多次牵引时出现滑结、脱结,也是为了避免颈外回流出血,减少大鼠手术中失血,第三结不用保留牵引线,左手通过第二结牵引线提起颈外动脉近心端残端,利用神经外科显微镊细心分离颈外动脉第一分支枕动脉,注意尽量下压颈丛及迷走神经,结扎枕动脉(尽量远离颈外动脉),禁止结扎颈丛及迷走神经,神经外科纤维剪刀剪断枕动脉(断端离线结距离尽量远些),为了防脱结,此时枕动脉远心端回流会出现少量出血,小纱布块压迫,很快止血;充分分离颈外动脉残端、颈内动脉及颈总动脉分杈处血管外膜周围附着的纤维结缔组织,耐心分离颈动脉窦及颈动脉小球,先用动脉夹夹闭颈总动脉近心端,再用另一个动脉夹夹闭颈内动脉远心端(图3 C,D)。
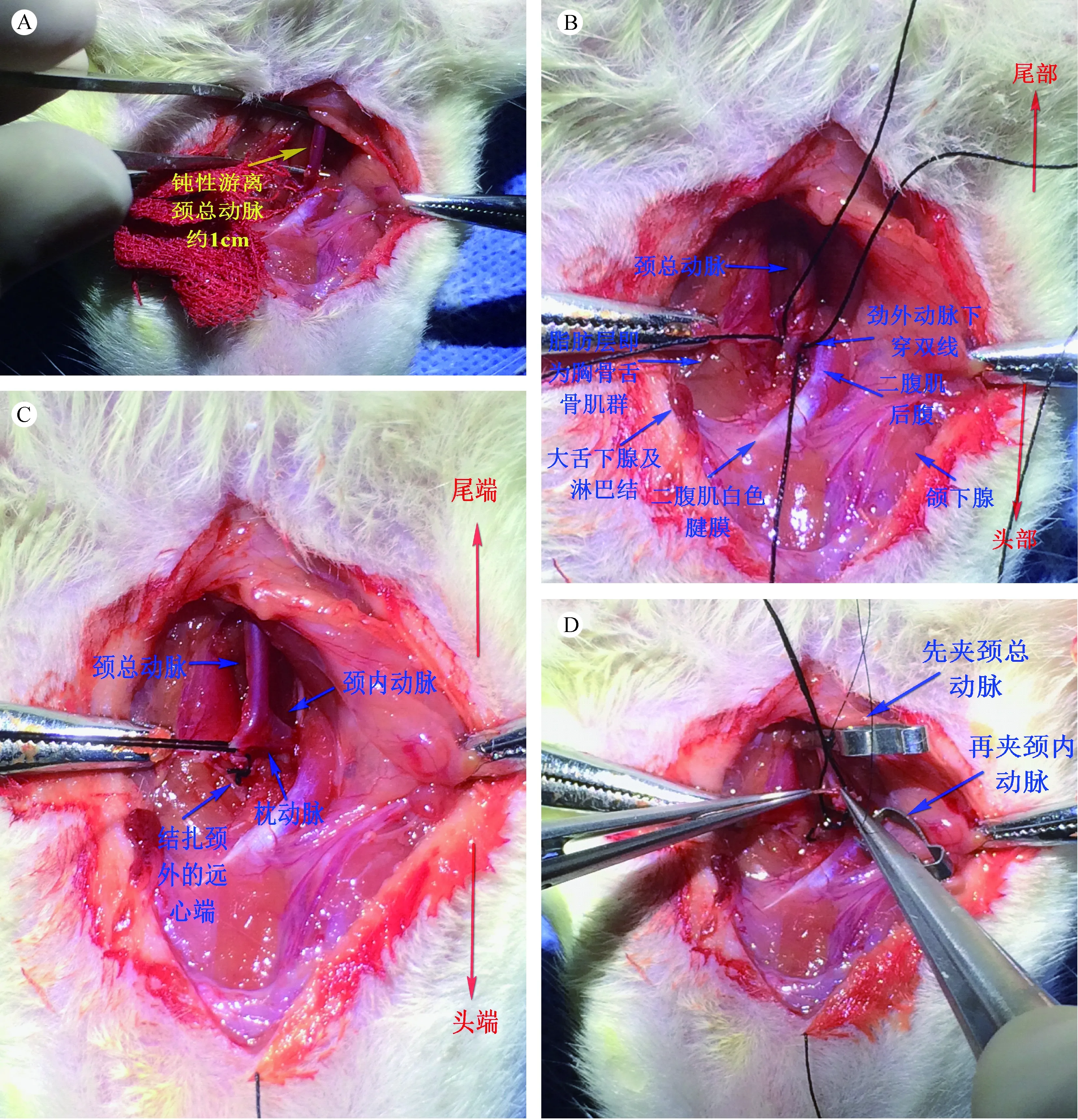
注:(A)血管分离;(B)颈外穿线;(C)颈外结扎;(D)临时夹闭。图3 血管游离与血流临时阻断Note.(A)Vascular separation;(B)External carotid artery threading;(C)Ligation of the external carotid artery;(D)Temporarily clipped carotid arteries.Fig.3 Vascular separation and temporary blood flow occlusion
1.4.5 插入纤芯:轻轻提起颈外动脉,用神经外科显微剪在颈外动脉近分杈处(不可过近)、枕动脉残端对侧剪一小口,导入纤芯,牵拉颈外动脉,使其与颈内动脉近似呈一直线(纤芯尾部与颈部正中线呈30°~45°角、与水平面也呈30°~45°角,纤芯头部向内侧),由颈外开口插入颈内动脉至动脉夹处,助手在松开颈内动脉动脉夹,快速插入纤芯,此时会有较多颈内动脉回流血液流出,插入约20 mm左右(用蓝色指甲油在纤芯一端20 mm处做了标记)[4],此时有畅通无阻力感,再次快速插入纤芯1~2 mm[5],当有突破感时表明前交通动脉已经插破,此时有扎豆腐渣的感觉,快速抽出纤芯,用小纱布块短暂压迫止血,提起颈外动脉,在颈外动脉剪口的近心端结扎颈外动脉,为颈外动脉第一结,打开颈总动脉动脉夹(图4 A,B)。
1.4.6 评判模型成功与否的指征:观察颈总动脉、颈内动脉的血流、搏动情况及大鼠的瞳孔及大小便,血管充盈、搏动良好、双侧瞳孔不等大或双侧瞳孔针尖样大小或出现大小便失禁,可考虑手术成功(图4 C,D)。
1.5 解剖验证
1.5.1 解剖验证手术是否成功:穿刺进入20 mm后再次进入5 mm左右,在第三结处用5-0线固定纤芯或用动脉夹夹住纤芯与主要动脉,行颈部及颅脑相关组织的解剖验证(图5 A,B)。
1.5.2 路径证明造模成功:切开二腹肌前后腹的连接处,分离咬肌和下颌骨,可见面神经及颈外静脉(面神经在颈外静脉的下面),可从颅底与颅盖骨两个方向进行仔细剥离,显露颈内动脉在颅外的分支-翼腭支,此支通过岩鼓裂进入颅内,主支通过颈动脉孔进入颅内,分出大脑中动脉与大脑前动脉,清晰可见纤芯刺破了颈内动脉在颅内段的分叉[6],颅底动脉环布满陈旧性血块(图5 C,D)。
2 结果
模型经过改进并创新能够较完美的实现SD大鼠蛛网膜下腔出血,纤芯所到达的位置也较理想;经过图表形式描述统计分析可得,利用此模型成功大鼠的死亡率=(死亡-未见出血)/(总只数-未见出血)=13/105=12.38%,总死亡率=死亡大鼠/大鼠总只数=28/120=23.33%;通过大鼠血管刺破法建立的动物模型能够模拟临床动脉瘤破裂所致蛛网膜下腔出血的发生过程,有极高的死亡率,有统计称总死亡率在35%左右[7],本次实验成功模型大鼠的死亡率在12.38%,总死亡率在23.33%,经过两者比较,改进并创新的造模方式更稳定,可控性与可重复性更好,更能完美的模拟临床动脉瘤破裂所致蛛网膜下腔出血的发生过程(表1)。
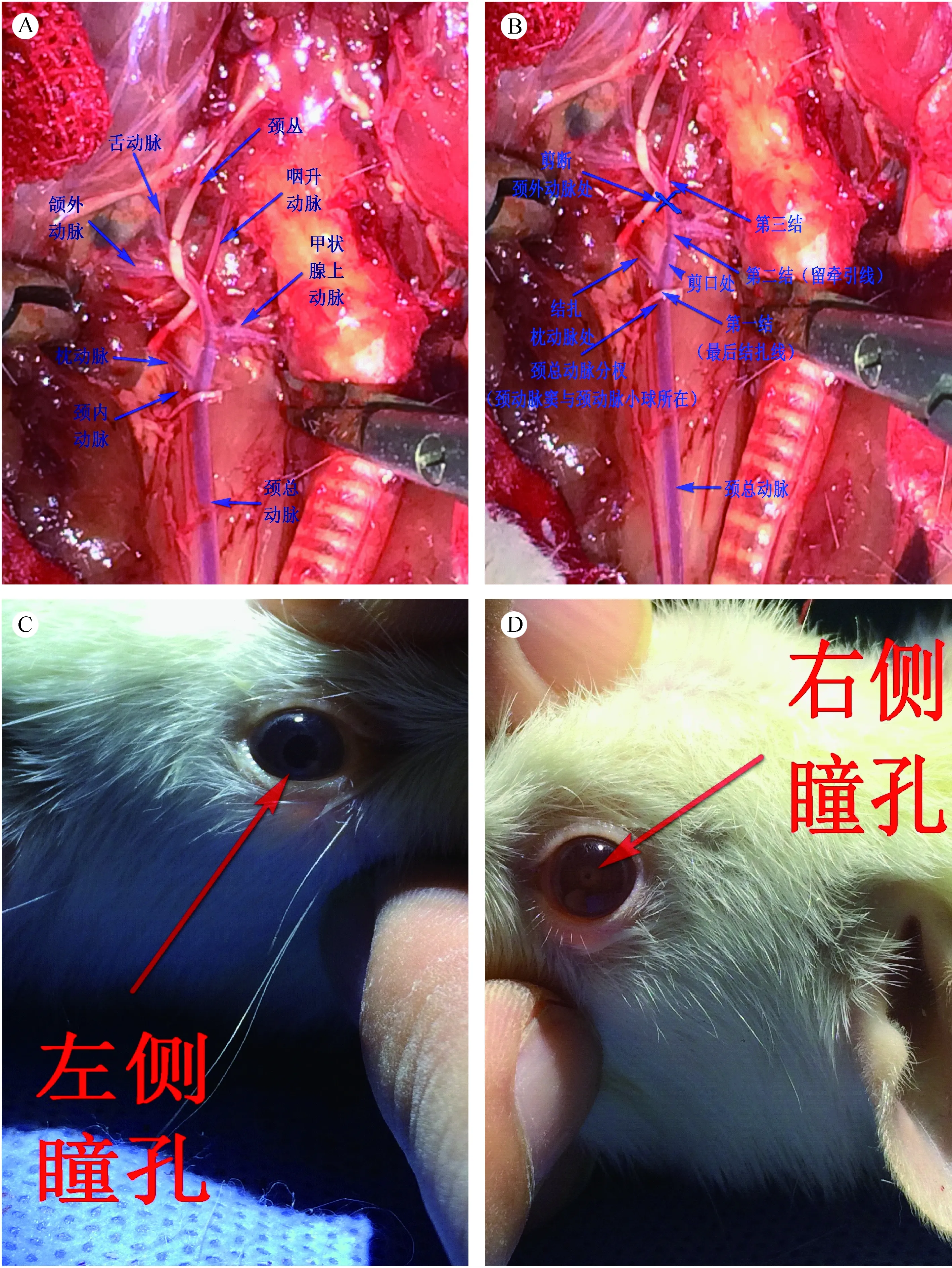
注:(A)血管解剖;(B)图解演示;(C)瞳孔增大;(D)针尖瞳孔。图4 血管穿刺技术路线与成功相关指征Note.(A)Vascular anatomy;(B)Photo-illustration of the operative field;(C)Pupil dilation;(D)Pinpoint pupil.Fig.4 The route of vascular puncture and related successful indicators

注:(A)纤芯固定;(B)解剖验证;(C)路径验证;(D)造模成功。图5 解剖验证造模的结果Note.(A)Core fixed;(B)Anatomical confirmation;(C)Path identification;(D)Successful modeling.Fig.5 Anatomical confirmation of the successful modeling

造模Modeling瞳孔Pupil无改变Nochange针尖样大小Pinpointsize不等大Anisocoria散大Dilation尿崩Polyuria失明blindness肢体瘫痪Limbparalysis死亡Death出血Bleeding无出血Nobleeding0.5h47263413155103h106h163512h324h73572h5352
3 讨论
自发性蛛网膜下腔出血多源于颅内动脉瘤,一旦破裂对人的危害是非常大的,尤其是动脉瘤破裂后被诊断为3或4级[8],危及患者生命且死亡率极高,正由于其极高的致残、致死率且又为神经外科常见疾病,所以一直成为临床医生所高度关注的焦点;动脉瘤破裂发病急,病情演变迅速,给疾病的研究带来了非常大的困难,这就迫切需要一种动物模型,能够较稳定而准确的模拟这种病变化,本实验经过改进并创新建立的SD大鼠蛛网膜下腔出血模型,能更好的模拟临床,较为真实的演示疾病的发生过程,给科研工作者带来了希望;本实验的创新点在于:①采用普通光纤纤芯,取材方便、容易,光滑度高,粗细及光滑度与大鼠线栓相似,但较线栓有较强的硬度与锋利度,非常适应蛛网膜下腔造模刺破血管。②通过对颈外动脉及其分支的处理,尤其是颈外三个结的设计,使术中基本没有出血,操作灵活、方便,术野清晰,组织层次分明。③枕动脉的处理与颈外入口的特殊设计,使穿刺时,颈外与颈内基本成一直线,为纤芯的顺利地通过创造了良好的条件。④造模成功率高,出血相对易控制,能够较好的在动物模型上模拟动脉瘤破裂出血所形成的蛛网膜下腔出血。⑤通过对穿刺角度的把握可避免对颈内动脉分支翼腭支的结扎及其由结扎翼腭支所致过分分离二腹肌等损害,避免大鼠复苏后部分正常功能的丧失,减少死亡率。⑥此法制作模型稳定,方法通俗易懂,操作精巧灵活,可重复性强,理解后短时间内就会造模成功。纵观现有文献,尚缺乏以图文并茂的形式详细阐述这种模型制作过程的文献,希望通过本室的努力,能给予本方面研究者提供便利。
下面是对此模型制作过程中的一点体会总结与相关注意事项:①穿刺时一定把握好角度,不然很容易进入翼腭支,使造模失败。②一定要处理好枕动脉,不然无法修正角度使颈外与颈内成一直线,枕动脉紧靠颈总动脉分杈,内部压力高,结扎后不要过分牵拉线结,易造成滑结、脱结。③处理颈动脉窦与颈动脉小球时,一定要仔细认真。④每次结扎颈外动脉时,一定要注意剥离颈丛神经,勿被一起结扎。⑤穿刺时,一定要在放开颈内动脉夹的瞬间顺势插入纤芯,颅内血液回流时,颈内动脉入颅处即颈动脉孔处血管充盈,时间越长,血管逐渐萎陷,同时术野模糊,由于进颅处为骨缝结构,当压迫止血停止后,颈内动脉孔处的血管干瘪,纤芯无法进入颅内,此时易刺破颈内动脉颅外段,使造模失败。⑥当第一次失败时,不要再反复尝试,纤芯会由于大鼠的凝血作用,在纤芯上形成多个小栓子,会形成类似棘刺结构,使纤芯在血管中运动受限,可拔出纤芯,用医用酒精擦拭后再用生理盐水冲洗,去除其表面的油脂与血块,恢复其表面光滑度。⑦纤芯在20 mm处用指甲油标记时,不可标记过大,轻点一下即可。⑧不建议对颈内动脉分支翼腭支进行结扎,因为分离翼腭支,会使颈部分离过度,伤及大鼠维持基本生活功能组织,同时结扎后,过多减少颅内供血,加大复苏困难,延长苏醒时间或醒后造成食、水等生活状态差,大大增加死亡率[9]。⑨最好在大鼠体温控制仪下造模,实时监测大鼠体温,提高大鼠的耐受时间。⑩术中避免器械对气管的压迫。大鼠复苏过程中要保温。从血管夹夹闭颈总动脉刺破颈内动脉血管颅内段到松开,完成造模时间能够控制在2~3 min内[10]。穿刺成功后,对瞳孔的观察越早越好,最好在拔出纤芯结扎颈外第一结后当即观察,发现很多时候在缝合肌肉及皮肤组织时,双侧瞳孔会在较短时间恢复等大。在剪颈外动脉小口时,过小纤芯可能会刺入血管外膜周围间隙的结缔组织,过大当牵拉颈外第二结时,可能会扯断血管。纤芯穿刺时不可用力过猛,应顺势,否则会刺破颈内动脉颅外段分杈。
[1] 高志, 赵海苹, 罗玉敏, 等. 大鼠蛛网膜下腔出血模型的研究进展[J]. 中国比较医学杂志, 2013, 23(11): 78-82.
[2] Pluta RM, Bacher J, Skopets B, et al. A non-human primate model of aneurismal subarachnoid hemorrhage (SAH)[J]. Transl Stroke Res, 2014, 5(6): 681-691.
[3] Marbacher S, Fandino J, Kitchen N. Characteristics of in vivo animal models of delayed cerebral vasospasm[J]. Acta Neurochir Suppl, 2011, 110(Pt 1): 173-175.
[4] Kikkawa Y, Kurogi R, Sasaki T. The single and double blood injection rabbit subarachnoid hemorrhage model[J]. Transl Stroke Res, 2015, 6(1): 88-97.
[5] Du GJ, Lu G, Zheng ZY, et al. Endovascular perforation murine model of subarachnoid hemorrhage[J]. Acta Neurochir Suppl, 2016, 12(1): 83-88.
[6] 季鹰, 吴建中, 赵雅度, 等. 一种新的蛛网膜下腔出血(SAH)动物模型的建立[J]. 中华神经外科杂志, 1991, 7(1): 11-13.
[7] Guvenc Tuna B, Lachkar N, de Vos J, et al. Cerebral artery remodeling in rodent models of subarachnoid hemorrhage[J]. J Vasc Res, 2015, 52(2): 103-115.
[8] Yan T, Chopp M, Chen J. Experimental animal models and inflammatory cellular changes in cerebral ischemic and hemorrhagic stroke[J]. Neurosci Bull, 2015, 31(6): 717-734.
[9] Zhou N, Xu T, Bai Y, et al. Protective effects of urinary trypsin inhibitor on vascular permeability following subarachnoid hemorrhage in a rat model[J]. CNS Neurosci Ther, 2013, 19(9): 659-666.
[10] Sehba FA. Rat endovascular perforation model[J]. Transl Stroke Res, 2014, 5(6): 660-668.
Preparation of a rat model of subarachnoid hemorrhage by a fiber core inserted in the internal carotid artery
LIU Zhen-gang1,GAO Jian-liang2,SUN Lin-lin1,GUO Xin3,WANG Meng3,PANG Zhi-yin1,
FU Ai-jun1,LI Jian-min1,TIAN Jing-rui4
(1.Department of Neurosurgery, Affiliated Hospital of North China University of Science and Technology, Tangshan 063000, China; 2. Department of Neurosurgery, Zunhua People's Hospital, Zunhua 064200; 3. Department of Neurology, Affiliated Hospital of North China University of Science and Technology, Tangshan 063000; 4. Hebei Key Laboratory of Chronic Diseases, Tangshan Key Laboratory of Preclinical and Basic Research on Chronic Diseases, School of Basic Medical Sciences, North China University of Science and Technonogy, Tangshan 063000 )
Objective To report a newly developed method and procedure to establish a rat model of subarachnoid hemorrhage in detail, and to provide a better model simulating the clinical subarachnoid hemorrhage caused by a ruptured aneurysm for related research. Methods One hundred and twenty healthy SPF 2-3-month old male Sprague-Dawley rats were divided into 4 groups, 30 rats in each group. The three experimental groups were sacrificed at 6, 24 and 72 hours after modeling. Rat models of subarachnoid hemorrhage were established by inserting a fiber core in the internal carotid artery and piercing this artery. Successful establishment of the subarachnoid hemorrhage model was confirmed by observation of breathing, pupil, defecation, urination and inspection at autopsy dissection. The controllability and reproducibility of this model were verified by observation of clinical manifestation and explored by mortality analysis. Results Subarachnoid hemorrhage was successfully induced by fiber core piercing the internal carotid artery at the needed location. Conclusions This method of model preparation is stable and understandable. The operation is nimble, with a good reproducibility. This model can be successfully performed after a short time learning, well simulate the sudden hemorrhage caused by a ruptured aneurysm, and suitable for research on early brain injury and vasospasm after subarachnoid hemorrhage.
Subarachnoid hemorrhage (SAH); Aneurysm; Internal carotid artery; Surgery;Animal model; Rat; Fiber core
河北省省级重大医学项目(Zd2013093)。
刘振刚(1982-)男,主治医师,硕士研究生,研究方向:蛛网膜下腔出血后早期脑损害及血管痉挛的基础研究。E-mail: 1525669738@qq.com。
付爱军(1968-)男,主任医师,硕士生导师,教授,研究方向:颅内动脉瘤所致蛛网膜下腔出血的基础与临床。E-mail: tsfaj@sina.com。
研究报告
【文献标识码】 A 【文章编号】1671-7856(2017) 06-0037-09
10.3969.j.issn.1671-7856. 2017.06.008
2017-05-10
