SGT基因杂合缺失小鼠血液生理生化指标分析
2017-08-07顾取良郐一贺陈佳园郑凌云王丽京
顾取良,黄 韧,郐一贺,陈佳园,郑凌云,王丽京
(1. 广东药科大学基础学院血管生物学研究所,广州 510006;2.广东省实验动物监测所,广州 510633)
SGT基因杂合缺失小鼠血液生理生化指标分析
顾取良1,黄 韧2,郐一贺1,陈佳园1,郑凌云1,王丽京1
(1. 广东药科大学基础学院血管生物学研究所,广州 510006;2.广东省实验动物监测所,广州 510633)
目的 分析SGT基因杂合缺失对不同年龄小鼠血液指标和代谢的影响。方法 分别采集10周龄、26周龄SGT基因杂合缺失(SGT+/-)小鼠和野生型小鼠眼眶血液,用全自动血细胞分析仪和生化分析仪检测常用血液生理指标和生化指标,进行不同年龄和基因型间统计比较。结果 与同基因型低龄小鼠对比,高龄小鼠多项血液生理生化指标均发生增龄性改变。与同龄野生型对照相比,10周龄SGT+/-小鼠大血小板比率降低,未结合型胆红素浓度降低(P<0.05),其余指标均未见统计学差异;26周龄SGT+/-小鼠血小板计数、血小板比容和中性粒细胞计数降低,碱性磷酸酶、未结合型胆红素、胆固醇及甘油三酯等指标改变有统计学意义(P<0.05)。结论SGT基因杂合缺失能够诱发高龄小鼠部分血液、血清生化指标的改变。
SGT;基因缺失;血液学;血液生化
SGT [small glutamine-rich tetratricopeptide repeat (TPR)-containing protein] 蛋白能与HIV-1病毒编码蛋白U、自主性细小病毒H-1非结构蛋白1及核心蛋白前体GAG(group-specific antigen)等结合,调节病毒颗粒的装配和释放,也被称为病毒蛋白U结合蛋白,其结构特征为分子中间含有三个串联重复的TPR基序[1]。TPR基序是一个包含34个氨基酸残基的多肽重复序列,进化过程中高度保守,目前已发现五十多种含TPR基序的蛋白质,含TPR基序的蛋白质广泛参与各种生物学过程[2]。SGT在多种组织中均有表达,参与多种不同生物学过程,包括细胞周期调控、细胞凋亡、病毒装配与释放、激素信号转导、神经突触传导等。SGT可通过与Hsp70及热休克同源蛋白Hsc70(heat shock cognate protein 70)等相互作用发挥共分子伴侣的功能,参与细胞内蛋白质折叠、转运及翻译后修饰等过程,协助介导细胞应激反应[3, 4]。SGT表达改变与前列腺癌、卵巢癌、食管癌、肝癌、朊病毒相关疾病以及淀粉样阿尔茨海默病等的发生发展相关[5-7]。
目前国内外关于SGT共分子伴侣的功能研究多以体外培养的细胞为主要研究对象,如敲减Hela或NBE细胞中SGT表达,能够有效抑制细胞有丝分裂并促进细胞凋亡[3]。鉴于SGT组织表达及生物学功能的广泛性,我们构建了SGT基因缺失杂合子(SGT+/-)小鼠,以便从整体水平研究该基因及其产物在体内的生理功能。本文以SGT基因野生型(SGT+/+)同窝小鼠为对照,对构建的SGT+/-小鼠血液生理生化指标进行检测分析,为利用该基因工程小鼠研究SGT的生物学功能和在相关疾病的作用及其发生机制提供基础资料及重要线索。
1 材料和方法
1.1 实验动物及实验环境
SGT+/-小鼠由上海生命科学院构建赠送(129;B6背景,与C57BL/6小鼠回交已达8代以上),同窝野生型(SGT+/+)小鼠作为对照,雌雄不限,实验动物生产许可证号:【SCXK(苏)2010-0001】。10周龄及26周龄不同背景各8只,体重16~25 g。按照SPF标准进行饲养,实验动物使用许可证号:【SYXK(粤)2012-0125】。
1.2 试剂
2× PCR Master Mix购自Thermo Fisher Scientific,DNA Ladder DL2000和组织细胞DNA提取试剂盒购自上海捷瑞生物工程有限公司,PCR引物由上海生工生物公司合成。
1.3 动物实验
1.3.1 小鼠SGT基因型鉴定:剪取小鼠尾尖约3~5 mm,按说明书提取小鼠基因组DNA作为PCR反应模板。小鼠SGT基因型鉴定所用引物序列为G1:5′-GGGAATAGATGTGCACTAGC-3′,G2:5′-TAGAC ATGCTTGTGTGACCC-3′, G3:5′-TAGGGGAGGAG TAGAAGGTG-3′,引物对G1/G2用于野生型SGT基因扩增,产物大小为508 bp;引物对G1/G3用于SGT缺失的基因型扩增,产物大小为519 bp。美国应用生物系统公司PCR仪常规条件扩增,产物经琼脂糖凝胶电泳后用凝胶成像系统分析。
1.3.2 小鼠血液生理指标测定:禁食12 h后,小鼠眼眶后静脉丛采血入EDTA-K2抗凝管。采用日本Sysmex XT-2000i型动物全血细胞分析仪检测白细胞(WBC)计数、红细胞(RBC)计数、血红蛋白(HGB) 含量、红细胞比容(HCT)、红细胞平均体积(MCV)、红细胞平均血红蛋白含量(MCH)、血小板(PLT)计数、平均血小板体积(MPV)、大血小板比率(P-LCR)、血小板比容(PCT)、中性粒细胞(NEUT)、淋巴细胞(LYMPH)、单核细胞(MONO)、嗜酸性粒细胞(EOS)、嗜碱性粒细胞(BASO)分类计数等血液生理指标。
1.3.3 小鼠血液生化指标测定:禁食12 h后,小鼠眼眶后静脉丛采血入Eppendorff管。采用日立7020型全自动生化分析仪、广州科方生物技术有限公司试剂盒测定血清常规生化指标:丙氨酸氨基转移酶(ALT)、天冬氨酸转氨酶(AST)、碱性磷酸酶(ALP)、总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、总胆红素(TBIL)、直接胆红素(DBIL)、甘油三酯(TG)、胆固醇(CHOL)、尿素氮(BUN)、肌酐(CREA)、血糖(GLU)、乳酸脱氢酶(LDH),计算间接胆红素(IBIL)(IBIL=TBIL-DBIL)。

2 结果
2.1 小鼠SGT基因型鉴定
如图1所示,以野生型小鼠(SGT+/+)基因组DNA为模板,引物对G1/G2扩增的产物约为500 bp而引物对G1/G3扩增无特异性产物;以杂合缺失型(SGT+/-)小鼠基因组DNA为模板,引物对G1/G2和引物对G1/G3扩增均产生约500 bp的特异性产物。

图1 小鼠SGT基因型PCR鉴定电泳图Fig.1 Mouse SGT genotyping by PCR
2.2SGT+/-和SGT+/+小鼠血液生理指标比较
与同基因型低龄小鼠相比,高龄小鼠多项血液生理指标发生明显改变,但不同年龄两种基因型小鼠MCV、MCH、MPV指标未改变;此外,野生型小鼠P-LCR以及SGT+/-小鼠RBC、HGB、HCT、PLT、PCT等未见不同年龄间的统计学差异(#NS)。与同龄野生型相比,10周龄SGT+/-小鼠P-LCR降低(*P<0.05),其余指标均未见统计学差异;26周龄SGT+/-小鼠PLT计数、PCT及NEUT计数明显降低,差异有统计学意义(*P< 0.05),而PLT其他参数、红细胞相关参数、WBC计数及其他分类计数等均无统计学差异,见表1。
2.3SGT+/-和SGT+/+小鼠血清生化指标比较
与同基因型低龄小鼠对比,高龄小鼠多项血液生化指标均发生改变,而不同年龄组间野生型小鼠血清ALP差异未见统计学意义,SGT+/-小鼠DBIL指标差异未见统计学意义(#NS)。与同龄野生型相比,10周龄SGT+/-小鼠血清TBIL、IBIL升高(*P<0.05),其余指标均未见统计学差异;26周龄SGT+/-小鼠ALP、TBIL、IBIL升高,CHOL和TG降低,差异有统计学意义(*P< 0.05),见表2。
3 讨论
已证实能够与SGT发生相互作用的蛋白包括Hsp70、Hsc70、J蛋白家族成员CSP(cysteine string protein)、BCL2关联永生基因6(BAG6)蛋白、泛素样蛋白Ubl4A、HIV-1编码的病毒蛋白U、生长激素受体、雄激素受体等,其中多数蛋白与维持体内蛋白质稳定的分子伴侣功能相关[8, 9]。蛋白质折叠、转运及翻译后修饰等过程如果发生错误,则有可能促进某些肿瘤发生发展[10]。因此不难理解近年来发现SGT表达改变与多种肿瘤细胞增殖或癌症预后等病理状态相关,但目前对于SGT在体内正常的生理功能仍知之甚少。

Tab.1 Comparison of blood physiological indexes in the wild type and heterozygousSGT-deficient

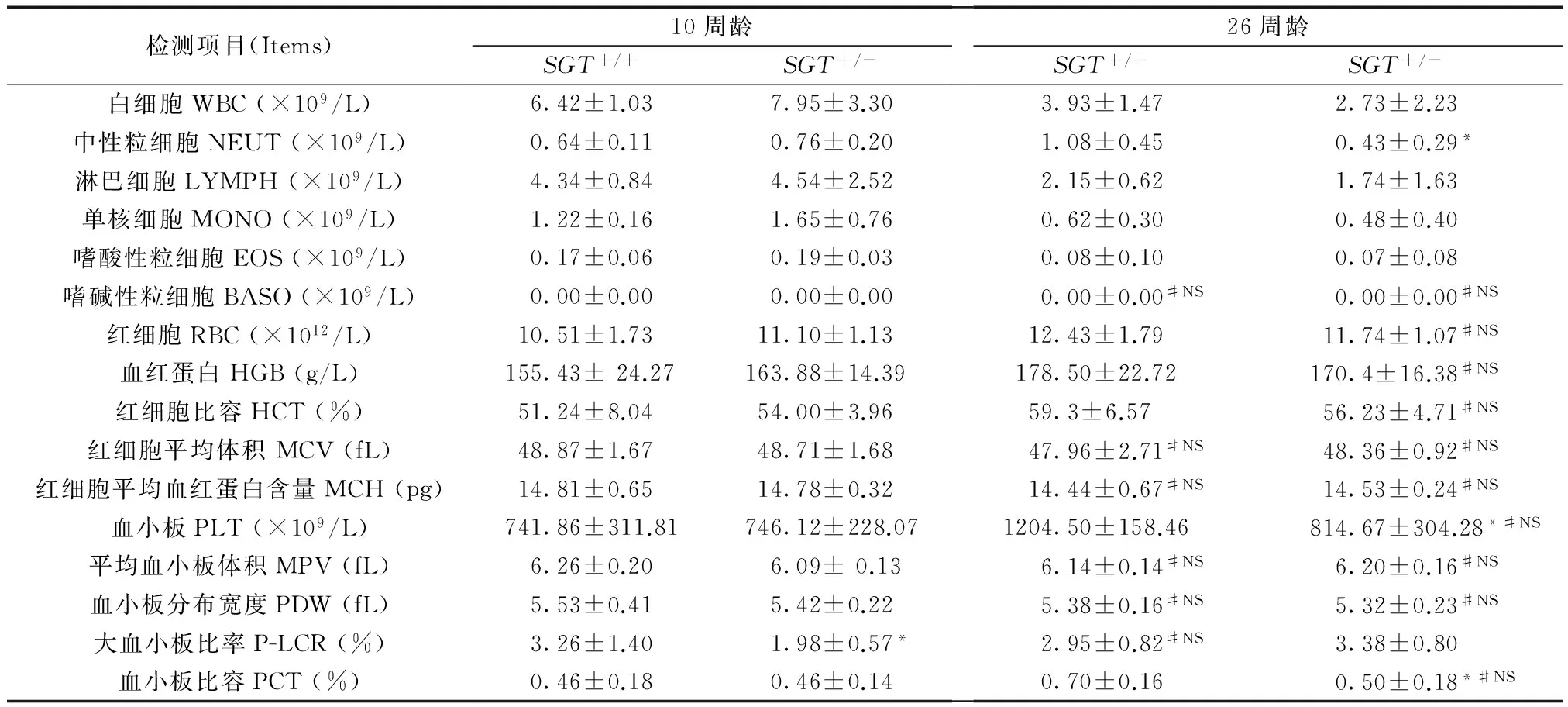
检测项目(Items)10周龄SGT+/+SGT+/-26周龄SGT+/+SGT+/-白细胞WBC(×109/L)6.42±1.037.95±3.303.93±1.472.73±2.23中性粒细胞NEUT(×109/L)0.64±0.110.76±0.201.08±0.450.43±0.29*淋巴细胞LYMPH(×109/L)4.34±0.844.54±2.522.15±0.621.74±1.63单核细胞MONO(×109/L)1.22±0.161.65±0.760.62±0.300.48±0.40嗜酸性粒细胞EOS(×109/L)0.17±0.060.19±0.030.08±0.100.07±0.08嗜碱性粒细胞BASO(×109/L)0.00±0.000.00±0.000.00±0.00#NS0.00±0.00#NS红细胞RBC(×1012/L)10.51±1.7311.10±1.1312.43±1.7911.74±1.07#NS血红蛋白HGB(g/L)155.43±24.27163.88±14.39178.50±22.72170.4±16.38#NS红细胞比容HCT(%)51.24±8.0454.00±3.9659.3±6.5756.23±4.71#NS红细胞平均体积MCV(fL)48.87±1.6748.71±1.6847.96±2.71#NS48.36±0.92#NS红细胞平均血红蛋白含量MCH(pg)14.81±0.6514.78±0.3214.44±0.67#NS14.53±0.24#NS血小板PLT(×109/L)741.86±311.81746.12±228.071204.50±158.46814.67±304.28*#NS平均血小板体积MPV(fL)6.26±0.206.09±0.136.14±0.14#NS6.20±0.16#NS血小板分布宽度PDW(fL)5.53±0.415.42±0.225.38±0.16#NS5.32±0.23#NS大血小板比率P-LCR(%)3.26±1.401.98±0.57*2.95±0.82#NS3.38±0.80血小板比容PCT(%)0.46±0.180.46±0.140.70±0.160.50±0.18*#NS
注:*:同龄SGT+/-小鼠与SGT+/+小鼠间比较P<0.05;#NS:同基因型小鼠26周龄与10周龄间比较无统计学差异
Note.*: Comparison between groups at the same age,P<0.05.#NS: No statistically significant difference between groups with the same genotype.

Tab.2 Comparison of blood biochemical indexes in the wild type and heterozygousSGT-deficient


检测项目(Items)10周龄10-week-oldmiceSGT+/+SGT+/-26周龄26-week-oldmiceSGT+/+SGT+/-丙氨酸氨基转移酶ALT(U/L)22.12±5.4621.67±4.9261.33±16.0659.20±14.80天冬氨酸转氨酶AST(U/L)54.00±18.6351.33±20.17128.33±36.90129.60±42.51AST/ALT2.46±0.802.30±0.372.17±0.46#NS2.30±0.87#NS总蛋白TP(g/L)29.72±1.3529.70±2.6251.72±2.0150.58±2.02白蛋白ALB(g/L)18.31±0.9618.23±3.0229.82±0.9829.90±1.98球蛋白GLB(g/L)11.41±0.5111.47±0.4421.90±1.6420.68±1.67总胆红素TBIL(μmol/L)0.30±0.180.77±0.44*1.45±0.412.06±0.58*直接胆红素DBIL(μmol/L)0.10±0.010.27±0.290.47±0.230.48±0.27#NS间接胆红素IBIL(μmol/L)0.20±0.180.50±0.24*0.98±0.271.58±0.40*碱性磷酸酶ALP(U/L)95.75±31.3992.33±11.8293.33±29.17#NS141.80±25.03*血糖GLU(mmol/L)7.22±0.337.53±0.8412.00±2.1511.06±2.31尿素氮BUN(g/L)7.31±1.837.29±0.7413.00±3.7611.59±2.16肌酐CREA(μmol/L)6.88±3.044.33±3.2815.00±3.2916.60±1.52胆固醇CHOL(mmol/L)1.08±0.061.10±0.132.47±0.201.85±0.10*甘油三酯TG(mmol/L)0.46±0.120.39±0.030.94±0.270.67±0.22*乳酸脱氢酶LDH(U/L)220.62±38.52255.00±88.13621.33±220.02524.40±131.25
注:*:同龄SGT+/-小鼠与SGT+/+小鼠间比较P<0.05;#NS:同基因型小鼠10周龄与26周龄间差异比较无统计学意义
Note.*: Comparison between groups at the same age,P<0.05.#NS: No statistically significant difference between groups with the same genotype.
Winnefeld等[11]报道,利用siRNA下调细胞内源性SGT表达能够导致胞质分裂缺陷、染色体排列不能完成而使有丝分裂受阻,从而降低细胞增殖和细胞存活率。鉴于SGT表达和参与生物学过程的广泛性及其对生命活动的重要性[12],推测动物体内降低SGT表达水平可能造成致死性,因此我们部分敲减了小鼠体内SGT表达。结果获得了存活的SGT基因杂合缺陷(SGT+/-)小鼠,这可能是由于在不同类型的细胞中SGT发挥不同的作用,如Wang等[13]报道过表达SGT使人肝癌7721细胞对凋亡事件敏感性增加,还可能与体内共分子伴侣系统的冗余性有关,可能有其他含TPR基序的共分子伴侣表达上调、实现了部分功能代偿,具体机制有待进一步检测各组织SGT同源异构体蛋白、TRP2、CHIP(carboxy-terminus of Hsp70 interacting protein)等其他共分子伴侣的表达情况后分析探讨[14]。
与野生型同窝对照相比,构建的SGT+/-小鼠大体观察未显示繁育率、生存率差异或行为学异常等症状。实验动物的血液生理生化指标在一定程度上能反映动物的新陈代谢、生理机能和健康状况,对病理学等相关实验的研究具有重要的参考价值[15]。本实验分别选择10周、26周SGT基因野生型(SGT+/+)和杂合型(SGT+/-)的小鼠,检测比较不同年龄阶段SGT基因缺失对血液生理生化指标的影响。两组10周龄小鼠的血液生理指标比较结果显示,SGT基因杂合缺失对低龄小鼠血液生理指标几乎没有影响,除了P-LCR即大血小板比率有一定程度的下降。血小板参数PLT、MPV、PDW、P-LCR、PCT通常需要综合考虑,单纯P-LCR下降仅提示血小板成熟度较高或者血小板生成不活跃,可能会造成机体凝血时间有所延长,但对这种改变出现的原因有待进一步考证。两组26周龄小鼠的血液生理指标比较显示,SGT+/-小鼠血液血小板数量下降约30%、血小板比容(PCT)相应降低,MPV、PDW、P-LCR等均没有明显变化,即血小板活化状态没有明显变化,而同时,红细胞参数和功能亦没有受到影响。体内血小板生成是一个复杂的过程,血小板数量减少的原因一般是血小板生成障碍或血小板破坏增加。若因血小板破坏增加所致,则将在骨髓功能正常时反馈激活巨核细胞,产生体积更大的血小板,使MPV增大,并由于新生PLT大小不一使PDW也增大。而若是骨髓增生低下所致,则其MPV、PDW 也将减小。综合上述结果分析,高龄SGT+/-小鼠血液中血小板减少的原因可能是巨核细胞成熟不良导致释放血小板异常所致,需要进行骨髓细胞成分检测以证实,同时提示,26周龄SGT+/-小鼠凝血功能受到影响,机体凝血时间和出血时间将会延长,后续研究将对血小板功能进行检测。血象检查还观察到SGT+/-小鼠血液中性粒细胞计数低于对照组,总白细胞计数有下降趋势,而其他白细胞分类计数无明显差异,但原因不明。这也进一步佐证了SGT在不同的特定细胞环境中发挥不同的生物学效应。
小鼠血液生化指标比较结果显示,SGT基因杂合缺失对低龄小鼠血液生化指标的影响仅表现为总胆红素(TBIL)和IBIL即未结合胆红素有所升高,对高龄小鼠血液生化的影响则还包括血清ALP升高以及TG和CHOL水平下降。胆红素的主要来源是红细胞的血红蛋白,而SGT+/-小鼠血液红细胞参数基本没有改变,因而无法确定血清ALP、TBIL和IBIL三者升高的共同原因,仅推测可能与催化II相反应的转移酶不足及轻微胆道阻塞有关。此外,近年研究认为适当较高浓度的BIL能够清除氧自由基、减少氧化型低密度脂蛋白的生成,总胆红素和间接胆红素含量降低与急性脑梗死有密切关联,颈动脉斑块患者血清间接胆红素较低[16],因而SGT+/-小鼠较高的TBIL血清水平还可能与血管内皮细胞保护作用增强有关,预示其心脑血管疾病易患风险较低,这也与26周龄SGT+/-小鼠血清TG和CHOL水平较低基本相符。
总之,相对于低龄小鼠而言,SGT基因杂合缺失对高龄小鼠诱发的部分血液生理生化指标变化更明显。其中,血清血红素的变化在低龄和高龄组均具有统计学意义但高龄组差异更显著,而其他指标在不同年龄组呈现不同的变化,提示年龄与SGT基因杂合缺失共同影响小鼠生理生化指标,即这些指标的变化是其功能减弱后的间接反应。由于共分子伴侣在机体应激时发生的蛋白质去折叠或正确折叠及蛋白质运输中发挥必不可少的功能,可以预测,在应激状态下SGT+/-小鼠或SGT基因敲除(SGT-/-)小鼠将表现出更明显的表型差异。另外,考虑到血小板和中性粒细胞均在介导炎症反应中起着重要作用[17],后续研究可在炎症相关疾病如深静脉血栓、动脉粥样硬化、老年性痴呆、炎症相关性结肠癌等模型上进行。
[1] Angeletti PC, Walker D, Panganiban AT. Small glutamine-rich protein/viral protein U-binding protein is a novel cochaperone that affects heat shock protein 70 activity [J]. Cell Stress Chaperones, 2002, 7(3): 258-268.
[2] Allan RK, Ratajczak T. Versatile TPR domains accommodate different modes of target protein recognition and function [J]. Cell Stress Chaperones, 2011, 16(4): 353-367.
[3] Philp LK, Butler MS, Hickey TE, et al. SGTA: a new player in the molecular co-chaperone game[J]. Horm Cancer, 2013, 4(6): 343-357.
[4] Trotta AP, Need EF, Butler LM, et al. Subdomain structure of the co-chaperone SGTA and activity of its androgen receptor client [J]. J Mol Endocrinol, 2012, 49(2): 57-68.
[5] Fielding BC, Gunalan V, Tan TH, et al. Severe acute respiratory syndrome coronavirus protein 7a interacts with hSGT [J]. Biochem Biophys Res Commun, 2006, 343(4): 1201-1208.
[6] Trotta AP, Need EF, Selth LA, et al. Knockdown of the cochaperone SGTA results in the suppression of androgen and PI3K/Akt signaling and inhibition of prostate cancer cell proliferation [J]. Int J Cancer, 2013, 133(12): 2812-2823.
[7] Lu C, Liu G, Cui X, et al. Expression of SGTA correlates with prognosis and tumor cell proliferation in human hepatocellular carcinoma [J]. Pathol Oncol Res, 2014, 20(1): 51-60.
[8] Xu Y, Cai M, Yang Y, et al. SGTA recognizes a noncanonical ubiquitin-like domain in the Bag6-Ubl4A-Trc35 complex to promote endoplasmic reticulum-associated degradation [J]. Cell Rep, 2012;2(6): 1633-1644.
[9] Paul A, Garcia YA, Zierer B, et al. The cochaperone SGTA (small glutamine-rich tetratricopeptide repeat-containing protein alpha) demonstrates regulatory specificity for the androgen, glucocorticoid, and progesterone receptors [J]. J Biol Chem, 2014, 289(22): 15297-15308.
[10] Meshalkina DA, Shevtsov MA, Dobrodumov AV, et al. Knock-down of Hdj2/DNAJA1 co-chaperone results in an unexpected burst of tumorigenicity of C6 glioblastoma cells[J]. Oncotarget, 2016, 7(16): 22050-22063.
[11] Winnefeld M, Grewenig A, Schnolzer M, et al. Human SGT interacts with Bag-6/Bat-3/Scythe and cells with reduced levels of either protein display persistence of few misaligned chromosomes and mitotic arrest [J]. Exp Cell Res, 2006, 312(13): 2500-2514.
[12] 宋玲,阮元元,王彦林,等. SGT蛋白在小鼠脑发育过程中的表达 [J].复旦学报(医学版),2007,34(6): 793-799.
[13] Wang H, Shen H, Wang Y, et al. Overexpression of small glutamine-rich TPR-containing protein promotes apoptosis in 7721 cells [J]. FEBS Lett, 2005, 579(5): 1279-1284.
[14] Andreyeva A, Leshchyns’ka I, Knepper M, et al. CHL1 is a selective organizer of the presynaptic machinery chaperoning the SNARE complex [J]. PLoS ONE, 2010, 5(8): e12018.
[15] 魏杰,王洪,刘甦苏,等. 不同周龄C57-ras转基因小鼠模型杂交1代CB6F1小鼠的脏器及血液学参数测定 [J]. 中国比较医学杂志,2015, 25(8): 6-11.
[16] Kawamoto R, Ninomiya D, Hasegawa Y, et al. Mildly elevated serum bilirubin levels are negatively associated with carotid atherosclerosis among elderly persons [J]. PLoS One, 2014, 9(12): e114281.
[17] Voudoukis E, Karmiris K, Koutroubakis IE. Multipotent role of platelets in inflammatory bowel diseases: A clinical approach [J]. World J Gastroenterol, 2014, 20(12): 3180-3190.
Analysis of hematological and biochemical parameters of heterozygousSGT-deficient mice in young and elderly ages
GU Qu-liang1, HUANG Ren2, KUAI Yi-he1, CHEN Jia-yuan1, ZHENG Ling-yun1, WANG Li-jing1
(1. Vascular Biology Research Institute, School of Basic Sciences, Guangdong Pharmaceutical University, Guangzhou 510006, China; 2. Guangdong Laboratory Animals Monitoring Institute, Guangzhou 510633)
Objective To study the effect of heterozygous deficiency ofSGTgene on the hematological and biochemical parameters of mice in young and elderly ages.Methods Blood samples were analyzed for complete hematological and biochemical parameters from heterozygousSGT-deficient and wild-type mice of 10-weeks and 6-months old mice, respectively. Results Age-related changes in most indexes were found statistically significantly different between young and elderly mice with the same genotype. Compared with the wild type at the same age, the platelet large cell ratio (P-LCR) was lower in young heterozygousSGT-deficient mice. However, platelet count, plateletcrit (PCT) and neutrophil count were more significantly lower in elderly heterozygousSGT-deficient mice (P<0.05). There was no significant difference for biochemical parameters ALT, AST, LDH, urea nitrogen, creatinine and blood glucose. Total and unconjugated bilirubin as well as ALP were significantly higher in elderly heterozygousSGT-deficient mice but not for conjugated bilirubin (P<0.05). In addition, significant differences existed for the lipids between two elderly groups (P<0.05). Conclusions Heterozygous deficiency ofSGTgene induced changes of some hematological and biochemical parameters in elderly mice. It provides helpful information for further investigation onSGTinvolvement in some biological and pathological processes.
SGT; Heterozygous deficiency; Hematology; Blood biochemistry; Platelets; Mice; Aging
国家自然科学基金项目(编号:44164006,31200861,31100852)。
顾取良(1979-),女,研究方向:肿瘤分子生物学。E-mail: qlgu@gdpu.edu.cn。
王丽京(1962-),女,研究方向:分子病理学。E-mail: wanglijing@gdpu.edu.cn。
研究报告
R-33
A
1671-7856(2017) 06-0022-05
10.3969.j.issn.1671-7856. 2017.06.005
2017-01-24
