鼠伤寒沙门氏菌S.Typhimurium感染C57BL/6小鼠肠道模型的建立及表型分析
2017-08-07韦荣飞李梦媛徐大模
韦荣飞,李梦媛,徐大模,高 苒
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
鼠伤寒沙门氏菌S.Typhimurium感染C57BL/6小鼠肠道模型的建立及表型分析
韦荣飞,李梦媛,徐大模,高 苒
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
目的 建立鼠伤寒沙门氏菌S.Typhimurium感染C57BL/6小鼠肠道模型。方法 先用5% NaHCO3溶液灌胃,中和部分胃酸,提高鼠伤寒沙门氏菌S.Typhimurium的感染能力,随后进行鼠伤寒沙门氏菌S.Typhimurium灌胃攻毒。观察小鼠的临床症状,对小鼠的生存情况及体重进行统计学分析,并通过组织病理切片分析小鼠肠道组织病理变化等。结果 鼠伤寒沙门氏菌S.Typhimurium攻毒后C57BL/6小鼠出现体重下降、萎靡不振、寒颤及死亡等表型,解剖学水平显示小鼠肠道充血膨胀。病理分析结果显示小鼠小肠绒毛间质水肿、肠粘膜层坏死及炎性细胞浸润等。结论 成功建立鼠伤寒沙门氏菌S.Typhimurium感染C57BL/6小鼠肠道模型,该模型在研究相关免疫分子或细胞因子在S.Typhimurium引发肠炎过程中的生物学功能及治疗等方面具有重要的科学意义。
肠道感染;S.Typhimurium;C57BL/6;组织病理
鼠伤寒沙门氏菌是一种能够感染多种宿主的革兰氏阴性病原体,能够躲避宿主的天然免疫系统,在宿主体内进行复制并引发疾病[1]。鼠伤寒沙门氏菌感染畜禽造成巨大的经济损失,同时严重威胁人类健康,沙门氏菌是经食物传播的疾病中主要的病原菌。鼠伤寒沙门氏菌S.Typhimurium与沙门氏菌Paratyphi感染人类的途径相似,S.Typhimurium感染能够引起急性肠胃炎。目前,对于鼠伤寒沙门氏菌引发肠炎的发病机制及免疫、病理生理特征等方面的研究尚浅,需要构建合适的小鼠模型进行深入研究。然而,鼠伤寒沙门氏菌入侵小鼠体内后可造成类似人类伤寒样全身系统性感染,因此,构建鼠伤寒沙门氏菌急性感染模型将为研究沙门氏菌感染疾病的发病机制等提供便利。前期已有报道基于使用链霉素预处理方法建立鼠伤寒沙门氏菌感染小鼠模型[2],然而模型建立时间较长,容易导致肠道免疫系统损伤而影响实验结果。本研究利用5% NaHCO3溶液灌胃中和胃酸从而减少胃酸对鼠伤寒沙门氏菌的影响,避免对肠道免疫系统的影响,同时增加了鼠伤寒沙门氏菌的感染活性,且有效缩短了建模周期。
利用S.Typhimurium建立C57BL/6小鼠肠道感染模型对于研究沙门氏菌病原体入侵宿主的作用机制和疾病治疗,以及相关免疫调控分子在沙门氏菌感染过程中的免疫学功能及其C57BL/6转基因小鼠在沙门氏菌感染引发疾病过程中的病理变化分析等具有重要的科学意义,同时也为抗沙门氏菌感染药物的临床前试验提供保障[3-6]。
1 材料和方法
1.1 材料
1.1.1 实验动物及菌种:SPF级C57BL/6小鼠,6~8周龄,购自北京华阜康生物科技股份有限公司【SCXK(京)2014-0004】,饲养于中国医学科学院医学实验动物研究所动物实验室【SYXK(京)2014-002】。鼠伤寒沙门氏菌(Salmonella typhimurium,S.Typhimurium)标准菌种为英国格拉斯哥大学惠赠。
1.1.2 主要试剂:胰蛋白胨、酵母提取物、琼脂购自英国Oxiod公司,NaCl、NaHCO3购自国药集团化学试剂有限公司;苏木精、伊红购自北京中杉金桥生物技术有限公司;PCNA抗体购自Cell Signaling Technology公司。
1.2 方法
1.2.1 细菌培养:鼠伤寒沙门氏菌划线接种于固体无抗LB平板,37℃,过夜培养。随后挑取单菌落培养于无抗液体LB培养基,37℃,过夜静置培养,培养至对数期后,5 000 r/min,10 min,离心收集菌体,用PBS缓冲液调节浓度至108cfu/mL,用于小鼠攻毒。
1.2.2 鼠伤寒沙门氏菌S.Typhimurium感染小鼠模型的建立: PBS组和实验组各9只C57BL/6小鼠,鼠伤寒沙门氏菌攻毒前,每只小鼠灌胃5% NaHCO3溶液100 μL,中和胃酸后,采用PBS缓冲液调节浓度至108cfu/mL的鼠伤寒沙门氏菌,每只小鼠灌胃200 μL,对照组小鼠给予相同体积5% 的NaHCO3溶液和PBS缓冲液。正常条件饲养小鼠8 d。本研究相关实验均在生物安全2级(P2,BSL-2)实验室开展,IACUC批准号GR2016001。
1.2.3 动物表型分析:鼠伤寒沙门氏菌灌胃时(即0 d)和3 d后每天称量小鼠体重并观察小鼠的临床症状和死亡情况。并解剖濒临死亡小鼠,观察肠道病理形态,并进行石蜡切片和病理分析。
1.2.4 石蜡切片:组织固定:4%甲醛溶液固定48 h以上;酒精梯度脱水:70%、80%、90% Ⅰ、90% Ⅱ、95% Ⅰ、95% Ⅱ各20 min,100% Ⅰ、100% Ⅱ各15 min;透明:二甲苯Ⅰ、Ⅱ各10 min;浸蜡:蜡缸Ⅰ、Ⅱ、Ⅲ各30 min;包埋:用包埋机操作,将组织包埋于蜡中,制成蜡块;切片:调整适当厚度(5 μm),切片机切片;经摊片机摊片,后经烤片机烤片,制成白片。
1.2.5 免疫组化:白片脱蜡:将白片置于二甲苯Ⅰ、Ⅱ各10 min;复水:100% Ⅰ、100% Ⅱ、95%、90%、80%、75%的酒精各放8 min;双蒸水洗涤3次,每次2 min;3%的双氧水去除内源过氧化物酶15 min,注意避光;PBS洗3次,每次2 min;抗原修复:微波炉中高火将柠檬酸盐修复液煮沸,将片子浸入煮沸的柠檬酸盐修复液中,小火13 min,完毕后自然冷却至室温;蒸馏水洗1次,PBS洗3次,每次3 min;37℃,10%山羊血清封闭30 min;甩掉山羊血清,加PBS配制的PCNA抗体,4℃过夜;PBS洗3次,每次3 min;加二抗辅助剂,37℃,30 min;PBS洗3次,每次3 min;加辣根过氧化物酶标记的二抗,37℃,30 min;PBS洗3次,每次3 min;DAB显色,镜下观察;蒸馏水冲洗,苏木素染核10~30 s,自来水冲洗2 min,酒精盐酸分化5 s,自来水冲洗;脱水:70%、75%、80%、90%、95%、100%各2 min;透明:二甲苯Ⅰ、Ⅱ各4 min;中性树脂封片。
1.2.6 HE染色:按照免疫组化复水步骤将白片进行复水;双蒸水洗涤3次,每次2 min;苏木素染色2 min;自来水洗2 min;酒精盐酸分化10 s;自来水洗2 min;伊红染色2 min;自来水洗2 min;90%酒精1 min;100%酒精1 min;二甲苯I、II各4 min;中性树脂封片。
2 结果
2.1 鼠沙门氏菌感染降低C57BL/6小鼠的生存率
200 μL浓度为107cfu/mL的鼠伤寒沙门氏菌攻击C57BL/6小鼠3 d后,小鼠开始出现明显的临床症状,主要表现为萎靡不振、寒颤、被毛粗乱等;感染第4天,小鼠开始出现死亡,且8 d内全部死亡(图1)。对照组未见任何异常。

图1 鼠伤寒沙门氏菌感染降低C57BL/6小鼠的生存率Fig.1 S. Typhimurium decreased the survival rate of the S. Typhimurium-uinfected C57BL/6 mice
2.2 鼠伤寒沙门氏菌感染导致C57BL/6小鼠的体重减少
从鼠伤寒沙门氏菌攻击C57BL/6小鼠开始(第0天)直至第7天,对小鼠的体重进行统计学分析。结果如图2所示,对照组在整个实验过程中体重呈增加趋势,而鼠伤寒沙门氏菌感染组小鼠体重逐渐减少。
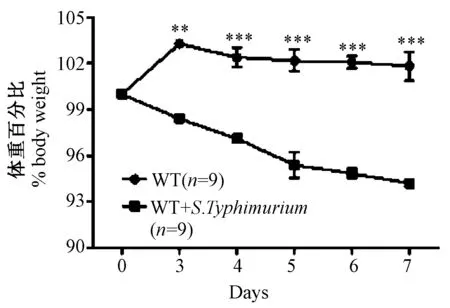
图2 鼠伤寒沙门氏菌攻击C57BL/6小鼠后小鼠的体重随时间而减轻Fig.2 Loss of body weight of the S. Typhimurium-infected mice
2.3 病理形态分析结果
鼠伤寒沙门氏菌感染C57BL/6小鼠4或7 d后处死小鼠,体外分离小肠,观察其形态变化,并对小肠进行石蜡切片和HE染色。病理组织学检查结果显示,鼠伤寒沙门氏菌感染后,肠道出现明显的充血膨胀(图3A)。与对照组相比(图3B),鼠伤寒沙门氏菌感染C57BL/6小鼠7 d后,小鼠小肠呈现明显的局部肠粘膜层坏死(图3C),且肠绒毛间质水肿严重(图3C和D)。此外,肠粘膜固有层炎性细胞浸润及小肠腺上皮细胞点状坏死等(图3E)。
2.4 小鼠肠道细胞增殖检测
利用PCNA抗体检测鼠伤寒沙门氏菌感染C57BL/6小鼠后小肠腺上皮细胞的增殖情况。结果如图4所示,与对照组相比(图4A),鼠伤寒沙门氏菌感染4 d后,小鼠小肠腺上皮细胞增殖明显减少

注: A:S. Typhimurium感染4 d后小肠病理形态观察;B:对照组(100×);C和D:鼠伤寒沙门氏菌感染7 d(100×);E图为鼠伤寒沙门氏菌感染4 d(400×),红色箭头指示炎性细胞。图3 鼠伤寒沙门氏菌感染C57BL/6小鼠后小肠组织学及病理学分析结果Note. A. Small intestine of a normal control mouse (upper) and a mouse at 4 days after S. Typhimurium infection (lower). B. Histological changes in the intestine of a normal control mouse, ×100); C and D indicate the histological changes in the intestine of mice at 7 days after S. Typhimurium infection, ×100; E. indicates histological changes in the intestine of a mouse at 4 days after S. Typhimurium infection. The red arrows indicate inflammatory cell infiltration. ×400.Fig.3 Pathological changes in the intestine of S. Typhimurium-infected mice. HE staining 。

注: A图为对照组(400×);B图为鼠伤寒沙门氏菌感染4 d(400×)。图4 鼠伤寒沙门氏菌感染C57BL/6小鼠后小肠腺上皮细胞增殖减少Note. A: A control mouse. B: A mouse at 4 days after S. Typhimurium infection. Immunohistochemical staining with PCNA antibody. ×400.Fig.4 Proliferation of intestinal glandular epithelial cells is reduced in the C57BL/6 mice after S. Typhimurium infection.
3 讨论
鼠伤寒沙门氏菌具有沙门氏菌的普遍特性,能够引起诸多宿主特异性的感染性疾病,包括感染小鼠导致类似人类伤寒的系统性疾病[7]。鼠伤寒沙门氏菌是对人类健康产生威胁的重要传染病源,其感染引起的沙门氏菌病对于人畜共患病的研究具有重要的意义[8]。
为更好地研究鼠伤寒沙门氏菌感染引起的疾病及后续研究相关免疫分子在沙门氏菌感染过程中的免疫学功能,我们成功构建了鼠伤寒沙门氏菌感染C57BL/6小鼠模型。为提高C57BL/6小鼠对鼠伤寒沙门氏菌感染的敏感性,鼠伤寒沙门氏菌攻毒前,先对小鼠进行5% NaHCO3溶液灌胃处理,中和部分胃酸。随后,每只小鼠灌胃107cfu/mL的鼠伤寒沙门氏菌200 μL。统计分析小鼠的生存情况及体重变化情况。病理分析小肠组织结构变化及免疫组化分析小肠细胞增殖情况。我们发现,鼠伤寒沙门氏菌感染后,C57BL/6小鼠萎靡嗜睡,第4天开始出现死亡,且8 d内全部死亡;小鼠体重逐渐减少;小肠绒毛间质水肿、肠粘膜层坏死及炎性细胞浸润;小肠腺上皮细胞增殖减少等。该模型可为临床研究奠定基础,同时,该模型也可用于抗沙门氏菌药物临床前试验药效评价等。此外,本研究为基于相关免疫分子C57BL/6基因敲除或转基因小鼠建立鼠伤寒沙门氏菌感染模型奠定了重要的基础,对于研究相关免疫分子在鼠伤寒沙门氏菌感染过程中发挥的免疫生物学功能具有重要的科学意义和价值。
[1] Matamouros S, Miller SI. S. Typhimurium strategies to resist killing by cationic antimicrobial peptides [J]. Biochim Biophys Acta. 2015, 1848(11 Pt B): 3021-3025.
[2] Wu S, Lu R, Zhang YG et al. Chronic Salmonella infected mouse model [J]. J Vis Exp,2010,39:1947.
[3] Mastroeni P, Sheppard M. Salmonella infections in the mouse model: host resistance factors and in vivo dynamics of bacterial spread and distribution in the tissues [J]. Microbes Infect. 2004, 6(4): 398-405.
[4] Tsolis RM, Kingsley RA, Townsend SM. et al. Of mice, calves, and men. Comparison of the mouse typhoid model with other Salmonella infections [J]. Adv Exp Med Biol. 1999, 473: 261-274.
[5] Kaufmann SH, Raupach B, Finlay BB. Introduction: microbiology and immunology: lessons learned from Salmonella [J]. Microbes Infect. 2001, 3(14-15): 1177-1181.
[6] Santander J, Curtiss R, 3rd. Salmonella enterica Serovars Typhi and Paratyphi A are avirulent in newborn and infant mice even when expressing virulence plasmid genes of Salmonella Typhimurium [J]. J Infect Dev Ctries. 2010, 4(11): 723-731.
[7] Asahara T, Shimizu K, Takada T. et al. Protective effect of Lactobacillus casei strain Shirota against lethal infection with multi-drug resistant Salmonella enterica serovar Typhimurium DT104 in mice [J]. J Appl Microbiol. 2011, 110(1): 163-173.
[8] Dolejska M, Villa L, Hasman H, et al. Characterization of IncN plasmids carrying bla CTX-M-1 and qnr genes in Escherichia coli and Salmonella from animals, the environment and humans [J]. J Antimicrob Chemother. 2013, 68(2): 333-339.
Etablishment and phenotypic analysis of a C57BL/6 mouse model ofS.Typhimuriuminfection
WEI Rong-fei, LI Meng-yuan, XU Da-mo, GAO Ran
( Institute of Laboratory Animal Science, Chinese Academy of Medical Sciences & Comparative Medical Center, Peking Union Medical College, Beijing 100021,China)
Objective To establish a C57BL/6 mouse model of intestinal infection induced byS.Typhimurium. Methods In order to improve the infectious sensitivity ofS.Typhimurium, C57BL/6 mice were intragastrically given 5% (w/v) NaHCO3.Then mice were challenged withS.Typhimurium. The health condition, survival and body weight of mice were observed from day 0 to day 7 after the bacterial infection. The pathological changes were also examined. Results the mice challenged withS.Typhimuriumshowed decreased body weight and typical clinical signs, including in appetence, piloerection and low survival rate. Macroscopic dissection revealed that intestinal hyperemia and swelling were founded in the mice challenged withS.Typhimurium. Histopathology showed intestinal epithelial and mucosal damages. Conclusions We have successfully established a C57BL/6 mouse model ofS.Typhimuriuminfection. This model may be of crucial significance for studying the biological functions of associated immunological molecules or cytokines in the process of inflammatory bowel disease induced byS.Typhimurium.
Intestinal infection;S.Typhimurium; C57BL/6 mouse; Histopathology
国家自然科学基金(81601375),协和青年基金资助,中央高校基本科研业务费专项资金资助(3332016077),中国医学科学院医学实验动物研究所基本科研业务费专项资助(2016ZX310033)。
韦荣飞(1990-),女,助理研究员,研究方向:免疫与肿瘤。E-mail: weirongfei2010@163.com。
高苒(1980-),女,副研究员,研究方向:肿瘤学、免疫学。E-mail: gaoran26@Hotmail.com。
研究报告
【文献标识码】 A 【文章编号】1671-7856(2017) 06-0033-04
10.3969.j.issn.1671-7856. 2017.06.007
2017-02-15
