miR-214通过靶向调控E2F3抑制肝癌细胞的增殖
2017-08-07杜朝阳杨如玉段丽娟
杜朝阳,杨如玉,李 超,段丽娟
(河南省南阳市中心医院血液科,河南 473001)
miR-214通过靶向调控E2F3抑制肝癌细胞的增殖
杜朝阳,杨如玉,李 超,段丽娟
(河南省南阳市中心医院血液科,河南 473001)
目的 探讨miR-214通过靶向调控E2F转录因子3(E2F3)抑制肝癌细胞的增殖。方法 RT-PCR法检测细胞株SMMC-7721、HepG2、SK-Hep-1和Huh 7中miR-214的表达量,并利用脂质体转染miR-214 NC及miR-214 mimics。采用MTT法检测miR-214对肝癌细胞活力的影响;Hoechst染色试剂盒检测miR-214对细胞凋亡的影响,流式细胞术检测miR-214对细胞周期的影响;Western blot及RT-PCR法检测miR-214对肝癌细胞中E2F3蛋白及mRNA表达量的影响,并通过荧光素酶报告基因进行验证。结果 SMMC-7721、SK-Hep-1、Huh 7及HepG2中miR-214的表达量分别为(0.83±0.08)、(0.32±0.03)、(0.33±0.03)、(0.08±0.01),其中HepG2中miR-214表达量最低,因此选用HepG2作为后续实验细胞株。HepG2细胞转染miR-214 NC及miR-214 mimics、miR-214 mimics组中miR-214表达量(0.65±0.06)明显高于miR-214 NC组(0.14±0.01),miR-214 mimics组细胞活力(0.35±0.03)明显低于miR-214 NC组(0.69±0.06),miR-214 mimics组细胞凋亡率(36.37±3.43)%明显高于miR-214 NC组(3.74±0.34)%,miR-214 mimics组G1期明(57.79±5.78)显长于miR-214 NC组(45.319±4.53),miR-214 mimics组中E2F3蛋白[(0.23±0.02)、(0.24±0.02)]及mRNA表达量明显低于miR-214 NC组[(0.98±0.09)、(0.99±0.10)],差异均具有统计学意义(P<0.01)。结论 miR-214过表达能通过下调E2F3表达抑制肝癌细胞的增殖。
miR-214,肝癌细胞;E2F3;增殖
原发性肝癌是肝细胞或肝内管细胞发生的恶性肿瘤,其中90%为肝细胞肝癌(hepatocellular carcinoma, HCC),是位居世界第五位及致死率第3位的肿瘤[1, 2]。目前,手术切除和肝移植是HCC最为有效的治疗方法,然而,临床研究表明超过50%的接受肝切除术的HCC患者出现术后复发[1, 2]。因此,探讨肝癌的发生发展的相关机制,对于肝癌的诊断,治疗及预后具有重要的意义。
MicroRNA(miRNA)是一类非编码小分子RNA,能够结合于靶基因mRNA的3’-UTR区域,降解或者阻遏靶基因的翻译,从而抑制靶基因的表达。近些年大量研究证实miRNA在肿瘤的发生发展中起着重要的作用,包括肝癌[3]。miRNA微阵列研究显示,miR-214在肝癌组织中的表达明显低于正常肝组织[4]。同时恢复肝癌细胞中miR-214的表达,能显著的抑制细胞的增殖,但具体的作用机制未知。而miRNA对细胞生物学行为的调控作用,大部分源于其对靶基因的调控作用[5, 6]。研究表明E2F家族基因E2F转录因子3(E2F3)在肝癌组织中高表达,并与肝癌的发生发展密切相关,且有研究显示miR-214与E2F3在多种病理情况下的表达具有相关性[7, 8],提示miR-214可能通过调控E2F3调控细胞的生物学行为。所以本研究将在此基础上,探讨miR-214在肝癌细胞株中的表达,及恢复其表达后对细胞的增殖、凋亡行为的影响及具体机制。
1 材料和方法
1.1 细胞株
人SK-Hep-1购于中国科学院细胞库。人HepG2、SMCC-7721、Huh 7购于美国菌种保藏中心(ATCC)。
1.2 试剂及主要仪器
四唑盐试剂(MTT)(美国Sigma公司);兔抗E2F3、GAPDH单克隆抗体(美国Epitmics公司);trizol试剂盒(美国Corning 公司);辣根过氧化物酶标记山羊抗兔IgG(H+L),Hoechst染色试剂盒,细胞周期检测试剂盒(碧云天生物技术研究所);胎牛血清,DMEM培养基,胰蛋白酶(Gibco公司);结晶紫(Sigma公司)。CO2培养箱,超净工作台(美国Thermo Scientific公司);TS100倒置显微镜(日本Nikon公司);FACS Calibur型流式细胞仪(美国BD 公司);迷你双垂直电泳仪,迷你转印电泳仪,ChemiDocTM XRS凝胶成像系统(美国Bio-Rad公司)。
1.3 miRNA合成、配制、存储及转染
在广州市锐博生物科技有限公司订购合成miR-214 mimic及对照mimic negative control(miR-214 NC)。合成样品先离心,然后每5 nmol miRNA中加入250 μL DEPC水稀释,配成20 μmol/L母液,分装,-20℃保存备用。转染前1 d,在无双抗培养基中接种细胞(6孔板,每孔加2000 μL,其他按比例增加或减少),转染时细胞的汇合度要达到50%;用适量无血清Opti-MEM® I培养基稀释miRNA (250 μL),轻轻混匀。摇匀Lipofectamine 2000,取适量用Opti-MEM® I稀释并轻轻混匀后室温孵育5 min。将稀释的Lipofectamine 2000和稀释的miRNA轻轻混合,室温孵育(20~30) min;将miRNA/Lipofectamine 2000复合物加入6孔板,前后轻轻摇动混合;6 h以后换成含10%血清的DMEM培养基,于37℃,CO2培养箱培养,并用RT-PCR检测miR-214的表达。
1.4 MTT检测细胞活力
将处于生长对数期的HepG2细胞消化,细胞浓度调整为2×104个/ mL,接种于96孔板,每孔200 μL,转染48 h后,加入20 μL终浓度为5 mg/mL的MTT,继续培养4 h后,加150 μL 二甲基亚砜,震荡10 min,采用酶标仪于570 nm处测吸光度(A)值,每个实验组三个平行复孔。
1.5 Hoechst染色检测细胞凋亡
将处于生长对数期的HepG2细胞接种于6孔板,细胞浓度调整为1×104个/ mL,接种于6孔板,每孔1 mL,转染48 h后,用不含EDTA的胰蛋白酶消化收集细胞,4%多聚甲醛固定15 min,PBS洗涤3次,加入Hoechst 33258染色液避光染色15 min,PBS洗涤3次,在荧光显微镜下观察并拍照。每个实验组三个平行复孔。
1.6 流式细胞术检测细胞周期
将处于生长对数期的HepG2细胞接种于6孔板,细胞浓度调整为1×104个/ mL,接种于6孔板,每孔1 mL,转染48 h后,按细胞周期检测试剂盒说明书进行检测:用不含EDTA的胰蛋白酶消化细胞,离心,并重悬,接着加入5 μL终浓度为10 mg/mL 的Rnase,37℃孵育1 h,再加入 碘化丙啶染液,室温下避光染色 30 min,用流式细胞仪进行细胞周期检测分析。每个实验组三个平行复孔。
1.7 RT-PCR验证miR-214在不同肝癌细胞株中的表达
参考trizol试剂盒使用说明书提取总RNA,并用微量紫外分光光度计检测RNA的纯度,通过一步法RT-PCR试剂盒将逆转录RNA,并进行PCR扩增,最后将扩增产物用于2%的琼脂糖胶电泳。引物分别加入25 μL PCR反应体系中,反应条件为94℃变性45 s,59℃复性45 s,72℃延伸60 s,共35个循环。miR-214上游引物:5’-GGACAGGACGCACAGTCA-3’,下游引物:5’- CAGACGAGGCTCCGTGGT-3’,E2F3上游引物:5’- AGAAAGCGGTCAATCAGTACCT-3’,下游引物:5’- TGGACTTCGTAGTGCAGCTCT-3’,GAPDH上游引物:5’-AGCCACATCGCTCAGACA-3’,下游引物:5’- TGGACTCCACGACGTACT-3’。
1.8 Western blot检测E2F3的表达
将处于生长对数期的HepG2细胞接种于6孔板,细胞浓度调整为1×104个/ mL,接种于6孔板,每孔1 mL,转染48 h后,刮下细胞,离心,后加入适量的RIPA裂解液,裂解30 min,离心,小心吸取上清液,即可获得总蛋白。根据BCA试剂盒测定蛋白浓度。蛋白变性,上样,进行十二烷基苯磺酸钠凝胶电泳,后湿法转膜30 min左右。将膜浸入一抗溶液(兔抗E2F3,GAPDH单克隆抗体,稀释度1:100)孵育,4℃过夜;次日二抗溶液(辣根过氧化物酶标记山羊抗兔IgG(H+L))中室温孵育1~2 h。将膜取出漂洗,在凝胶成像系统中曝光。用“Quantity one”软件统计分析各抗体条带灰度值。每个实验组三个平行复孔。
1.9 荧光素酶报告基因表达分析
miR-214及E2F3重组载体共转染到HepG2细胞中。分组如下: miR-214 mimics+Wt E2F3,miR-214 NC+ Wt E2F3,miR-214 mimics+Mut E2F3,miR-214 NC+ Mut E2F3。应用双荧光素酶检测系统检测转染好的荧光素酶活性,计算公式:相对荧光值=萤火虫荧光素酶荧光值/海肾荧光素酶荧光值。每个实验组三个平行复孔。
1.10 统计学方法

2 结果
2.1 四株肝癌细胞中miR-214的表达情况
如图1,RT-PCR结果显示,miR-214在SMMC-7721、SK-Hep-1、Huh 7及HepG2细胞中的表达情况分别为(0.83±0.08),(0.32±0.03),(0.33±0.03),(0.08±0.01),其中HepG2中miR-214表达量最低,因此选用HepG2作为后续实验细胞株。
2.2 miR-214 mimics对HepG2肝癌细胞中miR-214表达量的影响
如图2所示,RT-PCR结果显示,miR-214 NC及miR-214 mimics在HepG2细胞中的表达量分别为(0.14±0.01),(0.65±0.06),二者比较,差异具有统计学意义(P<0.01)。
2.3 miR-214 mimics对肝癌细胞活力的影响
HepG2细胞转染miR-214 NC及miR-214 mimics,经MTT实验发现,二者细胞活力分别为为(0.69±0.06),(0.35±0.03),二者比较,差异具有统计学意义(P<0.01)。
2.4 miR-214 mimics对肝癌细胞凋亡情况的影响
如图3所示,HepG2细胞转染miR-214 NC及miR-214 mimics,经annexin V/PI流式细胞术检测发现,二者细胞凋亡率分别为(3.74±0.34)%,(36.37±3.43)%,二者比较,差异具有统计学意义(P<0.01)。
2.5 miR-214对肝癌细胞周期的影响
如图4所示,HepG2细胞转染miR-214 NC及miR-214 mimics,二者G1期细胞数目分别为(45.319±4.53),(57.79±5.78),二者比较,差异具有统计学意义(P<0.01)。
2.6 miR-214对HepG2肝癌细胞中E2F3表达量的影响
如图5所示,HepG2细胞转染miR-214 NC及miR-214 mimics,二者细胞中E2F3的mRNA及蛋白表达量分别为(0.98±0.09),(0.24±0.02)及(0.99±0.10),(0.23±0.02),二者比较,差异具有统计学意义(P<0.01)。
2.7 荧光素酶报告基因表达分析
将miR-214 mimics、miR-214 NC及野生型载体pMir E2F3 3’UTR-Wt、及突变型载体pMir E2F3 3’UTR-Mut转入HepG2细胞中,结果发现,miR-214 mimics与野生型载体pMir E2F3 3’UTR-Wt共转染组的荧光信号强度明显弱于其它转染组,差异具有统计学意义(P<0.01)。而对于突变型载体pMir E2F3 3’UTR-Mut来说,各组间荧光强度无任何差别(P>0.05),说明E2F3是miR-214下游靶基因。见图6。
3 讨论
原发性肝癌在恶性肿瘤发病中居世界前五,也是世界第三大致死性癌症[1, 2]。研究表明,在各种病理、生理过程,包括癌症过程中,许多miRNAs异常表达[3]。miRNAs作为一类新型的调节因子,既可以作为原癌基因发挥作用,也可以作为抑癌基因进而调节细胞的生物学特性[3]。miR-214是在小鼠,大鼠及鸡等种属中高度保守的非编码RNA分子,位于染色体1q24.3。最初把miRNAs和癌症联系在一起是在慢性淋巴细胞白血病的研究中,研究发现在大多数的这类病人中miR-15a和miR-214-1的表达是下调或是缺失的[9]。后续miRNA微阵列进一步的证实肝癌组织中miR-214的表达低于癌旁组织[4]。提示miR-214在肝癌组织中是作为抑癌基因存在的,并参与肝癌的发生发展过程。因此本研究在此基础上首先通过RT-PCR法检测4株肝癌细胞株SMMC-7721、SK-Hep-1、Huh 7及HepG2中miR-214的表达,结果表明miR-214在HepG2的表达量最低,因而选为后续实验细胞株。接着通过RT-PCR法证实了miR-214 NC及miR-214 mimics成功转染HepG2细胞。所以进一步采用MTT法,Hoecsht染色法检测miR-214 mimics对HepG2细胞活力及凋亡情况的影响,结果表明miR-214 mimics能显著的降低细胞活力,并提高细胞凋亡率,与Xu等[5]在骨肉瘤细胞,Yang等[6]在胃癌细胞株的研究结果一致,从而说明恢复miR-214的表达能显著的抑制HepG2的增殖,并诱导细胞凋亡。而肿瘤细胞的不可控制的生长增殖源于细胞周期的紊乱,其中细胞周期一般分为G1、G2/M及S期,且G1期及G2期是多数抗癌药物作用肿瘤细胞的靶点[10]。miR-214能够通过调控细胞周期相关蛋白Cyclin D1,CDK3及CDK6的表达,从而使细胞周期阻滞于G1期,最后使肝癌细胞DNA复制及有丝分裂阻断,最终导致细胞增殖受阻[11, 12]。所以本研究采用流式细胞术检测miR-214 mimics对HepG2细胞周期的影响,结果与上述报道一致[11, 12],miR-214 mimics能显著的延长HepG2细胞的G1期,使细胞周期阻滞于G1期,最终导致细胞增殖阻断。

注:1:miR-214 NC;2:miR-214 mimics图5 miR-214 mimics对HepG2肝癌细胞中E2F3表达量的影响Fig.5 Effect of miR-214 mimics on expression of E2F3 in the HepG2 cells

注:1:SMMC-7721;2:SK-Hep-1;3:Huh 7;4:HepG2图1 四株肝癌细胞中miR-214的表达情况Fig.1 Expression of miR-214 in the four hepatocellular carcinoma cells

注:1:miR-214 NC;2:miR-214 mimics图2 miR-214 mimics对HepG2肝癌细胞中miR-214表达量的影响Fig.2 Effect of miR-214 mimics on expression of miR-214 in the HepG2 cells

注:1:miR-214 NC;2:miR-214 mimics图3 miR-214 mimics对HepG2肝癌细胞凋亡情况的影响(×200)Fig.3 Effect of miR-214 mimics on cell apoptosis in the HepG2 cells
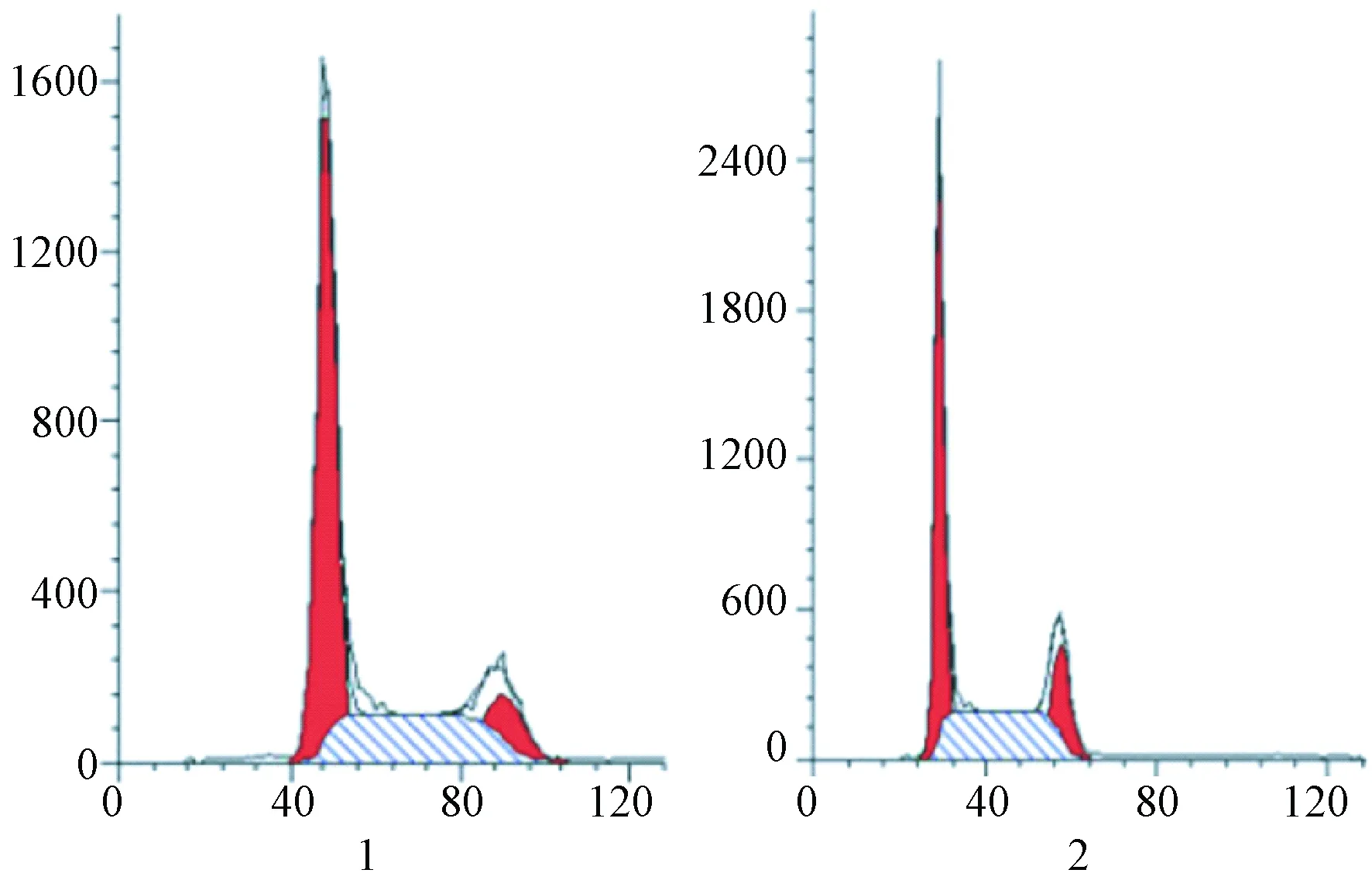
注:1:miR-214 NC;2:miR-214 mimics图4 miR-214 mimics对HepG2肝癌细胞周期的影响Fig.4 Effect of miR-214 mimics on cell cycle in the HepG2 cells

1:pMir E2F3 3’UTR-Wt;2:pMir E2F3 3’UTR-Mut图6 荧光素酶报告基因表达分析Fig.6 Luciferase reporter gene expression analysis与miR-214 NC比较,**P<0.01Compared with the miR-214 NC,**P<0.01
miRNAs对肿瘤细胞生物学行为的影响,一般是通过调控靶蛋白表达量来实现的,有报道证实1/3蛋白的转录表达是由miRNAs所调控的[13]。E2F家族最初是在腺病毒E2基因的研究中发现的,后面陆续发现了8个的E2F家族成员,这8个E2F家族成员,由于结构上的差异,导致了功能上的不同。其中E2F3属于激活的亚群,能够促使静息细胞快速的从G1期进入S期,在细胞的增殖与凋亡过程中发挥着重要的作用。同时研究已经显示E2F3在肝癌组织中高表达,且通过下调E2F3表达,能促使肝癌细胞周期阻滞在G1期[8, 14]。另外研究已经表明miR-214与E2F3在多种病理过程中的表达量具有相关性,且有研究也发现E2F3是miR-214的靶基因[14, 15]。所以本研究利用荧光素酶报告基因检测E2F3是否是miR-214的靶基因,结果表明野生型的E2F3活性被miR-214 mimics显著下调,提示E2F3是miR-214的靶基因,接着采用western blot检测miR-214 mimics对E2F3蛋白及mRNA表达量的影响,结果表明miR-214 mimics能显著的降低E2F3蛋白及mRNA的表达,进一步的证实了E2F3确实是miR-214的靶基因。
综上所述,提高肝癌细胞HepG2中miR-214的表达,能显著的降低细胞活力,提高细胞凋亡率,并使细胞周期阻滞在G1期,同时能够靶向的下调E2F3表达。
[1] de Lope C R, Tremosini S, Forner A,etal. Management of HCC[J]. J Hepatol, 2012,56 Suppl 1:S75-S87.
[2] Finn R S. Advanced HCC: emerging molecular therapies[J]. Minerva Gastroenterol Dietol, 2012,58(1):25-34.
[3] Mizuguchi Y, Takizawa T, Yoshida H,etal. Dysregulated miRNA in progression of hepatocellular carcinoma: A systematic review[J]. Hepatol Res, 2016,46(5):391-406.
[4] Peveling-Oberhag J, Seiz A, Doring C,etal. MicroRNA Profiling of Laser-Microdissected Hepatocellular Carcinoma Reveals an Oncogenic Phenotype of the Tumor Capsule[J]. Transl Oncol, 2014,7(6):672-680.
[5] Xu Z, Wang T. miR-214 promotes the proliferation and invasion of osteosarcoma cells through direct suppression of LZTS1[J]. Biochem Biophys Res Commun, 2014,449(2):190-195.
[6] Yang T S, Yang X H, Wang X D,etal. MiR-214 regulate gastric cancer cell proliferation, migration and invasion by targeting PTEN[J]. Cancer Cell Int, 2013,13(1):68.
[7] Katoh M. Cardio-miRNAs and onco-miRNAs: circulating miRNA-based diagnostics for non-cancerous and cancerous diseases[J]. Front Cell Dev Biol, 2014,2:61.
[8] Zeng X, Yin F, Liu X,etal. Upregulation of E2F transcription factor 3 is associated with poor prognosis in hepatocellular carcinoma[J]. Oncol Rep, 2014,31(3):1139-1146.
[9] Calin G A, Cimmino A, Fabbri M,etal. MiR-15a and miR-16-1 cluster functions in human leukemia[J]. Proc Natl Acad Sci U S A, 2008,105(13):5166-5171.
[10] Vermeulen K, Van Bockstaele DR, Berneman ZN. The cell cycle: a review of regulation, deregulation and therapeutic targets in cancer[J]. Cell Prolif, 2003,36(3):131-149.
[11] Wang P, Chen S, Fang H,etal. miR-214/199a/199a* cluster levels predict poor survival in hepatocellular carcinoma through interference with cell-cycle regulators[J]. Oncotarget, 2016,7(1):929-945.
[12] Zhang L L, Guo Y J, Zhao C N,etal. Effects and mechanism of miR-214 on hepatocellular carcinoma[J]. Asian Pac J Trop Med, 2015,8(5):392-398.
[13] 刘浩, 尹华斌, 纪方. MicroRNA与肿瘤的相关研究进展[J]. 现代生物医学进展, 2012,12(7):1388-1390.
[14] Cao T, Li H, Hu Y,etal. miR-144 suppresses the proliferation and metastasis of hepatocellular carcinoma by targeting E2F3[J]. Tumour Biol, 2014,35(11):10759-10764.
[15] Yang Y, Chang S, Zhao Z,etal. MicroRNA-214 suppresses the proliferation of human hepatocellular carcinoma cells by targeting E2F3[J]. Oncol Lett, 2015,10(6):3779-3784.
Inhibition of the proliferation of hepatocellular carcinoma cells by miR-214 via regulation of E2F3 expression
DU Zhao-yang, YANG Ru-yu, LI Chao, DUAN Li-juan
(Department of Hematology, Nanyang Central Hospital, Nanyang, Henan Province 473001, China)
Objective To explore the effect of inhibition of miR-214 expression on the proliferation of hepatocellular carcinoma cells via regulation of E2F3 expression. Methods The expression of miR-214 in SMMC-7721, HepG2, SK-Hep-1 and Huh 7 cells was examined by RT-PCR. Hepatocellular carcinoma cells were transfected with miR-214 NC and miR-214 mimics with liposomes. The expression of miR-214 was detected by RT-PCR. The cell viability was detected by MTT assay. Cell apoptosis was detected by Hoechst staining. Cell cycle was detected by flow cytometry. Western blot, RT-PCR and dual luciferase reporter gene assay were used to detect whether E2F3 was a downstream target gene of miR-214. Results The expression of miR-214 in SMMC-7721, HepG2, SK-Hep-1 and Huh 7 cells was 0.83±0.08, 0.32±0.03, 0.33±0.03, and 0.08±0.01, respectively. The expression of miR-214 in the HepG2 cells was the lowest, so HepG2 cells were selected as the subsequent experimental cell line. Compared with the miR-214 NC group, the expression of miR-214 (0.65±0.06 vs. 0.14±0.01) was up-regulated, the cell viability (0.35±0.03 vs. 0.69±0.06) was decreased, cell apoptosis rate [(36.37±3.43)% vs. (3.74±0.34)%] was increased, the G1 phase of the cell cycle (57.79±5.78 vs. 45.319±4.53) was prolonged, the expression of E2F3 protein (0.23±0.02 vs. 0.98±0.09) and mRNA (0.24±0.02 vs. 0.99±0.10) was significantly down-regulated in the miR-214 mimics group (P<0.01). Conclusion miR-214 mimics suppress the HepG2 cell proliferation via targeted down-regulation of E2F3 expression.
miR-214; Hepatocellular carcinoma; E2F3; Proliferation
杜朝阳(1974-),女,主治医师,主要研究方向:血液内科E-mail: doctor681@163.com。
研究报告
R-33
A
1671-7856(2017) 06-0027-06
10.3969.j.issn.1671-7856. 2017.06.006
2016-10-26
