酸敏感离子通道的调控新进展
2017-08-07鲁璟一肖哲曼卢祖能
鲁璟一 肖哲曼 卢祖能
酸敏感离子通道的调控新进展
鲁璟一 肖哲曼 卢祖能
酸敏感离子通道(acid-sensing ion channels, ASICs)是一类由氢离子(H+)激活的配体门控阳离子通道,是上皮钠离子通道/退化蛋白(ENaC/DEG)超家族一个分支。1980年Krishtal 等[1]在神经元上首次记录到了一种被H+激活的阳离子电流, 猜测细胞膜上可能存在质子受体。1997年Waldmann等[2]克隆了第1个被酸激活的通道蛋白,将其命名为酸敏感离子通道(acid-sensing ion channels, ASICs)。此后,人们对ASICs的研究进展也更加迅速。在啮齿类动物中发现 4 种编码酸敏感离子通道的基因,分别为 ACCN1、ACCN2、ACCN3 和 ACCN4,迄今为止已成功克隆了6种ASICs亚基蛋白,即ASIC1a、ASIC1b (BNC2)、ASIC2a (MDEG1,BNC1)、ASIC2b (MDEG2)、ASIC3 (DRASIC)和ASIC4。近年来,研究发现ASICs参与多种疾病的发生、发展过程,具有重要的生理和病理意义,已成为神经生物学中发展最为迅速的研究内容之一。本研究目的在于综述近年国内外酸敏感离子通道蛋白分布、功能及其调节机制的研究进展。
1 ASICs的结构及分布
ASICs 在体内分布广泛, 但其不同亚基存在着分布特异性。它们具有相同的拓扑结构:2个疏水跨膜区域(TM)、一个短的胞内氨基末端(N末端)、羧基末端(C末端)和一个夹在疏水域之间的大的富含半胱氨酸的胞外环(ECD)。2007年Gouaux等首次描绘酸敏感离子通道的三维结构,指出其中大的ECD突出于膜外,3个独立的亚基形成三聚体,共同构成了杯状的酸敏感离子通道。在原子层面酸敏感通道看起来像一个紧握的手,质子主要结合在酸囊袋、“手掌”、“腕关节”处(图1)[3]。
在神经系统中ASIC1a亚基主要在中枢的大脑皮质、海马、小脑、上丘脑、脊髓和外周的背根节神经元(DRG)等部位表达,在外周软骨组织、人类造骨细胞和味蕾细胞中也有表达,它遍及胞体并沿着轴突和树突的分支分布,但在突触小体或突触膜上分布很少[5]。此外,在人的肠神经节细胞中也有ASIC1a亚基的表达。目前ASIC1b只发现存在于外周背根神经节中。 ASIC2a和ASIC2b亚基广泛分布于神经系统的各部分,包括人的肠神经节细胞。ASIC3主要存在于外周背根神经节,也包括人的肠神经节细胞[6],但也有报道显示ASIC3在中枢神经系统中有表达[7]。ASIC4亚基在神经系统各个部位均有分布,在腺垂体中表达量尤其多[8]。
非神经系统中也有ASICs的分布。曾报道在人的肺和睾丸,有ASIC3亚基mRNA的表达[9]。在人的骨细胞中也发现了ASICs的存在[10]。在味觉细胞中也有ASICs亚基的表达。
2 ASICs的功能
在中枢神经系统中ASICs被认为参与了学习记忆过程,Welsh等发现ASIC1a参与突触可塑性,证明其在学习记忆过程中发挥了作用[11],且与惊恐和焦虑的产生也有一定的关系[12]。多种研究表明,ASIC1a在脑缺血中也起到了重要的作用。而ASIC1a和ASIC2b可能参与了症状性癫痫的发生过程。此外,ASICs可能参与了帕金森病和亨廷顿氏舞蹈病的发生过程,与肝性脑病引起的高血氨综合症、恶性胶质瘤的发生、发展也存在着某种联系[13]。

图1 酸敏感离子通道的结构[4] 1a为酸敏感离子通道二维结构模拟图;1b为酸敏感离子通道三维结构模拟图;1c为酸敏感离子通道在原子层面看起来像一个紧握的手;(TM,transmembranedomin)为跨膜结构域;N(amino)为氨基;C(carboxy)为羧基
在外周神经系统中ASICs已经被普遍认为是一种伤害性感觉的受体,并在炎症、缺血和组织酸中毒等病理变化中起作用[14]。ASICs参与形成或调制了机械感觉,但在皮肤和内脏发挥的功能是不同的[15]。ASICs作为人体感受皮肤、肌肉酸痛的主要感受器,其在痛觉中也发挥着作用, ASlC1主要和内脏痛有关,参与感受消化道牵拉等机械刺激,ASIC3主要参与外周慢性痛的调制,但是ASICs只是组成痛觉感受器的一部分,即使敲除ASIC基因,也不能完全去除任何一种形式的痛觉[16]。
Ugawa等人证实, ASIC2a同聚体或ASIC2a/ASIC2b异聚体参与了酸味觉的形成,但ASICs介导的味觉信号传导在不同的物种并不相同。Ettaiche等人发现,ASIC2可以抑制视杆细胞的光传导过程,对光信号的传导起到负性调控作用,ASIC1a则对光信号的传导起到正性调控作用[17]。有实验表明,多种ASICs亚基在耳蜗中有表达,但ASICs对听觉的功能作用还有待进一步证实[18]。
3 ASICs的调控
ASICs作为细胞膜受体,除了感受细胞外细微的pH值变化外,还受细胞内、外各种调控分子的调控。调控ASICs的分子,除了细胞外H+外,还包括二价阳离子如钙、锌、镁;多胺类如精胺、胍丁胺;神经肽如强啡肽、神经肽FF和FMRF肽;局部缺血和炎症条件下产生的调控分子如乳酸盐、花生四烯酸、NO、三磷酸腺苷、5-羟色胺等;阿米洛利、非甾体抗炎药和萘莫司他同样能有效地抑制ASICs,一些毒素也能抑制或激活ASICs(图2)[19]。
3.1 内源性调控因子
3.1.1 二价阳离子
Ca2+对ASIC1a、ASIC1b和ASIC3亚基都有调控作用。Ca2+对ASlC3亚基的抑制是直接结合阻断。Ca2+对ASIC1a电流幅值的调控取决于不同的给药方式:当共给予Ca2+和H+时,Ca2+浓度依赖性的抑制ASIC1a介导的电流,而当给予高浓度Ca2+后再共给予Ca2+和H+时, ASIC电流也出现抑制;但是当给予高浓度Ca2+后再仅仅给予H+时, ASIC电流反而得到了增强。说明在ASIC1a亚基至少存在两个Ca2+作用位点,一个是通道阻断位点,Ca2+与之结合可以阻断离子电流;另一个是调节性位点,Ca2+与之结合可以引起通道蛋白变构,从而影响离子电流大小[20]。Mg2+对ASICs的调控类似于Ca2+。Zn2+可以抑制ASIC1a同聚体介导的电流,对ASIC1a+2a异聚体的作用表现为双向调节,而Zn2+对ASIC2a同聚体或含有ASIC2a的异聚体(如ASIC1a+2a、ASIC2a+3)介导的电流则表现为增强作用[21]。
Ni2+和Cd2+都可以浓度依赖且电压不依赖的方式抑制ASIC电流, Ni2+特异性的抑制ASIC1a和ASIC1a+2a通道电流。Cd2+则特异性的抑制同聚体ASIC2a和ASIC3,异聚体ASIC1a+2a、1a+3和2a+3通道电流[21]。Gd3+可以抑制ASIC3和ASIC2a+3通道电流。
3.1.2 多胺类
精胺通过直接与通道的ECD结合提高了ASIC1a的活动性[22],与其他内源性调控因子不同,胍丁胺直接在中性环境下激活ASIC3,其主要通过与ECD上的质子独立配合基结合位点结合来实现此功能[23]。

图2 酸敏感通道的相互作用和调控 酸敏感通道主要通过钠离子,细胞内钠离子的增多导致了膜去极化,引起钙通过电压门控通道(VGCC)和NMDA受体内流,继而通过钙调蛋白激酶II(CaMKII)磷酸化影响下游;ASICs主要被一些内源性和外源性调控因子通过ECD上的位点调控,内源性调控因子包括H+,二价阳离子、多胺类、神经肽、局部缺血和炎症条件下产生的调控分子等;阿米洛利、非甾体抗炎药和萘莫司他同样能有效的抑制ASICs,一些毒素也能抑制ASICs。+为activate(激活);⁃为inhibit(抑制)。VGCC(voltage⁃gatedcalciumchannel)为电压门控钙通道;NMDAR(N⁃methyl⁃D⁃asparticacidreceptor)为N⁃甲基⁃D⁃天冬氨酸受体;CaMKII(Calmodulin⁃DependentProteinKinaseII)为钙调蛋白激酶II;ca2+(calmodulin⁃)为钙离子;Na+(sodion⁃)为钠离子;Zn2+(zinc⁃)为锌离子。
3.1.3 神经肽
氨基化合物 FMRF及其类似物(神经肽FF和神经肽AF)并不能直接激活ASIC通道,但能增强质子门控电流的强度,减慢ASIC电流的失活速度。另外,它们可以上调异聚体ASIC基因的表达[24]。其中神经肽FF对ASIC1a作用甚轻而对ASIC3影响较大[25]。
强啡肽是在中枢神经系统中大量表达的内源性神经肽,强啡肽A通过直接作用于通道而增强ASIC1a活性,大强啡肽也通过同样的方式促进酸诱导的神经元死亡[25]。
3.1.4 局部缺血和炎症产物
炎症和缺血缺氧条件下机体产生许多代谢产物如花生四烯酸、乳酸盐、缓激肽和一氧化氮。乳酸可以通过鳌合细胞外的二价金属阳离子(Ca2+和Mg2+)而间接的上调ASIC电流。神经生长因子(NGF)和5-HT可以通过ASIC3编码基因的启动子,上调该通道的表达,其中NGF通过TrkA/PKC和TrkA/JNK两条信号通路作用于ASIC3编码基因启动子的AP1反应元件。5-HT2R通过同源三聚体Gq/11蛋白激活磷脂酶Cβ(PLCβ),PLCβ胞膜上的磷脂酰肌醇4.5-二磷酸[PI(4.5)P 2]水解成2个第二信使,即1,4,5-三磷酸肌醇(IP3)和二酰基甘油(DAG),IP3释放内质网中储存的钙离子,DAG激活蛋白激酶C(PKC),PKC通过酸敏感离子通道C末端的PDZ 结合域与PICK1相互作用,增高酸敏感离子通道活性和表达水平(图3)[25]。花生四烯酸(AA)可以直接调控ASICs,背根感觉神经元中的AsIC1a、ASIC2a和ASIC3都是其作用位点,而对小脑蒲肯野神经元中的ASIC电流则表现为上调作用[25]。
3.1.5 信号分子
一些信号分子也能通过磷酸化作用调控ASIC通道功能,例如Ca2+/CAMKII可增加ASIC电流振幅,磷脂酰肌醇-3激酶(PI3K)被TrkB激活后可通过调控脑源性神经营养因子(BDNF),通过Akt蛋白增强ASICs的表达(图3)[25]。
PKC降低ASIC1活性但增加ASIC2活性,寡肽片段CFTR是一种PKC调节剂,可以上调ASIC1a/ASIC2a共表达的ASIC通道,PKC的激活剂OAG可以增强30%左右的ASIC2a电流,而当PDZ域的蛋白PICK1与其共同作用时则可增加3倍左右的电流幅度。活性氧也能通过影响ECD中的半胱氨酸剩余物影响ASIC通道功能。NO、琉基还原剂谷胱甘肽增加ASIC电流,而过氧化氢只降低ASIC1a的表达[20]。
大麻素-1受体(CB1R)主要调节疼痛,它的激活剂WIN55-212-2可以可逆地减少大鼠外周感觉神经的ASIC电流振幅,CB1R可以抑制腺苷环化酶(AC)引起的cAMP水平的减少,cAMP通过抑制PKA与AKAP150的结合减少了ASIC电流的振幅[20]。
3.2 药物和毒素
3.2.1 药物

图3 ASIC通道相关的信号传导通路[20] +(activate)为激活;⁃(inhibit)为抑制。5⁃HT2R(serotonin2receptor5⁃)为羟色胺受体2;PLCβ(phospholipaseCβ)为磷脂酶Cβ;PI(4,5)P2(phosphatidylinositol4,5⁃bisphosphate)为磷脂酰肌醇4,5⁃二磷酸;IP3(inositol1,4,5⁃trisphosphate)为1,4,5⁃三磷酸肌醇;IP3R(inositol1,4,5⁃triphosphatereceptor)为1,4,5⁃三磷酸肌醇受体;ER(endoplasmicreticulum)为内质网;PKC(proteinkinascC)为蛋白激酶C;DAG(diacylglycerol)为二酰基甘油;TrkB(tropomyosin⁃relatedkinaseB)为原肌球蛋白相关激酶B;BDNF(brain⁃derivedneurotrophicfactor)为脑源性神经营养因子;PI3⁃K(phosphatidylinositol3⁃kinase)为磷脂酰肌醇3⁃激酶;PI(3,4,5)P3(phosphatidylinositol3,4,5⁃trisphosphate)为磷脂酰肌醇3,4,5⁃三磷酸;Akt(serine/threoninekinase)为丝氨酸/苏氨酸激酶;PICK1(proteininteractingwithCkinase1)为蛋白激酶C相互作用蛋白1;ASIC(acid⁃sensingionchannel)为酸敏感离子通道;AA(arachidonicacid)为花生四烯酸;AKAP150(A⁃kinaseanchoringprotein150)为A型激酶锚定蛋白150;cAMP(cyclicadenosinemonophosphate)为环腺苷酸;PKA(cAMP⁃dependentproteinkinaseA,cAMP)为依赖性蛋白激酶A;AC(adenylatecyclase)为腺苷酸环化酶;CB1R(cannabinoid⁃1recep⁃tor)为大麻素受体1
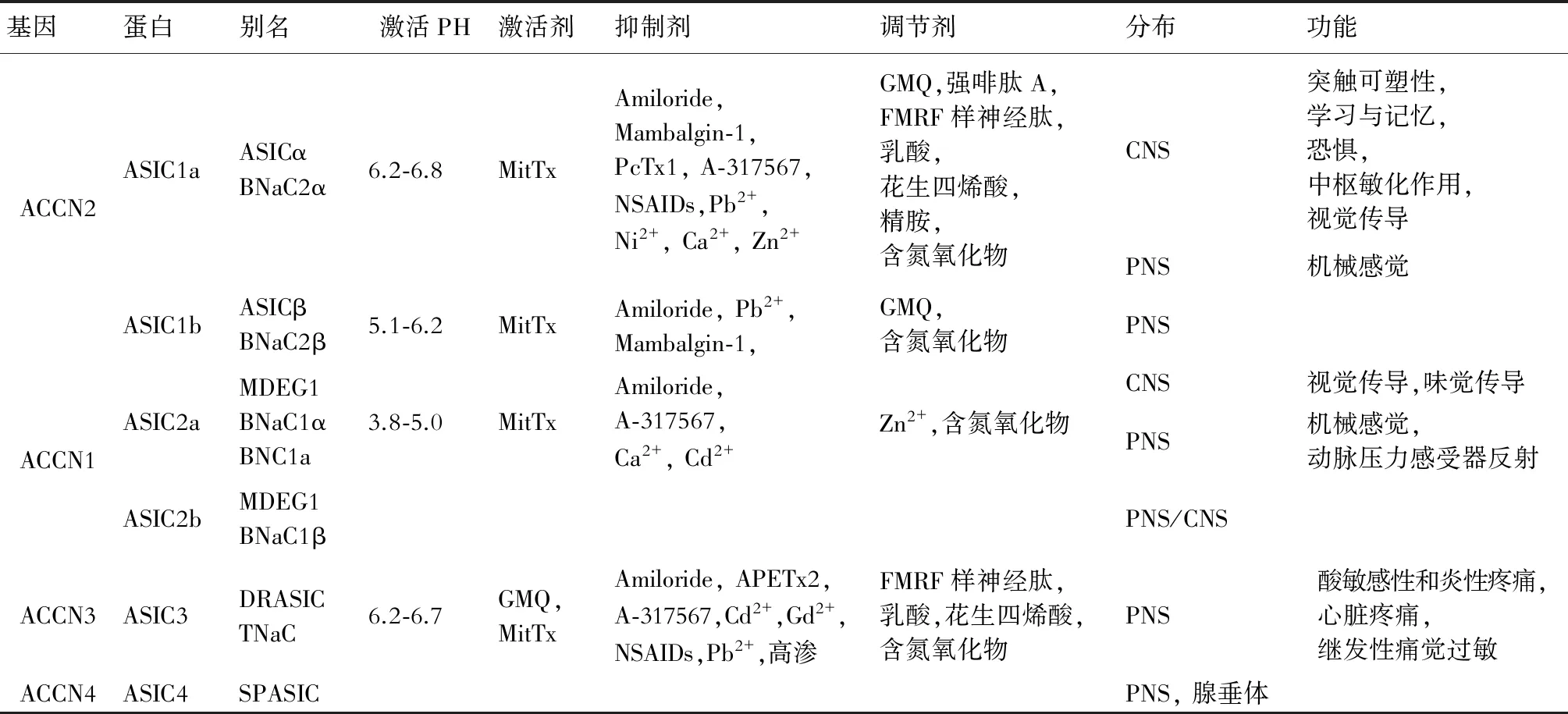
表1 酸敏感通道的分布,功能和调控因子
氨氯吡咪及其类似物是目前已知的一大类小分子 ASICs 抑制剂,对H+引起的痛觉感受有抑制作用,可以阻断伤害感受神经末梢中的 Na+/H+交换泵(NHE)。Amiloride是一种氨氯毗咪类的利尿药,它是ENaC超家族的非特异阻断剂,微摩浓度的Amiloride可以浓度依赖性地抑制ASIC电流的幅值,而且可以可逆地抑制酸诱导的神经细胞膜兴奋性升高和细胞内Ca2+浓度的升高[13]。 非甾体抗炎药(NSAIDs)是一类具有解热、镇痛作用的药物,其作用机制主要是抑制花生四烯酸代谢过程中的环氧合酶(COX)。因此,NSAIDs可以抑制炎症引起的感觉神经中ASICs表达量的增加[13]。
A-317567最初是作为尿激酶抑制剂设计合成的一个新型萘咪类化合物,它可以浓度依赖性地抑制天然细胞中ASIC1a样、ASIC2a样和ASIC3样电流[13]。NS838是一种新的小分子ASICs 抑制剂,可以强力且特异地阻断ASIC1a或ASIC3亚基,可以有效地减轻病理性的疼痛[26]。
3.2.2 毒素
在体外实验中一些毒液中提取的毒素也能抑制或激活ASICs,并作为探索ASIC通道功能的实验工具被广泛使用, Psalmotoxin1(PcTx1)是一种存在于狼蛛毒液中碱性多肽毒,Mambalgin-1是一种存在于黑眼镜蛇的毒液中的肽类,它们都可以特异性地抑制ASIC1通道,MitTx是一种德州珊瑚蛇体内的多肽毒素,可以在中性环境下激活ASIC1a和ASIC1b通道[19]。APETx2是一种特异性的ASIC3抑制剂,非天然小分子配体2-肽-4-甲基喹唑啉(GMQ)可以在中性环境下持续地激活ASIC3,PhcrTx1是一种人工萃取出的海葵毒素合成物,可以抑制大鼠DRG上的ASIC电流峰[13](表1)。
综上所述,ASICs在体内分布广泛,参与多种生理和病理过程,受细胞内、外多种调控因子的调控,与很多疾病都存在一定的联系。研究ASICs的作用机制及信号通路对发现更多的神经精神疾病的治疗方法是很有意义的。但是,我们对ASICs在许多疾病中表达的调节机制仍处于探索之中,相关分子信号通路尚待更加深入、系统地研究。
[1] Krishtal OA,Pidoplichko VI.A receptor for protons in the nerve cell membrane[J].Neuroscience,1980,5(12):2325-2327.
[2] Waldmann R,Champigny G,Bassilana F,et al.A proton-gated cation Channel involved in acid-sensing[J].Nature,1997,386(6621):173-177.
[3] Jasti J,Furukawa H,Gonzales EB,et al.Structure of acid-sensing ion Channel 1 at 1.9 A resolution and low pH[J].Nature,2007,449(7160):316-323.
[4] No l J,Salinas M,Baron A,et al.Current perspectives on acid-sensing ion channels: new advances and therapeutic implications[J].Expert Rev Clin Pharmacol,2010,3(3):331-346.
[5] Alvarez DD,Krueger SR,Kolar A,et al.Distribution,subcellular localization and ontogeny of ASIC1 in the mammalian central nervous system[J].J Physiol,2003,546(Pt 1):77-87.
[6] Ugawa S,Ueda T,Takahashi E,et al.Cloning and functional expression of ASIC-beta2, a splice variant of ASIC-beta[J].Neuroreport,2001,12(13):2865-2869.
[7] Hruska-Hageman AM,Benson CJ,Leonard AS,et al.PSD-95 and Lin-7b interact with acid-sensing ion channel-3 and have opposite effects on H+-gated current[J].J Biol Chem,2004,279(45):46962-46968.
[8] Lilley S,Letissier P,Robbins J.The discovery and characterization of a proton-gated Sodium current in rat retinal ganglion cells[J].J Neurosci,2004,24(5):1013-1022.
[9] Babinski K,L KT,S gu la P.Molecular cloning and regional distribution of a human proton receptor subunit with biphasic functional properties[J].J Neurochem,1999,72(1):51-57.
[10]Jahr H,Van Driel M,Van Osch GJ,et al.Identification of acid-sensing ion channels in bone[J].Biochem Biophys Res Commun,2005,337(1):349-354.
[11]Wemmie JA,Chen J,Askwith CC,et al.The acid-activated ion Channel ASIC contributes to synaptic plasticity, learning, and memory[J].Neuron,2002,34(3):463-477.
[12]Pidoplichko VI,Aroniadou-Anderjaska V,Prager EM,et al.ASIC1a activation enhances inhibition in the basolateral amygdala and reduces anxiety[J].J Neurosci,2014,34(9):3130-3141.
[13]Liu S,Cheng XY,Wang F,et al.Acid-sensing ion channels: potential therapeutic targets for neurologic diseases[J].Transl Neurodegener,2015,4(1):10.
[14]Duan B,Wu LJ,Yu YQ,et al.Upregulation of acid-sensing ion Channel ASIC1a in spinal dorsal Horn neurons contributes to inflammatory pain hypersensitivity[J].J Neurosci,2007,27(41):11139-11148.
[15]Hughes PA,Brierley SM,Young RL,et al.Localization and comparative analysis of acid-sensing ion Channel (ASIC1, 2, and 3) mRNA expression in mouse colonic sensory neurons within thoracolumbar dorsal root ganglia[J].J Comp Neurol,2007,500(5):863-875.
[16]Yudin YK,Tamarova ZA,Krishtal OA.Peripherally applied neuropeptide SF is equally algogenic in wild type and ASIC3-/- mice[J].Neurosci Res,2006,55(4):421-425.
[17]Ettaiche M,Deval E,Cougnon M,et al.Silencing acid-sensing ion Channel 1a alters cone-mediated retinal function[J].J Neurosci,2006,26(21):5800-5809.
[18]Ugawa S,Inagaki A,Yamamura H,et al.Acid-sensing ion channel-1b in the stereocilia of mammalian cochlear hair cells[J].Neuroreport,2006,17(12):1235-1239.
[19]Benarroch EE.Acid-sensing cation channels: structure, function, and pathophysiologic implications[J].Neurology,2014,82(7):628-635.
[20]Zha XM.Acid-sensing ion channels: trafficking and synaptic function[J].Mol Brain,2013,6(1):1.
[21]Staruschenko A,Dorofeeva NA,Bolshakov KV,et al.Subunit-dependent Cadmium and Nickel inhibition of acid-sensing ion channels[J].Dev Neurobiol,2007,67(1):97-107.
[22]Duan B,Wang YZ,Yang T,et al.Extracellular spermine exacerbates ischemic neuronal injury through sensitization of ASIC1a channels to extracellular acidosis[J].J Neurosci,2011,31(6):2101-2112.
[23]Li W G, Yu Y, Zhang Z D, et al. ASIC3 channels integrate agmatine and multiple inflammatory signals through the nonproton ligand sensing domain[J]. Mol Pain, 2010,6(1):88.
[24]Vick JS,Askwith CC.ASICs and neuropeptides[J].Neuropharmacology,2015,94(2015):36-41.
[25]Kweon HJ,Suh BC.Acid-sensing ion channels (ASICs): therapeutic targets for neurological diseases and their regulation[J].BMB Rep,2013,46(6):295-304.
[26]Munro G,Christensen JK,Erichsen HK,et al.NS383 selectively inhibits Acid-Sensing ion channels containing 1a and 3 subunits to reverse inflammatory and neuropathic hyperalgesia in rats[J].CNS Neurosci Ther,2016,22(2):135-145.
(2016-06-28收稿)
430060 武汉大学人民医院神经内II科[鲁璟一 肖哲曼 卢祖能(通信作者)]
R33
A
1007-0478(2017)02-0161-05
10.3969/j.issn.1007-0478.2017.02.024
