葛根素通过Nrf2-ARE信号通路抵抗氧化应激对创伤性脑损伤的神经保护作用
2017-08-07陈江生陈保东凌毕益宋明浩李志祥
陈江生 陈保东 凌毕益 宋明浩 李志祥
葛根素通过Nrf2-ARE信号通路抵抗氧化应激对创伤性脑损伤的神经保护作用
陈江生 陈保东 凌毕益 宋明浩 李志祥
目的 探讨葛根素对创伤性脑损伤(TBI)模型大鼠的神经保护作用及脑组织红系衍生的核因子相关因子2(Nrf2)一抗氧化反应原件(ARE)信号通路参与的机制。方法 选择健康成年雄性大鼠体重250~300 g构建TBI模型,将大鼠分为4组:创伤组(A组)、假手术组(B组)、葛根素治疗的创伤组(C组)和葛根素治疗的假手术组(D组);通过采用改良的神经功能缺损评分(mNSS)评价神经功能,脑组织干湿重称量法评价脑水肿,Nissl染色,TUNEL染色评价脑损伤体积和神经元的凋亡,使用酶活试剂盒检测损伤48 h后抗氧化酶SOD,GSH,和GSSG的活性以及氧化应激产物MDA和NO的水平,最后使用western blot和RT-PCR的方法检测Nrf2-ARE信号通路及其下游分子HO-1,NQO1的表达水平。结果 TBI手术后损伤组mNSS评分明显增高(P<0.05),葛根素治疗组能够明显降低mNSS评分(P<0.05)。TBI手术后损伤组脑水肿加重及神经元凋亡增加(P<0.05),葛根素治疗组能够明显挽救脑水肿及神经元凋亡(P<0.05)。TBI手术12 h后损伤组脑内抗氧化酶SOD,GSH,和GSSG的活性增加及氧化应激产物MDA和NO的水平升高(P<0.05),葛根素治疗组能够明显降低抗氧化酶SOD,GSH,和GSSG的活性以及氧化应激产物MDA和NO的水平(P<0.05)。western blot和RT-PCR显示葛根素不改变Nrf2的翻译和表达,但是RT-PCR显示葛根素能够明显促进Nrf2-ARE信号通路下游分子HO-1,NQO1的表达。结论 葛根素可能通过Nrf2-ARE信号通路抵抗氧化应激对创伤性脑损伤发挥神经保护作用。
葛根素 Nrf2-ARE信号通路 创伤性脑损伤 氧化应激
创伤性脑损伤主要包括原发性脑损伤和继发性脑损伤,是威胁45岁以下成年人群致死致残的重要原因,给家庭和社会带来严重负担,目前并没有有效的治疗药物[1]。有研究表明氧化应激反应是引起继发性脑损伤的主要病理机制[2-3],而Nrf2-ARE信号通路参与调解创伤性脑损伤中的氧化应激反应[4]。葛根素在多种疾病模型中能够显著地清除氧自由基而发挥抗氧化作用[5]。本研究通过探讨葛根素对创伤性脑损伤的神经保护作用、氧自由基的清除以及对Nrf2-ARE信号通路的影响,从而为创伤性脑损伤的治疗提供新的干预措施和新的理论基础。
1 材料与方法
1.1 试验动物和试剂 选择成年健康雄性SD大鼠 80只,体质量230~260 g,周龄 7~8周,从史莱克实验动物有限公司购买。主要试剂: Nissl和TUNEL检测试剂盒购自美国罗氏生物公司,蛋白提取试剂盒购自碧云天生物科技有限公司。GSSG、GSH、 SOD酶活试剂盒,MDA和NO检测试剂盒 (由南京建成生物工程研究所提供)批号分别为20080829,20080801,20071129,20080801,20080801; 兔抗Nrf-2单克隆抗体(由Santa Cruz biotechnology公司提供)。RT-PCR逆转录试剂盒(由碧云天生物科技有限公司提供)和引物合成(由上海生工生物科技有限公司提供)。
1.2 TBI模型建立 本实验的动物模型采BenchmarkTM颅脑损伤撞击器建立TBI模型。具体操作如下:使用2%戊巴比妥(50 mg/kg)通过腹腔注射进行麻醉,完全深度麻醉后将大鼠固定在外伤模型装备架上;在大鼠头部消毒后在正中切口,暴露颅骨,以Bregma为中心坐标xy轴坐标(-2.5 mm,-2.5 mm)处使用颅骨打磨器钻出直径5 mm骨孔作为撞击点,用5 mm直径的撞击头以3 m/s的速度撞击选定的颅骨位置,打击深度为2 mm,打击时间为120 ms;然后取出撞击器把头皮缝合,并放回饲养笼。假手术组同样进行手术操作但不予以重物撞击。在撞击过程中20%~25%的大鼠当即死亡,正常苏醒的大鼠无后续的死亡发生。当大鼠苏醒后给予腹腔注射葛根素(60 mg/kg)48 h后麻醉大鼠取脑进行后续试验。
1.3 神经功能评价 mNSS评分用于神经功能评价,总分最高为18分,最低为3分,其中包括运动对称性、自发运动、攀爬能力、提尾时双前肢对称性、惊吓反应、触须反应等六大方面。根据每个测试项目中大鼠行为能力给予0~3分评分,具体标准参照文献[6]。
1.4 Nissl和TUNEL染色 按照试剂盒标准步骤进行Nissl和TUNEL染色,在400倍镜下进行拍照和观察凋亡细胞情况,以细胞核染上棕黄色颗粒表示 TUNEL阳性细胞,Nissl染色的区域面积来计算大脑的完整性面积。
1.5 抗氧化酶活性以及氧化应激产物测定 造模成功后给予葛根素48 h后取出大鼠脑组织,根据酶活试剂盒检测损伤抗氧化酶SOD,GSH和GSSG的活性以及氧化应激产物MDA和NO的水平,测量值标准化到假手术组。
1.6 RT-PCR 用 Trizol沉淀法提取总 RNA,按照逆转录试剂盒的操作步骤进行逆转录反应;所得 c DNA用于后续实时荧光定量 PCR反应;同时将GAPDH作为内在参照基因;同时将 PCR产物进行测序以及做熔解曲线, 以保证以上 PCR反应产物良好的特异性,计算△Ct值用来比较给药前后 m RNA的表达变化。每个PCR反应都进行3个复孔。
1.7 Western Blot 将样品使用RIPA进行总蛋白的提取, Bradford法进行蛋白水平测定;每孔上样 20 μg蛋白, 10% SDS-PAGE分离样品, 电泳完成后进行常规转膜, 封闭;5% BSA稀释一抗 (兔抗 Nrf-2单克隆抗体), 4 ℃孵育过夜;第2 d用TBST进行洗膜, 将膜浸入二抗稀释液(1∶10000)中, 室温孵育2 h;TBST进行洗膜后加入 ECL发光试剂, 暗室进行曝光, 显色, Image J 软件用于数据分析。

2 结 果
2.1 葛根素提高大鼠创伤后神经功能评分
创伤后48h与假手术组相比,创伤组有明显的神经功能损伤症状,mNSS的评分下降,而葛根素治疗的创伤组显示腹腔注射葛根素后能明显改善大鼠的神经功能,表现为mNSS的评分增加,而单独给予葛根素于假手术组无明显差异(图1)。
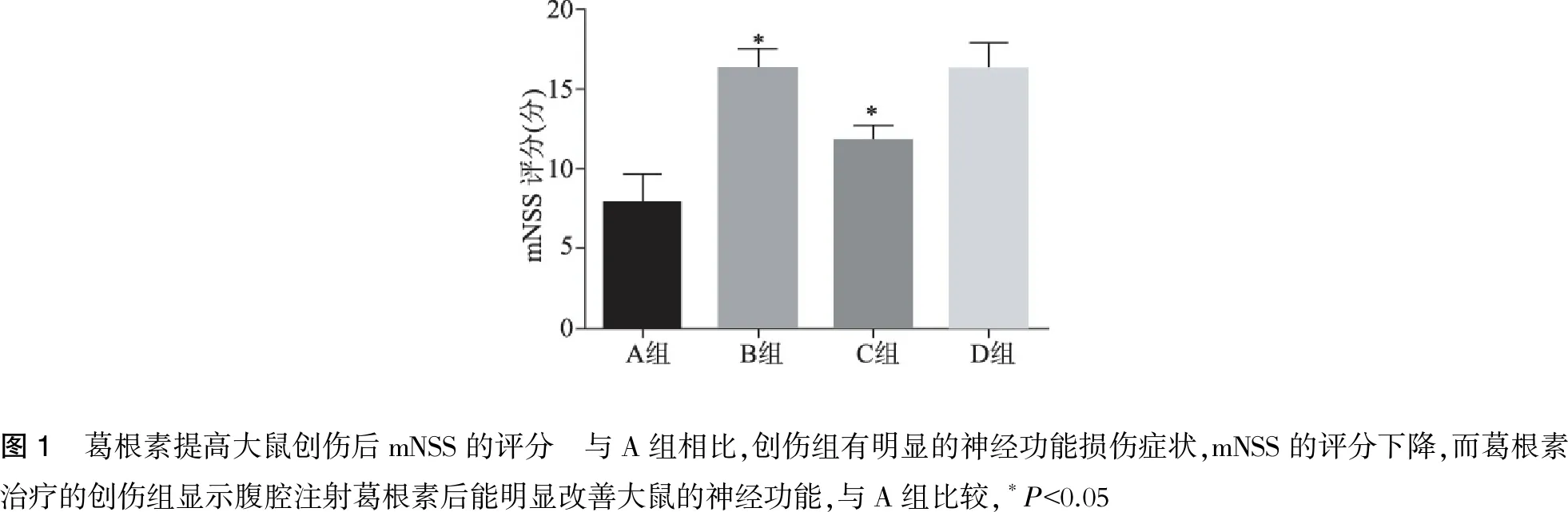
图1 葛根素提高大鼠创伤后mNSS的评分 与A组相比,创伤组有明显的神经功能损伤症状,mNSS的评分下降,而葛根素治疗的创伤组显示腹腔注射葛根素后能明显改善大鼠的神经功能,与A组比较,∗P<0.05
2.2 葛根素改善TBI大鼠神经元损伤
细胞凋亡能够反映神经元变性,本实验通过Nissl和TUNEL染色观察神经元变性的面积和比例。结果表明创伤后48h与假手术组相比,创伤组有明显的神经元变性,Nissl和TUNEL染色显示神经元变性的面积和比例增加,而葛根素治疗加创伤组显示腹腔注射葛根素后能明显降低神经元变性的面积和比例,而单独给予葛根素于假手术组无明显差异(表1)。

表1 Nissl和TUNEL染色观察神经元变性的面积和比例
注:与A组比较,*P<0.05
2.3 葛根素增加抗氧化酶活性并降低氧化应激产物水平
创伤后48 h与假手术组相比,创伤组抗氧化酶 SOD,GSH,和GSSG的活性明显增高,且氧化应激产物MDA和NO的水平也同时增高,而葛根素治疗的创伤组显示腹腔注射葛根素后能明显进一步增加抗氧化酶 SOD,GSH,和GSSG的活性,同时明显降低氧化应激产物MDA和NO的水平,而单独给予葛根素于假手术组无明显差异(表2)。
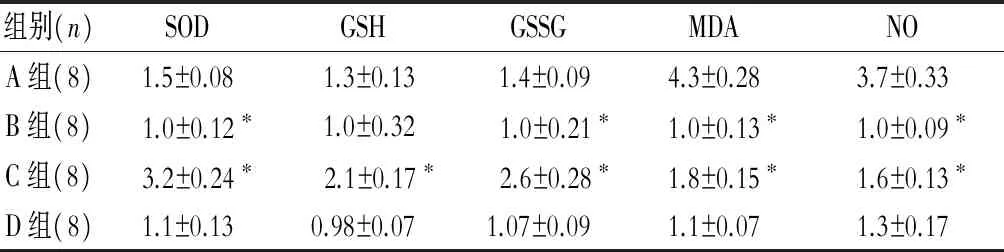
表2 创伤后抗氧化酶 SOD,GSH,和GSSG的活性以及 氧化应激产物MDA和NO的水平
注:与A组比较,*P<0.05
2.4 葛根素激活Nrf2-ARE信号通路下游分子
Western blot和RT-PCR结果显示葛根素不改变Nrf2的翻译和表达,但是RT-PCR显示葛根素能够明显促进Nrf2-ARE信号通路下游分子HO-1,NQO1的表达(表3)。
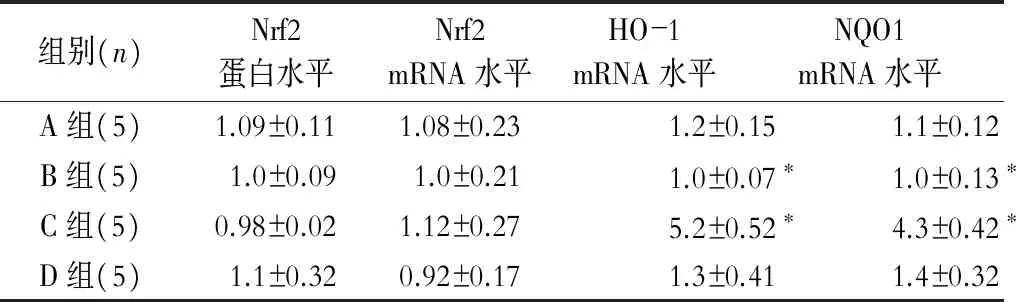
表3 葛根素能够明显促进Nrf2-ARE信号通路 下游分子HO-1,NQO1的表达
注:与A组比较*P<0.05
3 讨 论
创伤性脑损伤主要包括原发性脑损伤和继发性脑损伤,是威胁45岁以下成年人群致死致残的重要原因,给家庭和社会带来严重负担,目前并没有有效的治疗药物[1]。继发性脑损伤是指原发性损伤后的胶质细胞过度活化、炎症应激反应、氧化应激等复杂反应的综合反应,继发性脑损伤是创伤性脑损伤后慢性神经变性及神经功能损伤的主要机制。目前认为氧化应激是继发性脑损伤的核心的病理环节,研究表明氧化应激反应是引起继发性脑损伤的主要病理机制[2-3]。研究表明氧化应激主要通过细胞膜脂质过氧化产生丙二醛(MDA)而对血管内皮造成损伤,其中损伤机制是通过增加细胞内Ca2+浓度,降低NO的分泌,导致血管收缩功能受损[7]。MDA, NO的水平可反映氧化应激下组织受损程度[8]。本实验发现腹腔注射葛根素后能明显地降低氧化应激产物MDA和NO的水平,降低神经元变性的面积和比例,改善大鼠的神经功能。机体具有自主清除过量氧化应激产物并抵抗过度氧化系统,包括SOD, GSH,和GSSG等多种抗氧化酶,这些抗氧化酶在机体受到氧化应激损伤时起到重要的防御作用,但这种作用的维持有限,当受到过度损伤时机体的抗氧化体系并不能完全清除伤害[9-10]。本实验结果显示创伤后48 h与对照组相比,创伤组有明显抗氧化酶 SOD,GSH和GSSG活性的增高,但是氧化应激产物MDA和NO的水平也同时增高,而葛根素治疗的创伤组显示腹腔注射葛根素后能明显进一步增加抗氧化酶 SOD,GSH,和GSSG的活性,同时明显地降低氧化应激产物MDA和NO的水平,因此葛根素是通过增加抗氧化酶 SOD,GSH,和GSSG的活性来清除氧化应激产物。
大量研究表明Nrf2-ARE信号通路参与调解创伤性脑损伤中的氧化应激反应[4]。葛根素是否通过调节Nrf2-ARE信号通路来参与创伤性脑损害的抗氧化应激过程?本研究发现葛根素不改变Nrf2的翻译和表达,但是RT-PCR显示葛根素能够明显促进Nrf2-ARE信号通路下游分子HO-1,NQO1的表达。Nrf2是机体降低活性氧、抵御氧化应激的重要转录因子[11]。正常情况下Nrf2在胞浆中与抑制因子Keap1结合, 处于失活性状态。在诱导 Nrf2激活后Nrf2与 Keap1分离, 转入细胞核中, 进而识别并结合抗氧化反应元件 (ARE), 启动下游基因表达,增强细胞抗损伤能力, 从而有效防御有害物质的攻击[4]。Nrf2调控下游主要基因分别为解毒酶基因和抗氧化基因、应激基因等。其中醌 氧 化 还 原 酶 1[NAD (P) H: quinoneoxidoreductase-1, NQO1]和血红素加氧酶-1(hemeoxygenase-1, HO-1)发挥对抗氧化应激作用。以往研究表明 HO-1在脑外伤后表达下降并能够预测脑梗死后神经变性的预后情况[12-13]。NQO1同时也是Nrf2下游调控表达的细胞保护性蛋白,在多种退行性疾病中起到重要作用[14]。葛根素在多种疾病模型中能够显著地清除氧自由基发挥抗氧化作用[15]。本研究通过探讨葛根素对创伤性脑损害的神经保护作用、氧自由基的清楚以及对Nrf2-ARE信号通路的影响,发现葛根素可能通过激活 Nrf2入核进而激活下游解毒酶和抗氧化靶基因酶的表达、清除MDA和NO, 提高细胞的抗氧化酶 SOD,GSH,和GSSG的活性, 减轻创伤性脑损害的神经功能损伤,从而为创伤性脑损害的治疗提供新的干预措施和新的理论基础。
[1] Menon DK,Maas AI.Traumatic brain injury in 2014.Progress,failures and new approaches for TBI research[J].Nat Rev Neurol,2015,11(2):71-72.
[2] Cornelius C,Crupi R,Calabrese V,et al.Traumatic brain injury:Oxidative stress and neuroprotection[J].Antioxid Redox Signal,2013,19(8):836-853.
[3] Arent AM,De Souza LF,Walz R,et al.Perspectives on molecular biomarkers of oxidative stress and antioxidant strategies in traumatic brain injury[J].Biomed Res Int,2014,65(6):203-224.
[4] 乔梁.Nrf2通路在创伤性脑损伤中保护作用的研究进展[J].医学研究生学报,2012,25(4):422-426.
[5] 朱庆磊,吕欣然,何爱霞.葛根素对氧自由基的清除和抗氧化性损伤作用[J].解放军药学学报,2001,17(1):1-3, 13.
[6] Choi BY,Jang BG,Kim JH,et al.Prevention of traumatic brain injury-induced neuronal death by inhibition of NADPH oxidase activation[J].Brain Res,2012,1481(30):49-58.
[7] Leonarduzzi G,Sottero B,Poli G.Targeting tissue oxidative damage by means of cell signaling modulators:the antioxidant concept revisited[J].Pharmacol Ther,2010,128(2):336-374.
[8] 陈远寿,刘华庆,潘贵书,等.还原型谷胱甘肽对脑缺血大鼠海马神经元泛素蛋白结合物表达的影响[J].解放军医学杂志,2010,35(10):1205-1207, 1211.
[9] Van Muiswinkel FL.Kuiperij H B.the Nrf2-ARE signalling pathway:promising drug target to combat oxidative stress in neurodegenerative disorders[J].Curr Drug Targets CNS Neurol Disord,2005,4(3):267-281.
[10]Vera S,Martinez R,Guillermo Gormaz JA,et al.Novel relationships between oxidative stress and angiogenesis-related factors in sepsis: New biomarkers and therapies[J].Ann Med,2015,47(4):289-300.
[11]Shih AY,Johnson DA,Wong G,et al.Coordinate regulation of glutathione biosynthesis and release by Nrf2-expressing glia potently protects neurons from oxidative stress[J].Journal of Neuroscience,2003,23(8):3394-3406.
[12]吴丹,陈志颖,周君,等,HO-1调控Nrf2-ARE信号通路对脑出血后神经保护作用的实验研究[Z].中国江西南昌:2015.
[13]吴丹.HO-1调控Nrf2-ARE信号通路对脑出血后神经保护作用的实验研究[D]. 中国江西南昌:2014.
[14]王伟.Nrf2-ARE信号通路在癫痫脑损伤中的作用及莱菔硫烷的神经保护机制研究[D].石家庄:河北医科大学,2014.
(2016-10-16收稿)
Puerarin protects traumatic brain injury through Nrf2-ARE pathway to resist oxidative stress
ChenJiangsheng,ChenBaodong,LingBiyi,etal.
DepartmentofNeurosurgery,Songgangpeople’sHospital,BaoanDistrict,Shenzhen518105
Objective To investigate the puerarin protective effect on traumatic brain injury (TBI) model rats through tissue red derivative of nuclear factor related factor 2 (Nrf2) antioxidant/electrophilic response element (ARE) signal pathway.Methods TBI model was constructed using healthy adult male rats weigh 250~300 g. Animals were divided into four groups: injury group (group A) and control group (group B), puerarin treatment of injury group (group C), and puerarin treatment of control group (group D). Modified neural function defect scale (mNSS) were used to evaluate neural function, brain wet weight evaluation method was used for the weighing cerebral edema, Nissl staining, TUNEL staining was used to evaluate brain damage volume and neuronal apoptosis. Using enzyme activity kits detect the activities of antioxidant enzymes SOD, GSH, MDA and oxidative stress productor GSSG and NO at 12 hours after injury. Finally using western blot and rt-pcr methods to detect the expression of Nrf2-ARE signaling pathway and its downstream molecular HO-1, NQO1 levels.Results After TBI surgery, mNSS scores were significantly higher (P<0.05), puerarin treatment significantly reduced mNSS score (P<0.05) and improved brain function after TBI. After TBI surgery increased edema and neuronal apoptosis (P<0.05), puerarin treatment group significantly rescued cerebral edema, neuron apoptosis (P<0.05). At 48 h after TBI surgery the activity of antioxidant enzymes SOD, GSH, MDA and oxidative stress product GSSG and NO were increased (P<0.05), puerarin treatment significantly reduced the activities of antioxidant enzymes SOD, GSH, MDA and oxidative stress product GSSG and NO (P<0.05). Western blot and RT-PCR results showed that the puerarin did not change the translation and expression of Nrf2, but the RT-PCR results showed that puerarin significantly enhanced the Nrf2-ARE signaling pathways downstream molecular HO-1, and NQO1.Conclusion Puerarin has protective effect on traumatic brain injury through Nrf2-ARE signaling pathways to resist oxidative stress.
Puerarin Nrf2-ARE signaling pathway Eraumatic brain injury Oxidative stress
2015年深圳市科技计划项目(JCYJ20150403115305748)
518105 深圳市宝安区松岗人民医院神经外科(陈江生 凌毕益 宋明浩 李志祥);深圳市第二人民医院神经外科(陈保东)
R64
A
1007-0478(2017)02-0091-04
10.3969/j.issn.1007-0478.2017.02.002
