稻黄单胞菌碳代谢在致病性中的作用研究进展*
2017-08-02邹丽芳陈功友
郭 威, 邹丽芳, 陈功友
(1.浙江师范大学 化学与生命科学学院,浙江 金华 321004;2.上海交通大学 农业与生物学院,上海 200240)
稻黄单胞菌碳代谢在致病性中的作用研究进展*
郭 威1, 邹丽芳2, 陈功友2
(1.浙江师范大学 化学与生命科学学院,浙江 金华 321004;2.上海交通大学 农业与生物学院,上海 200240)
碳代谢是稻黄单胞菌体内最基本的代谢之一.碳源的获取对于病原菌在寄主水稻体内成功建立寄生关系和生长繁殖尤为重要.营养驱动是稻黄单胞菌与水稻互作的重要方面,并且与其他致病性决定因素,如Ⅲ型分泌系统(T3SS)等常相关联.为此,对稻黄单胞菌碳代谢的途径与功能、碳代谢途径中编码催化酶基因的生物学特性,以及碳代谢与hrp(hypersensitive response and pathogenicity)系统、群体感应(quorum sensing,QS)的关联性等方面进行了归纳,对利用碳代谢途径防控水稻细菌病害的可能性进行了展望.
水稻;稻黄单胞菌;碳代谢;生物学特性
水稻是我国第一大主粮作物,其产量约占全国粮食总产量的40%[1].水稻白叶枯病菌(Xanthomonasoryzaepv.oryzae)和水稻条斑病菌(Xanthomonasoryzaepv.oryzicola)是稻黄单胞菌种下的2个致病变种,可分别引起水稻白叶枯病(bacterial leaf blight,BLB)和水稻条斑病(bacterial leaf streak,BLS),是水稻生产中最重要的2种细菌病害[1-2].水稻白叶枯病菌从水孔侵入,系统危害维管束组织,造成叶枯症状[3];而水稻条斑病菌则从气孔侵入,危害水稻薄壁细胞,受叶脉限制最终发展成条斑症状[4-5].2种病害分布很广,亦可混合发生.由于杂交水稻的大面积推广,且无持续遗传的抗病基因,病害常年造成6%以上的减产,严重时可达到40%,严重制约着我国水稻的安全生产[2,6].
稻黄单胞菌利用Ⅲ型分泌系统(type Ⅲ secretion system,T3SS)将各类效应蛋白注入寄主水稻细胞内,从而使水稻产生抗(感)病性[2,7-9].病原菌从寄主水稻获取营养、成功建立寄生关系是病害发生的基础,其重要性超过病原菌利用T3SS向植物细胞内注射效应蛋白以调控寄主的抗/感病性[10-11].据预测,稻黄单胞菌中致病相关基因约250个,主要包括hrp(hypersensitive response and pathogenicity)[7-9]、效应蛋白[6,12]、rpf(regulatory pathogenicity factors)[12-13]、胞外多糖(extracellar polysaccharide,EPS)生物合成基因[14]、胞外酶基因[15]及碳代谢基因[16]等.是否将碳代谢途径中的编码催化酶基因归类为毒性基因,目前仍存在很大的争议,但其的确是病原菌在寄主水稻上生长繁殖、致病性(pathogenicity)与全毒性(virulence)所需的.因此,阐明病原细菌碳源获取与代谢的生物机制,对于深入理解病原细菌的致病机理具有重要的科学意义.鉴于碳代谢在水稻与稻黄单胞菌互作中的重要性,本文对碳代谢途径在稻黄单胞菌中的功能作用及碳代谢途径中编码催化酶基因的生物学特性等方面的研究进展进行了综述.
1 稻黄单胞菌的碳代谢
在病原菌与寄主互作过程中,一个至关重要的方面就是病原菌在寄主植物体内获取营养的能力,因为营养的获取影响着病原菌细胞的分裂与DNA复制[17].为了在寄主植物体内存活和高效复制,并能达到克服寄主植物防御反应所需的细胞密度,病原菌需要调节它们的新陈代谢,以最大限度地获取所需的一切营养物质,并积极适应寄主体内的环境条件(如pH、渗透压等)[2,11,18].因而,病原菌要在寄主植物体内成功建立寄生关系并成功侵染,必须确保能从寄主植物体内不断获取营养来源,以维持其正常的生长与繁殖.
在所有的营养物质中,碳源最为重要,不仅能为病原菌的生命活动提供能量来源,而且能为其生长提供物质基础(如碳架).其中,糖类是最优先利用的碳源,其次是醇类、有机酸与脂类.在糖类中,单糖优于双糖与多糖,已糖优于戊糖,果糖与葡萄糖优于半乳糖与甘露糖.在植物细胞中,主要的碳源是蔗糖,然后依次是葡萄糖、果糖、二羧酸和苹果酸[19].与其他异养细菌一样,稻黄单胞菌利用糖酵解途径(glycolytic pathway,EMP)、ED(Entner-Doudoroff)途径、磷酸戊糖途径(pentose phosphate pathway,PPP)和末端三羧酸(tricarboxylic acid,TCA)循环介导的氧化途径来分解单糖(如葡萄糖),生成CO2和H2O,同时产生能量(ATP/GTP),用于满足生长所需的能量和碳素分子(见图1).当寄主植物体内己糖(六碳单糖)短缺时,病原细菌可以利用糖质新生(gluconeogenesis)途径将TCA循环中的产物、C2/C3非糖化合物合成为葡萄糖,进行新一轮的碳代谢[2,10].在稻黄单胞菌中:ED途径是葡萄糖进行分解代谢的主要途径;PPP所起的分解作用相对较小(约占8%~16%);由于磷酸果糖激酶活性缺失,因而EMP在葡萄糖分解代谢中几乎不起任何作用[16,20].
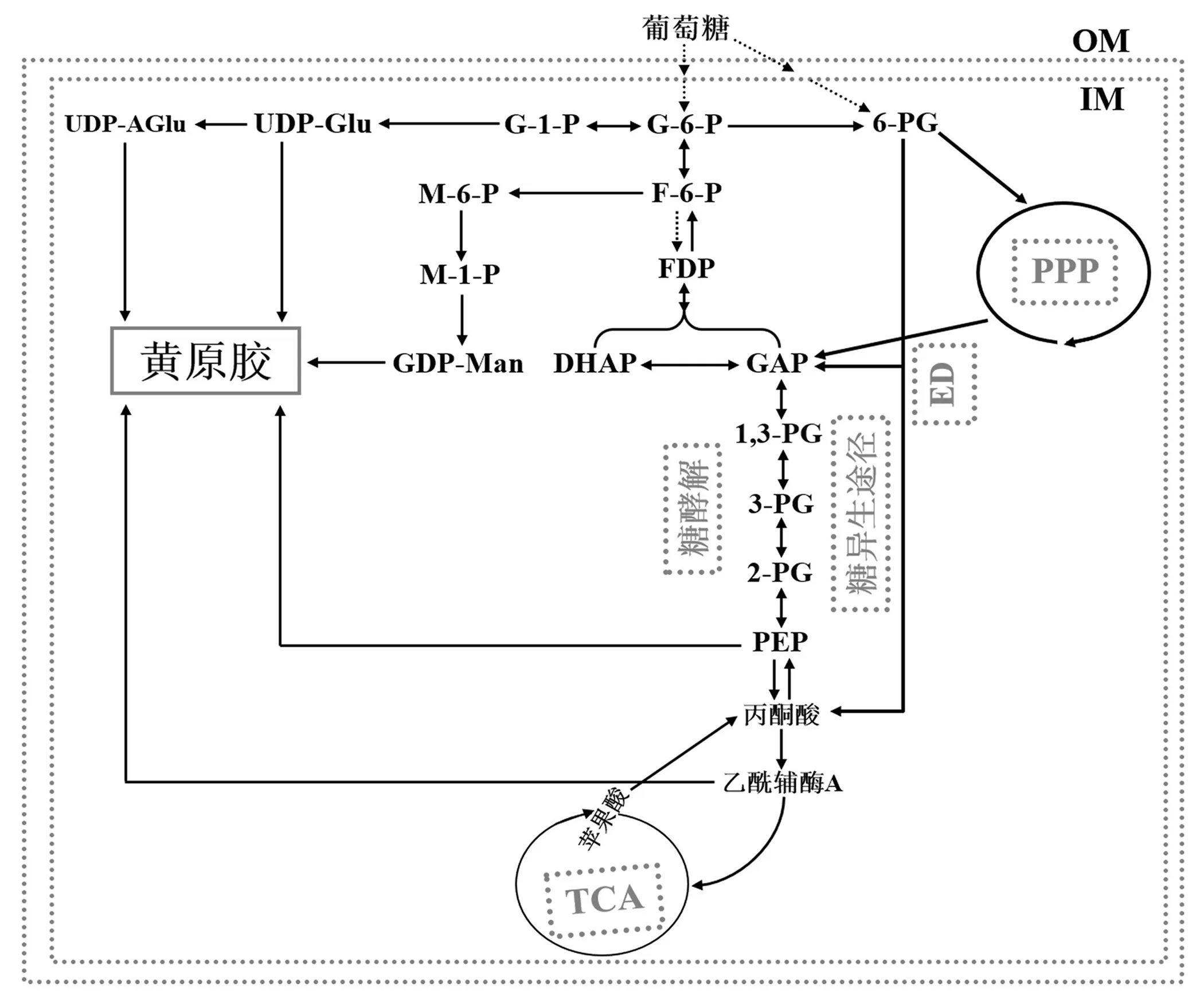
G-6-P:6-磷酸葡萄糖;G-1-P:1-磷酸葡萄糖;F-6-P:6-磷酸果糖;M-6-P:6-磷酸甘露糖;M-1-P:1-磷酸甘露糖;GDP-Man:鸟苷二磷酸甘露糖;6-PG:6-磷酸葡萄糖酸;FDP:1,6-二磷酸果糖;DHAP:磷酸二羟丙酮;GAP:3-磷酸甘油;1,3-PG:1,3-二磷酸甘油酸;3-PG:3-磷酸甘油酸;2-PG:2-磷酸甘油酸;PEP:磷酸烯醇式丙酮酸;UDP-Glu:尿苷二磷酸葡萄糖;UDP-AGlu:尿苷二磷酸葡萄糖酸;PPP:磷酸戊糖途径;TCA:三羧酸循环;OM:外膜;IM:内膜图1 稻黄单胞菌碳代谢和胞外多糖合成途径
碳水化合物代谢是一个极其复杂的过程,需要一系列代谢催化酶基因共同作用.水稻白叶枯病菌KACC10331[21],MAFF311018[22],PXO99A[23]和水稻条斑病菌BLS256[24]等菌株全基因组序列显示,稻黄单胞菌拥有编码参与碳代谢的所有催化酶基因.目前研究报道,部分催化酶基因参与稻黄单胞菌的全毒性,调控毒性因子(如胞外酶、EPS、游动性)的合成.其他碳代谢途径中编码催化酶基因是否也有类似的功能及其他生物学特性,仍需进一步研究.
2 稻黄单胞菌碳代谢与生物学特性的关系
2.1 碳代谢途径中编码催化酶基因在细菌毒性方面的作用
为了全基因组范围内挖掘水稻条斑病菌(RS105菌株)的致病相关基因,文献[5]构建了一个Tn5转座子插入突变体库,从中鉴定出110个与致病性相关的候选基因,其中10个候选基因(如:Xoc_0592(isocitrate dehydrogenase,NADP-dependent,icdH),Xoc_0442(glucose-6-phosphate 1-dehydrogenase,zwf),Xoc_0872(phosphoenolpyruvate carboxylase,ppc),Xoc_3327(glucose kinase),Xoc_2261(phosphoenolpyruvate synthase,ppsA)[10],Xoc_3589(phosphoglycerate kinase,pgk),Xoc_3841(phosphohexose mutases,xanA)[25],Xoc_2607(glucose-6-phosphate 1-dehydrogenase,zwf)[26],Xoc_2172(glucose-6-phosphate-isomerase,pgi)和Xoc_3585(fructose-bisphosphate aldolase class-I,fbaB)[16])分别位于EMP,ED,PPP,TCA循环及糖异生途径的不同位置,在碳水化合物代谢过程中起着重要的作用(见图1).与野生型相比,除Xoc_3327的致病性差异不显著外,其余9个碳代谢途径中的编码催化酶基因均显著减弱在寄主水稻上的全毒性[5-6].Xoc_3327编码葡萄糖激酶,在水稻条斑病菌全基因组中注释有3个基因编码葡萄糖激酶,而且同源性极高,Xoc_3327致病性不显著或许是基因功能冗余的原因.文献[4]也构建了一个水稻条斑病菌(BLS303菌株)Tn5插入突变体库,共鉴定出16个致病候选基因,其中3个位于碳代谢途径上,分别是Xoc_3585,Xoc_3589和Xoc_3592(glyceraldehyde-3-phosphate dehydrogenase,gapA),均显著降低在寄主水稻上的全毒性.
有关水稻白叶枯病菌中碳代谢途径中编码催化酶基因的研究相对较少.据文献[27]报道,编码磷酸葡萄糖异构酶(glucose-6-phosphate-isomerase,pgi)基因突变,显著减弱病原菌在感病寄主水稻上的生长能力与全毒性,但仍能激发其在抗性水稻和番茄上的过敏性反应(hypersensitive response,HR).α-酮戊二酸转运蛋白(α-ketoglutarate transport protein,kgtP)也是水稻白叶枯病菌全毒性所需的,虽然kgtP不位于碳代谢途径上,但与碳代谢有密切的联系,它能把水稻细胞中TCA循环中间产物α-酮戊二酸转运至病原菌胞内,用于病原菌的生长与繁殖[3].已有的研究结果表明,碳代谢途径中大部分编码催化酶基因参与稻黄单胞菌的全毒性.
2.2 碳代谢途径中编码催化酶基因在细菌碳源利用上的作用
碳水化合物是病原菌赖以生长、繁殖及成功侵染的重要物质与能量来源.植物细胞内的多糖在水解酶作用下分解为单糖,在透性酶催化下进入病原菌细胞内,胞内激酶使其磷酸化,然后进入病原菌碳代谢途径;或者,植物细胞内的单糖直接在病原菌磷酸转移酶系统(phosphotransferase system,PTS)作用下转移到病原菌细胞内并磷酸化,然后进入碳代谢途径[28].随后,单糖在一系列碳代谢途径催化酶基因的作用下氧化分解,生成CO2和H2O,为病原菌的一切生命活动提供腺嘌呤核苷三磷酸(ATP)和还原力.
目前为止,有关稻黄单胞菌碳代谢途径中编码催化酶基因参与碳源利用的研究报道相对较少.例如:水稻条斑病菌fbaB编码1,6-二磷酸果糖醛缩酶,可逆地催化1,6-二磷酸果糖生成磷酸二羟丙酮和3-磷酸甘油醛,参与功能性的糖异生途径与糖酵解下游途径,延迟果糖的利用,不能利用丙酮酸和苹果酸[16];另一基因zwf,编码6-磷酸葡萄糖脱氢酶,催化6-磷酸葡萄糖生成6-磷酸葡萄糖酸,控制着PPP与ED途径初始物6-磷酸葡萄糖的浓度,显著削弱了病原菌获取己糖(六碳单糖)的能力[26].水稻白叶枯病菌pgi编码磷酸葡萄糖异构酶,可逆地催化6-磷酸葡萄糖生成6-磷酸果糖,在糖代谢途径中起重要作用,导致病原菌不能利用果糖与木糖,同时也削弱了其利用葡萄糖的能力[27].与水稻白叶枯病菌TCA循环相关联的kgtP突变,严重削弱病菌对TCA中间产物α-酮戊二酸的利用[3].
在野油菜黄单胞菌(Xanthomonascampestrispv.campestris)中,XC_0972(glyceraldehyde-3-phosphate dehydrogenase,gapdH)[29],XC_1976(glucose kinase)[28],XC_1952(phosphoenolpyruvate synthase,ppsA)[10]均在PPP,ED途径及糖异生途径中起着重要的作用,严重制约着己糖的利用,而且不能利用丙酮酸.稻黄单胞菌中的这些及其他碳代谢途径中编码催化酶基因是否均影响碳水化合物的利用,仍需进一步的验证.
2.3 碳代谢对细菌胞外多糖合成能力的作用
胞外多糖(EPS)广泛存在于植物病原黄单胞菌中,由多个“五糖单元”聚合而成[30].EPS是植物病原黄单胞菌重要的毒性因子,它通过抑制胼胝质沉积[31]、促进生物膜形成[32]等方式来抑制植物的防卫反应、增强病原菌对寄主的抗性,以提高寄主植物的易感病性;它还可以掩蔽病原菌以阻止寄主植物识别,从而定殖到寄主组织中.
EPS的生物合成是一个能量密集型的复杂网络,需要大量的碳素分子前体、ATP及还原力(NADPH)[33](见图1).可利用的ATP是EPS生物合成的最大瓶颈,其重要性远超过碳素分子前体.碳源获取的过程,也是病原细菌合成能量、提供其生长所需碳素分子的过程.黄单胞菌碳源分解代谢的途径基本是一致的,6-磷酸葡萄糖是其分解代谢过程中的一个至关重要的结点,一部分用于合成EPS前体分子,另一部分则被氧化分解以提供细胞生命活动所需要的ATP.因此,EPS的生物合成与细胞生长会发生竞争[2,20,30,33](见图1).在黄单胞菌中,由于磷酸果糖激酶活性缺失,6-磷酸葡萄糖主要通过ED途径进行分解代谢[29-30,33],其中产物3-磷酸甘油醛经由糖质新生途径进行再循环,或经由糖酵解下游途径氧化生成丙酮酸.3-磷酸甘油醛碳源流的分布至今仍没有可靠的定量数据,但其分布差异很可能影响EPS生物合成的产量[2,33].若3-磷酸甘油醛流向糖酵解下游途径,将会产生更多的ATP,因而EPS产量最大化;若3-磷酸甘油醛经糖质新生途径再循环,增加EPS生物合成过程中可利用的碳素分子,但减少糖酵解下游途径中ATP的产生,凸显能量的限制[2,33].
研究表明,在黄单胞菌中,ED途径是碳源代谢、EPS生物合成的主要途径,并且葡萄糖和蔗糖是EPS合成最优先利用的碳源[16,20,28].位于水稻条斑病菌碳代谢途径上游的xanA,负责1-磷酸葡萄糖与6-磷酸葡萄糖之间的相互转换,可显著地削弱病原菌EPS的生物合成[25].zwf是水稻条斑病菌ED代谢途径的第一步限速酶基因,控制着胞内6-磷酸葡萄糖的浓度,其突变严重削弱病原菌EPS的生物合成[26].除此之外,水稻条斑病菌fbaB突变也部分地削弱病原菌EPS生物合成的产量(仅果糖作为碳源)[16].在水稻白叶枯病菌中,PPP与ED初始途径中的限速酶——6-磷酸葡萄糖脱氢酶(glucose 6-phosphate dehydrogenase,G6PD)失活,胞内6-磷酸葡萄糖的质量摩尔浓度从17.6 μmol/g增加到99.4 μmol/g(细胞干质),EPS产量达到了2.23 g/L;然而,在含0.4%葡萄糖的培养基中,其EPS产量是野生型的52.9%[34].ED途径中的磷酸葡萄糖酸脱水酶(phosphogluconate dehydratase,edd)基因缺失,胞内6-磷酸葡萄糖的质量摩尔浓度从0.05 mmol/g增加到1.17 mmol/g,同时也伴随着EPS产量增加,达到2.55 g/L;而PPP中的6-磷酸葡萄糖酸脱氢酶(6-phosphogluconate dehydrogenase,gndA)基因失活,不影响胞内6-磷酸葡萄糖的浓度,也不改变病原菌EPS的产量[20].这些结果说明:6-磷酸葡萄糖的浓度与EPS的生物合成有正相关性;ED途径是EPS生物合成的主要途径,而PPP对EPS的生物合成则无足轻重.
2.4 碳代谢途径中编码催化酶基因对细菌游动性的影响
细菌游动性有利于病原菌在侵染过程中获得更多更好的营养、避开不利环境及高效传播和寻找寄主[25-26,35].在动物致病细菌中,游动性使得病原菌移向寄主或在寄主体内的移动更为便利,从而具有更大的选择优势.但是,对游动性在植物病原菌中的功能作用却知之甚少.在Erwiniaamylovora,Pseudomonassyringae,Pseudomonasphaseolicola和Ralstoniasolanacearum中,研究认为,在侵染和定殖的早期阶段,游动性能增强病原菌的毒性[35].
目前,研究报道在野油菜黄单胞菌中,毒性基因rsmA,dsbB,pilZ和adk参与多种细胞进程,包括游动性[35-38].在稻黄单胞菌中,tatC,flgD,flgE等毒性基因是病原菌游动性所需的[39-40].然而,有关碳代谢途径中编码催化酶基因参与病原菌游动性的研究还鲜有报道.在水稻条斑病菌中,zwf和xanA不仅都参与病原菌EPS的生物合成,而且还显著减弱病原菌的游动性[25-26].目前的研究认为,碳代谢途径合成生物体所有生命活动所需的ATP,碳代谢途径中催化酶基因突变造成碳源代谢途径紊乱、ATP合成减少.ATP减少或许是游动性削弱的部分原因,因为所有活细胞需要ATP提供能量驱动生物体的多重需能活动,包括游动性.据推测,EPS与游动性之间有密切的关联性.至于EPS如何影响游动性,有待进一步的探索.
3 碳代谢与细菌致病性的关联性
在寄主植物体内,病原菌存活和高效复制需要特异的适应能力.一些致病相关基因是病原菌适应寄主体内环境压力所需的,其转录表达易受环境因子、植物源信号(如碳源)等的调节.一些致病相关基因是病原菌应答寄主体内营养源变化所需的,用于调节自身的生理代谢以利于自身的致病性[2-3,16,41].例如,在黄单胞菌与假单胞菌中有专门负责应答生理和环境变化控制致病因子合成的基因簇[41].
3.1 碳代谢途径中编码催化酶基因的转录表达模式
据报道,碳源能诱导或抑制植物病原细菌毒性相关基因的表达,而且部分研究表明自身底物能诱导相应代谢或转运基因的表达[3,41].在水稻条斑病菌中,蔗糖、葡萄糖、果糖、半乳糖与甘露糖能显著诱导fbaB的转录表达,而苹果酸与丙酮酸则显著抑制fbaB的转录表达[2,16].在水稻白叶枯病菌中,α-酮戊二酸显著诱导kgtP的表达[3].为了探索不同碳源对碳代谢途径基因转录的影响,利用real-time PCR分析了部分碳代谢途径基因(如icdH,ppc,pgi,ppsA,zwf(Xoc_0442),zwf(Xoc_2607)[26],Xoc_3327,pgk和xanA[25])的转录表达模式,结果表明:己糖对大部分代谢基因有显著的诱导作用;而苹果酸和丙酮酸对部分代谢基因具有明显的抑制作用,苹果酸的抑制效果更为显著.
3.2 碳代谢与hrp系统的关联性
如同其他革兰氏阴性植物病原细菌一样,稻黄单胞菌拥有由27个hrp-hrc-hpa基因组成的hrp基因簇,编码T3SS并将各类效应蛋白注入植物细胞内,从而决定着在非寄主烟草上激发过敏性反应(HR)和在寄主水稻上的致病性[7-9].尽管不同的病原细菌引起不同的植物细菌病害,但他们的hrp基因转录表达模式基本是一致的.营养贫乏或与植物互作时,hrp基因诱导表达;营养丰富时,hrp基因转录表达则明显受抑制[2,16,42].
由于黄单胞菌获取碳源的能力不同,因而导致不同碳源对其hrp基因表达诱导能力的差异[2,43-44].研究表明,蔗糖几乎能诱导所有植物黄单胞菌hrp基因的转录表达[44-45].肖友伦等[44]研究发现,蔗糖和木糖对稻黄单胞菌hrp基因的转录表达诱导效果均较好,其中木糖的诱导效果最好.在野油菜黄单胞菌中,植物提取液(分子量小于10 kDa;主要成分依次是蔗糖、葡萄糖、果糖和柠檬酸等)显著抑制hrp基因簇的转录表达,但诱导hrpG的转录表达[19].当水稻条斑病菌与水稻悬浮细胞互作时,fbaB受HrpX和HrpG的负调控[16].类似的现象也存在于水稻条斑病菌xanA中[25].此外,还发现fbaB突变导致病原菌hrcC,hrpE和hrpD5表达上调,但却抑制了hrpX和hrpG的表达[16].表明碳代谢途径的改变或许导致代谢中间产物的改变或积累,从而对hrp的表达起一定的诱导或抑制作用.
根据目前的研究报道可知,革兰氏阴性植物病原细菌的碳代谢与hrp系统之间有着密切的关联.然而,目前为止还没有任何报道称碳代谢途径中编码催化酶蛋白是通过T3SS外泌的.此外,是否T3SS外泌效应蛋白具有利用植物碳源的能力,以及是否hrp调控因子对碳代谢途径中编码催化酶基因具有调控作用?目前仍知之甚少.
4 稻黄单胞菌碳代谢与群体感应的关联性
在黄单胞菌中,其菌种群数量具有明显的群体感应(quorum sensing,QS)特征.研究证明,由DSF(diffusible signal factor)家族信号介导的QS在稻黄单胞菌全毒性、EPS生物合成、生物膜形成及游动性等生物学特性方面有着重要的影响[13,46].DSF家族信号是一个复合的信号群体,由DSF,BDSF,CDSF和IDSF 4种信号组成,它们均是由黄单胞菌碳代谢途径提供前体分子——乙酰辅酶A和氨基酸,然后经由脂肪酸合成(fatty acid synthesis,FAS)延伸循环合成的[47].此外,研究表明,黄单胞菌生长所用的培养基成分也显著影响着DSF家族信号合成的种类和比例[48].
全基因组芯片数据分析表明,野油菜黄单胞菌中有165个基因的转录表达受DSF家族信号的调控,包括参与TCA循环、脂肪酸代谢及琥珀酸代谢的脱氢酶[49-50].稻黄单胞菌中是否也存在诸多基因受DSF家族信号的调控,需要进一步的探究.此外,在水稻条斑病菌中,pgi突变致使DSF家族信号介导的QS途径中关键基因(如rpfF,rpfC,rpfG,clp)的表达发生改变,并且导致病原菌DSF家族信号分子合成量显著减少(未发表).暗示:黄单胞菌碳代谢与其QS之间可能也存在着某种内在联系.
5 总结与展望
碳代谢是稻黄单胞菌体内最基本的代谢之一,但对其在水稻与稻黄单胞菌互作方面的作用却知之甚少.目前,有关稻黄单胞菌碳代谢的研究还相对较少,而且主要集中在碳源吸收利用的途径、种类和效率,以及碳代谢途径中编码催化酶基因的生物学特性等方面.但是,对病原菌碳代谢在水稻细胞内的适应性、对水稻代谢的影响,以及水稻与稻黄单胞菌互作时基因表达的变化等方面仍知之甚少.所以,目前和未来的研究应主要集中在:1)稻黄单胞菌以一种特异性的方式适应水稻细胞内的定殖环境,这种方式是毒性基因最佳表达所需的吗?如果这种适应性主要是受病原菌碳代谢能力所控制的,那么病原菌的碳代谢会发生怎样的改变,会不会干扰寄主水稻细胞内的代谢来满足自身的需要?2)稻黄单胞菌的碳代谢是灵活易变的,不局限于某一优选碳源;当优选碳源短缺时,便会转向其他可选择的次优选碳源,这种灵活易变的机制是什么?3)稻黄单胞菌拥有新型的依赖DSF家族信号的QS特征,碳代谢途径为其提供前体分子——乙酰辅酶A和氨基酸,其改变是否会影响病原菌感应群体密度变化的能力,这种依赖DSF家族信号的QS特征又是如何调控稻黄单胞菌的碳代谢以适应高群体密度环境的,其机理阐明能否为研发绿色环保防治措施提供新的思路?在这些领域广泛的研究,无疑将促使对水稻与稻黄单胞菌互作分子机理更深入的了解,或许能为水稻细菌病害的生物防治开拓新的途径.
[1]李争,熊鹂,纪志远,等.白叶枯病菌和细菌性条斑病菌多样性的TALE效应蛋白调控水稻抗(感)病性机理与利用策略[J].中国农业科学,2013,46(14):2894-2901.
[2]郭威.水稻条斑病菌致病相关基因的鉴定与功能研究[D].南京:南京农业大学,2011.
[3]Guo Wei,Cai Lulu,Zou Huasong,et al.Ketoglutarate transport protein KgtP is secreted through the type Ⅲ secretion system and contributes to virulence inXanthomonasoryzaepv.oryzae[J].Applied and Environmental Microbiology,2012,78:5672-5681.
[4]Wang Li,Makino S,Subedee A,et al.Novel candidate virulence factors in rice pathogenXanthomonasoryzaepv.oryzicolaas revealed by mutational analysis[J].Applied and Environmental Microbiology,2007,73(24):8023-8027.
[5]Zou Huasong,Yuan Liang,Guo Wei,et al.Construction of a Tn5-tagged mutant library ofXanthomonasoryzaepv.oryzicolaas an invaluable resource for functional genomics[J].Current Microbiology,2011,62(3):908-916.
[6]Guo Wei,Cui Yiping,Li Yurong,et al.Identification of sevenXanthomonasoryzaepv.oryzicolagenes potentially involved in pathogenesis in rice[J].Microbiology,2012,158:505-518.
[7]Zou Lifang,Wang Xingping,Xiang Yong,et al.Elucidation of thehrpclusters ofXanthomonasoryzaepv.oryzicolathat control the hypersensitive response in nonhost tobacco and pathogenicity in susceptible host rice[J].Applied and Environmental Microbiology,2006,72:6212-6224.
[8]Li Yurong,Che Yizhou,Zou Huasong,et al.Hpa2 required by HrpF to translocateXanthomonasoryzaetranscriptional activator-like effectors into rice for pathogenicity[J].Applied and Environmental Microbiology,2011,77:3809-3818.
[9]Li Yurong,Zou Huasong,Che Yizhou,et al.A novel regulatory role of HrpD6 in regulatinghrp-hrc-hpagenes inXanthomonasoryzaepv.oryzicola[J].Molecular Plant-Microbe Interactions,2011,24:1086-1101.
[10]Tang Dongjie,He Yongqiang,Feng Jiaxun,et al.Xanthomonascampestrispv.campestrispossesses a single gluconeogenic pathway that is required for virulence[J].Journal of Bacteriology,2005,187:6231-6237.
[11]Tamir-Ariel D,Navon N,Burdman S.Identification of genes inXanthomonascampestrispv.vesicatoriainduced during its interaction with tomato[J].Journal of Bacteriology,2007,189:6359-6371.
[12]赵帅,张子宇,冯家勋.水稻黄单胞菌三型分泌系统效应物的研究进展[J].微生物学通报,2011,38(12):1828-1842.
[13]Zhao Yancun,Qian Guoliang,Yin Fangqun,et al.Proteomic analysis of the regulatory function of DSF-dependent quorum sensing inXanthomonasoryzaepv.oryzicola[J].Microbial Pathogenesis,2011,50:48-55.
[14]Kim S Y,Kim J G,Lee B M,et al.Mutational analysis of thegumgene cluster required for xanthan biosynthesis inXanthomonasoryzaepv.oryzae[J].Biotechnology Letters,2009,31:265-270.
[15]Zou Huasong,Song Xue,Zou Lifang,et al.EcpA,an extracellular protease,is a specific virulence factor required byXanthomonasoryzaepv.oryzicolabut not byX.oryzaepv.oryzaein rice[J].Microbiology,2012,158:2372-2383.
[16]Guo Wei,Zou Lifang,Li Yurong,et al.Fructose-bisphophate aldolase exhibits functional roles between carbon metabolism and thehrpsystem in rice pathogenXanthomonasoryzaepv.oryzicola[J].PLoS ONE,2012,7(2):e31855.
[17]Mellgren E M,Kloek A P,Kunkel B N.Mqo,a tricarboxylic acid cycle enzyme,is required for virulence ofPseudomonassyringaepv.tomatostrain DC3000 onArabidopsisthaliana[J].Journal of Bacteriology,2009,191:3132-3141.
[18]Eisenreich W,Dandekar T,Heesemann J,et al.Carbon metabolism of intracellular bacterial pathogens and possible links to virulence[J].Nature Reviews Microbiology,2010,8(6):401-412.
[19]Watt T F,Vucur M,Baumgarth B,et al.Low molecular weight plant extract induces metabolic changes and the secretion of extracellular enzymes,but has a negative effect on the expression of the type-Ⅲ secretion system inXanthomonascampestrispv.campestris[J].Journal of Biotechnology,2009,140:59-67.
[20]Kim S Y,Lee B M,Cho J Y.Relationship between glucose catabolism and xanthan production inXanthomonasoryzaepv.oryzae[J].Biotechnology Letters,2010,32(4):527-531.
[21]Lee B M,Park Y J,Park D S,et al.The genome sequence ofXanthomonasoryzaepathovaroryzaeKACC10331,the bacterial blight pathogen of rice[J].Nucleic Acids Research,2005,33:577-586.
[22]Ochiai H,Inoue Y,Takeya M,et al.Genome sequence ofXanthomonasoryzaepv. oryzae suggests contribution of large numbers of effector genes and insertion sequences to its race diversity[J].Japan Agricultural Research Quarterly,2005,39:275-287.
[23]Salzberg S L,Sommer D D,Schatz M C,et al.Genome sequence and rapid evolution of the rice pathogenXanthomonasoryzaepv.oryzaePXO99A[J].BMC Genomics,2008,9:204-221.
[24]Bogdanove A J,Koebnik R,Lu Hong,et al.Two new complete genome sequences offer insight into host and tissue specificity of plant pathogenicXanthomonasspp.[J].Journal of Bacteriology,2011,193(19):5450-5464.
[25]Guo Wei,Chu Cong,Yang Xiaoxia,et al.Phosphohexose mutase ofXanthomonasoryzaepv.oryzicolais negatively regulated by HrpG and HrpX,and required for the full virulence in rice[J].European Journal of Plant Pathology,2014,140:353-364.
[26]Guo Wei,Zou Lifang,Cai Lulu,et al.Glucose-6-phosphate dehydrogenase is required for extracellular polysaccharide production,cell motility and the full virulence ofXanthomonasoryzaepv.oryzicola[J].Microbial Pathogenesis,2015,78:87-94.
[27]Tsuge S,Ochiai H,Inoue Y,et al.Involvement of phosphoglucose isomerase in pathogenicity ofXanthomonasoryzaepv.oryzae[J].Phytopathology,2004,94:478-483.
[28]Lu Guangtao,Yang Zhengjiu,Peng Fangyin,et al.The role of glucose kinase in carbohydrate utilization and extracellular polysaccharide production inXanthomonascampestrispathovarcampestris[J].Microbiology,2007,153:4284-4294.
[29]Lu Guangtao,Xie Jiari,Chen Lei,et al.Glyceraldehyde-3-phosphate dehydrogenase ofXanthomonascampestrispv.campestrisis required for extracellular polysaccharide production and full virulence[J].Microbiology,2009,155:1602-1612.
[30]谭旖宁,马增凤,陆光涛,等.野油菜黄单胞菌6-磷酸葡萄糖脱氢酶基因的初步分析[J].广西农业生物科学,2007,6(3):190-195.
[31]Yun M H,Torres P S,Oirdi M E,et al.Xanthan induces plant susceptibility by suppressing callose deposition[J].Plant Physiology,2006,141:178-187.
[32]Dow J M,Crossman L,Findlay K,et al.Biofilm dispersal inXanthomonascampestrisis controlled by cell-cell signaling and is required for full virulence to plants[J].Proceedings of the National Academy of Sciences of the United States of America,2003,100:10995-11000.
[33]Letisse F,Chevallereau P,Simon J L,et al.The influence of metabolic network structures and energy requirements on xanthan gum yields[J].Journal of Biotechnology,2002,99:307-317.
[34]Jang S G,Lee B M,Cho J Y.Effect of modified glucose catabolism on xanthan production inXanthomonasoryzaepv.oryzae[J].Journal of Industrial Microbiology & Biotechnology,2012,39:649-654.
[35]Lu Guangtao,Tang Yongqin,Li Caiyue,et al.An adenosine kinase exists inXanthomonascampestrispathovarcampestrisand is involved in extracellular polysaccharide production,cell motility,and virulence[J].Journal of Bacteriology,2009,191:3639-3648.
[36]Chao Naixia,Wei Ke,Chen Qi,et al.ThersmA-like genersmA(Xcc) ofXanthomonascampestrispv.campestrisis involved in the control of various cellular processes,including pathogenesis[J].Molecular Plant-Microbe Interactions,2008,21:411-423.
[37]Jiang Bole,Liu Jiao,Chen Lifeng,et al.DsbB is required for the pathogenesis process ofXanthomonascampestrispv.campestris[J].Molecular Plant-Microbe Interactions,2008,21:1036-1045.
[38]McCarthy Y,Ryan R P,O′Donovan K,et al.The role of PilZ domain proteins in the virulence ofXanthomonascampestrispathovarcampestris[J].Molecular Plant Pathology,2008,9:819-824.
[39]Chen Lei,Hu Baishi,Qian Guoliang,et al.Identification and molecular characterization of twin-arginine translocation system (Tat) inXanthomonasoryzaepv.oryzaestrain PXO99[J].Archives of Microbiology,2009,191(2):163-170.
[40]殷芳群,赵延存,刘春晖,等.水稻细菌性条斑病菌中受DSF调控的鞭毛基因flgD、flgE的功能分析[J].微生物学报,2011,51(7):891-897.
[41]Tamir-Ariel D,Rosenberg T,Burdman S.TheXanthomonascampestrispv.vesicatoriacitHgene is expressed early in the infection process of tomato and is positively regulated by the TctDE two-component regulatory system[J].Molecular Plant Pathology,2011,12:57-71.
[42]Li Yurong,Xiao Youlun,Zou Lifang,et al.Identification of HrpX regulon genes inXanthomonasoryzaepv.oryzicolausing a GFP visualization technique[J].Archives of Microbiology,2012,194(4):281-291.
[43]Tang Xiaoyan,Xiao Yanmei,Zhou Jianmin.Regulation of the type Ⅲ secretion system in phytopathogenic bacteria[J].Molecular Plant-Microbe Interactions,2006,19(11):1159-1166.
[44]肖友伦,李玉蓉,刘之洋,等.水稻条斑病菌hrp基因诱导表达系统的建立[J].微生物学报,2007,47(3):396-401.
[45]Tsuge S,Furutani A,Fukunaka R,et al.Expression ofXanthomonasoryzaepv.oryzaehrpgenes in XOM2,a novel synthetic medium[J].Journal of General Plant Pathology,2002,68:363-370.
[46]孙蕾,吴茂森,陈华民,等.水稻白叶枯病菌Δrpfxoo基因缺失突变体DSF信号产生和毒性表达[J].微生物学报,2010,50(6):717-723.
[47]Zhou Lian,Yu Yonghong,Chen Xiping,et al.The multiple DSF-family QS signals are synthesized from carbohydrate and branched-chain amino acids via the FAS elongation cycle[J].Scientific Reports,2015,DOI:10.1038/srep13294.
[48]He Yawen,Wu Ji′en,Cha J S,et al.Rice bacterial blight pathogenXanthomonasoryzaepv.oryzaeproduces multiple DSF-family signals in regulation of virulence factor production[J].BMC Microbiology,2010,10(1):1-9.
[49]He Yawen,Xu Min,Lin Kui,et al.Genome scale analysis of diffusible signal factor regulon inXanthomonascampestrispv.campestris:Identification of novel cell-cell communication dependent genes and functions[J].Molecular Microbiology,2006,59:610-622.
[50]He Yawen,Zhang Lianhui.Quorum sensing and virulence regulation inXanthomonascampestris[J].FEMS Microbiology Reviews,2008,32(5):842-857.
(责任编辑 薛 荣)
A review of relationship between carbon metabolism and pathogenicity inXanthomonasoryzae
GUO Wei1, ZOU Lifang2, CHEN Gongyou2
(1.CollegeofChemistryandLifeSciences,ZhejiangNormalUniversity,Jinhua321004,China; 2.CollegeofAgricultureandBiology,ShanghaiJiaoTongUniversity,Shanghai200240,China)
Carbon metabolism was one of the most basic metabolisms inXanthomonasoryzae. Carbohydrate nutrient acquisition was crucial for pathogen to establish a successful parasitism and to grow, reproduce in host rice. Nutrition drive was also a vital aspect of rice-Xanthomonasoryzaeinteraction, and often associated with other crucial pathogenicity determinants, such as type Ⅲ secretion system (T3SS). It was summed up the carbon metabolism pathways and functions ofXanthomonasoryzae, the biological properties of related-genes encoding catalytic enzyme in carbon metabolism pathways, the relevance of carbon metabolism with thehrp(hypersensitive response and pathogenicity) system and quorum sensing (QS). In addition, it was discussed the prospects that carbon metabolic pathway might be used as a way to control rice bacterial diseases.
rice;Xanthomonasoryzae; carbon metabolism; biological properties
10.16218/j.issn.1001-5051.2017.01.011
2016-02-29;
2016-05-31
国家自然科学基金青年项目(31301633);浙江省教育厅科研项目(Y201328481)
郭 威(1983-),男,河南信阳人,讲师,博士.研究方向:分子植物病理学.
S432.42
A
1001-5051(2017)01-0071-08
