不同成熟期杨梅果实微生物的多样性*
2017-08-02罗晓辉朱心怡陈晓青郑晓梅罗诗怡沈芷琦陈文荣
罗晓辉, 朱心怡, 陈晓青, 郑晓梅,罗诗怡, 沈芷琦, 陈文荣
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
不同成熟期杨梅果实微生物的多样性*
罗晓辉, 朱心怡, 陈晓青, 郑晓梅,罗诗怡, 沈芷琦, 陈文荣
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
以不同发育期的杨梅果实(黑炭)为实验材料,测定了杨梅果实在成熟及劣变过程中有关果实品质相关指标的变化规律;并利用变性梯度凝胶电泳分离菌群的技术,研究了杨梅果实从发育早期至成熟腐烂发霉期间微生物菌群的变化规律.结果显示:杨梅果实软化及劣变迅速;发育早期无可培养微生物侵染,当果实发育至转色期时才检测到微生物菌群;通过基因序列测序结果分析发现,杨梅果实发育过程中存在18种优势菌,细菌6种、真菌12种,其中荧光假单胞菌(Pseudomonasfluorescens)、甲基杆菌属(Methylobacterium)、掷孢酵母属(Sporobolomyces)、出芽短梗霉菌(Aureobasidiumpullulans)和曲霉属(Aspergillus)一直存在至果实成熟时期.研究发现,杨梅果实的腐烂发霉主要由伯克氏菌属(Burkholderia)、魏斯氏菌(Weissellacibaria)、腐皮壳属(Diaporthe)和黑曲霉(Aspergillusniger)的快速繁殖引起.
杨梅;果实品质;病原微生物;变性梯度凝胶电泳
杨梅(MyricarubraSieb. et Zucc.)是杨梅科杨梅属常绿植物,为我国著名的特产水果果树,也是我国南方地区良好的经济生态树种[1].杨梅的栽培地主要分布在北纬18°~33°,即我国长江流域以南地区,主要为浙江、江西和广东等13个省,其中栽培面积、产量和品质等均以浙江为最[2].杨梅除具有食用价值外,还具有园林观赏价值及药用价值[3].
杨梅果实的成熟集中在我国的初夏时节,此时气候为高温多湿,且杨梅果为聚合果,果肉多浆,采后果实劣变快而不易保藏[4-6].随着果实的成熟,杨梅果实的软化为病原微生物的侵染提供了条件[7],从而导致果实迅速腐烂,丧失其商品价值.因此,研究杨梅果实发育过程中微生物菌群多样性的变化规律,可为研发合适的生物保鲜剂提供理论基础.
目前,研究报道杨梅果实病害主要由真菌引起,主要病原菌有桔青霉(PenicilliumcitrinumThom)、绿色木霉(TrichodermaviridePers. ex Fr.)、尖孢镰刀菌(Fusariumoxysporum)等[8-9].针对病原菌侵染的状况,常用鉴定微生物菌种的方法主要是形态学方法,但自然生长条件下可培养的菌种仅占自然环境中总微生物的10%左右,微乎其微[10].近年来,随着分子生物学的发展,一些新的生物技术,如PCR技术、原位杂交、荧光定量和变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)等,亦被用于微生物的鉴定.其中,DGGE技术能够较准确地反映出样品中优势种群的动态变化规律[11].并且,随着研究领域的不断发展,Myers 等[12]大胆地对DGGE技术进行了创新,加入“GC夹板”和异源微生物DNA,从而使DGGE技术得到了进一步的完善.本实验采用DGGE技术分离鉴定了不同成熟期杨梅果实中的微生物菌群,并采用质粒重组转化、蓝白斑筛选等技术手段,结合基因序列测定和序列比对,以达到菌种的鉴定,旨在为进一步研究杨梅果实病害及其生物防治提供依据.
1 材料与方法
1.1 实验材料
杨梅(M.rubraSieb. et Zucc.黑炭)分别于2014-06和2015-06中旬开始,在浙江省兰溪市同一个果园中的同一棵树上摘取不同发育时期和腐烂期的杨梅果实作为实验材料(见图1),其中A,B,C,D和E分别表示发育期、转色前期、转色后期、成熟期和腐烂期的杨梅果实.

图1 不同发育时期的杨梅
1.2 果实品质相关指标测定
1.2.1 硬度
用硬度计(GY-3型)测定果实的硬度,每个果实在赤道两端各测一次,每个阶段随机选取10个果实,求平均值.
1.2.2 可溶性固形物和可滴定酸含量
每个阶段取50 g果实榨汁后过滤,果汁用来测定可溶性固形物和可滴定酸的含量.用毛细滴管吸取杨梅汁液,滴入可溶性固形物测定仪中,读数并记录.可滴定酸含量测定采用酸碱滴定法,用0.1 mol/L氢氧化钠溶液滴定25 mL果汁,结果以柠檬酸的质量分数表示.
1.2.3 花青素含量
采用pH示差法[13]测定.
1.3 杨梅果肉中微生物的提取及鉴定
1.3.1 微生物DNA的提取及测定
取各阶段的杨梅果实5颗放入无菌聚乙烯(PE)袋中,加入30 mL 1×PBS灭菌缓冲液,放置旋转仪中低速旋转1.25 h,转移上清液至50 mL灭菌离心管中静置0.5 h,转移上清液至2 mL离心管中,13 000 r/min离心,去上清,留沉淀.
取上述沉淀0.25 g,通过MO试剂公司的PowerFoodTMMicrobial DNA Isolation Kit试剂盒提取微生物DNA.将提取所得杨梅果实中微生物的总DNA进行浓度测定,测定时取1 μL样液进行测定,剩余部分放置在-20 ℃冰箱中保存备用.
1.3.2 总DNA的PCR扩增
本实验为得到足够量的杨梅果实中微生物菌群的有效DNA,采用2次重复PCR扩增的方法对提取所得总DNA进行扩增,扩增目的DNA为细菌16S及真菌ITS的部分核糖体核苷酸序列.
细菌所用引物为534:5′-ATTACCGCGGCTGCTGG-3′和341-GC:5′-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGGCCTACGGGAGGCAGCAG-3′.PCR反应体系为25 μL:10×buffer 2.5 μL,dNTP 2.5 μL,引物534 0.5 μL,引物341-GC 0.5 μL,Ex Tag酶0.125 μL,DNA模板2 μL,ddH2O补足.PCR反应程序采用降落PCR,条件为:94 ℃ 4 min,20×(94 ℃ 1 min,65 ℃ 1 min,72 ℃ 1 min),每个循环降温0.5 ℃,5×(94 ℃ 1 min,55 ℃ 1 min),72 ℃ 10 min,16 ℃保存.
真菌所用引物为28S1r:5′-TATGCTTAAGTTCAGCGGGTA-3′和5.8Sf-GC:5′-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGGGTGAATCATCGATTCTTTGAAC-3′.PCR反应体系为25 μL:10×buffer 2.5 μL,dNTP 2.5 μL,引物28S1r 0.5 μL,引物5.8Sf-GC 0.5 μL,Ex Tag酶0.125 μL,DNA模板2 μL,ddH2O补足.PCR反应程序采用降落PCR,条件为:94 ℃ 4 min,20×(94 ℃ 1 min,60 ℃ 1 min,72 ℃ 2 min)每个循环降温0.5 ℃,5×(94 ℃ 1 min,50 ℃ 1 min),72 ℃ 10 min,10 ℃保存.
1.3.3 电泳
取PCR扩增产物各5 μL,2.0%琼脂糖凝胶电泳检测.
1.3.4 二次PCR
以第一次PCR产物为模板,反应体系为50 μL,即第一次体系的2倍.
细菌PCR反应程序为94 ℃ 4 min,4×(94 ℃ 1 min,55 ℃ 1 min,72 ℃ 1 min)每个循环降温0.5 ℃,72 ℃ 10 min,16 ℃保存.
真菌PCR反应体系为95 ℃ 4 min,4×(95 ℃ 1 min,50 ℃ 1 min,72 ℃ 2 min)每个循环降温0.5 ℃,72 ℃ 10 min,16 ℃保存.
1.4 变性梯度凝胶电泳分析
经大量的预实验不断地调整变性梯度凝胶电泳的浓度范围,最终,细菌16S V3 DGGE选用35%~70%的梯度,而真菌ITS DGGE选用40%~65%的梯度,作为正式实验的浓度梯度.二次PCR产物15 μL和上样缓冲液(3×)7.5 μL,加样前混合.电泳条件:50 V,14 h,电泳液温度为60 ℃,染色20 min.
1.5 DGGE条带的序列分析
在紫外线照射下,将电泳条带回收用蒸馏水浸没,水浴1 h后用不带GC夹的引物(细菌:534和341;真菌:5.8Sf和28S1r)进行降落PCR扩增,将PCR产物纯化后与PMD-18-T载体连接,克隆成功后送上海生工生物工程股份有限公司测序.
2 结果与分析
2.1 各时期杨梅果实的硬度及可溶性固形物、可滴定酸和花青素的含量变化
果实硬度及可溶性固形物(TSS)和可滴定酸(TA)的含量是衡量杨梅果实品质的重要标准.从图2可知:杨梅在成熟过程中果实硬度呈逐渐降低的趋势(见图2中(a));而可滴定酸含量虽然也呈下降趋势,但在成熟期前已经降到最低点(见图2中(b));花青素含量随果实发育和成熟进程而迅速增加,并在成熟后有一上升过程,之后随着品质劣变而显著下降(见图2中(c));可溶性固形物含量亦随着果实成熟进程而不断增加,并在果实成熟后保持较高的含量(见图2中(d)).根据以上分析可以得知,杨梅果实在成熟期时果实品质和营养成分都达到最佳,随后进入腐烂期时开始降低.
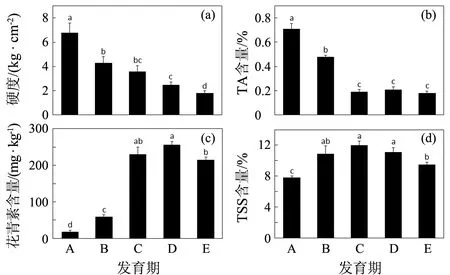
不同小写字母表示0.05水平上差异显著图2 不同发育期杨梅果实的硬度及可溶性固形物、可滴定酸和花青素含量的变化
2.2 基因组DNA的提取及PCR扩增
取上述各阶段杨梅微生物基因组DNA进行浓度稀释至15 ng/μL,分别进行16S V3 降落PCR和 ITS降落PCR扩增.取PCR产物5 μL进行琼脂糖凝胶电泳,电泳结果如图3所示:扩增产物与目的片段的长度相似,细菌在230 bp左右,真菌在300 bp左右.各时期条带亮度有差异,且真菌出现拖尾现象,这可能是由于样品DNA浓度较低、PCR反应特异性较差导致的,但不影响变性梯度凝胶电泳的进一步操作.
2.3 变性梯度凝胶电泳与分析
16S V3和ITS变性梯度凝胶电泳结果见图4.

2015Y与2014Y分别表示2015年和2014年的样品;图中1—15表示割胶回收条带图4 变性梯度凝胶电泳图
DGGE电泳后割胶条带进行测序比对,并用BLAST在GenBank中搜索相近序列,经序列比对后杨梅微生物菌群如表1和表2所示.

2015Y与2014Y分别表示2015年和2014年的样品图3 降落PCR电泳图

条带编号菌种相似度/%序列号阈值1Pseudomonasfluorescens荧光假单胞菌99KC920987.13552Methylobacteriumradiotolerans甲基杆菌98KC902793.12893Burkholderia伯克氏菌属98JF958162.13354Prinsepia扁桃木属100KC571835.13155Rhizobialesbacterium根瘤菌目菌100JQ617869.13116Weissellacibaria魏斯氏菌100KF023199.13117P.fluorescens荧光假单胞菌100KC920987.1357

表2 ITS PCR-DGGE后割胶条带的分析结果
由表1和表2可知,杨梅果实在其生长发育初期至成熟腐烂发霉过程中,其优势菌总共有18种,其中细菌6种,真菌12种.根据图4(a)可知,杨梅果实在发育至转色前期(B)时出现了4种细菌优势菌群,分别为荧光假单胞菌(P.fluorescens)、甲基杆菌(M.radiotolerans)、根瘤菌目菌(R.bacterium)和扁桃木属(Prinsepia),并且在果实发育至成熟的过程中菌群种类变化不明显.然而,当果实发育至腐烂发霉时,杨梅果实的菌群发生了明显的变化,如:荧光假单胞菌(P.fluorescens)几乎消失;伯克氏菌属(Burkholderia)和魏斯氏菌(W.cibaria)则明显增强.
同时,在果实发育过程中,杨梅果实的真菌菌群也有类似的结果.由表2可知,杨梅果实发育至转色期时出现了10种优势真菌菌种,分别为掷孢酵母属(Sporobolomyces)、梗孢属(Dissoconium)、出芽短梗霉菌(A.pullulans)、灰葡萄孢霉(B.fuckeliana)、青霉属(Penicillium)、烟草赤星病菌(A.alternate)、黑附球菌(E.nigrum)和曲霉属(Aspergillus).由图4(b)可以明显地看出,当果实发育至腐烂发霉时,杨梅果实中的真菌种类及其数量发生了明显的变化,如:早期的掷孢酵母属和梗孢属菌群弱化;而腐皮壳属(Diaporthe)和黑曲霉(Aspergillusniger)则增强.实验中基因测序比对结果的相似度均在98%以上,说明结果比较可靠.
综合以上结果:杨梅果实在果实发育早期无优势菌群出现,直至转色期时才出现优势菌群,且这些优势菌一直伴随着杨梅果实发育至完全成熟的阶段;而在果实发育至腐烂发霉的过程中,杨梅果实中的微生物菌群发生了较大的变化,主要是前期的部分菌群弱化,如掷孢酵母属(Sporobolomyces),而加速果实腐烂的菌群加强,如腐皮壳属(Diaporthe)和黑曲霉(A.niger),加速了杨梅果实的腐烂变质.
3 讨 论
随着微生物研究领域的不断延伸,内生菌的分离培养越来越得到研究者的关注.石晶盈等[14]采用平板培养法成功地筛选培养出番木瓜的内生菌群,并利用分离菌成功地抑制了木瓜炭疽病的发生.自Fischer首次提出利用变性梯度凝胶电泳分离微生物菌群以来,DGGE技术广泛应用于环境土壤微生物的分离鉴定,如王君等[15]对高温功能微生物的分离、农田土壤微生物群落结构的鉴定等,而利用DGGE分离杨梅果实内生菌尚未见相关报道.
根据PCR-DGGE图谱可知,不同阶段的条带分布相似,但粗细及亮度有所差异,表明杨梅果实各发育期菌群结构相似,但数量略有不同.条带粗亮说明该菌群数量多,为优势菌群.DGGE技术与传统的琼脂糖凝胶电泳分离菌群的方法相比,变性梯度凝胶电泳能够很好地把不同分子量的DNA电泳分离,可精确至一个碱基的变化;同时,通过DGGE割胶回收电泳后的条带,回收率高,对DNA的损伤小.这为提取果肉中微量的微生物DNA提供了有力的技术手段.由16S V3 DGGE和ITS DGGE图可以得出,杨梅果实在其生长发育早期果实内部及其表面无附着菌落,可能是:由于果实生长分裂早期细胞代谢旺盛,抵抗外界菌群侵染的能力强,使菌群无法在其上生长;同时,早期果实的生长主要以4月为主,杨梅果实的生长环境相对于6月的高温高湿季节,环境中的微生物代谢缓慢,不易入侵至杨梅幼果,最终使杨梅果实在早期发育过程中无有害菌附着.
目前,杨梅的微生物种群研究相对较少.戚行江等[16]采用培养基培养成功地分离出了20种真菌,其中主要的致病菌有酵母类、青霉菌、芽枝霉、曲霉菌和镰孢霉.文献[17]对云南杨梅的微生物研究报道了6类新的微生物种类:微紫青霉(Penicilliumjanthinellum)、托姆青霉(P.thomii)、灰葡萄孢(Botrytiscinema)、尖镰孢(Fusariumoxysporium)、链格孢(Alternariaalternata)和立枯丝核菌(Rhizoctoniasolani).上述结果与本研究结果相比,杨梅果实腐败变质的菌种有部分相同,如酵母类、曲霉等.然而,本实验中发现了新的菌种,如伯克氏菌属(Burkholderia)、魏斯氏菌(W.cibaria).这很可能与杨梅的生长环境有关.杨梅果实上的微生物由外界的寄生菌及其自身内部的菌种共同组成,因此,针对不同地区的杨梅果实采取不同的保鲜剂防范措施是十分必要的.
[1]周延锋.杨梅的开发利用及发展对策[J].福建轻纺,2007(6):1-6.
[2]陈亦辉,肖功年.杨梅加工技术及其产业发展分析[J].农产品加工,2007(9):71-73.
[3]何新华,陈力耕,陈怡,等.中国杨梅资源及利用研究评述[J].果树学报,2004(5):467-471.
[4]张望舒,郑金土,汪国,等.不同成熟度杨梅果实采后呼吸速率,乙烯释放速率和品质的变化[J].植物生理与分子生物学学报,2005,31(4):417-424.
[5]Cantu D,Vicente A R,Greve L C,et al.The intersection between cell wall disassembly,ripening,and fruit susceptibility toBotrytiscinerea[J].Proceedings of the National Academy of Sciences,2008,105(3):859-864.
[6]巩卫琪,房祥军,郜海燕,等.杨梅采后病害与控制技术研究进展[J].生物技术进展,2013(6):403-407.
[7]Luo Zisheng,Xu Tingqiao,Xie Jing,et al.Effect of hot air treatment on quality and ripening of Chinese bayberry fruit[J].Journal of the Science of Food and Agriculture,2009,89(3):443-448.
[8]戚行江,王连平,梁森苗,等.杨梅气调贮藏保鲜后果实真菌区系研究[J].浙江农业学报,2003,15(1):28-30.
[9]汪开拓.热空气与天然挥发性物质对杨梅果实绿霉病的抑制作用及其机理研究[D].南京:南京农业大学,2010.
[10]郭斌,吴晓磊,钱易.提高微生物可培养性的方法和措施[J].微生物学报,2006(3):508-511.
[11]Muyzer G,de Waal E C,Uitterlinden A G.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J].Applied and Environmental Microbiology,1993,59(3):695-700.
[12]Myers R M,Sheffield V C,Lerman L S,et al.Attachment of a 40-base-pair G+C-rich sequence (GC-clamp) to genomic DNA fragments by the polymerase chain reaction results in improved detection of single-base changes[J].Proceedings of the National Academy of Sciences,1989,86(1):232-236.
[13]Salvador A,Fiszman S M.Textural and sensory characteristics of whole and skimmed flavored set-type yogurt during long storage[J].Journal of Dairy Science,2004,87(12):4033-4041.
[14]石晶盈,刘爱媛,李雪萍,等.番木瓜果实内生细菌MGP3菌株的鉴定及拮抗作用[J].微生物学报,2011,51(9):1240-1247.
[15]王君,马挺,刘静,等.利用PCR-DGGE技术指导高温油藏中功能微生物的分离[J].环境科学,2008,29(2):462-468.
[16]戚行江,梁森苗,周利秋,等.微容气调环境对杨梅的保鲜效果研究[J].浙江农业学报,2003,15(4):237-240.
[17]张宏,桂明英,张陶,等.云南杨梅贮藏期真菌病害研究[J].云南农业大学学报,2007(4):503-506.
(责任编辑 薛 荣)
The microbial diversity in different maturity stages of Chinese bayberry
LUO Xiaohui, ZHU Xinyi, CHEN Xiaoqing, ZHENG Xiaomei,LUO Shiyi, SHEN Zhiqi, CHEN Wenrong
(CollegeofChemistryandLifeSciences,ZhejiangNormalUniversity,Jinhua321004,China)
The Chinese bayberry sampled at different ripening and deterioration stages were subjected to the assay of fruit quality related indicators. Meanwhile, the Denaturing Gradient Gel Electrophoresis (DGGE) technology was applied to separate and identify microbial DNA in the fruits. The results showed that the fruit softened and deteriorated quickly. In the early stages of fruit development, no cultivable bacteria infection was observed. The cultivable microbe emerged in turn color period, and a total of 18 dominant microbe was detected during the whole fruit ripening process, which included 6 bacteria species and 12 fungi species. Among them,Pseudomonasfluorescens,Methylobacteriumradiotolerans,Sporobolomyces,AureobasidiumpullulansandAspergillusexisted ever since early stage to mature period. Meanwhile, the results also showed the dominant bacteria resulted in bayberry fruit rotting wereBurkholderia,Weissellacibaria,DiaportheandAspergillusniger, and their rapid propagations led to fruits decay.
Chinese bayberry; fruit quality; pathogenic microorganisms; DGGE
10.16218/j.issn.1001-5051.2017.01.013
2016-03-28;
2016-05-20
浙江省科技计划公益技术研究项目(2013C32074);浙江省重大科技专项(2013C02004)
罗晓辉(1990-),男,安徽合肥人,硕士研究生.研究方向:生物化学与分子生物学.
陈文荣.E-mail: cwr@zjnu.cn
S667.6
A
1001-5051(2017)01-0085-06
