复配混凝剂去除地下水中溶解性硅酸盐的试验研究*
2017-08-01陶辉赖连花陈清白新征
陶辉 赖连花 陈清 白新征
(1.河海大学 浅水湖泊综合治理与资源开发教育部重点实验室, 江苏 南京 210098; 2.河海大学 环境学院, 江苏 南京210098; 3.苏州立升净水科技有限公司, 江苏 苏州 215152)
复配混凝剂去除地下水中溶解性硅酸盐的试验研究*
陶辉1,2,3赖连花1,2陈清3白新征3
(1.河海大学 浅水湖泊综合治理与资源开发教育部重点实验室, 江苏 南京 210098; 2.河海大学 环境学院, 江苏 南京210098; 3.苏州立升净水科技有限公司, 江苏 苏州 215152)
为有效去除水中的溶解性硅酸盐,以某溶解性硅酸盐含量高达50~60 mg/L的地下水为对象,开展复配混凝剂去除水中溶解性硅酸盐的试验研究.结果表明:当Ca(OH)2投加量为450 mg/L时,对水中溶解性硅酸盐和浑浊度的去除率分别为51.16%和74.8%;进一步增加Ca(OH)2投加量可进一步强化溶解性硅酸盐的去除,但会引起出水pH值的大幅升高;FeCl3对水中溶解性硅酸盐的去除率低于12.55%,但其对出水浑浊度具有明显的控制优势;MgO对水中溶解性硅酸盐的最优投加量为400 mg/L,此时去除率为14.53%,处理后出水浑浊度较高;FeCl3复配Ca(OH)2时,对水中溶解性硅酸盐的去除率超过60%,并且出水浑浊度低于0.65 NTU;FeCl3复配MgO时,对水中溶解性硅酸盐的去除率可达75%以上;Ca(OH)2复配MgO时,对水中溶解性硅酸盐的去除率最高达73.76%,较单独使用Ca(OH)2除硅时(81.41%)有所下降.3种复配方案中,以FeCl3复配MgO的方案为佳,在此方案下,当Fe3+质量浓度为16.8 mg/L、MgO 质量浓度为500 mg/L时,硅的去除率达76.67%,滤后浑浊度为0.83 NTU,同时出水pH值最低,可节省后续调整pH时的酸用量.
地下水;溶解性硅酸盐;混凝;复配混凝剂
硅是水体中的天然组分之一,其在水中主要以悬浮态、胶体态和溶解态的硅酸盐形式存在[1].天然水中硅的含量根据地区及水体种类不同约为6~120 mg/L,地下水中硅含量相对较高[2].研究发现高硅饮食的人群中出现局灶性肾小球肾炎、肾组织中含硅量明显增高的现象[3].长期过量摄取硅会导致人体抗氧化功能降低,有可能使硅在泌尿系统堆积,生成尿结石[4].天然水体中的硅元素含量一般尚不至于对人体产生危害,但有研究表明[5]:家庭用水点处的白斑及结垢主要由硅和少量碳酸钙及其他矿物质组成,严重影响生活饮用水的使用感受.随着生活水平的提高,人们对饮用水也提出了越来越高的要求,因此对生活饮用水中硅的去除正引起重视.
目前,对水中硅的去除研究主要集中于工业水处理领域,如锅炉用水、冶金、造纸和电子工业等,地下水中硅的去除研究较少.硅的去除技术主要有:混凝除硅[2,6- 7]、离子交换除硅[5,8- 9]、膜法除硅[2,9- 10]等.其中,混凝除硅是较为常用的方法,常用的除硅混凝药剂有镁剂[10- 12]、铝剂[2]和铁剂[13]等,其主要是利用某些金属氧化物或氢氧化物与硅的吸附、凝聚或絮凝来达到除硅的目的.混凝对水中以悬浮态和胶体态形式存在的硅酸盐具有良好的去除效果,但对以溶解态形式存在的硅酸盐去除效果较差.
针对某地地下水中硅酸盐含量高达50~60 mg/L且绝大部分硅酸盐以溶解态形式存在的情况,文中选用氢氧化钙、氧化镁和三氯化铁等混凝剂进行复配试验开展了溶解性硅酸盐去除效果的研究.
1 试验材料及方法
1.1 试验材料
试验中所采用的主要化学试剂包括硅酸钠、氢氧化钙、三氯化铁、氧化镁、钼酸铵和草酸等,其纯度均为分析纯.
某地地下水主要水质为:溶解性硅酸盐(以SiO2计)含量约50~60 mg/L、pH值为7.0~7.5.试验过程中采用去离子水为本底,按前述水质条件配制所需水样,其硅含量为60~70 mg/L,浑浊度为2.0~2.2 NTU,pH值为7.0~7.5.
1.2 试验方法
使用ZR4-6型六联混凝实验搅拌机(深圳市中润水工业技术发展有限公司生产)进行混凝、沉淀实验.搅拌程序如下:第1阶段以300 r/min快搅30 s,速度梯度G=180 s-1;第2阶段以150 r/min慢搅15 min,G=72 s-1;第3阶段为静沉阶段,静沉时间为30 min.
向混凝试验杯中加入1.0 L预先配制好的水样,并向混凝剂管中加入所需的混凝剂后,开启搅拌装置.程序运行结束后,从每个烧杯中取上清液200 mL,其中100 mL水样用于测定静沉后浑浊度和pH值指标;另外100 mL水样经定性滤纸模拟过滤过程后测定硅含量、浑浊度和pH值指标.
1.3 测试方法
水样中的二氧化硅含量采用硅钼黄分光光度法测定[14],浑浊度采用Hach 2100N台式浊度仪测定,pH值采用赛多利斯PB-10型pH计测定.
2 试验结果与讨论
2.1 Ca(OH)2除硅效果
图1为不同Ca(OH)2投加量对水中溶解性硅酸盐的去除效果及pH值的变化.由图1可见,Ca(OH)2对水中的溶解性硅酸盐具有一定的去除效果.随着Ca(OH)2投加量的增加,残余SiO2质量浓度逐渐减小.Ca(OH)2与水中溶解性硅盐的反应式如下:

图1 Ca(OH)2投加量对溶解性硅酸盐去除率的影响
Fig.1 Effect of Ca(OH)2dosage on the removal efficiency of dissolved silicate

图2为不同Ca(OH)2投加量下水中浑浊度的变化.由图2可见,随着Ca(OH)2投加量增加,浑浊度去除率出现先升高后降低的现象.这是因为原水中ζ电位为负,当大量 Ca2+涌入吸附层以致扩散层变薄甚至消失导致ζ电位减小,胶体开始产生明显的聚集和沉淀,出水浑浊度降低.随Ca(OH)2投加量的增加,混凝后的絮体电荷重新分布,小絮体表面电荷比混凝前均匀,小絮体之间自由电荷排斥,降低它们的碰撞机率[7];并且Ca(OH)2在水中的溶解度不大,随着其投加量的增大,部分Ca(OH)2颗粒悬浮在水中,导致水中浑浊度增大.经定性滤纸过滤后浑浊度大大降低,约在0.2~0.8 NTU之间.

图2 Ca(OH)2投加量对浑浊度去除率的影响Fig.2 Effect of Ca(OH)2 dosage on turbidity removal efficiency
2.2 FeCl3除硅效果
图3为不同 FeCl3投加量对水中溶解性硅酸盐的去除情况及pH值的变化.由图3可见,FeCl3对水中溶解性硅酸盐的去除率最高仅为12.55%,远低于Ca(OH)2.在FeCl3投加量较小时,随FeCl3投加量的增加,其混凝作用不断加强,因而对水中溶解性硅酸盐的去除率逐渐增加.而当FeCl3投加量增加到16.8~22.4 mg/L以上时,会导致水体pH值的快速下降(最低pH值仅为5.78),此时水中的溶解性硅主要以H2SiO3胶体形态存在,对水中溶解性硅的去除产生了不利影响.一般认为,铁盐最有效的除硅pH值为9,这也是单独使用铁盐除硅效果不明显的原因之一.

图3 FeCl3投加量对溶解性硅酸盐去除率的影响
Fig.3 Effect of FeCl3dosage on the removal efficiency of dissolved silicate
图4为不同 FeCl3投加量下水中浑浊度的变化情况.由图可知,随着FeCl3投加量的增加,沉淀后水样浑浊度逐渐减小,而经定性滤纸过滤后浑浊度均在0.5 NTU以下,表明FeCl3对水中浑浊度的去除效果明显优于Ca(OH)2.

图4 FeCl3投加量对浑浊度去除率的影响Fig.4 Effect of FeCl3 dosage on turbidity removal efficiency
2.3 MgO除硅效果
不同MgO投加量对水中溶解性硅酸盐和浑浊度的去除情况如图 5和6所示.


图5 MgO投加量对溶解性硅酸盐去除率的影响
Fig.5 Effect of MgO dosage on the removal efficiency of dissolved silicate

图6 MgO投加量对浑浊度去除率的影响Fig.6 Effect of MgO dosage on turbidity removal efficiency
2.4 FeCl3复配Ca(OH)2除硅试验结果
根据2.1和2.2节试验结果,选取除硅效果较好的条件(Fe3+质量浓度ρ(Fe3+)为16.8和22.4 mg/L)作为不变因素,复配不同浓度的氢氧化钙进行除硅试验[13,16],试验结果如图7所示.
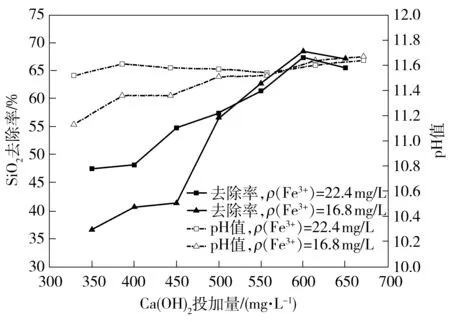
图7 FeCl3/Ca(OH)2复配混凝剂投加量对溶解性硅酸盐去除率的影响
Fig.7 Effect of FeCl3/Ca(OH)2dosage on the removal efficiency of dissolved silicate

2.5 FeCl3复配MgO除硅试验结果
根据2.1和2.2节试验结果,选取除硅效果较好的Fe3+质量浓度为16.8、22.4 mg/L作为不变因素,复配不同浓度的MgO进行除硅试验,试验结果如图8所示.

图8 FeCl3/MgO复配混凝剂投加量对溶解性硅酸盐去除率的影响
Fig.8 Effect of FeCl3/MgO dosage on the removal efficiency of dissolved silicate

2.6 Ca(OH)2复配MgO除硅试验结果
根据2.3节试验结果,选取除硅效果较好的MgO质量浓度(400 mg/L)作为不变因素,复配不同浓度的Ca(OH)2进行除硅试验,试验结果如图9所示.

图9 Ca(OH)2/MgO复配混凝剂投加量对溶解性硅酸盐去除率的影响
Fig.9 Effect of Ca(OH)2/ MgO dosage on the removal efficiency of dissolved silicate

3 结论
(1)Ca(OH)2对水中溶解性硅酸盐的去除效果较好,当Ca(OH)2投加量达到450 mg/L时,硅去除率基本可以达到50%以上,但对水中浑浊度去除效果较差,不宜单独使用;
(2)FeCl3对溶解性硅酸盐的去除效果不明显,但对浑浊度的去除有较好的效果,应与其他混凝剂复配使用以达到更好的除硅效果;
(3)MgO对溶解性硅酸盐的去除效果较差,并且其对浑浊度的控制效果较差;
(4)3种复配方案中,以FeCl3复配氧化镁对溶解性硅酸盐的去除效果较好:当Fe3+质量浓度为16.8 mg/L、MgO质量浓度为500 mg/L时,硅的去除效率达到76.67%,出水浑浊度为0.83 NTU.同时,出水pH值在3种复配方案中最低,可减少后续调整pH值时的酸用量.因此,推荐FeCl3复配MgO作为处理方案.
[1] 张新珏,辛宝东,王晓红,等.我国地下水污染研究进展 [J].地球与环境,2011,39(3):415- 421. ZHANG Xin-yu,XIN Bao-dong,WANG Xiao-hong,et al.Progress in research on groudwater pollution in our country [J].Earth and Environment,2011,39(3):415- 421.
[2] 张国辉.电厂水处理除硅工艺完善 [D].杭州:浙江工业大学,2008:1- 17.
[3] 侯建明.硅的生理作用研究近况 [J].河北中医学院学报,1995,10(4):38- 39. HOU Jian-ming.Progress in research on physiological function of silicon [J].Journal of Hebei University of Chinese Medical,1995,10(4):38- 39.
[4] 吴茂江.硅与人体健康 [J].微量元素与健康研究,2012,29(2):65- 67. WU Mao-jiang.The relationship between silicon and human health [J].Studies of Trace Elements and Health,2012,29(2):65- 67.
[5] STEPHEN Booth,MELINDA Friedman.Distribution system water quality evaluation:Finaltribution system water qlongview:city of longview [J].Silica White Paper,2014:1- 16.
[6] DAPHNE Hermosilla,RUTH Ordonez,LAURA Blanco,et al.pH and particle structure effects on silica removal by coagulation [J].Chem Eng Technol,2012,35(9):1632- 1640.
[7] 杜文婷,王兵,刘光全,等.化学混凝法同步除炼油污水中硅和浊度的研究 [J].石油与天然气化工,2014,43(3):326- 329. DU Wen-ting,WANG Bing,LIU Guang-quan,et al.Removal of silicon and turbidity from oil refinery effluent by chemical coagulation progress [J].Chemical Engineering of Oil & Gas,2014,43(3):326- 329.
[8] 孙冬艳.地下水中胶体硅对除盐设备的影响及去除 [J].科技资讯,2011,25:42. SUN Dong-yan.Removal of colloidal silica from ground-water and its effect on desalination equipment [J].Science & Technology Information,2011,25:42.
[9] SHENG Hsuhui,CHEN Shiaoshing,YANG Shuru.Irrline coagulation/ultration for silica removal from hrackish water as remembrane pretreatment [J].Separation and Purification Technology,2009(70):112- 117.
[10] 邵磊,宋存义,胡永平,等.工业用水中硅化合物的去除方法 [J].中国给水排水,2000,16(4):26- 28. SHAO Lei,SONG Cun-yi,HU Yong-ping,et al.Methods of removal silicon compounds from industrial water [J].China Water & Wastewater,2000,16(4):26- 28.
[11] ISABEL Latour,RUBEN Miranda,ANGELES Blanco.Silica removal with sparingly soluble magnesium compounds(Part I)[J].Separation and Purification Technology,2014(138):210- 218.
[12] ISABEL Latour,RUBEN Miranda,ANGELES Blanco.Silica removal with sparingly soluble magnesium compounds(Part II)[J].Separation and Purification Technology,2015(149):331- 337.
[13] 刘桂秋,张鹤飞,赵振华.采用石灰-铁盐混凝沉淀法去除废水中的As [J].化工环保,2008,28(3):226- 229. LIU Gui-qiu,ZHANG He-fei,ZHAO Zhen-hua.Removal of arsenic from wastewater by lime-molysite coagulation precipitation process [J].Environmental Protection of Chemical Industy,2008,28(3):226- 229.
[14] 二氧化硅(可溶性)的测定(硅钼黄分光光度法):SL 91.1—1994 [S].
[15] 金若菲,王栋,周集体,等.混凝法处理含硅盐废水的实验研究 [J].工业水处理,2003,23(1):42- 44. JIN Ruo-fei,WANG Dong,ZHOU Ji-ti,et al.Study on the treatment of high silicate containing wastewater by coagulation [J].Industrial Water Treatment,2003,23(1):42- 44.
[16] 李婉青,乐昕朋,李洪毕,等.混凝除硅在采油污水回用锅炉处理中的试验研究 [J].实验科学与技术.2013,11(5):19- 22. LI Wan-qing,LE Xin-peng,LI Hong-bi,et al.Experimental study of coagulation silicon removal in production sewage reused in boiler [J].Experiment Science and Technology,2013,11(5):19- 22.
Experimental Investigation into Removal of Soluble Silicate in Groundwater by Using Compound Coagulants
TAO Hui1,2,3LAI Lian-hua1,2CHEN Qing3BAI Xin-zheng3
(1.Key Laboratory of Integrated Regulation and Resource Development on Shallow Lake of the Ministry of Education, Hohai University,Nanjing 210098,Jiangsu, China; 2.College of Environment,Hohai University,Nanjing 210098,Jiangsu, China; 3. Suzhou Litree Water Purification Technology Co., Ltd., Suzhou 215152, Jiangsu, China)
In order to effectively remove the soluble silicate in water, by taking the groundwater with a soluble silicate content of 50~60 mg/L as the research objective, coagulation experiments for the soluble silicate removal by using different compound coagulants were performed. The results show that (1) when the dosage of Ca(OH)2is 450 mg/L, the removal of soluble silicate and the turbidity reaches 51.16% and 74.8%, respectively; (2) with the increase of Ca(OH)2dosage (more than 450 mg/L), the removal of soluble silicate slightly increases while the pH value of the effluent greatly increases,too;(3) FeCl3has a poor removal on soluble silicate (less than 12.55%) but has an advantage in turbidity control; (4) MgO possesses poor efficiency for both soluble silicate removal (less than 14.53%) and turbidity control, and the optimal MgO dosage is 400 mg/L; (5) the compound of FeCl3and Ca(OH)2possesses good performance on both soluble silicate removal and turbidity control, more than 60% of soluble silicate is removed and the effluent turbidity is less than 0.65 NTU; (6) the compound of FeCl3and MgO also possesses good performance on both soluble silicate removal and turbidity control, more than 75% of soluble silicate is removed; (7) the compound of Ca(OH)2and MgO results in a soluble silicate removal up to 73.76%, which is relatively less than that contributed by Ca(OH)2only (81.41%); and (8) among the three above-mentioned compound approaches, the compound of FeCl3and MgO with a Fe3+dosage of 16.8 mg/L and a MgO dosage of 500 mg/L is the best because it results in a soluble silicate removal of 76.67% and an effluent turbidity of 0.83 NTU, and because it helps to obtain effluent with the lowest pH value, which saves the acid added in the later process.
groundwater; soluble silicate; coagulation; compound coagulant
2016- 09- 29
水体污染控制与治理科技专项基金资助项目(2014ZX07405);2015年江苏省“双创计划”项目;江苏省高校优势学科建设工程资助项目 Foundation items: Supported by the Found of Major Science and Technology Program for Water Pollution Control and Treatment(2014ZX07405) and the Found of “Double Creation Plan” in Jiangsu Province
陶辉(1981-),男,副教授,主要从事饮用水处理研究.E-mail:taohui@hhu.edu.cn
1000- 565X(2017)06- 0139- 06
X 523
10.3969/j.issn.1000-565X.2017.06.021
