副猪嗜血杆菌菌体蛋白的提取及蛋白质双向电泳方法建立
2017-08-01谢宇舟冯世文禤雄标陈泽祥许力干
谢宇舟,李 军,冯世文,彭 昊,潘 艳,禤雄标,陈泽祥,许力干,杨 威
(1.广西兽医研究所,广西 南宁 530001;2.广西畜禽疫苗新技术重点实验室,广西 南宁 530001)
副猪嗜血杆菌菌体蛋白的提取及蛋白质双向电泳方法建立
谢宇舟1,2,李 军1,2,冯世文1,2,彭 昊1,2,潘 艳1,2,禤雄标1,2,陈泽祥1,2,许力干1,2,杨 威1,2
(1.广西兽医研究所,广西 南宁 530001;2.广西畜禽疫苗新技术重点实验室,广西 南宁 530001)
为了建立副猪嗜血杆菌菌体蛋白的双向电泳方法,获得背景清晰、蛋白分辨率高的双向电泳图,对细菌裂解方法、蛋白上样量、IPG胶条选择等关键步骤进行优化。结果显示,采用超声(9.9 s/停顿9.9 s,200 W)冰浴破碎细菌,5 min后,裂解液溶解沉淀,4℃过夜裂解提取菌体蛋白,以0.6 mg菌体蛋白上在pH值3~10非线性IPG胶条上进行电泳,最后考马斯亮蓝G250染色,获得的蛋白质点清晰,效果最好,随机挑取14个蛋白点进行质谱鉴定,证实均为副猪嗜血杆菌菌体蛋白。
副猪嗜血杆菌;双向电泳;菌体蛋白;蛋白质组学
副猪嗜血杆菌(HPS)属巴斯德菌科嗜血杆菌属成员,是革拉泽病(Glasser's disease)的病原。HPS通常定植在健康仔猪的鼻腔、扁桃体和气管前段等上呼吸道部位,与宿主呈共栖状态。当仔猪感染猪繁殖与呼吸障碍综合征、猪圆环病毒2型等免疫抑制病或处于应激状态时,HPS可以突破宿主的免疫屏障保护,引起断奶仔猪发生纤维素性浆膜炎、脑膜炎和多发性关节炎,病死率较高,对养猪业的健康发展构成一定的威胁[1]。
HPS分为15个血清型,此外,还有约20%的菌株未能定型,HPS血清型的多样性是造成其临床症状差异的主要原因[2]。
蛋白质双向凝胶电泳 (Two dimensional polyacrylamide gel electrophoresis,2-DE)技术是蛋白质组学研究的平台,它通过等电聚焦电泳和SDSPAGE分离将细菌强、弱毒力菌株的各种菌体蛋白在二维平面上分离后,应用质谱技术对两者的差异表达蛋白进行比较蛋白质组学研究,找出毒力相关的蛋白,为阐明其致病机制提供线索[3]。本试验通过对HPS菌体蛋白提取、蛋白上样量以及第一向等电聚焦电泳pH值范围的选择进行比较,建立一套HPS菌体蛋白制样及蛋白质双向电泳技术,为筛选HPS毒力相关蛋白奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株 HPS血清4型菌株由本实验室分离、鉴定和保存。
1.1.2 主要试剂和仪器 胰酪胨大豆肉汤培养基(TSB)、胰酪胨大豆琼脂培养基(TSA)和烟酰胺腺嘌呤二核苷酸(NAD),购自北京索莱宝科技有限公司;马血清,购自Hylone公司。IPG胶条(pH值3~10、pH值3~10 NL和pH值4~7)、IPG覆盖液、IPG缓冲液、2~D Clean-Up kit蛋白质纯化试剂盒,购自GE公司。裂解液为自配,成份为7mol/L尿素,2mol/ L硫脲,4%w/v CHAPS,1%DTT,1mmol/L PMSF。双向电泳系统:一相Ettan IPGphor 3型,二相Ettan Dalt 6型为GE公司产品。光密度扫描仪(型号GS800)、图像分析系统为Amer sham Bio sciences公司产品;基质辅助激光解离飞行时间质谱仪(型号4800 Plus MALDI TOF/TOF Analysis)为AB公司产品。
1.2 方法
1.2.1细菌裂解 将在TSA培养基中培养36 h的HPS单菌落接种于TSB培养基中,37℃摇床200 r/ min培养36 h;13 000 r/min(4℃)离心10 min收集菌体,PBS洗涤3次,弃去上清;采用以下3种方法裂解菌体:(1)菌体蛋白在裂解液中,4℃过夜裂解; (2)超声波细胞破碎仪在冰浴中以200 W的功率破碎细菌,超声9.9 s,停顿9.9 s,超声5 min后,4℃裂解4 h;(3)超声波细胞破碎仪在冰浴中以200 W的功率破碎细菌,超声9.9 s,停顿9.9 s,超声5 min后,置于裂解液中,4℃中过夜12 h处理。
1.2.2 菌体蛋白粗提 将获得的细菌粗蛋白混合液,13 000 r/min(4℃)离心10 min,取上清,用6倍体积含0.07%DTT、10%TCA的丙酮溶液沉淀30 min;1 3000 r/min(4℃)离心20 min,弃上清;沉淀物用含0.07%DTT的丙酮溶液重新悬浮10 min,13 000 r/min(4℃)离心10 min,弃上清,重复2次;裂解液复溶,13 000 r/min(4℃)离心10 min,上清即为粗提的菌体蛋白。
1.2.3 菌体蛋白的纯化 应用2-D Clean-Up kit蛋白质纯化试剂盒纯化粗提的菌体蛋白,方法按试剂盒说明书进行。纯化后的菌体蛋白立即使用或-80℃保存备用。
1.2.4 蛋白质定量 用Bradford法测定所提取的菌体蛋白浓度[4]。
1.2.5 2-DE的优化 分别取0.3 mg、0.6 mg和1.0 mg的纯化菌体蛋白进行上样,以确定最佳的蛋白上样量。分别采用pH值3~10、pH值3~10 NL和pH值4~7的IPG胶条进行第一向等电聚焦电泳,以判断HPS菌体蛋白的总体分布情况。样品首先加载于两性电解质溶液(含8 mol/L尿素,2%w/v CHAPS,0.0078%DTT,0.01%IPG Buffer)中水化,第一向等电聚焦电泳结束后,IPG胶条首先在平衡缓冲液Ⅰ(含6 mol/L尿素,50 mmol/L Tris–HCl pH值8.8,20%v/v甘油,2%w/v SDS,1%DTT)中平衡15 min后,再在平衡缓冲液Ⅱ(含50 mmol/L Tris–HCl,6 mol/L尿素,30%甘油,2%SDS,4% IAA)中平衡15 min。平衡结束后,IPG胶条放置于浓度为12.5%的SDS-PAGE凝胶上,覆盖含有0.002%溴酚蓝的0.5%低熔点琼脂糖封顶,进行第二向SDS-PAGE电泳,电泳程序首先为600 V,400 mA,2 W/胶,电泳0.5 h后,按 600 V,400 mA,20 W/胶进行,至溴酚蓝达到胶底部时结束电泳。
1.2.6 染色、采集与分析 用考马斯亮蓝G-250考染法进行凝胶染色,最后在含有10%甲醇和10%冰醋酸的脱色液进行脱色[5]。染色结束后,通过Image Scanner扫描仪扫描采集图像,用Image MasterTM2D Platinum7.0软件进行数据分析。
1.2.7 蛋白质质谱鉴定 随机挑取14个蛋白质点,将其从凝胶上切取,进行脱色、脱水、干燥、酶解[6],最后将样品提取肽段后进行质谱鉴定,获得PMF图谱,检索NCBInr数据库获取数据。
2 结果
2.1 细菌裂解方法的确定 以在冰浴中以200 W的功率破碎细菌,超声9.9 s,停顿9.9 s,超声5 min后,置4℃过夜12 h的方法获得的菌体蛋白浓度最高,为40μg/μL。而前2种方法的效果较差,蛋白质未能得到充分裂解,获得的蛋白质浓度较低为24~33μg/μL。
2.2 蛋白质上样量的确定 2~DE后,以0.3 mg纯化菌体蛋白上样,检出的低丰度蛋白较少;以1.0 mg纯化菌体蛋白上样,高丰度蛋白掩盖部分低丰度蛋白;而以0.6 mg纯化菌体蛋白上样,蛋白分布均匀,无拖尾,检出率最高。
2.3 IPG胶条的确定 pH值3~10线性胶条有成片模糊现象(图1 A);pH值4~7胶条中约有5~10%的蛋白质点丢失(图1 C)。相对于pH值3~10线性和pH值4~7线性胶条而言,pH值3~10非线性胶条获得的蛋白质点不容易产生成片的模糊现象,能够尽量多的完整呈现(图1 B)。

图1 2-DE图谱
使用Image MasterTM2D Platinum 7.0分析软件对pH值3~10非线性胶条的2-DE进行初步分析,可以分辨出600±50个清晰可辨的蛋白质点,这些蛋白质点在酸性和中性区域的中高分子量区域较为集中而碱性低分子量区域则出现较少;选择蛋白质点分布较为密集的区域进行软件侦测,结果所有的蛋白质点均能被有效识别,并且没有出现蛋白质点相互覆盖的现象;对所选区域蛋白质点进行3D模拟,峰图显示,每一个峰代表一个蛋白质点,峰与峰之间相互独立,峰高错落有致,说明这些蛋白质点已经被有效的分离。
2.4 质谱鉴定 随机选取14个蛋白质点进行质谱分析。根据PMF图谱,采用Mascot软件进行生物信息学分析,并与NCBInr数据库进行比对,证实所得的14个蛋白质均为HPS菌体蛋白(表1)。
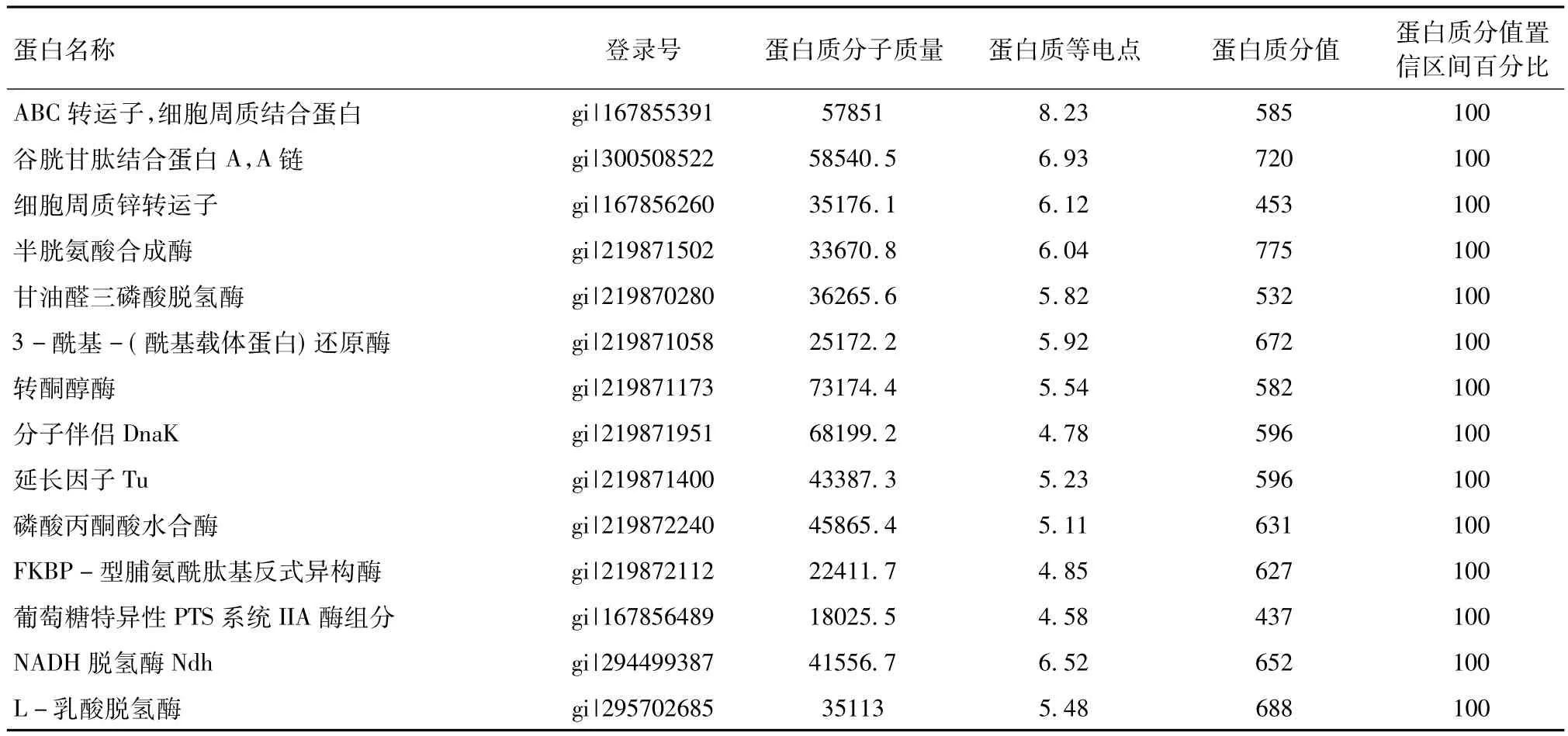
表1 蛋白质点的质谱鉴定
3 讨论
提取纯度高的蛋白是2-DE成功的基础,本研究使用的细菌裂解液中含有尿素、硫脲、CHAPS和DTT,有助于提高细菌蛋白的溶解度,防止蛋白聚集。PMSF作为一种蛋白酶抑制剂,可以防止蛋白的降解。应用超声破碎的方法可破坏细菌的核酸,防止核酸混杂在蛋白中堵塞IPG胶条孔径,造成蛋白在胶条酸性端聚集,影响2-DE图谱的质量。在3种裂解方法的比较中,采用超声冰浴破碎细菌,裂解液溶解沉淀,4℃过夜12 h裂解的方法获得的蛋白最多,因此,选择此方法作为裂解细菌,提取蛋白的最佳方法。同时,还应用2-D Clean-Up kit蛋白质纯化试剂盒纯化粗提的菌体蛋白,去除提取过程中出现的糖类、盐分和脂类等有可能对聚焦产生影响的物质。
样品蛋白上样量的多少是决定2-DE成功的另一个因素,蛋白上样量太大,会造成部分蛋白在等电聚焦电泳中沉淀,2-DE图谱出现重叠或拖尾,影响数据的分析。蛋白上样量过少,会影响低丰度表达的蛋白的检出。2-DE图谱显示,以0.6 mg纯化菌体蛋白上样,所获得的结果最好,蛋白分布均匀,无拖尾,检出率最高。
IPG胶条的pH值范围、线性或非线性分布也影响了蛋白在2-DE中的分布。2-DE图谱显示,pH值3~10线性胶条的蛋白发生聚集,影响了分辨率;pH值4~7线性胶条则扩大了蛋白的分布,造成部分蛋白丢失;而pH值3~10非线性胶条的pH值在胶条上呈对数性分布,扩大了胶条上的3~10 pH值的分布,获得的蛋白质点清晰,效果最好。
本试验通过对2-DE方法中的细菌裂解方法、蛋白上样量大小和IPG胶条的选择等几个关键步骤进行了优化,成功建立了一个适合HPS蛋白组学研究的2-DE方法,获得的蛋白质点能被有效识别,没有出现蛋白相互覆盖的现象,随机挑取14个蛋白质点进行质谱鉴定,证实均为HPS菌体蛋白,为下一步开展HPS不同血清型菌株的比较蛋白组学奠定了基础。
[1] Oliveira S,Pijoan C.Haemophilus parasuis:new trends in diagnosis,epidemiology and control[J].Vet Microbiol,2004,68:71-75.
[2] Kielstein P,Rapp-Gabrielson V J.Designation of15 serovars of-Haemophilus parasuis on the basis ofimmunodiffusion using heatstable antigen extracts[J].J Clin Microbiol,1992,30(4): 862-865.
[3] Grg A,Obermaier C,Boguth G,et al.Very alkaline immobilized pH gradients for two-dimensionalelectrophoresis ofribosomaland nuclear proteins[J].Electrophoresis,1997,18(3‐4):328-337.
[4] Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J].Anal biochem,1976,72(1):248-254.
[5] 理查德J.辛普森.蛋白质与蛋白质组学实验指南[M].北京:化学工业出版社,2006:180-182.
[6] 谢宇舟,密克,李军,等.猪源大肠杆菌O157:H7菌体蛋白双向电泳方法的建立[J].中国兽医杂志,2012,48(10): 31-33.
Establishment of two-dimensional electrophoresis assay for proteome analysis of Haemophilus parasuis
XIE Yu-zhou1,2,LI Jun1,2,FENG Shi-wen1,2,PENG Hao1,2,PAN Yan1,2,XUAN Xiong-biao1,2,CHEN Ze-xiang1,2,XU Li-gan1,2,YANG Wei1,2
(1.Guangxi Veterinary Research Institute,Nanning 530001,China; 2.Guangxi Key Laboratory of Animal Vaccines and New Technology,Nanning 530001,China)
To establish a two-dimensional electrophoresis(2-DE)assay for proteome analysis of Haemophilus parasuis and to get an electrophoretogram with a clear background,high protein point resolution and good repeatability,2-DE program was optimized,and various sample preparation methods,different loading quantities and IPG strip selection were studied.Samples were ultra-sounded with ice bath in 5 minute(9.9 s/every 9.9 s)followed by deposited at4℃ at24 hours.0.6 mg total protein was loaded onto pH3-10 nolinear IPG strip for 2-DE followed by staining with Coomassie Brilliant Blue G–250 nitrate.14 proteins were randomly chosen to identify by mass spectrum,and detection rate was 100%.
Haemophilus parasuis;two-dimensional electrophoresis;bacterial protein;proteomes
s:CHEN Ze-xiang;XU Li-gan
S852.65+1
A
0529-6005(2017)06-0046-04
2016-02-24
广西科技攻关项目(桂科攻0993009-1);广西基本科研业务费专项(桂科专项13-2);广西畜禽疫苗新技术重点实验室专项(13-051-27-A-4)
谢宇舟(1984-),女(壮族),助理研究员,硕士,主要从事动物病原学研究,E-mail:Rain_1113@163.com
李军(1971-),男,副研究员,博士,研究方向为动物疫病防控与病原分子生物学,E-mail:jlee9981@163.com
注:李军与谢宇舟对本文具有同等贡献
陈泽祥,E-mail:xjszexiang@163.com;许力干,E-mail:xuligan@163.com
