VA纳米乳制备工艺研究
2017-07-31毛跟年曹晴许牡丹黄萌周丹马可纯周亚丽贺磊
毛跟年,曹晴,许牡丹,黄萌,周丹,马可纯,周亚丽,贺磊
(陕西科技大学 食品与生物工程学院,陕西 西安,710021)
VA纳米乳制备工艺研究
毛跟年*,曹晴,许牡丹,黄萌,周丹,马可纯,周亚丽,贺磊
(陕西科技大学 食品与生物工程学院,陕西 西安,710021)
研究了VA纳米乳的制备并对其质量进行评价。运用伪三元相图筛选出了最佳表面活性剂与助表面活性剂以及二者最优配比,确定的最优工艺为:5.3 g吐温80与2.7 g丙三醇搅拌均匀,加入2 g VA油,边搅拌边滴加去离子水,直至形成澄清透亮乳液,去离子水用量1mL。所制备的VA纳米乳为水包油型,粒径分布范围为10~40 nm,平均粒径23.68 nm。将VA纳米乳10 000 r/min离心20 min,或常温放置6个月均未见分层,表明制备的VA纳米乳性质稳定。经检测,纳米乳中VA含量41.66 mg/g。
VA;纳米乳;伪三元相图;稳定性
VA(vitamin A)是指具有视黄醇(retinal)结构,并具有其生物活性的一大类物质的总称,是人和动物所必需的一种营养元素[1]。具有维持视觉正常,基因调控,免疫功能及骨骼发育等生理功能[2]。但是VA作为一种脂溶性的维生素,在水中几乎不溶,将VA油直接应用于食品、药品及保健品中,对于生物体的吸收利用率较低[3]。且VA结构中含有较多的不饱和双键,易氧化,稳定性较差[4],从而影响其功效。所以,提高VA的溶解度和稳定性是一个难题。
纳米乳又称做微乳(ME),是由水相、油相、表面活性剂及助表面活性剂按照合适的比例所形成的热力学稳定的胶体分散体系[5-6]。其粒径为10~100 nm,整个体系外观透明且黏度低、各向同性。将脂溶性的VA油制成O/W型纳米乳,在水中以纳米级均匀分散,一定程度上可以提高VA的溶解度,增加其稳定性[7-8]。
本试验选择普通的搅拌装置进行乳化,乳化剂廉价易得,降低了制备成本,为VA纳米乳的工业化生产提供保证。作为一种营养添加剂,VA纳米乳的制备,解决了VA溶解度低及稳定性差的缺点,在食品与保健饮料等方面有一定应用前景[9]。
1 材料与方法
1.1 仪器设备
JJ-1型精密增力电动搅拌器,常州国华电器有限公司;YP802N电子天平,北京赛多利斯仪器系统有限公司;TG-16-WS台式高速离心机,湘仪离心机仪器有限公司;1200LC高效液相色谱仪,美国安捷伦公司;Zetasizer NANO-ZS90纳米粒度表面电位分析仪,英国Malvern公司;FEI Tecnai G2 F20 S-TWIN型透射电子显微镜,美国FEI。
1.2 材料试剂
VA(100万IU/g,食品级),陕西金冠牧业有限公司;吐温80(药品级),浙江遂昌惠康药业有限公司;聚氧乙烯清华蓖麻油(EL40,美国药典国家处方,药品级),成都艾科达化学试剂有限公司;无水乙醇、正丁醇、PEG400、丙三醇(药品级),四川金山制药有限公司;苏丹红、亚甲基蓝,生物染色剂,上海源叶生物试剂有限公司;甲醇(色谱纯),天津市天力化学试剂有限公司。
1.3 实验方法
1.3.1 VA纳米乳制备方法
将油相和表面活性剂按比例混合均匀,向其中缓慢滴加蒸馏水,边加边搅拌,开始时体系黏度较低,形成油包水(W/O)型纳米乳,随着水量的增加,体系黏度逐渐增加,继续滴加蒸馏水,体系又会突然由黏变稀,此时W/O型纳米乳发生转相[10],即形成水包油(O/W)型VA纳米乳。本实验选用一般的搅拌装置进行纳米乳的制备,相对于超声、均质等,降低了生产成本,防止制备过程中对药物产生物理破坏。
1.3.2 表面活性剂的选择
离子型表面活性剂一般毒性较大,只能应用于外用制剂,故本研究主要采用无毒的非离子表面活性剂[11],吐温类HLB值较高,亲水性很强。聚氧乙烯氢化蓖麻油HLB值13~15,能和脂肪醇、一些动物油、植物油混均,是一种新型的食品乳化剂[12]。
本试验需制备O/W型纳米乳,故根据HLB值初步选用吐温80和聚氧乙烯氢化蓖麻油,再按照油相与表面活性剂质量比为1∶9~9∶1,运用伪三元相图筛选出最佳的表面活性剂。
1.3.3 助表面活性剂的筛选
选用毒副作用小的无水乙醇、正丁醇、PEG400、丙三醇[13],按照油相与表面活性剂质量比为1∶9~9∶1,运用伪三元相图筛选最佳助表面活性剂。
1.3.4 VA纳米乳配方的优化
根据选定的表面活性剂与助表面活性剂,利用伪三元相图确定其最优配比。
试验过程中,记录相转变时的耗水量,以VA油、表面活性剂和水分别作为三角形的3个顶点,绘制伪三元相图,以纳米乳形成区域面积大小为指标筛选配方,试验选择油相与表面活性剂1∶9~9∶1的比例来筛选配方用量。
1.3.5 VA纳米乳的质量评价
(1)乳剂类型的判别:
根据染料苏丹红和亚甲基兰在纳米乳中的扩散快慢进行判别[14],若红色扩散速度快,则为油包水(W/O)型;若蓝色扩散速度快,则为水包油(O/W)型。
(2)纳米乳形态与粒径测定:
(a)形态观察:使用Tecnai G2 F20 200 kV场发射透射电子显微镜观察。取VA纳米乳0.1 mL,稀释1 000倍后,滴加在铜网上,自然干燥,然后用2%磷钨酸复染,待干燥后观察。
(b)粒径测定:采用Zetasizer NANO-ZS90型激光粒度分析仪进行粒度分析[15]。取VA纳米乳0.1 mL,稀释250倍后,进行检测。
(3)纳米乳中VA含量测定
采用高效液相色谱法[16]测定。
(a)色谱条件。色谱柱:C18(2.8 μm,150 mm×4.6 mm);流动相:V(甲醇)∶V(水)=98∶2;流速:1.0 mL/min;柱温:40 ℃;波长:利用紫外全波长扫描确定测定波长。
(b)标准曲线的建立。称取VA对照品3 mg,甲醇溶解并定容至50 mL,制成0.06 mg/mL VA标准溶液。然后用流动相稀释该溶液,制成浓度分别为0.012、0.024、0.036、0.048、0.060 μg/mL的对照品溶液,每个浓度分别吸取20 μL进样,测得峰面积。以浓度对峰面积进行线性回归,即得到标准曲线方程。
(c)溶液的制备。精密称取3份VA纳米乳样品各0.06 g,分别编号为1、2、3,50 ℃超声,冷却,甲醇稀释并定容至50 mL,作为供试品溶液。精密称取不含VA的样品0.06 g,同法制备,作为阴性对照溶液。2种溶液分别取20 μL进样。
(d)精密度和重现性试验。精密度:精密吸取对照品溶液20 μL,重复进样3次,计算RSD值。
重现性:取同一批样品,按照上述色谱条件平行测定6份,计算RSD值。
(e)加样回收试验。精密称取供试品溶液适量,加入对照品溶液,甲醇定容至10 mL,配制浓度分别为0.029、0.032、0.035 mg/mL的待测样品,进样,测定实测浓度,计算回收率及RSD值。
(4)纳米乳稳定性检验
(a)外观 将所制备的纳米乳常温6个月,观察其外观、透明度及分层情况[18],判断纳米乳的稳定性。
(b)高速离心试验 将VA纳米乳于10 000 r/min离心20 min,观察其外观是否有变化。
2 结果与讨论
2.1 最佳表面活性剂的确定
选择吐温80、聚氧乙烯氢化蓖麻油(EL40)以及二者复配作为表面活性剂,制备VA纳米乳,以VA油、表面活性剂及滴加水量为坐标绘制伪三元相图,如图1所示。

图1 不同表面活性剂对纳米乳形成区域的影响Fig.1 Effect of different surfactants on the formation of emulsion
由图1可知,以吐温80作为表面活性剂制备VA纳米乳时形成的微乳区域最大,表明吐温80作为表面活性剂更易形成纳米乳。形成的微乳区域越大,越有利于减少表面活性剂的用量、增加VA的载药量[19],故表面活性剂选择吐温80较适宜。
2.2 助表面活性剂筛选结果
助表面活性剂从无水乙醇、正丁醇、丙三醇、PEG400中进行选择,试验结果如表1所示。

表1 不同助表面活性剂对纳米乳形成的影响
由表1可知,当以无水乙醇和正丁醇为助表面活性剂时,乳液出现浑浊,说明并未形成纳米乳。而丙三醇与PEG400作为助表面活性剂时,均可形成澄清透明的纳米乳,再通过伪三元相图从丙三醇和PEG400中筛选出适宜的助表面活性剂。
分别以丙三醇和PEG400为助表面活性剂,表面活性剂与助表面活性剂质量比按1∶1进行试验,试验结果如图2所示。

图2 不同助表面活性剂对纳米乳形成区域的影响Fig.2 Effect of differentcosurfactant on the formation of nano emulsion
由图2可得,与PEG400相比,丙三醇作为助表面活性剂,所形成纳米乳的微乳区域面积更大。由于丙三醇易溶于水,且具有一定的亲脂性,提高了界面膜的柔顺性和牢固性,降低了体系的黏度。作为助表面活性剂,丙三醇还可以调节体系的亲水亲油平衡值(HLB值),当其与吐温80混合后,HLB值与VA更接近,有利于降低体系的油水界面张力[20],有助于O/W型纳米乳的形成,故最终确定丙三醇为制备VA纳米乳的助表面活性剂。
2.3 VA纳米乳最优配方确定
以吐温80为表面活性剂,丙三醇为助表面活性剂,设定表面活性剂与助表面活性剂的质量比(Km)为1∶1、1∶2和2∶1进行试验,试验结果如图3所示。
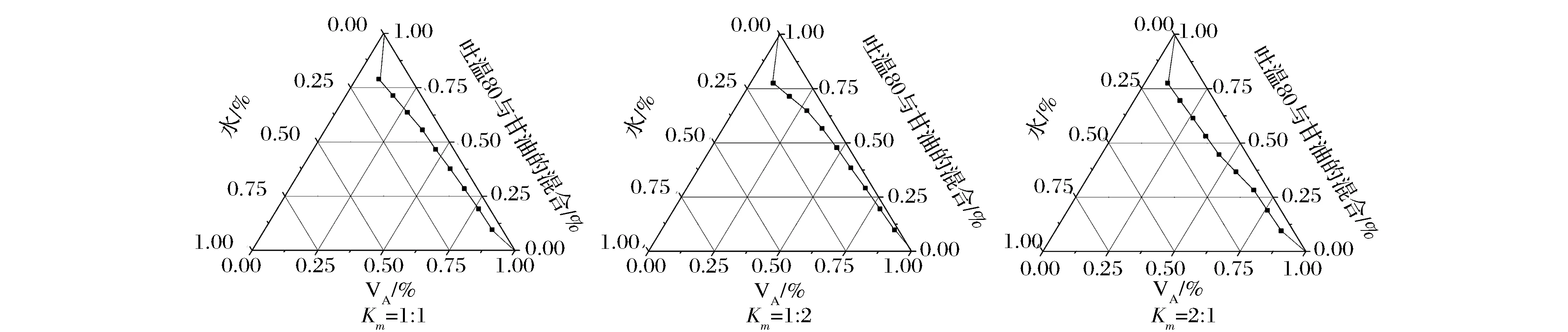
图3 不同Km对纳米乳形成区域的影响Fig.3 Effect of different Km on the formation ofnano emulsion
当吐温80与丙三醇比例为2∶1时,HLB值与油相最接近,所制备纳米乳的微乳区域最大,随着表面活性剂用量的增加,纳米乳更易形成,且粒径更小。当表面活性剂与油达到一定比例时,体系形成层状结构,产生最小界面张力,促进了纳米乳滴的形成。根据微乳区域大小及纳米乳在水中的分散性,确定出最佳配方及制备工艺为:取5.3 g吐温80与2.7 g丙三醇搅拌均匀,加入2 gVA油,边搅拌边滴加去离子水,直至形成澄清透亮乳液,去离子水最终用量为1 mL。
2.4 VA纳米乳质量评价结果
2.4.1 纳米乳类型的判别
在制备的纳米乳中加入油溶性染料苏丹红和水溶性染料亚甲基兰,结果蓝色扩散速度较快,说明所制备的乳剂为水包油型。
2.4.2 纳米乳形态与粒径分布结果
VA纳米乳形态和粒径分布分别如图4、图5所示。

图4 VA纳米乳透射电镜照片Fig.4 TEM photograph of vitamin A nano emulsion

图5 VA纳米乳粒度测定结果Fig.5 The results of VA nano emulsion particle size
由图4、图5可得,所制备VA纳米乳在水中分散呈球形,大小较均匀,没有黏连,粒径分布10~40 nm,平均粒径为23.68 nm,说明VA纳米乳的粒径分布范围较窄,粒径较均匀,符合纳米乳基本要求。
2.4.3 纳米乳中VA含量测定结果
2.4.3.1 最大波长的确定
对所制备的对照品、供试品、阴性对照品在190~500 nm进行紫外波长扫描,结果如图6所示。

图6 VA纳米乳波长扫描结果Fig.6 The results of wavelength scanning of vitamin A nano emulsion
由图6结果可得,VA对照品和VA纳米乳供试品在325 nm处均有最大吸收峰,而阴性对照与供试品在285 nm处均有吸收峰,其对VA的含量测定不会产生影响,故选择波长325 nm进行VA含量测定。
2.4.3.2 含量测定
根据所配浓度梯度对照品测定结果,以样品浓度对峰面积进行线性回归,得回归方程为:y=118 861x-270.29,R2=0.999 3,线性范围:0.012~0.06 mg/mL。取供试品溶液20 μL进样,测定峰面积,计算可得纳米乳中VA含量为41.66 mg/g。
2.4.3.3 精密度和重现性试验
将对照品进样3次,所得结果的RSD为0.87%,表明仪器精密度良好;同一批供试品平行测定6次,结果RSD为1.13%,表明该方法重现性好。
2.4.3.4 加样回收试验
经测定,3个浓度的加样回收率分别为101.65%、100.48%、98.95%,平均回收率100.4%,RSD为1.77%,表明测定结果较准确。
2.4.4 纳米乳稳定性检验结果
2.4.4.1 外观
由图7可知,所制备的VA纳米乳澄清透亮,常温下放置6个月未出现浑浊、分层等现象,表明该纳米乳稳定性良好。

图7 VA纳米乳稳定性考察结果Fig.7 Results of the stability of vitamin A nano emulsion
2.4.4.2 高速离心试验
将VA纳米乳10 000 r/min离心20 min后仍为澄清、透亮、流动性好、均一稳定的乳液,未出现分层、破乳现象,说明所制纳米乳性质稳定。
3 结论
本文制备了水包油型VA纳米乳,利用伪三元相图进行配方和工艺优化,确定最优配比为:2 g VA油,5.3 g吐温80,2.7 g丙三醇,去离子水1 mL。所制备乳剂粒径分布为10~60 nm,平均粒径23.68 nm,该纳米乳中VA含量41.66 mg/g,稳定性良好。采用本工艺技术能够将脂溶性的VA有效地转变为水溶性的VA纳米乳,能够为脂溶性VA在食品和保健饮料、口服液中的应用提供便利。
[1] 多乐, 尹福泉, 高振华. VA的营养研究进展[J]. 饲料研究,2010(4): 33-35.
[2] 张云波, 李明伟. VA的免疫研究进展[J]. 中国畜牧兽医, 2014, 41(3): 137-141.
[3] 何云飞, 徐济达. 儿童VA缺乏的研究进展[J]. 中国学校卫生, 2005, 26(6): 521-523.
[4] 任国谱, 颜景超. 乳制品中VA稳定性的研究进展[J]. 中国乳品工业, 2009, 37(10): 34-37.
[5] NEUBERT R H H. Potentials of new nanocarriers for dermal and transdermal drug delivery[J]. European Journal of Pharmaceutics and Biopharmaceutics,2011, 77(1): 1-2.
[6] GANNU R, PALEM C R, YAMSANI V V, et al. Enhanced bioavailability of lacidipine via microemulsion based transdermal gels: Formulation optimization,exvivoandinvivocharacterization[J]. International Journal of Pharmaceutics,2010, 388(2): 231-241.
[7] HATEGEKIMANA J, CHAMBA M V M, SHOEMAKER C F, et al. Vitamin E nanoemulsions by emulsion phase inversion: Effect of environmental stress and long-term storage on stability and degradation in different carrier oil types[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects,2015, 483(2): 70-80.
[8] OJALA J, SIRVIÖ J A, LIIMATAINEN H. Nanoparticle emulsifiers based on bifunctionalized cellulose nanocrystals as marine diesel oil-water emulsion stabilizers[J]. Chemical Engineering Journal,2016, 288: 312-320.
[9] 陈晓兰, 刘艳玲, 王帅兵, 等. VA对人和动物营养与毒性研究进展[J]. 饲料研究,2010(3): 36-38.
[10] DEVENDIRAN D K, AMIRTHAM V A. A review on preparation, characterization, properties and applications of nanofluids[J]. Renewable and Sustainable Energy Reviews, 2016, 60: 21-40.
[11] GUTTOFF M, SABERI A H, MCCLEMENTS D J. Formation of vitamin D nanoemulsion-based delivery systems by spontaneous emulsification: Factors affecting particle size and stability[J]. Food Chemistry, 2015, 171: 117-122.
[12] 杨雪峰, 齐永华, 宁红梅, 等. 恩诺沙星纳米乳的制备及其质量评价[J]. 浙江大学学报:农业与生命科学版, 2012,38 (6): 693-699.
[13] FENG Y, LEE Y. Surface modification ofzein colloidal particles with sodium caseinate to stabilize oil-in-water pickering emulsion[J]. Food Hydrocolloids, 2016, 56: 292-302.
[14] 周莹, 欧阳五庆, 郭建军, 等. 复方联苯苄唑纳米乳的制备及其质量评价[J]. 精细化工, 2012, 29(8): 790-794.
[15] DEGRAND L, MICHON C, BOSC V. New insights into the study of the destabilization of oil-in-water emulsions with dextran sulfate provided by the use of light scattering methods[J]. Food Hydrocolloids, 2016, 52: 848-856.
[16] 颜景超, 任国谱, 安静, 等. 高效液相色谱法测定乳制品中VA的研究进展[J]. 中国乳品工业, 2011, 39(9): 43-46.
[17] 邓国东, 王亚吨, 毛乾慧. 饲料中VA分析方法研究进展[J]. 中国饲料, 2006(12): 32-34.
[18] ZHANG Y, CHEN Z,BIAN W, et al. Stabilizing oil-in-water emulsions with regenerated chitin nanofibers[J]. Food Chemistry, 2015, 183: 115-121.
[19] 许婧. VA和维生素E纳米球/微球双包埋体系的研究 [D].无锡: 江南大学, 2008.
[20] LUO L, HAN G, CHUNG T-S, et al. Oil/water separation via ultrafiltration by novel triangle-shape tri-bore hollow fiber membranes from sulfonatedpolyphenylenesulfone[J]. Journal of Membrane Science, 2015, 476: 162-170.
Study on preparation of vitamin A nano emulsion
MAO Gen-nian*, CAO Qing, XU Mu-dan, HUANG Meng, ZHOU Dan, MA Ke-chun, ZHOU Ya-li, HE Lei
(College of Food and Biological Engineering, Shaanxi University of Science&Technology, Xi’an 710021,China)
The preparation of vitamin A nano emulsion was studied and its properties were evaluated. The best surfactant, co-surfactant and the two optimal ratio were screened out by using the pseudoternary phase diagram. The optimal process was as follows: 5.3 g Tween 80 and 2.7 g glycerol, stir evenly, add Vitamin A oil 2g, stir while dropping deionized water, until the forming a clear and transparent emulsion, the amount of deionized water was 1mL. The vitamin A nano emulsion for the preparation was of oil-in-water, the distribution range of particle size was 10-40 nm, the average particle size was 23.68 nm. By centrifuged at 10 000 r/min for 20 min, the vitamin A nano emulsion was stable without stratification at the room temperature for 6 months. The vitamin A of 41.66 mg/g in nano emulsion was detected.
vitamin A; nano emulsion; pseudoternary phase diagram; stability
学士,教授(本文通讯作者,E-mail:maogn@sust.edu.cn)。
陕西省科技攻关项目(2016NY-167)
2016-09-26,改回日期:2016-11-23
10.13995/j.cnki.11-1802/ts.201706039
