食醋浸泡对大豆中异黄酮转化的影响
2017-07-31陈玉婷陈继承田晶晶
陈玉婷,陈继承,田晶晶
(福建农林大学 食品科学学院,福建 福州,350002)
食醋浸泡对大豆中异黄酮转化的影响
陈玉婷,陈继承*,田晶晶
(福建农林大学 食品科学学院,福建 福州,350002)
采用红曲老醋浸泡大豆,对大豆自身的内源性β-葡萄糖苷酶(β-glucosidase,E.C. 3.2.1.21,BG)促进大豆中异黄酮的转化进行研究。用合成底物p-硝基苯基-β-D-吡喃葡萄糖苷测定大豆BG酶活,高效液相色谱法测定大豆异黄酮的含量。结果表明,随着浸泡时间的延长,大豆BG酶活呈先上升后下降的趋势,浸泡4 h时酶活达到最高为0.74 U/g。在内源BG酶解和酸解的共同作用下,结合型异黄酮的糖苷逐渐被水解,其中丙二酰基葡萄糖苷型和β-葡萄糖苷型含量显著下降,分别降低47.39%和36.27%;苷元含量显著上升,增加12倍。食醋浸泡有利于提高大豆的生物效价。
醋泡大豆;BG活性;大豆异黄酮;苷元
大豆异黄酮是由苷元、β-葡萄糖苷、β-葡萄糖苷结合丙二酰基和乙酰基组成的酚类化合物[1]。大豆中天然存在的异黄酮主要成分有3类,即染料木素类、大豆苷元类和黄豆黄素类,各自又主要以4种形式存在:丙二酰基葡萄糖苷型、乙酰基葡萄糖苷型、β-葡萄糖苷型和苷配基型(苷元)[2]。其中结合型的糖苷占总异黄酮含量的80%~95%[3]。大豆异黄酮作为一种植物雌激素[4-5],具有预防和治疗多种疾病的作用[6-17]。
研究发现,糖苷形式的大豆异黄酮不能直接被小肠壁吸收,必须经水解去除糖基转化为游离型的苷元才可被小肠吸收[18]。而且大豆异黄酮以苷元及其代谢产物体现其生物活性。大豆异黄酮糖苷水解方法主要有酸水解[19]、碱水解、Smith降解[20]和酶水解[21-22]。酸水解虽然成本低、技术简单、水解率高,但存在副反应发生、环境污染、产物不稳定等弊端。酶水解具有反应体系简单、条件温和、转化率高、耗时短等优点,但商业β-葡萄糖苷酶(β-glucosidase,E.C. 3.2.1.21,BG)价格昂贵、不能回收利用,在应用过程中受到很大限制。而产BG菌株筛选、分离、纯化繁琐,成本较高且微生物酶存在易受杂质污染和易导致酶失活等缺陷。
DE LIMA等[23]用不同温度的去离子水浸泡大豆,在BG最适pH条件下,研究了不同浸泡时间下的大豆的β-葡萄糖苷、总苷元及丙二酰基葡萄糖苷型异黄酮含量变化和BG酶活,发现大豆内源性BG活性与苷元及糖苷型异黄酮的含量变化密切相关。CHEN等[24]通过红曲老醋浸泡大豆胚芽,在不同料液比条件下,研究了大豆胚芽中12类异黄酮的含量变化及其互变现象,表明大豆胚芽内源性BG酶活与结合型异黄酮水解有关,BG酶解和醋的酸解作用存在协同效应。因此,利用醋酸水解和大豆内源性BG酶解的优势设计本实验,用于研究食醋浸泡对大豆异黄酮转化的影响。
1 材料与方法
1.1 材料与试剂
福建红曲老醋,福建永春顺德堂食品有限公司;北大荒绿野有机黄豆,北大荒营销股份有限公司。
对硝基苯酚,p-硝基苯基-β-D-吡喃葡萄糖苷,大豆苷元、乙酰基大豆苷、丙二酰基大豆苷、大豆苷、染料木苷元、乙酰基染料木苷、丙二酰基染料木苷、染料木苷、黄豆黄素、乙酰基黄豆黄苷、丙二酰基黄豆黄苷、黄豆黄苷,Sigma公司;三氟乙酸(色谱纯),乙腈(色谱纯),甲醇(色谱纯),北京迈瑞达科技有限公司;其余试剂均为分析纯。
1.2 仪器与设备
Universal 320R离心机,德国Hettich公司;GZY 200C科研级快速开盖万能粉碎机,上海高致精密仪器有限公司;Alpha 1-2真空冷冻干燥机,德国Christ公司;DK-8D电热恒温水槽,上海一恒科技有限公司;UV-5200 PC紫外可见分光光度计,上海元析仪器有限公司;岛津高效液相色谱仪LC-20A,Shimadzu corporation;KQ-500 VDE双频数控超声波清洗器,昆山市超声仪器有限公司。
1.3 实验方法
1.3.1 醋豆的制作方法
称取无霉变、颗粒饱满、大小均一的北大荒绿野有机黄豆200.0 g,福建永春红曲老醋800.0 g,在25 ℃(恒温水浴锅调控温度)下,用红曲老醋浸泡大豆0、4、8、12、16、20、24 h;分别称取浸泡0、4、8、12、16、20、24 h的大豆20.0 g,冻干,粉碎,过80目筛;称取250.0 mg醋豆粉用于测定大豆内源性BG酶活,剩余用于测定大豆异黄酮含量;实验数据采用Origin 8.5、SPSS 17.0软件进行分析。
1.3.2 大豆内源BG活性测定
1.3.2.1 BG酶活标准曲线的制作
配制一系列浓度梯度20、30、40、50、60、70 μmol/L的对硝基苯酚标准溶液,420 nm处测定吸光值,将每1 min内催化生成1 μmol/L的对硝基苯酚所需酶量作为1个BG活性单位。
1.3.2.2 醋豆BG活性的测定
用p-硝基苯基-β-D-吡喃葡萄糖苷做底物、对硝基苯酚做显色剂测定BG酶活。提取醋豆粉中的BG参考文献[25],即向0.05 mol/L(pH 4.5)的柠檬酸盐缓冲液中加入0.1 mol/L的NaCl,取上述溶液1.5 mL于20 ℃室温下萃取100 mg醋豆粉样品1 h;离心,上清液用于测定酶活。测定大豆内源性BG活性参考相关文献[1, 26]。简要操作如下:将1 mmol/Lp-硝基苯基-β-D-吡喃葡萄糖苷加入到0.1 mol/L磷酸盐-柠檬酸盐缓冲液(pH 5.0)中,30 ℃冰浴10 min;取上述溶液2.0 mL,并将0.5 mL待测上清液与对照上清液(上清液在100 ℃煮沸60 min)同时加入上述溶液中分别作为试验组和对照组,每组试验重复3次;30 ℃冰浴30 min后加入2.5 mL的Na2CO3溶液(0.5 mol/L)终止反应,产物p-硝基酚使反应呈黄色,测定420 nm处的吸光值;计算BG酶活,酶活单位为U/g干豆粉。
1.3.3 不同浸泡时间醋豆异黄酮含量的测定
采用高效液相色谱法[24]测定醋豆中异黄酮含量。操作简述如下,称取一定量不同浸泡时间的醋豆粉,加入10 mL 体积分数80%甲醇溶液,在温度20 ℃、功率200 W、频率30 Hz条件下,超声处理35 min;8 000 r/min离心15 min;上清液用0.45 μm的过滤器过滤后进行高效液相色谱分析,平行测定3组样品。色谱条件如下,色谱柱:配有一个保护柱的ODS C18柱;流动相:0.1%三氟乙酸水溶液、0.1%三氟乙酸乙腈溶液,线性梯度洗脱;流速:1.0 mL/min;进样量:5 μL;柱温:35 ℃;检测波长:254 nm;用液相色谱纯甲醇配制12类大豆异黄酮标样,浓度15~50 μg/mL。
2 结果与分析
2.1 BG酶活标准曲线
以对硝基苯酚浓度为横坐标,吸光值为纵坐标得到的标准曲线回归方程为:y=0.015 2x+0.023 7,R2=0.999 7。用此标准曲线来测定醋豆的内源性BG酶活。
2.2 浸泡过程中大豆BG酶活的变化规律
由图1可见,在浸泡0~24 h内,大豆内源BG活性呈先上升后下降的趋势,这一变化趋势与LIMA的报道[27]相同。浸泡4 h,酶活达到最高,为0.74 U/g。浸泡初期,老醋体系中的醋酸、水借助细胞内外的渗透压差通过大豆细胞膜进入细胞内,当细胞内pH接近或达到BG的最适pH 6.0[28-29]时,BG活性最高。
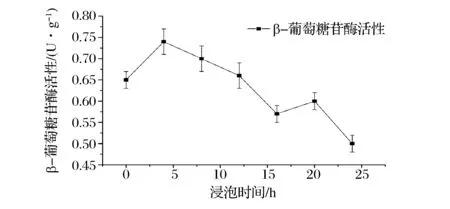
图1 不同浸泡时间对醋泡大豆β-葡萄糖苷酶 (BG) 活性的影响Fig.1 Effects of different soaking times on β-glucosidase (BG) activities of soaked soybeans
2.3 醋豆中与BG相关的活性物质变化
表1、图2-A是大豆异黄酮组分含量随浸泡时间的变化趋势。浸泡0~24 h,丙二酰基葡萄糖苷型和β-葡萄糖苷型的含量随浸泡时间的增加呈下降趋势;乙酰基葡萄糖苷型含量随浸泡时间的增加呈微升趋势。0~8 h,丙二酰基葡萄糖苷型含量变化明显,从258.3 mg/100 g下降到182.1 mg/100 g,减少29.5%;β-葡萄糖苷型含量从129.6 mg/100 g下降到107.8 mg/100 g,减少16.8%;8~24 h,上述2种物质含量的下降速率缓慢,分别减少17.9%和19.5%。0~8 h,苷元含量上升较快,从4.8 mg/100 g上升到57.7 mg/100 g,增加11.0倍;8~24 h,苷元含量从57.7 mg/100 g上升到113.8 mg/100 g,增加1.0倍。图2-B~图2-D是不同浸泡时间下大豆苷类、染料木素类、黄豆黄素类组分含量的变化。0~24 h,大豆苷、乙酰基大豆苷、丙二酰基大豆苷,染料木苷、丙二酰基染料木苷,黄豆黄苷、丙二酰基黄豆黄甙的含量均有不同程度的下降;乙酰基染料木苷、乙酰基黄豆黄苷的含量出现微升现象;大豆苷元、染料木苷元含量都明显增加,黄豆黄素含量微降。
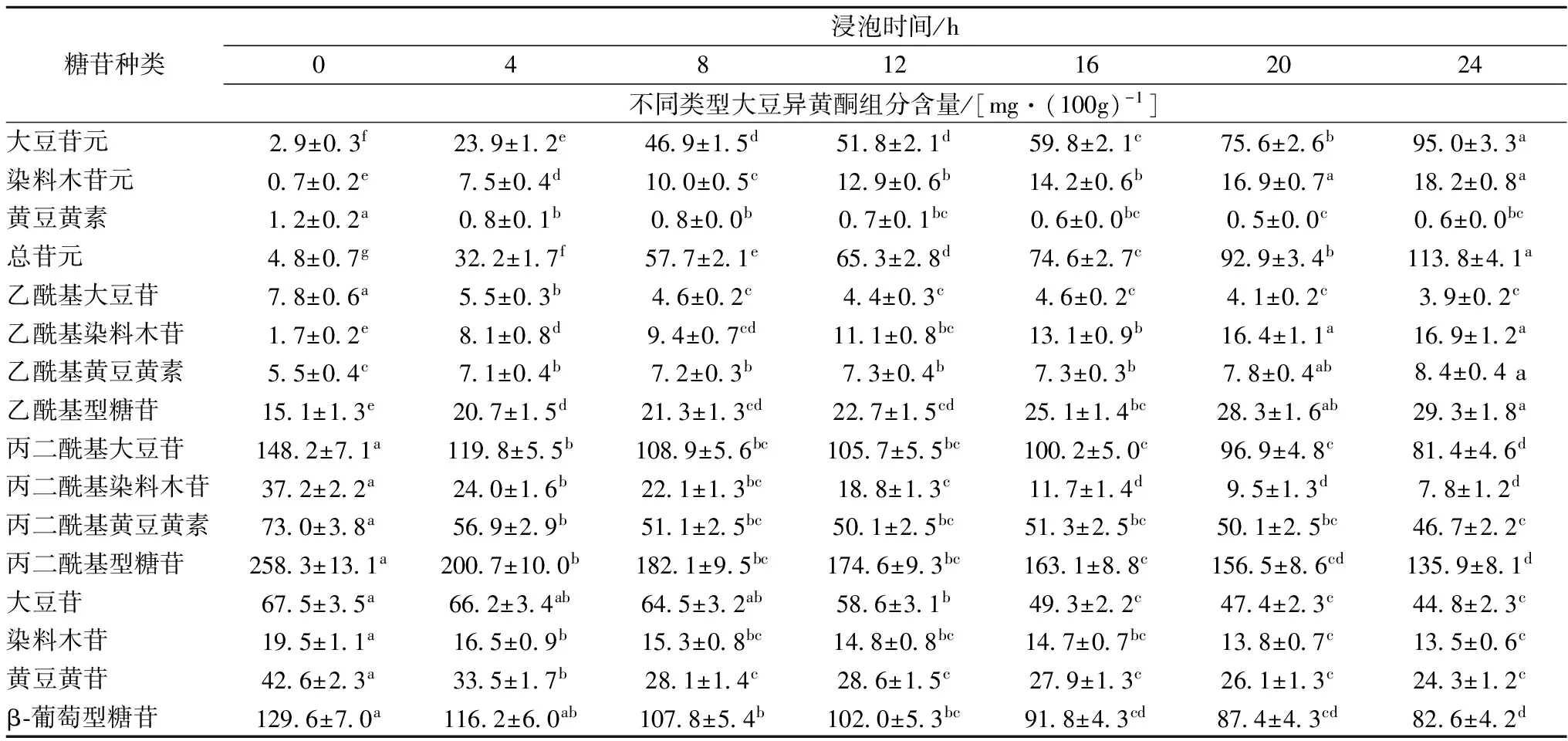
表1 不同类型大豆异黄酮组分含量随浸泡时间的变化
注:同一行数据,标小写英文字母表示存在显著性差异(P<0.05)。
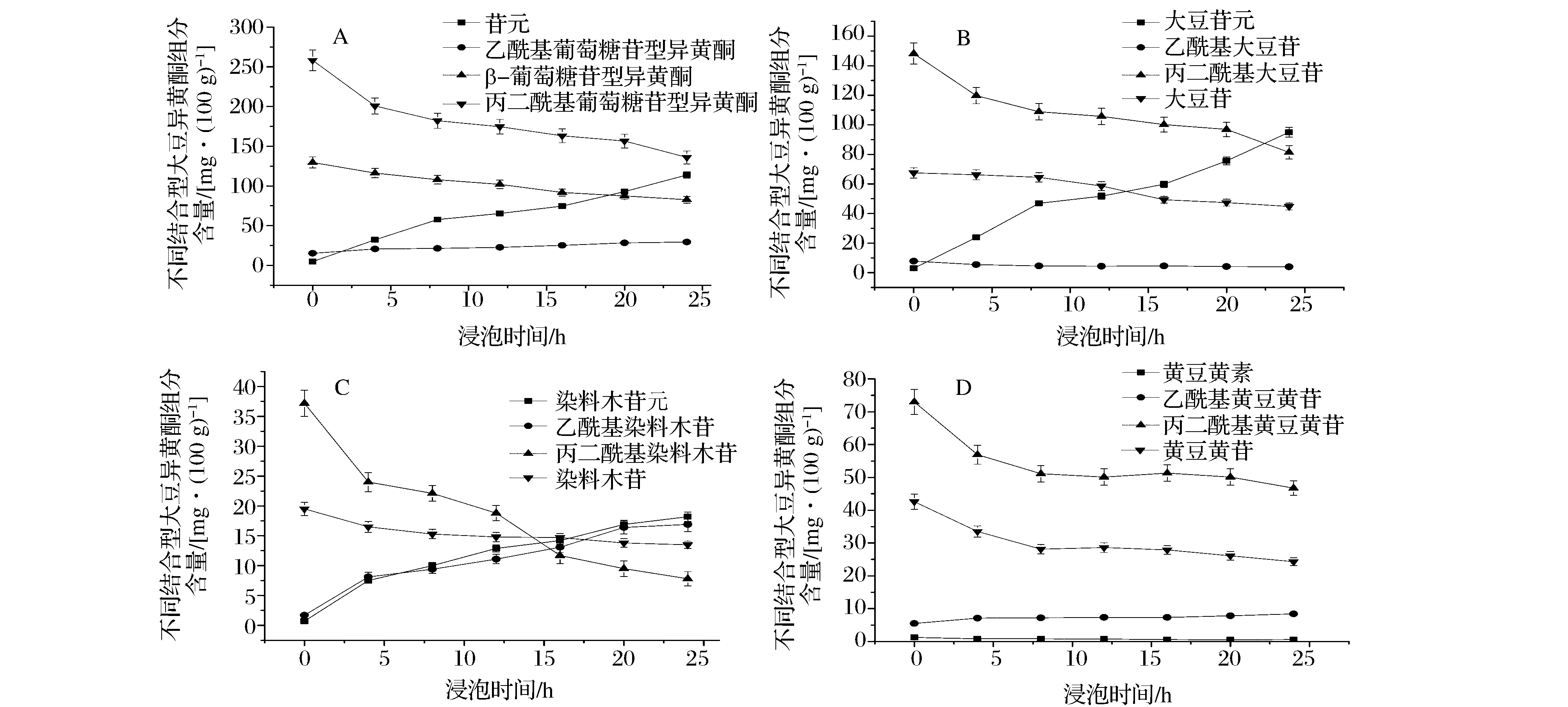
图2 浸泡时间对不同结合型大豆异黄酮组分含量的影响Fig.2 Effects of soaking times on contents of different combined types of soy-isoflavone in soaked soybeans
大豆异黄酮组分间的转化包含两方面:一是大豆异黄酮糖苷衍生物向糖苷的转化;二是结合型糖苷向游离苷元的转化。大豆内源性BG酶参与后者的转化。表1、图2的丙二酰基葡萄糖苷型、β-葡萄糖苷型含量下降,苷元含量上升,表明BG酶解结合型的大豆异黄酮的糖苷。LIU等[30]研究发现,酸解可有效地促进β-葡萄糖苷型转化为苷元。CHEN等[24]的研究表明,BG酶解和醋的酸解作用存在协同效应。GES-FAVONI等[31]发现,通过水浸大豆,大豆内源性BG催化糖苷型的异黄酮转化为苷元。TSANGALIS等[2]的研究表明,发酵可促进丙二酰基葡萄糖苷型、β-葡萄糖苷型转化为苷元。本实验结果与上述研究结果一致,表明食醋浸泡可促进大豆内源性BG催化结合型大豆异黄酮的转化。本实验无法对乙酰基葡萄糖苷型含量的微升现象做出合理解释,可能是由于酶解出的一小部分苷元与大豆多糖的水解产物结合所致。
3 结论
食醋浸泡能够提高大豆内源性BG酶活。食醋浸泡可促进大豆内源性BG催化糖苷型大豆异黄酮的转化。苷元形式的大豆异黄酮具有诸多生物活性,随着人们对提高大豆内源BG活性的深入研究,可大大降低微生物产酶的成本;同时,为大豆的深加工提供新视角。
[1] RIBEIRO M L L, MANDARINO J M G, CRRAO-PANIZZI M C, et al. Isoflavone content and β-glucosidase activity in soybean cultivars of different maturity groups[J]. Journal of Food Composition and Analysis, 2007, 20(1): 19-24.
[2] TSANGALIS D, ASHTON J F, MCGILL A, et al. Enzymic transformation of isoflavone phytoestrogens in soymilk by β-glucosidase-producing bifidobacteria[J]. Journal of Food Science, 2002, 67(8): 3 104-3 113.
[3] KING R A, BIGNELL C M. Concentrations of isoflavone phytoestrogens and their glucosides in Australian soya beans and soya foods[J]. Australian Journal of Nutrition and Dietetics, 2000, 57(2): 70-78.
[4] PHOMMALTH S, JEONG Y S, KIM Y H, et al. Effects of light treatment on isoflavone content of germinated soybean seeds[J]. Journal of Agricultural and Food Chemistry, 2008, 56(21), 10 123-10 128.
[5] LI D H, YEE J A, MCGUIRE M H et al. Soybeanisoflavones reduce experimental in metastasis mice[J]. The Journal of Nutrition, 1999, 129(5):1 075-1 078.
[6] WADA K, NAKAMURA K, TAMAI Y, et al. Soyisoflavone intake and breast cancer risk in Japan: From the Takayama study[J]. International Journal of Cancer, 2013, 133(4): 952-960.
[7] 杨镇洲,朱俊东,糜漫天,等.大豆异黄酮抑制Bcap-37乳腺癌细胞增殖的作用研究[J].中国公共卫生, 2000, 16(10): 913-914.
[8] MAGEE P J, ROWLAND I R. Phyto-oestrogens, their mechanism of action: current evidence for a role in breast and prostate cancer[J]. British Journal of Nutrition, 2004, 91(4): 513-531.
[9] 刘颖,张牧,王小雪,等.染料木黄酮对人胃癌细胞生长抑制作用研究[J].营养学报, 2001, 23(1): 62-65.
[10] 那晓琳,刘晓华,崔红斌.大豆异黄酮对去卵巢大鼠骨力学性能的影响[J].中国公共卫生, 2004, 20(3): 264 -265.
[11] 王海涛,王倩,谢明杰.大豆异黄酮对金黄色葡萄球菌的抑菌机制研究[J].中国农业科学, 2009, 42(7): 2 586-2 591.
[12] 石姗姗.大豆异黄酮抑菌活性的研究及抑菌机制的初步探讨[D].大连:辽宁师范大学, 2006.
[13] MATSUURA M, SASAKI J, MURAO S. Studies on β-glucosidases from soybeans that hydrolyze daidzin and genistin: Isolation and characterization of an isozyme[J]. Biosciences Biotechnology and Biochemistry, 1995, 59(9):1 623-1 627.
[14] PYO Y H, LEE T C, LEE Y C. Effect of lactic acid fermentation on enrichment of antioxidant properties and bioactive isoflavones in soybean[J]. Journal of Food Science, 2005, 70(3):S215-S220.
[15] RUSSIN T A, BOYE J I, PHAM H M. Antioxidant properties of genistein in a model edible oil system[J]. Journal of Food Science, 2006, 71(7):C395-C399.
[16] SAGARA M, KANDA T, NJELEKERA M, et al. Effects of dietary intake of soy protein and isoflavones on cardiovascular disease risk factors in high risk, middle-aged Men in Scotland[J]. Journal of the American College of Nutrition, 2004, 23(1): 85-91.
[17] 刘锦,鲁映青.金雀异黄素对低密度脂蛋白氧化修饰及氧化型低密度脂蛋白诱导的血管内皮细胞c-myc mRNA表达的抑制作用[J].中国动脉硬化杂志, 2002, 10(6):509-512.
[18] 张逊,姚文,朱伟云.肠道大豆异黄酮降解菌研究进展[J].世界华人消化杂志, 2006, 14(10): 973-978.
[19] 丁芳林,彭书练.大豆异黄酮酸水解条件的研究[J].食品与机械, 2006, 22(6): 58-59.
[20] 韩锋,翟桂香.大豆异黄酮及其水解研究进展[J].粮油食品科技, 2004,12(5): 35-36.
[21] 徐茂军. β-葡萄糖苷酶对豆奶及豆奶粉中大豆异黄酮糖苷化合物的转化作用研究[J].中国食品学报, 2005, 5(4): 28-33.
[22] OTIENO D O, SHAH N P. A comparison of changes in the transformation of isoflavones in soymilk using varying concentrations of exogenous and probiotic-derived endogenous β-glucosidases[J]. Journal of Applied Microbiology, 2007, 103(3): 601-612.
[23] DE LIMA F S, KUROZAWA L E, IDA E I. The effects of soybean soaking on grain properties and isoflavones loss[J]. LWT - Food Science and Technology, 2014, 59(2):1 274-1 282.
[24] CHEN Ji-cheng, WANG Jie, WANG Zhi-jiang, et al. Effect of Monascus aged vinegar on isoflavone conversion in soy germ by soaking treatment[J]. Food Chemistry, 2015,186:256-264.
[26] ROMERO-SEGURA C, GARCA-RODRGUEZ R, SNCHEZ-ORTIZ A, et al. The role of olive β-glucosidase in shaping the phenolic profile of virgin olive oil[J]. Food Research International, 2012, 45(1): 191-196.
[27] DE LIMA F S, IDA E I. Optimisation of soybean hydrothermal treatment for the conversion of β-glucoside isoflavones to aglycones[J]. LWT - Food Science and Technology, 2014, 56(2): 232-239.
[28] HSIEH M C, GRAHAM T L. Partial purification and characterization of a soybean β-glucosidase with high specific activity towards isoflavone conjugates[J]. Phytochemistry, 2001, 58 (7): 995-1 005.
[29] SUTIL G A, MANDARINO J M, LAURINDO J B, et al. Effect of hydrothermal treatment and pH on the formation of aglycones in soybean[J]. European Food Research and Technology, 2008, 227(6): 1 729-1 731.
[30] LIU Wei, ZHANG Hui-xin, WU Zhao-liang, et al. Recovery of isoflavone aglycones from soy whey wastewater using foam fractionation and acidic hydrolysis[J]. Journal of Agricultural and Food Chemistry, 2013, 61(30): 7 366-7 372.
Study on isoflavone conversion in vinegar soaked soybean
CHEN Yu-ting, CHEN Ji-cheng*, TIAN Jing-jing
(College of Food Science, Fujian Agriculture and Forestry University, Fuzhou 350002, China)
AgedMonascusvinegar was used to soak soybeans, the conversion of isoflavone by soybean's own endogenous β-glycosidase (β-glucosidase, E.C. 3.2.1.21, BG) was investigated. Synthetic substratep-nitrophenyl-β-D-glucopiranoside method was used in determination of β-glucosidase activity. The quantitative analysis of isoflavones was conducted by HPLC. Results showed that the activity of BG in soybean rose at first then went down with the extension of soaking time. The highest activity of BG was 0.74 U/g after soaking for 4 h. The combined types of soy-isoflavone were hydrolyzed under the interaction between acidolysis and enzymolysis. Under the combination of malonylglycoside-isoflavone and glycoside-isoflavone, glycosides in combined typeof soy-isoflavon was gradually hydrolyzed, malonyl glucoside type and β-clucoside type sioflavon reduced to 47.39% and 36.27% respectively, aglycones was increased significantly, up to 12-fold. Vinegar soaking can improve the bioavailability of soybean. This study provides data for soybean processing and extraction of active ingredients in soybean.
soaked soybean by vinegar; the activity of β-glycosidase (BG) ; soy-isoflavone; aglycone
硕士研究生(陈继承副教授为通讯作者,E-mail:newtaicjc@163.com)。
福建省自然科学基金项目(2016J01105);福建省海洋高新产业发展专项(技术支持)(闽海渔高新【2014】03号);福建农林大学高水平大学建设项目(612014042)
2016-08-13,改回日期:2016-11-21
10.13995/j.cnki.11-1802/ts.201706035
