蓝莓皮渣花色苷粗提物的抗氧化性
2017-07-31周笑犁杜斌周艳谢国芳兰国会肖娜
周笑犁,杜斌,周艳,谢国芳,兰国会,肖娜
1(贵阳学院 食品与制药工程学院,贵州 贵阳,550005)2(贵州医科大学 食品安全学院,贵州 贵阳,550025)
蓝莓皮渣花色苷粗提物的抗氧化性
周笑犁1*,杜斌1,周艳2,谢国芳1,兰国会1,肖娜1
1(贵阳学院 食品与制药工程学院,贵州 贵阳,550005)2(贵州医科大学 食品安全学院,贵州 贵阳,550025)
从蓝莓加工废弃物-皮渣中提取花色苷粗提物,研究花色苷粗提物清除超氧阴离子自由基、DPPH 自由基、羟自由基和抗脂质氧化、还原力等活性。结果表明:蓝莓皮渣花色苷粗提物对超氧阴离子自由基、DPPH 自由基、羟自由基的清除率和还原能力随着添加浓度的增大而升高。花色苷粗提物的羟自由基抑制率在同等浓度下与标准抗氧化剂VC相近、对脂质的抗氧化作用比标准抗氧化剂BHT和VC表现出更好的活性,但花色苷粗提物显著低于同浓度VC对DPPH 自由基的清除率。通过与VC、刺梨多糖的协同作用分析发现,VC对蓝莓皮渣花色苷粗提物具有更好的协同作用。因此,蓝莓皮渣花色苷粗提物具有一定的还原能力、较强的抗脂质过氧化能力,并对自由基具有较强的清除效果,为贵州省蓝莓皮渣的综合开发及新型食品添加剂的研制及进一步推广应用提供了依据。
蓝莓皮渣;粗提物;花色苷;抗氧化
蓝莓学名越橘,富含着维生素、矿物质、微量元素以及花色苷、酚酸、黄酮等酚类化合物而极富营养价值,是世界粮农组织推荐的五大健康水果之一[1-2]。尤其是其中的花色素作为自然界中广泛存在的一种水溶性天然植物色素[3],因其具有抗氧化作用,还被誉为“水果皇后”[4-5]。我国蓝莓栽培主要分布在东北三省、长白山及西南等地区,其中贵州省黔东南州现已成为南方最重要的蓝莓人工种植基地之一。蓝莓资源虽日趋丰富,但其综合利用的程度却较低,除了少量鲜销,大量蓝莓均被加工成便于运输和贮存的产品消费,然而加工过程中产生的皮渣大多被当成废弃物丢弃,其中的活性成分没有得到充分利用,这不仅浪费了大量的资源而且污染了环境。现已发现蓝莓皮渣中花色苷、多酚、黄酮等生物活性物质均高于果肉[6],因此皮渣可以作为蓝莓花色苷的主要来源之一,这些成分的安全性相对人工合成的抗氧化物质要高,综合利用蓝莓皮渣中有价值的成分,对于蓝莓产业的发展将是一种必然趋势。特别是飞速发展的科技和生活水平的提高,让人们对饮食的追求从单一的口感逐渐向着营养和保健的方向发展,促使日常饮食中功能性成分的研究正快速发展着。如膳食多糖不仅可以调节免疫系统,还具有清除自由基等抗氧化、降血糖血脂作用[7],因而得到广泛的应用和发展。
因此本试验以蓝莓皮渣为原料,通过粗提取花色苷,比较其在不同浓度下的体外抗氧化活性,并尝试分析粗提物与刺梨多糖、VC是否具有协同作用以充分利用蓝莓皮渣从而避免资源的浪费。。
1 材料与方法
1.1 试验原料
蓝莓皮渣干粉和刺梨冻干粉由贵州省果品加工工程技术研究中心提供;铁氰化钾、三氯乙酸、FeCl3、FeSO4、水杨酸、NH4SCN、FeCl2、冰乙酸、三氯甲烷等所用化学试剂均为分析纯。
1.2 主要仪器设备
TDL-166RH离心机,上海安亭科学仪器厂;恒温箱,天津市泰斯特仪器有限公司;生化培养箱,天津市泰斯特仪器有限公司;PHS-3C pH计,上海仪电科学仪器股份有限公司;SHB-III循环水真空泵,上海亚荣生化仪器厂;超声仪,昆山市超声仪器有限公司;UV-2550紫外分光光度计,日本岛津公司。
1.3 实验方法
1.3.1蓝莓皮渣花色苷粗提物的提取及含量测定
称取一定量的蓝莓皮渣干粉,用体积比为1∶1的95%乙醇-0.1%HCl溶液作为提取液,在40℃下超声提取2h,冷却后进行抽滤,取滤液进行花色苷含量的测定。测定方法参照BUCKOW等(2010)方法进行测定[8],将滤液分别用NaAc缓冲液和KCl缓冲液稀释,于黑暗处静置20min后在分光光度计上分别测定样品在510 nm和710 nm处的吸光度进行计算:
A=(A510-A700)pH1.0-(A510-A700)pH4.5
(1)
则粗提物样品液中花色苷的浓度为:
C/(mg·L-1) =(A×MW×DF×1 000) / (ε×1)。
(2)
式中:MW,样品中主要花色苷的分子质量,MW= 449.2;DF,稀释因子;ε,样品中主要花色苷的摩尔吸收率,ε=26,900。
1.3.2 刺梨多糖的提取及含量测定
称取一定量的刺梨干粉,采用浸提法提取多糖,然后进行乙醇沉淀和除蛋白后,冷冻干燥用于实验分析,其中多糖的含量采用蒽酮-硫酸法测定[7]。
1.3.3 蓝莓皮渣花色苷粗提物抗氧化性分析
1.3.3.1 还原能力的测定
采用普鲁士蓝法[9]:分别准确移取一定量花色苷浓度分别为0.2、0.4、0.6、0.8和1.0 mg/mL的蓝莓皮渣花色苷粗提物、及其他抗氧化剂(0.2 mg/mL VC、0.2 mg/mL刺梨多糖及0.6 mg/mL提取物和多糖或VC的两两混合物)到试管中,依次加入2.5 mL 0.2 mol/L的磷酸盐缓冲液和2.5 mL 1%六氰合铁酸钾溶液,50 ℃保温20 min后,迅速冷却,再加入2.5 mL 10%的三氯乙酸2.5 mL,3 000 r/min离心10 min,取上清液2.5mL于带塞试管中,依次加入2.5 mL 蒸馏水、0.5 mL 0.1% FeCl3溶液,混合均匀,静置10 min后,在700 nm波长处测定其吸光值。
1.3.3.2 清除羟自由基(·OH)活性研究
在带塞试管中依次加入2 mL 9 mmol/L FeSO4、2 mL 9 mmol/L水杨酸和3mL花色苷浓度分别为0.02、0.04、0.06、0.08和0.1 mg/mL的蓝莓皮渣花色苷粗提物、及其他抗氧化剂(0.02 mg/mL VC、0.02 mg/mL刺梨多糖及0.06 mg/mL提取物和0.02 mg/mL多糖或VC的两两混合物),最后分别加入2 mL 8.8 mmol/L H2O2启动反应,在37℃水浴中反应1 h,于波长510nm处测量吸光值[10]
清除率/%= [A0-(Ai-Ai0)]/A0×100
(3)
式中:A0,样品浓度为0 mg/mL时的吸光值;Ai,样品为i时的吸光值;Ai0,无显色剂、样品质量浓度为i时的吸光值。
1.3.3.3 DPPH自由基的清除作用
准确称取0.198 4 g DPPH,用无水乙醇溶解后定容至50 mL用作储备液,然后吸取DPPH储备液2 mL,用无水乙醇定容至100 mL,分别吸取2 mL DPPH溶液和2 mL乙醇于试管中,用力摇匀,避光反应30 min,以乙醇作为空白,在波长517 nm处测定其吸光值(A0);在试管中分别加入2 mL DPPH溶液+2 mL不同花色苷浓度(0.02、0.04、0.06、0.08、0.1 mg/mL)的蓝莓皮渣花色苷粗提物以同样的方法在波长517 nm处测定其吸光值(Ai);然后测定2 mL乙醇+2 mL不同浓度蓝莓皮渣花色苷粗提物的吸光值(Aj),计算清除率
清除率/%=[A0-(Ai-Aj)]/A0×100[2]
(4)
1.3.3.4 清除超氧阴离子活性
向10 mL比色管中各加入6.0 mL Tris-HCl溶液(pH 8.2),和0.15 mL不同花色苷浓度的蓝莓皮渣花色苷粗提物(以0.15 mL水作为对照,即邻苯三酚自氧化反应),于37 ℃水浴10 min,然后加入37 ℃ 1.0 mL 7 mmol/L邻苯三酚,迅速摇匀。在波长325 nm处测定吸光值(A),每间隔30 s测定1次,邻苯三酚的自氧化速率则以线性范围内每1 min A的增加值对照[11]。
抑制率= [(ΔA1/Δt)-(ΔA2/Δt)]/(ΔA1/Δt)
(5)
式中:ΔA1/Δt,邻苯三酚自氧化反应速率;ΔA2/Δt,加入样品后邻苯三酚自氧化反应速率。
1.3.3.5 对食用油脂的抗氧化性
准确称取不同花色苷浓度的蓝莓皮渣花色苷粗提物(0.2、0.4、0.6、0.8、1.0 mg/mL)及0.2 mg/mL BHT分别加入50 g猪油中,用力搅拌混匀,以不添加任何物质的油脂作为空白对照。将所有样品放入(65±1)℃恒温箱中保存,定时搅拌、通入空气,并不断交换其在恒温箱中的位置,以保证受热等条件均匀。每隔3 d取样按照GB/T 5538—2005测定油脂的过氧化值(POV)[12]。
POV/(mmol·kg-1)= 1 000(V-V0) ×C/2m
(6)
式中:V,测定样品消耗的硫代硫酸钠溶液的体积,mL;V0,空白消耗的硫代硫酸钠溶液的体积,mL;C,硫代硫酸钠溶液的浓度,mol/L;m,试样的质量,g。
1.3.3.6 亚油酸自动氧化的抑制作用
精确吸取0.1 mL不同花色苷浓度的蓝莓皮渣花色苷粗提物(0.2、0.4、0.6、0.8、1.0 mg/mL)和0.2 mg/mL VC对照品溶液,分别依次加入0.10 mL 2.5%亚油酸、15 mL无水乙醇和5 mL 0.05 mol/L磷酸钠缓冲液(pH 7.0),试剂空白液以等量无水乙醇替代亚油酸,然后放入37 ℃培养箱中保存,3 d后吸取0.2 mL各反应液和试剂空白液于10 mL比色管中,分别加入9.4 mL 75%乙醇、0.2 mL 30%NH4SCN和0.2 mL 0.02 mol/L FeCl3溶液,精确反应3 min后,于500 nm波长处分别测定各反应液的吸光值[13]。
1.3.4 实验数据分析与统计
数据用(平均值±标准差)表示。用SPSS 17.0进行统计分析,以P<0.05作为差异显著性判断标准。
2 结果与讨论
2.1 蓝莓皮渣花色苷粗提物的还原能力
由图1可见,蓝莓皮渣花色苷粗提物具有一定还原能力,且还原能力随着粗提物花色苷浓度的增加而增大。当花色苷浓度达到0.6mg/mL时,还原能力基本稳定,显著高于0.2和0.4 mg/mL(P<0.05),而与0.8和1.0 mg/mL花色苷粗提物的还原能力差异不显著(P>0.05)。

图1 蓝莓皮渣花色苷粗提物的还原能力Fig.1 The reducing power of anthocyanins from blueberry pomace
从图2可以看出,0.2 mg/mL VC的还原能力是0.6 mg/mL蓝莓皮渣花色苷粗提物的71%(P<0.05),刺梨多糖也具有一定的还原能力,但仅为同浓度VC的14%(P<0.05)。提示粗提物、VC和多糖提供的电子不仅能够将Fe3+还原为Fe2+,而且还能与自由基形成惰性化合物,避免了自氧化链式反应。粗提物与多糖配合使用显著低于粗提物单独使用(P<0.05),但比多糖单独使用的还原能力强(P>0.05);而当粗提物与VC配合使用时,其还原能力分别是粗提物和VC单独使用的1.4倍和2倍(P<0.05),也显著高于粗提物与多糖混合物(P<0.05),说明两者配合使用具有较好的协同作用。

图2 蓝莓皮渣花色苷粗提物与其他物质对还原能力的协同作用Fig.2 Comparative of reducing power ofanthocyanins from blueberry pomace and its synergistic
2.2 蓝莓皮渣花色苷粗提物对羟自由基的抑制作用
H2O2与Fe2+反应生成的羟基自由基能与水杨酸产生有色物质,当向该混合物中加入花色苷等清除物质时,花色苷中释放出的H与羟基自由基反应,使体系的颜色发生变化,可由溶液颜色的变化程度,评价蓝莓皮渣花色苷粗提物抗氧化活性的高低[10]。由图3可见,0.02 mg/mL蓝莓皮渣花色苷与同浓度VC对羟自由基的抑制率相当(P>0.05)。这表明蓝莓皮渣花色苷粗提物具有较强的羟基自由基清除能力,并且其清除·OH 能力随花色苷浓度的增加呈直线上升,说明花色苷清除·OH 能力与其含量有关,含量越高能力越强,当蓝莓皮渣花色苷的浓度为0.2 mg/mL时抑制率近60%。
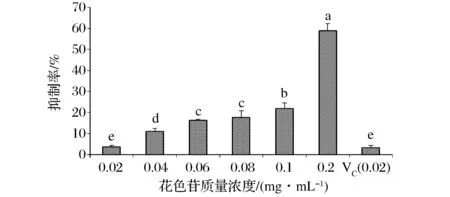
图3 蓝莓皮渣花色苷粗提物对羟自由基的抑制作用Fig.3 The hydroxyl free radical scavenging activity of anthocyanins from blueberry pomace
由图4可以看出,花色苷浓度为0.06mg/mL的蓝莓皮渣花色苷粗提物分别和0.02mg/mL刺梨多糖或0.02mg/mL VC配合使用均具有协同作用,都优于蓝莓皮渣花色苷粗提物、刺梨多糖和VC的单独使用(P<0.05),且两混合物组之间差异不显著(P>0.05),分别为同浓度蓝莓皮渣花色苷粗提物羟自由基清除率的1.3倍和1.4倍。

图4 蓝莓皮渣花色苷粗提物与其他物质对羟自由基抑制的协同作用Fig.4 Comparative of hydroxyl free radical scavenging activity ofanthocyanins from blueberry pomace and its synergistic
2.3 蓝莓皮渣花色苷粗提物对DPPH自由基的清除能力
DPPH自由基是一种较为稳定的、以氮为中心的有机物自由基,当溶液中存在花色苷等自由基清除剂时,花色苷提供的氢或质子就会与DPPH自由基的单电子配对,导致自由基浓度下降,溶液由紫色转变为黄色,其在517 nm处的吸收峰减弱甚至消失[2,10]。因此常用清除DPPH自由基的能力来衡量果蔬等物质的抗氧化能力[14]。由图5可见,蓝莓皮渣花色苷粗提物对DPPH自由基清除能力随花色苷浓度升高而显著增强。

图5 蓝莓皮渣花色苷粗提物对DPPH自由基的清除能力Fig.5 The DPPH radical scavenging effect ofanthocyanins from blueberry pomace
在本实验中,当粗提物中花色苷的浓度为0.06、0.08和0.1 mg/mL时,对DPPH自由基的清除能力均为95%左右,且差异不显著(P>0.05)。而1 mg/mL紫甘薯花色苷、5 mg/mL苹果皮渣多酚和0.08 mg/mL蓝莓酒渣花色苷对DPPH自由基的清除率分别仅为93.2%[15]、96%[16]和78.6%[17],说明蓝莓皮渣花色苷粗提物的抗氧化作用更强。另外,0.02 mg/mL VC对DPPH自由基的清除能力不仅显著高于同浓度的蓝莓皮渣花色苷(P<0.05),还高于其他几个花色苷浓度的蓝莓皮渣花色苷粗提物(P<0.05)。这与徐亚民报道的VC对自由基的清除率显著高于同浓度的紫甘薯花色苷相近[15],而与蓝莓酒渣花色苷清除DPPH自由基能力强于VC的结果不一致[1],可能与其中含有酰化的花色苷有关。
2.4 蓝莓皮渣花色苷粗提物对超氧阴离子自由基的清除作用
超氧阴离子自由基是机体生命代谢中产生的一种重要自由基,具有很强的氧化性[2,10]。从图6可以看出,蓝莓皮渣花色苷粗提物具有一定的超氧阴离子自由基清除作用,随着花色苷浓度的增加,清除率逐渐增大。当粗提物花色苷浓度为62.5mg/L时,超氧阴离子自由基的清除率最高(P<0.05),可达到63.8%。李珍报道的2 mg/mL苹果皮渣多酚对超氧阴离子自由基的清除率为60%[16],说明蓝莓皮渣花色苷粗提物对O2-的清除效果强于苹果皮渣多酚。

图6 蓝莓皮渣花色苷粗提物对超氧阴离子自由基的清除率Fig.6 Superoxide radical scavenging effect of anthocyanins from blueberry pomace
2.5 蓝莓皮渣花色苷粗提物对油脂的抗氧化作用
将蓝莓皮渣花色苷粗提物添加到新鲜猪油中,每隔3d分析油脂过氧化值的变化情况,结果见图7。随着贮藏时间的增加,油脂的过氧化值逐渐增大,在65℃条件下存放9d,空白组、0.2 mg/mL BHT和粗提物、及花色苷浓度为0.4 mg/mL的粗提物组猪油样品的POV即超出GB/T 5009137—2003规定的标准(POV≤10 mmol/kg),但空白组POV显著高于其他各组(P<0.05);不同花色苷浓度的蓝莓皮渣花色苷粗提物对猪油的氧化均有一定的抑制作用,且随着蓝莓皮渣花色苷浓度的增加,对猪油的抗氧化作用增强,时间越长效果越显著。当粗提物花色苷≥0.6 mg/mL存储15d时POV仍符合标准;18d后空白对照组油脂POV值为27.41 mmol/kg,而粗提物花色苷≥0.8 mg/mL时,油脂POV值≤10 mmol/kg,提示其抗氧化能力逐渐增强。当BHT浓度与蓝莓皮渣花色苷粗浓度相同时,从贮藏开始其POV值均差异不显著(P>0.05),随着时间的延长,贮藏15d后蓝莓皮渣花色苷粗提物对油脂的抗氧化活性强于BHT(P<0.05)。说明蓝莓皮渣花色苷粗提物对油脂有着良好的抗氧化性,能有效延缓油脂的氧化作用。
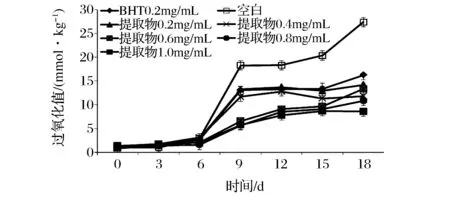
图7 蓝莓皮渣花色苷粗提物的抗油脂氧化性Fig.7 Anti-lipid peroxidation activity of anthocyanins from blueberry pomace
2.6 蓝莓皮渣花色苷粗提物对亚油酸过氧化的抑制作用
由图8可以看出,在不同花色苷浓度的蓝莓皮渣粗提物作用下,明显看出花色苷浓度为0.6 mg/mL时对亚油酸过氧化的抑制率最高,但与花色苷浓度为0.4 mg/mL的粗提物差异不显著(P>0.05);然而当浓度大于0.6 mg/mL后,抑制率降低(P<0.05);0.2 mg/mL VC和同浓度的皮渣花色苷相比较,可以看出VC对亚油酸过氧化的抑制作用不如皮渣花色苷粗提物(P<0.05)。因此当花色苷浓度为0.4 mg/mL时,蓝莓皮渣花色苷粗提物作为着色剂使用具有强烈的抗脂质过氧化作用。

图8 蓝莓皮渣花色苷粗提物对亚油酸过氧化的抑制作用Fig.8 Anti-linoleic acid peroxidation activity of anthocyanins from blueberry pomace
3 结论
通过对蓝莓皮渣中的花色苷进行粗提取后,分析花色苷粗提物对羟自由基、超氧阴离子自由基和DPPH自由基的清除能力,及抗脂质过氧化和还原能力发现:在实验浓度范围内,蓝莓皮渣花色苷粗提物对自由基的清除率和还原能力随着添加浓度的增大而升高,其中花色苷浓度为0.06 mg/mL时,对DPPH自由基清除率达95%,但各浓度花色苷粗提物均显著低于0.02 mg/mL VC对DPPH自由基的清除率;而花色苷粗提物与同等浓度下(0.02 mg/mL)标准抗氧化剂VC对羟自由基的抑制率的作用相近。在抗脂质过氧化作用方面,蓝莓皮渣花色苷粗提物对油脂氧化有较好的延缓作用,随着浓度的增加,其抗猪油过氧化能力逐渐增强,而对亚油酸自氧化的抑制作用在花色苷浓度为0.6 mg/mL时抑制率最高;另外,与标准抗氧化剂BHT和VC相比,蓝莓皮渣花色苷粗提物表现出更好的抗脂质过氧化作用;这充分说明蓝莓皮渣花色苷粗提物具有良好的体外抗氧化活性,从而为蓝莓皮渣的进一步推广应用提供了依据。并且蓝莓皮渣花色苷粗提物在与刺梨多糖、VC配合使用时,VC对花色苷粗提物具有更好的协同作用。因此蓝莓皮渣作为天然食用色素或天然抗氧化剂开发使用,不仅解决了资源的浪费和环境的污染,而且蓝莓皮渣安全无毒,在赋予食品鲜艳柔和色泽的基础上,还具有一定的抗氧化能力,对于蓝莓皮渣的综合开发及新型食品添加剂的研制有着一定的应用价值。
[1] 张杨, 谢笔钧, 孙智达. 蓝莓酒渣、果、酒中花色苷成分鉴定及酒渣与果中花色苷抗氧化活性比较[J].食品科学,2016,37(2):165-171.
[2] PRIOR R L, WILKES S E, ROGERS T R, et al.Purified blueberry anthocyanins and blueberry juice alter development of obesity in mice fed an obesogenic high-fat diet[J]. Journal of Agricultural and Food Chemistry, 2010, 58(7): 3 970-3 976.
[3] 陈云霞, 田密霞, 胡文忠, 等. 蓝莓花色苷提取工艺及其抗氧化性研究[J]. 保鲜与加工, 2015, 15(2): 34-39.
[4] SHEN X, SUN X H, XIE Q C, et al. Antimicrobial effect of blueberry (VacciniumcorymbosumL.) extracts against the growth ofListeriamonocytogenesandSalmonellaenteritidis[J]. Food Control, 2014, 35(1): 159-165.
[5] WHUTE A R, WILLIAMS C M. Effects of a single dose of a flavonoid-rich blueberry drink on memory in 8 to 10 y old children[J]. Nutrition, 2015, 31(3): 531-534.
[6] 周笑犁, 陈丽, 王瑞, 等. 蓝莓不同部位常规营养成分及活性物质的比较分析[J]. 食品工业科技, 2016(9): 363-366.
[7] 王金华, 杜超, 梁晨, 等. 贵长猕猴桃多糖提取工艺及体外抗氧化功能[J]. 食品科学, 2016,37(20):19-23.
[8] BUCKOW R, KASTELL A, TEREFE N, et al. Pressure and temperature effects on degradation kinetics and storage stability of totalanthocyanins in blueberry juice [J]. Journal of Agricultural and Food Chemistry, 2010, 58(18): 10 076-10 084.
[9] 齐美娜. 紫色马铃薯中花色苷的提取、产品研制及其抗氧化活性的研究[D]. 哈尔滨: 东北农业大学, 2013.
[10] 李颖畅,孟宪军. 蓝莓花色苷抗氧化活性的研究[J]. 食品与发酵工业, 2007, 33(9): 61-64.
[11] 韩志萍,曹艳萍. 桑椹提取物抗氧化性及其协同效应的研究[J]. 中国油脂, 2005, 30(8): 46-49.
[12] 李颖畅, 马春颖, 孟宪军, 等. 蓝莓花色苷提取物抗油脂氧化能力的研究[J]. 中国粮油学报, 2010, 25(2): 92-95.
[13] 李鸿梅, 徐力, 杨锐, 等. 玉米醇溶蛋白肽的制备及其对亚油酸自氧化的抑制作用[J]. 中国油脂, 2009, 34(9): 19-23.
[14] 周玮婧, 隋勇, 孙智达, 等. 荔枝皮原花青素与VC、VE的协同抗氧化研究[J]. 食品科学, 2012, 33(3): 5-8.
[15] 徐亚民, 赵晓燕, 马越, 等. 紫甘蓝色素抗氧化能力的研究[J]. 食品研究与开发, 2006, 27(11): 59-63.
[16] 李珍. 苹果皮渣多酚提取、纯化及抗氧化活性研究[D]. 北京:中国农业科学研究院, 2014.
[17] 刘晨, 刘安军, 马艳弘, 等. 蓝莓酒渣花色苷的超声波辅助提取工艺及抗氧化活性[J]. 江苏农业科学, 2015, 43(1) : 242-247.
Study on antioxidant activity of anthocyanins from crude extract of blueberry pomace
ZHOU Xiao-li1*, DU Bin1, ZHOU Yan2, XIE Guo-fang1, LAN Guo-hui1, XIAO Na1
1(College of Food and Pharmacy Engineering, Guiyang University, Guiyang 550005, China)2 (Guizhou Medical University, Guiyang 550025, China)
The oxidation resistant of anthocyanins from blueberry pomace such as scavenging activities on superoxide anion radical, DPPH radical and hydroxyl free radical, anti -lipid peroxidation activity and reducing power were studied. The results showed that, the hydroxyl radical scavenging rates, superoxide anion radical and DPPH radical scavenging were enhanced with the concentration increasing. The antioxidant activity of anthocyanins from blueberry pomace used on the oil had a better effect than that of VCand BHT, close to the same concentration of VCon the hydroxyl radical scavenging rates, but scavenging effect on DPPH radical was not as good as VCat the same concentration. It was found that VChad synergistic antioxidative activities with crude extracts. Therefore, anthocyanins extracted from blueberry pomace had good oxidation resistance. The research provides the basis for comprehensive development of blueberry pomace as a food additive in Guizhou province.
blueberry pomace; crude extract; anthocyanin; antioxidant activity
博士,副教授(本文通讯作者,E-mail:lizi008009@126.com)。
贵州省科技厅自然科学基金(黔科合J字[2014]2006号);贵州省科技厅联合基金(黔科合LH字[2015]7313号);贵州省食品科学与工程重点学科建设项目(黔学位合字ZDXK[2014]13号);贵州省普通高等学校功能食品重点实验室建设项目(黔教合KY字[2016]007号)
2016-08-15,改回日期:2016-11-05
10.13995/j.cnki.11-1802/ts.201706030
