酿酒酵母对萝卜泡菜发酵过程的影响
2017-07-31陈安特张文娟张羲吴秋昊高鸿贾利蓉
陈安特,张文娟,张羲,吴秋昊,高鸿,贾利蓉
(四川大学 轻纺与食品学院,四川 成都,610065)
酿酒酵母对萝卜泡菜发酵过程的影响
陈安特,张文娟,张羲,吴秋昊,高鸿,贾利蓉*
(四川大学 轻纺与食品学院,四川 成都,610065)
以樱桃萝卜为原料,设置4个试验组,分别为乳酸菌接种发酵组、乳酸菌与酵母菌混合接种发酵组、酵母菌接种发酵组和自然发酵组。对各试验组发酵过程中pH值、总酸、亚硝酸盐、色度、硬度、感官品质、乳酸菌数量、酵母菌数量及大肠菌群数量进行研究。实验结果表明:在樱桃萝卜发酵过程中,接种酿酒酵母能够阻止发酵后期pH进一步下降,降低总酸生成量,抑制泡菜过度酸化,使泡菜保持较高的脆度,并且产生浓郁的酯香风味;酿酒酵母的加入不改变亚硝酸盐消长规律,也不影响接种乳酸菌对大肠菌群的抑制效果;但在发酵后期,加入酿酒酵母的试验组,其乳酸菌的生长受到一定程度的抑制,因此酿酒酵母的使用量还需进一步研究。
酿酒酵母;四川泡菜;发酵过程;微生态
传统四川泡菜生产通常采用自然发酵方式,将蔬菜浸泡于浓度为5%~10%的食盐溶液中,利用天然附着在蔬菜表面的微生物(包括乳酸菌、酵母菌和醋酸菌),经以乳酸发酵为主、兼有酒精发酵、醋酸发酵等过程,产生有机酸、酮、醛、酯等风味物质,形成独特的风味和口感[1]。由于原料产地的土壤和气候以及采收季节不同,发酵微生物区系各不相同,自然发酵泡菜品质难以保持稳定。因此,近20年来,食品科学家们从传统发酵泡菜中分离、培养乳酸菌,制备成直投式乳酸菌剂,以期实现泡菜的接种发酵,从而使泡菜品质保持稳定[2]。直投式乳酸菌发酵生产四川泡菜缩短了生产周期,保持了产品质量稳定性,并且能阻止发酵过程形成亚硝酸盐峰值[3-5]。另一方面,由于直投式乳酸菌剂菌种单一,发酵后泡菜风味不及自然发酵风味柔和、丰富[6]。因此多菌种协同发酵成为近年来学者关注的热点,但目前的研究几乎都局限于多种乳酸菌协同发酵对泡菜品质的影响,而对于酵母菌的研究较少。事实上,在泡菜发酵过程中,酵母菌也起到了重要的作用。酵母菌通过酒精发酵产生酒精,既可以增加醇香,也可以抑制有害菌生长,还可以进一步与有机酸反应产生酯类等芳香成分,使泡菜风味更加丰富[7]。此外,酵母菌的代谢产物有利于乳酸菌的生长[8-11]。本研究采用乳酸菌、酿酒酵母接种发酵四川泡菜,研究两者协同发酵对泡菜品质的影响,以及酵母菌与乳酸菌在发酵过程中的生物演替规律,为多菌种协同发酵生产四川泡菜奠定基础。
1 材料与方法
1.1 材料与试剂
樱桃萝卜:购于成都市农贸市场。
酵母菌菌粉:酿酒酵母(Saccharomycescerevisiae),美国Fleischmann公司。
乳酸菌菌粉:含有植物乳杆菌(Lactobacillusplantarum)、肠膜明串珠菌(Leuconostocmesenteroides)、乳酸片球菌(Pediococcusacidilactici),美国The Raw Diet Health Shop。
NaOH、亚铁氰化钾、醋酸锌、冰醋酸、硼砂、对氨基苯磺酸、盐酸萘乙二胺、浓HCl、NaNO2:分析纯,成都市科龙化工试剂厂;MRS琼脂培养基、孟加拉红琼脂培养基、结晶紫中性红胆盐琼脂培养基:成都市科龙化工试剂厂。
1.2 仪器与设备
UV-1240型紫外可见光分光光度计,北京华运安特科技有限责任公司;TA.XT plus质构仪,英国Stable Micro Systerms公司;CM-5分光测色仪,日本柯尼卡美能达公司;LaboGene Scanspeed1736R 高速冷冻离心机,丹麦LaboGene公司。
1.3 实验方法
1.3.1 泡菜制作方法
设置4个试验组,分别为乳酸菌接种发酵(L组)、乳酸菌与酵母菌混合接种发酵(LY组)、酵母菌接种发酵(Y组)和自然发酵(S组)。按照食盐浓度72 g/L和蔗糖浓度36 g/L配制泡菜水,高温灭菌(121 ℃,15 min)后备用。L组添加1.6 g/L乳酸菌菌粉,LY组分别添加1.6 g/L乳酸菌菌粉和0.4 g/L酵母菌菌粉,Y组添加0.4 g/L酵母菌菌粉,S组不添加任何发酵剂。菌粉称取后置于100 mL离心管中,加20 mL无菌温水充分溶解混匀,静置10~15 min后加入泡菜水中。樱桃萝卜洗净后切片,厚度为0.5 cm。称取樱桃萝卜1 000 g,泡菜水1 250 g,装入泡菜坛,置于22 ℃的恒温培养箱中发酵。
1.3.2 理化性质测定方法
于0、1、2、3、4、5、10、15、20天测定泡菜的pH、总酸度、亚硝酸盐含量、色度及硬度。取20 mL泡菜水,在14 000 r/min下离心15 min,取上清液用pH计测定pH值。总酸度采用电位滴定法测定[12]。亚硝酸盐含量采用盐酸-萘乙二胺分光光度法测定[13]。取30 mL泡菜水,在14 000 r/min下离心15 min,取上清液用分光测色仪测定色度。采用质构仪的剪切模式测定萝卜片的硬度,探头下降速度2 mm/s,剪切速度2 mm/s,剪切距离10 mm,重复测试5次,取平均值。
1.3.3 微生物菌落计数方法
于0、2、4、6、8、10、15、20天测定泡菜中的乳酸菌总数、酵母菌总数和大肠菌群总数。乳酸菌总数参照《GB 4789.35—2010 食品安全国家标准食品微生物学检验乳酸菌检验》。酵母菌总数参照《GB 4789.15—2010 食品安全国家标准食品微生物学检验霉菌和酵母计数》。大肠菌群总数参照《GB 4789.3—2010 食品安全国家标准食品微生物学检验大肠菌群计数》。
1.3.4 感官评价方法
选取10名有经验的评员,采用简单描述评定法[14]对泡菜的气味、酸度、颜色进行评价,选取出现频率较高的描述语。
2 结果与分析
2.1 酿酒酵母对樱桃萝卜发酵过程中理化性质的影响
2.1.1 发酵过程中pH和总酸的变化
由图1可知,发酵过程中,各试验组pH均呈现先减小然后平稳的趋势。L组和LY组在0~2天pH分别迅速下降至pH3.72和pH3.81;第2~5天pH下降较为缓慢;第5天后,LY组pH降至pH3.41,保持稳定;而L组继续下降至pH3.20,10天后保持稳定。S组在发酵第2天为pH4.34,远高于L组和LY组;发酵10 d后pH降至pH3.37,然后保持稳定。Y组在0~3 d内pH下降至pH3.89,3 d后保持稳定。由图2可见,总酸度的变化与pH有类似的规律,L组和S组在发酵5 d后总酸度继续升高,而LY组和Y组则升高缓慢。对pH和总酸度的分析可知,加入酿酒酵母能够在发酵后期阻止泡菜的pH下降,减少总酸生成量,为有效解决泡菜过度酸化的问题提供了新的思路。Van Thi Thuy Ho[15]等人的研究表明,在可可豆发酵过程中,如果添加纳他霉素抑制酵母菌生长,会导致发酵成品pH值进一步降低,成品过度酸化。该研究结果与本试验结果一致。
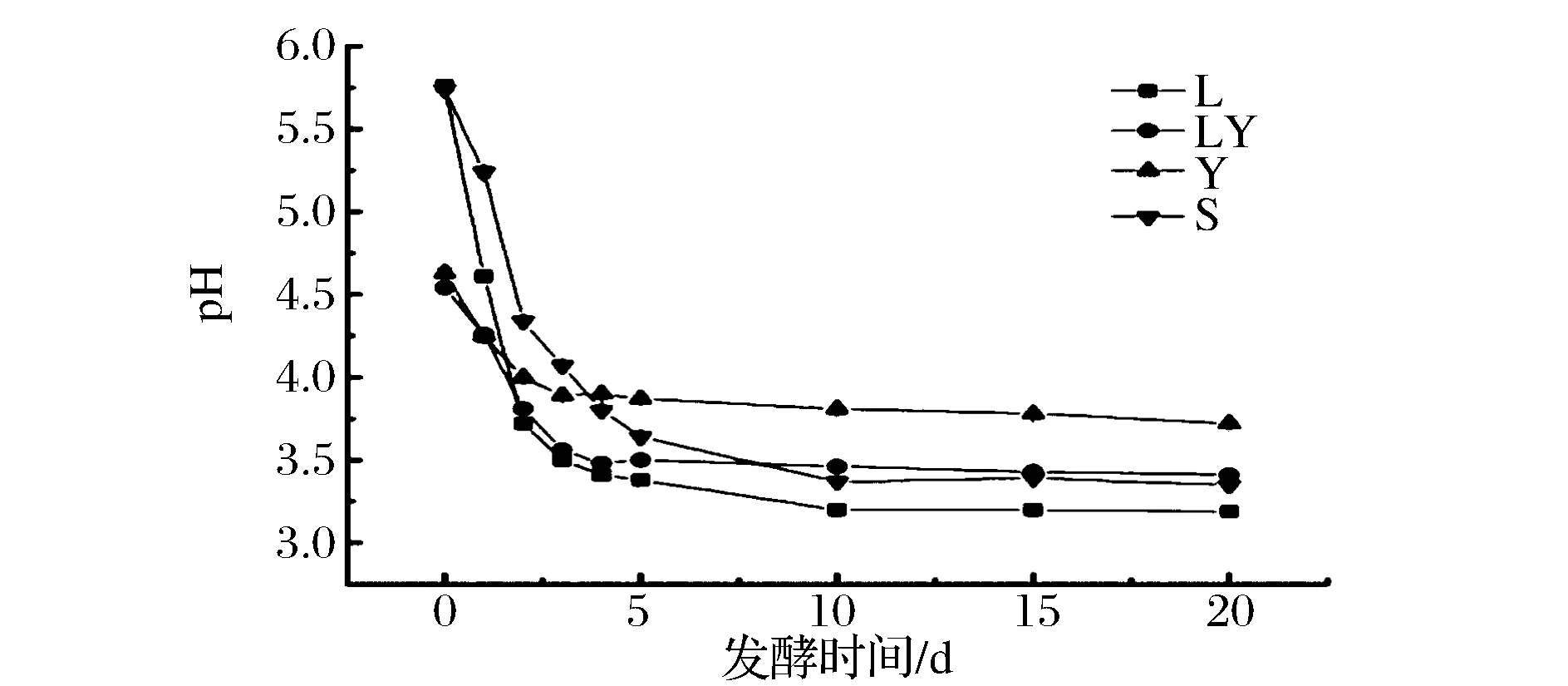
图1 发酵过程中pH的变化Fig.1 Change of pH during fermentation
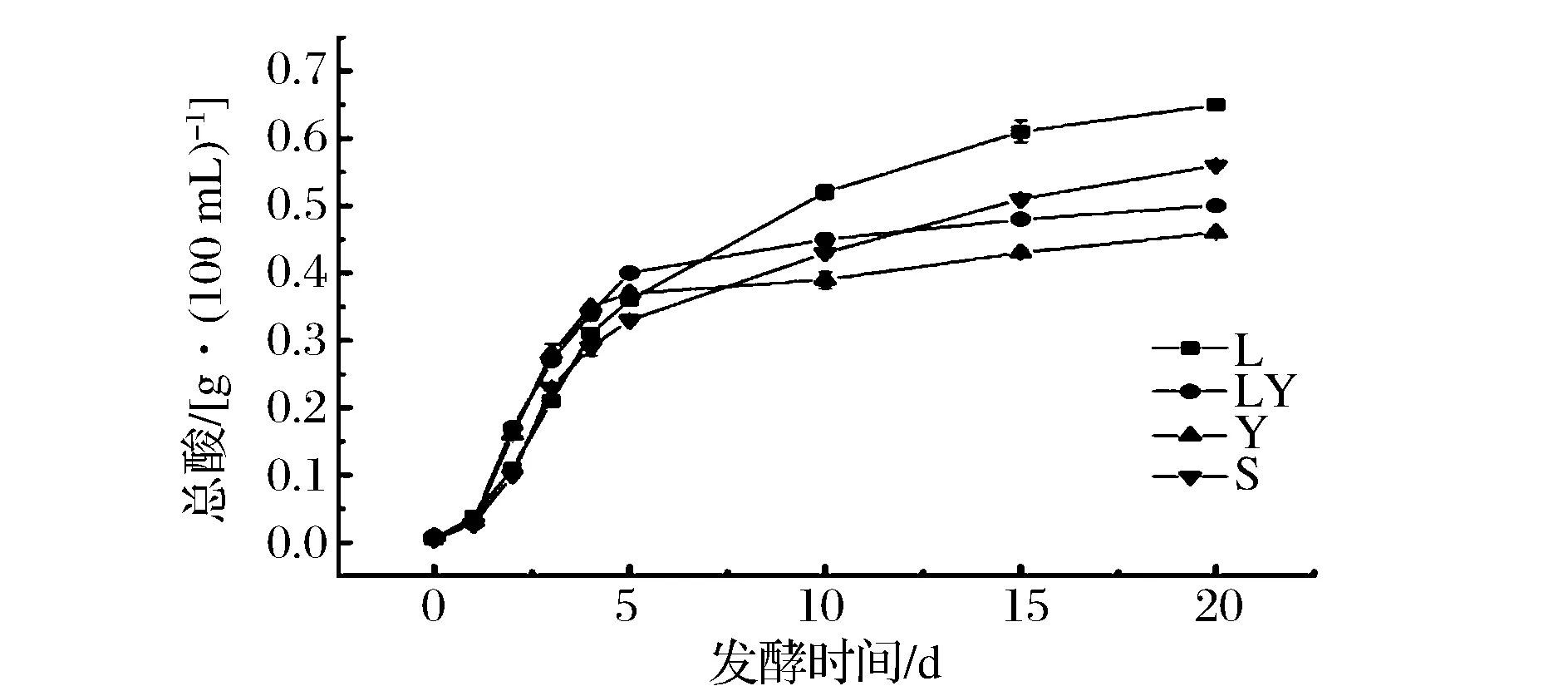
图2 发酵过程中总酸度的变化Fig.2 Change of total acid during fermentation
2.1.2 发酵过程中亚硝酸盐含量的变化
由图3可知,在整个发酵周期中,L组、LY组和Y组的亚硝酸盐含量持续处于极低的水平,不超过1 mg/kg,远远低于国家标准20 mg/kg;这3个试验组在发酵2 d后pH均降至4以下,因此杂菌的生长受到抑制,使得亚硝酸盐无法大量生成并积累[16]。S组在发酵第3天出现明显的“亚硝峰”,峰值为17.87 mg/kg;发酵第4天迅速下降至0.15 mg/kg。自然发酵过程中,在发酵初期,由于蔬菜表面附着一些含有硝酸盐还原酶的细菌,将蔬菜中的硝酸盐转化为亚硝酸盐,使得泡菜水中亚硝酸盐逐渐积累,含量增加。随着发酵的进行,乳酸菌大量繁殖,成为优势菌种,产生大量乳酸,pH值下降,从而抑制杂菌生长,硝酸盐还原酶活性减弱,亚硝酸盐产生量下降;同时,已经产生的亚硝酸盐可被乳酸菌分泌的亚硝酸盐还原酶和乳酸降解[17]。

图3 发酵过程中亚硝酸盐含量的变化Fig.3 Change of total nitrite content during fermentation
2.1.3 发酵过程中颜色的变化
萝卜表皮中富含花青素[18],是一种水溶性色素,在酸性条件下呈红色。在发酵过程中花青素会逐渐转移到泡菜水中,使泡菜水和萝卜片呈现均匀的红色。本试验采用L*a*b*色空间对萝卜片的红色进行描述,a*值越大,表明红色越深。由图4可知,L组和LY组在发酵0~3 d,a*值迅速上升,第5天后几乎不再变化;S组在发酵10 d后a*值保持稳定,大小介于L组和LY组之间;Y组第5天后a*值保持稳定,远低于其他试验组。结合泡菜pH变化的分析,在酸性环境中,泡菜颜色可能与萝卜表皮中色素溶出量有一定关系:pH越低,色素溶出量越高,泡菜颜色越深。加入酿酒酵母不影响樱桃萝卜发酵过程中的颜色变化。
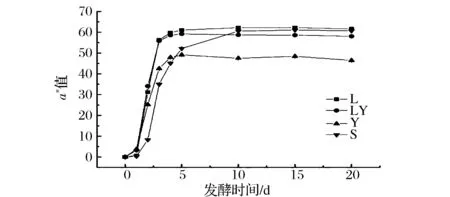
图4 发酵过程中颜色的变化Fig.4 Change of color during fermentation
2.1.4 发酵过程中硬度的变化
由图5可知,各试验组在发酵4 d后,萝卜片硬度均明显下降。发酵后期,LY组和Y组的硬度均大于L组和LY组。泡菜发酵过程中,随着pH下降,有机酸逐渐累积,原料中果胶在酸的作用下逐渐水解为果胶酸,细胞之间粘结性降低,从而导致萝卜片硬度下降[19]。发酵后期LY组和Y组总酸度均大于L组和S组,因此其萝卜片中果胶酸降解程度较低,从而保持较高的硬度。

图5 发酵过程中硬度的变化Fig.5 Change of hardness during fermentation
2.2 酿酒酵母对樱桃萝卜发酵过程中微生态的影响
2.2.1 发酵过程中乳酸菌数量的变化
由图6可知,在发酵初期,各试验组乳酸菌数量均有不同程度的增长,同时在第4天达到最大值,L组、LY组和S组均在107CFU/mL以上,而Y组则在106~107CFU/mL之间。之后L和S组中的乳酸菌数量基本保持稳定至第10天,然后缓慢下降;LY组和Y组则在第4天达到最大值后缓慢下降。导致LY组和Y组的乳酸菌数量过早下降的原因可能是酿酒酵母进行酒精发酵,使发酵体系酒精浓度过高,抑制了乳酸菌生长。李爱霞、秦伟帅等[20-21]的研究表明一定浓度的酒精会抑制乳酸菌的新陈代谢,甚至造成乳酸菌死亡。

图6 发酵过程中乳酸菌数量的变化Fig.6 Change of the colony counts of LAB during fermentation
2.2.2 发酵过程中酵母菌数量的变化
由图7可知,发酵过程中,L组和S组的酵母菌数量呈先增加后减少的趋势,发酵2 d数量达到最大,分别为102.7CFU/mL和104.3CFU/mL,之后迅速减少,第4天后无法检出。整个发酵过程中,LY组和Y组的酵母菌数量持续减少,LY组在10 d后无法检出,Y组酵母菌数量在发酵结束时为103.5CFU/mL。显著性差异分析结果表明,发酵第2天,L组和S组酵母菌数量具有显著性差异(P<0.05),S组明显大于L组,说明接种乳酸菌抑制了原料自身附着的酵母菌的生长,从而导致风味成分较自然发酵单薄。

图7 发酵过程中酵母菌数量的变化Fig.7 Change of the colony counts of yeast during fermentation
2.2.3 发酵过程中大肠菌群数量的变化
由图8可知,随着发酵的进行,各试验组的大肠菌群数量均呈现先增加后减少直至消失的趋势。L组和LY组中,大肠菌群在第2天达到最大值,分别为103.3CFU/mL和103.5CFU/mL,第4天后检测不到。S组中,发酵前第0~4天大肠菌群数量一直在增长,第4天上升到最大值103.3CFU/mL后迅速下降,第6天后没有检出。Y组中,大肠菌群在第2天达到最大值103.8CFU/mL,然后逐渐下降,第8天后检测不到。对比各试验组大肠菌群数量变化可发现,单独接种乳酸菌、同时接种乳酸菌和酿酒酵母均可明显抑制大肠菌群的生长,结合泡菜pH变化分析可知,发酵过程中pH降低越快,大肠菌群受抑制程度越强。乳酸菌对大肠杆菌具有抑制作用,并且环境pH越低,抑制效果越好,与本实验结果一致[22-24]。
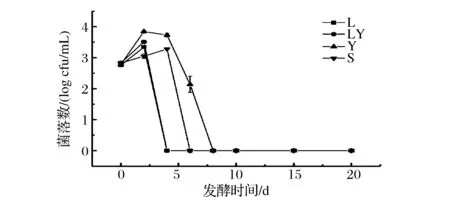
图8 泡菜水中大肠菌群数量的变化Fig.8 Change of the colony counts of coli-group during fermentation
2.3 酿酒酵母对樱桃萝卜发酵过程中风味品质的影响
感官评定结果表明(表1),发酵过程中,L组产生刺激性酸味,风味较单一,缺乏酯香味,不及LY组和S组酸味柔和、风味醇厚。乳酸菌和酵母菌共同发酵相对于乳酸菌单独发酵在风味和泡菜颜色上表现更佳[25]。

表1 感官评定
3 结论与讨论
在樱桃萝卜发酵过程中,接种酿酒酵母能够阻止其pH进一步下降,降低总酸生成量,可有效解决泡菜过度酸化的问题,从而使泡菜保持较高的脆度;并且使泡菜产生酯香风味,整体风味更加醇厚。此外,酿酒酵母的加入不会改变樱桃萝卜泡菜原有的色泽,不影响其亚硝酸盐消长规律,也不会改变接种乳酸菌对大肠菌群的抑制效果。
在乳酸菌纯种发酵泡菜过程中,接种的乳酸菌会抑制原料自身的酵母菌的生长,影响泡菜风味的醇厚感,所以在接种发酵泡菜中有必要添加增香酵母菌。另一方面,接种酵母菌会产生酒精发酵,生成大量酒精及其他代谢产物,使得泡菜在发酵前期出现酒糟味,并且酒精的积累可能会导致乳酸菌生长受到抑制,因此对酵母菌的添加量有待进一步研究。
[1] 于新,杨鹏斌,杨静.泡菜加工技术[M]. 北京:化学工业出版社,2012.
[2] 唐雪鹭.直投式乳酸菌剂发酵泡菜的研究现状及展望[J].中国调味品,2012,37(12):1-4.
[3] 赵爽,孙娟,刘书亮,等.泡菜直投式乳酸菌发酵剂的制备[J].食品工业科技,2014,35(17):171-175..
[4] 李浩艺,陈功,张其圣.等.直投式乳酸菌发酵青菜时亚硝酸盐的动态变化与控制[J].食品与发酵工业,2009,35(8):64-68.
[5] 余文华,张其圣,陈功,等.直投式菌剂发酵泡菜的动态研究[J].食品与发酵科技,2010,46(6):12-15.
[6] 李书华,陈封政.泡菜的研究进展及生产中存在的问题[J].食品科技,2007,32(3):8-11.
[7] TOFALO R,PERPETUINI G,SCHIRONE M,et al.Yeast biota associated to naturally fermented table olives from different Italian cultivars.[J].International Journal of Food Microbiology,2013,161(3):203-208.
[8] ALVES M,GONÇALVES T,QUINTAS C.Microbial quality and yeast population dynamics in cracked green table olives’ fermentations[J].Food Control,2012,23(2):363-368.
[11] 赵欠,王巧碧,周才琼.酿酒酵母相关营养功能成分的研究及应用进展[J].中国酿造,2015,34(6):15-18.
[12] 食品中总酸的测定:GB/T 12456—2008[S].中国标准出版社,2007:3-4.
[13] 食品中亚硝酸盐与硝酸盐的测定:GB 5009.33—2010[S].中国标准出版社,2010:4-9.
[14] 郑坚强.食品感官评定[M].北京:中国科学技术出版社,2013.
[15] Ho V T,ZHAO J,FLEET G.Yeasts are essential for cocoa bean fermentation.[J].International Journal of Food Microbiology,2014, 174(11):72-87.
[16] 袁亚,池金颖,黄丹丹,等.人工接种乳酸菌对泡菜感官品质和亚硝酸盐含量的影响[J].食品工业科技,2012,33(7):119-122.
[17] 黄丽慧,张雁,陈于陇,等.发酵蔬菜中亚硝酸盐消长规律及调控技术的研究进展[J].食品科学,2013,34(5):303-307.
[18] JING P,SONG L H,SHEN S Q,et al.Characterization of phytochemicals and antioxidant activities of red radish brines during lactic acid fermentation.[J]. Molecules,2014,19(7):9 675-9 688.
[19] JARVIS M C,MCCANN M C.Macromolecular biophysics of the plant cell wall: Concepts and methodology[J].Plant Physiology & Biochemistry,2000,38(1-2):1-13.
[20] 李爱霞,王盼雪,樊明涛,等.植物乳杆菌对pH、酒精浓度和SO2浓度耐受性的研究[J].中国酿造,2013,32(9):42-46.
[21] 秦伟帅,王玉峰,赵新节,等.葡萄酒苹果酸-乳酸发酵工艺控制研究进展[J].中外葡萄与葡萄酒,2008(5):64-67.
[22] SCHNÜRER J,MAGNUSSON J. Antifungal lactic acid bacteria as biopreservatives[J].Trends in Food Sci& Tech,2005,16(s 1-3):70-78.
[23] 肖长清,朱世明,陈姗姗.泡菜抑菌性的初步研究[J].湖北第二师范学院学报,2010,27(8):34-36.
[24] 李南薇,李宁.乳酸菌代谢产物对大肠杆菌和金黄色葡萄球菌抑制作用的研究[J].中国酿造,2009(5):49-52.
[25] 张鹏.四川泡菜中酵母菌的分离筛选及其应用研究[D].哈尔滨:东北农业大学,2007.
Effects ofSaccharomycescerevisiaeon pickled radishes during fermentation
CHEN An-te,ZHANG Wen-juan,ZHANG Xi,WU Qiu-hao,GAO Hong,JIA Li-rong*
(College of Light Industry, Textile and Food Engineering, Sichuan University, Chengdu 610065, China)
Cherry radishes were pickled into four groups: lactic acid bacteria (LAB) inoculated fermentation, LAB andSaccharomycescerevisiaemix-inoculated fermentation,Saccharomycescerevisiaeinoculated fermentation and spontaneous fermentation groups. Total acid, pH, nitrite content, chrominance, hardness, sensory quality, the colony counts of LAB, yeast and coli-group were monitored during the fermentation process of Cherry radishes. The results indicated that inoculatingSaccharomycescerevisiaecould decrease the generation of total acid, thereby inhibit a further drop in pH values during fermentation, and thus prevent the over-acidification and maintain the high brittleness of pickled cherry radishes, as well as produce a strong aroma of ester. The growth and decline rule of nitrite content and inhibitory effect of LAB toward coliform won’t be changed by inoculation ofSaccharomycescerevisiae. However, the usage ofSaccharomycescerevisiaeneeds to be further investigated because the growth of LAB was relatively inhibited in experimental groups withSaccharomycescerevisiae.
Saccharomycescerevisiae; Sichuan Paocai; fermentation process; microecology
硕士研究生(贾利蓉副教授为通讯作者,E-mail:771441479@qq.com)。
2017-01-11,改回日期:2017-02-08
10.13995/j.cnki.11-1802/ts.201706021
