调控NADH/NAD+对重组谷氨酸棒杆菌产L-丝氨酸的影响
2017-07-31朱加粉陈紫薇张晓梅史劲松许正宏
朱加粉,陈紫薇,张晓梅,史劲松,许正宏
1(江南大学 药学院,江苏 无锡,214122) 2(江南大学 生物工程学院,江苏 无锡,214122)
谷氨酸棒杆菌;L-丝氨酸;NADH氧化酶;NADH;NAD+
调控NADH/NAD+对重组谷氨酸棒杆菌产L-丝氨酸的影响
朱加粉1,陈紫薇1,张晓梅1,史劲松1,许正宏2*
1(江南大学 药学院,江苏 无锡,214122) 2(江南大学 生物工程学院,江苏 无锡,214122)
在谷氨酸棒杆菌中,L-丝氨酸由糖酵解中间产物3-磷酸甘油酸经过3步反应生成,这个过程产生2个NADH,而L-丝氨酸的合成过程并不涉及NAD+的生成,多余的NADH是否会影响菌株的生长及产L-丝氨酸?该研究通过外源添加NAD+的前体物质烟酸,内源表达NADH氧化酶编码基因noxA,考察调控NADH/NAD+对CorynbacteriumglutamicumSYPS-062 33aΔSSAAI生长和产L-丝氨酸的影响。结果表明,添加不同浓度烟酸,菌株的L-丝氨酸产量、生物量及糖耗较未添加时略有提高。而通过加强表达NADH氧化酶编码基因noxA,构建重组菌CorynbacteriumglutamicumSYPS-062 33aΔSSAAI-noxA,重组菌中NADH氧化酶比酶活是出发菌的11.6倍,L-丝氨酸产量达到28.93 g/L,较出发菌提高9.0%,糖酸转化率达到0.29 g/g蔗糖,较出发菌提高7.4%,OD562最大值为51.38,较出发菌提高6.6%,说明NADH氧化酶的过表达能够促进重组菌株的生长及碳源利用,提高菌株的L-丝氨酸产量。
L-丝氨酸属于非必需氨基酸,有多种重要的生理功能和价值,广泛应用于医药、食品、化妆品等领域。L-丝氨酸处于胞内代谢的中间位置,是生物体内一碳单位的重要来源,参与许多物质甘氨酸、蛋氨酸、嘌呤、嘧啶等物质的合成,代谢转运速度极快[1-2]。目前,L-丝氨酸的生产方法主要有化学合成法、蛋白质水解法、酶法转化法和微生物发酵法。其中,微生物发酵法具有绿色环保、高效、可持续发展等优点,成为国内外研究的热点[3]。
近年来,微生物发酵法生产L-丝氨酸主要集中于谷氨酸棒杆菌和大肠杆菌[4-5]。其中谷氨酸棒杆菌属于革兰氏阳性菌,是美国FDA认证的氨基酸生产菌,被广泛应用于L-谷氨酸、L-赖氨酸、L-缬氨酸等氨基酸的生产[6]。谷氨酸棒杆菌中L-丝氨酸的代谢途径如图1所示,L-丝氨酸由糖酵解中间产物3-磷酸甘油酸经3-磷酸甘油酸脱氢酶(PGDH)、磷酸丝氨酸转氨酶(PSAT)和磷酸丝氨酸磷酸酶(PSP) 3个酶催化生成L-丝氨酸。L-丝氨酸在丝氨酸羟甲基转移酶(SHMT)和L-丝氨酸脱氨酶(L-serDH)作用下分别降解为甘氨酸和丙酮酸[5]。目前,对谷氨酸棒杆菌产L-丝氨酸的研究主要集中于L-丝氨酸的降解途径和合成途径。SOTLZ等[7]等过表达C.glutamicumATCC13032L-丝氨酸合成途径中关键酶,敲除或弱化L-丝氨酸降解途径的酶,构建的菌株通过培养基优化、补料分批发酵,在20 L的发酵罐上L-丝氨酸的产量为36.26 g/L。

图1 谷氨酸棒杆菌中L-丝氨酸的代谢途径Fig.1 Metabolic pathway of L-serine in Corynebacterium glutamicum
本课题组前期从土壤中筛选出1株能直接利用糖质原料积累L-丝氨酸的谷氨酸棒杆菌C.glutamicumSYPS-062,并通过逐级诱变、代谢工程改造,最终构建的C.glutamicumSYPS-062 33aΔSSAAI在摇瓶发酵中L-丝氨酸的产量为26.23 g/L,在5 L发酵罐上补料分批发酵,L-丝氨酸的产量达到42.62 g/L[8-9],是目前文献报道利用糖质原料产L-丝氨酸的最高水平,但是菌株仍旧存在生长缓慢的问题。在微生物细胞内,NADH通过氧化磷酸化途径代谢为NAD+,这一过程中产生大量的ATP,变构抑制糖酵解途径的关键酶,降低糖的消耗速度,因此,一条加快糖酵解速率的策略是:过量的NADH在充分氧化为NAD+的同时,尽量减少ATP的合成。HEUX等[10]在Saccharomycescerevisiae过量表达编码NADH氧化酶基因,导致胞内NADH含量下降,糖的消耗速度增加10%。董志姚等[11]通过过表达NADH氧化酶编码基因,能够直接将NADH转化成NAD+,减少ATP的合成,重组菌葡萄糖消耗速度和目标产物产量均得到大幅提高。而PARK等[12]报道,在谷氨酸棒杆菌中,noxA所表达的蛋白具有氧化NADH的能力。谷氨酸棒杆菌在利用糖产L-丝氨酸过程中产生多余的NADH,是否多余的NADH导致C.glutamicumSYPS-062 33a△SSAAI生长缓慢?调控NADH/NAD+对谷氨酸棒杆菌生长及产L-丝氨酸是否会有影响,目前未见这方面的研究报道。
本文首先通过外源添加不同浓度的NAD+前体物质烟酸,考察其对谷氨酸棒杆菌C.glutamicumSYPS-062 33a△SSAAI菌株生长、碳源利用及L-丝氨酸产量的影响。随后在C.glutamicumSYPS-062 33a△SSAAI中过表达NADH氧化酶编码基因noxA,考察其对菌株生长、碳源利用及L-丝氨酸产量的影响,为菌株高产L-丝氨酸代谢改造提供新的思路。
1 材料与方法
1.1 材料
1.1.1 菌株和引物
CorynbacteriumglutamicumSYPS-062 33aΔSSAAI(缩写为ΔSSAAI)为江南大学药学院制药工程研究室前期构建并保藏;大肠杆菌JM109为实验室保藏;大肠杆菌-谷氨酸棒杆菌穿梭表达质粒pDXW-10为王小元实验室馈赠[13]。实验涉及引物见表1。

表1 实验中用到的引物
注:酶切位点用下划线表示。
1.1.2 试剂
细菌基因组提取试剂盒、凝胶Clean柱回收试剂盒、质粒小量提取试剂盒及PCR引物均购自上海捷瑞生物工程有限公司;PrimeSTAR聚合酶、T4DNA连接酶等购自TaKaRa生物公司;限制性内切酶购自Fermentas公司;NADH氧化酶酶活相关检测试剂购自sigma公司;蔗糖、磷酸二氢钠、琼脂粉等均为分析纯,均购于国药试剂有限公司;脑心浸液(BHI)、原儿茶酸、生物素等购于sigma公司;硫酸卡那霉素购于上海生物工程有限公司。
1.1.3 培养基
(1)LB 培养基(g/L):蛋白胨 10,酵母粉 5,NaCl 10(固体培养基,琼脂粉 20);121℃灭菌20 min;
(2)种子培养基(g/L):脑心浸液 37,葡萄糖 20,(NH4)2SO410,MgSO4·7H2O 0.5,K2HPO40.2,NaH2PO40.3;
(3)发酵培养基(g/L):蔗糖 100,CaCO360,KH2PO43,(NH4)2SO430,MgSO4·7H2O 0.5,FeSO4·7H2O 0.02,MnSO4·H2O 0.02,原儿茶酸 0.03,生物素 5×10-5,盐酸硫胺素 4.5×10-4;115 ℃灭菌7 min;
(4)谷氨酸棒杆菌感受态培养基(g/L):蛋白胨 10,酵母粉 5,NaCl 10,吐温 80 1,甘氨酸 25;121 ℃灭菌20 min;
(5)谷氨酸棒杆菌电转化培养基(g/L):蛋白胨 5,酵母粉 2.5,NaCl 5,脑心浸液 18.5,山梨醇 91;121 ℃灭菌20 min。
1.2 方法
1.2.1 重组质粒的构建
以谷氨酸棒杆菌ΔSSAAI基因组为模板,利用引物noxA-F和noxA-R扩增NADH氧化酶编码基因noxA(582 bp)用限制性内切酶EcoRI、XhoI双酶切目的基因和质粒载体pDXW-10,利用T4DNA ligase连接经过双酶切的目的片段和质粒载体。
1.2.2 重组菌的构建
制备ΔSSAAI电转化感受态细胞,将重组质粒pDXW-10-noxA电转入ΔSSAAI感受态细胞,电转化条件1.8 kV、5 ms,在谷氨酸棒杆菌电转化培养基中加入适量的硫酸卡那霉素(50 mg/mL)筛选阳性转化子,最终提取质粒,通过PCR及双酶切验证,得到重组菌C.glutamicumSYPS-062 33aΔSSAAI-noxA(缩写为ΔSSAAI-noxA)。
1.2.3 重组质粒稳定性分析
质粒稳定性分析参照诸葛鑫[14]的方法。将重组菌接种至不含卡那抗性的液体种子培养基中,30 ℃培养24 h,以1%的接种量进行传代培养。将菌液稀释一定倍数涂布在种子平板和含有抗性的平板上,统计菌落数。
1.2.4 NADH氧化酶酶活力的测定
取对数生长期的细胞,4 000 r/min,离心10 min收集菌体。用pH 7.0 的磷酸钾缓冲液洗涤3次,用磷酸钾缓冲液适当稀释菌体,在冰浴条件下,超声破碎菌体细胞,工作4 s间歇6 s,99个循环,破碎3轮。离心取上清即为细胞总蛋白的粗提液。采用Bradford方法测定蛋白浓度。
酶活检测方法参照PARK等[12],配制磷酸钾反应体系,包含50 mmol/L磷酸盐;0.3 mmol/L EDTA;0.3 mmol/L NADH;50 μmol/L FAD。其中NADH作为反应电子的供体,在340 nm处有吸收峰,FAD则作为反应电子的受体。取1 mL的磷酸钾反应液,加入50 μL总蛋白提取液,记录3 min内吸光度变化。每分钟氧化1 μmol NADH 所需的酶量为1个单位。
1.2.5 发酵参数的测定
生物量的测定:发酵液用1 mol/L HCl稀释至一定浓度,紫外分光光度计检测OD562。
L-丝氨酸和糖浓度的测定:采用HPLC测定发酵液中糖及L-丝氨酸产量[8]。
2 结果与分析
2.1 添加不同浓度的烟酸对ΔSSAAI发酵的影响
微生物中的磷酸核糖转移酶能够将培养基中的烟酸催化生成NAD+,刘杰等[15]在光滑球拟酵母发酵培养基中添加8 mg/L烟酸(NAD+合成前体)后,使得在发酵生产丙酮酸的过程中的葡萄糖消耗速度加快48.4%且丙酮酸产量增加29%。本文中添加0、16、24、32、40 mg/L烟酸,考察烟酸添加对出发菌ΔSSAAI发酵性能的影响。添加不同浓度烟酸菌株发酵96 h,相关发酵参数如表2所示。

表2 烟酸添加量对菌株ΔSSAAI发酵性能影响
从表2可以看出,添加不同浓度烟酸的发酵培养基中,发酵96 h,L-丝氨酸的产量较未添加有所提高,添加32 mg/L烟酸对菌株生长糖耗产酸最有利,L-丝氨酸产量最高达到27.75 g/L,比对照提高4.5%;菌株最大OD562达到49.24,比对照提高了2.1%;图2为菌株ΔSSAAI添加32 mg/L烟酸的发酵过程曲线,从研究结果可以看出,外源添加烟酸菌株的生长及产酸略有提高,分析原因可能是由烟酸反应合成NAD+过程中,将烟酸催化生产烟酸单核苷酸的烟酸磷酸核糖转移酶是其中的关键限速酶,在大肠杆菌中过量表达烟酸磷酸核糖转移酶编码基因可以有效地提高胞内的NAD+的含量[16]。
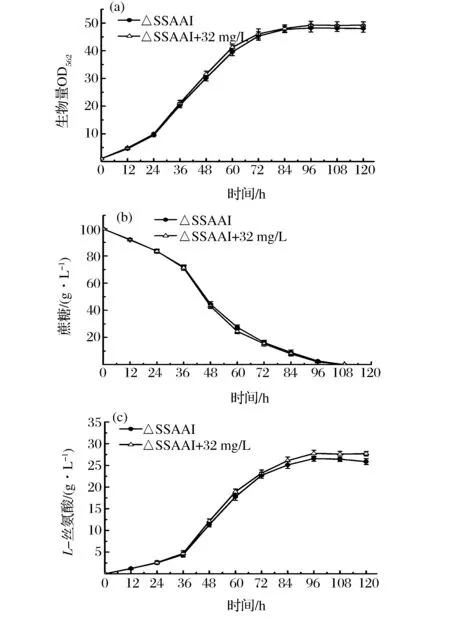
图2 添加32 mg/L烟酸对菌株ΔSSAAI发酵过程的影响Fig.2 Time course of L-serine fermentation by ΔSSAAI
2.2 重组菌ΔSSAAI-noxA的构建
依据方法1.2.1构建重组质粒pDXW-10-noxA,依据方法1.2.2构建重组菌ΔSSAAI-noxA,挑取转化子培养,提取质粒并利用EcoRI/XhoI双酶切验证,结果如图3所示。从图3可以看出,1、2、3泳道条带分别与8351 bp的质粒pDXW-10和582 bpnoxA基因相对应,表明成功构建重组菌ΔSSAAI-noxA。

M1-DL10000 DNA Marker;M2-DL2000 DNA Marker;1,2,3-重组质粒pDXW-10-noxA双酶切结果图3 重组菌ΔSSAAI-noxA构建结果Fig.3 Verification of recombinant strain ΔSSAAI-noxA
2.3 重组质粒pDXW-10-noxA传代稳定性分析
将活化的种子平板上重组菌ΔSSAAI-noxA转接至液体培养基中进行传代培养,分别取4,8,12,16,20代的菌液稀释至适当浓度涂布固体种子平板和添加卡那抗性的平板上,30 ℃培养2~3 d,对平板上的菌落数进行统计,考察重组质粒pDXW-10-noxA的传代稳定性。结果如表3所示,随着传代次数的增加,菌株依然保持原有特性,当传代20次,重组菌ΔSSAAI-noxA所占比例为90.18%,说明重组质粒pDXW-10-noxA在ΔSSAAI中稳定性良好。

表3 质粒稳定性评价
2.4 重组菌ΔSSAAI-noxA与出发菌ΔSSAAI中NADH氧化酶酶活力的测定
收获种子培养基中对数生长期的重组菌和出发菌细胞,破碎细胞取上清得到粗酶液,检测NADH氧化酶酶活力,结果如表4所示。加强表达noxA基因能够显著提高NADH氧化酶酶活力,重组菌中NADH氧化酶比酶活是出发菌的11.6倍。

表4 重组菌ΔSSAAI-noxA和出发菌ΔSSAAI中NADH氧化酶酶活
2.5 重组菌ΔSSAAI-noxA发酵过程分析
noxA基因的过表达对菌株ΔSSAAI发酵性能的影响如图4所示。从图4(a)可以看出,发酵前期重组菌ΔSSAAI-noxA的生长略慢于出发菌ΔSSAAI,说明质粒过表达在一定程度上给菌体代谢造成负担,随着发酵时间的增加,在菌体对数生长期,重组菌ΔSSAAI-noxA生长明显好于出发菌ΔSSAAI,发酵至84 h,重组菌OD562达到最大值51.38,出发菌株OD562最大值为48.21,较出发菌提高6.6%,由此可以看出,基因noxA的过表达能够在一定程度上促进菌体的生长,增加生物量。从图4(b)可以看出,发酵前期重组菌的糖耗相比于出发菌未见明显变化,从36 h开始,重组菌的糖耗明显快于出发菌,发酵至96 h,重组菌消耗完所有的糖,说明基因noxA的过表达能促进菌体对糖的利用。从图4(c)可以看出,发酵96 h,重组菌L-丝氨酸达到最大值28.93 g/L,较出发菌提高9.0%,重组菌的糖酸转化率为0.29 g/g蔗糖,较出发菌提高7.4%,说明基因noxA的过表达能提高重组菌的L-丝氨酸产量糖酸转化率。

图4 重组菌ΔSSAAI-noxA和出发菌ΔSSAAI发酵过程比较Fig.4 The fermentation performance comparison of ΔSSAAI-noxA and ΔSSAAI
3 结论
谷氨酸棒杆菌在利用糖质原料合成L-丝氨酸过程中产生2个NADH,而L-丝氨酸的合成过程并不涉及NAD+的生成,NADH/NAD+不平衡的问题可能会对菌株生长产酸造成影响。本文通过内源外源2个方面调控NADH/NAD+,考察其对谷氨酸棒杆菌ΔSSAAI生长和发酵的影响。首先通过外源添加不同浓度的NAD+前体物质烟酸,菌株ΔSSAAI的生长及产酸略有提高;随后,通过加强表达 NADH 氧化酶编码基因noxA,成功构建1株过量表达noxA的L-丝氨酸生产菌ΔSSAAI-noxA,比较了重组菌ΔSSAAI-noxA和出发菌ΔSSAAI中NADH氧化酶的酶活力,重组菌ΔSSAAI-noxA中NADH氧化酶酶比活力是出发菌ΔSSAAI的11.6倍。通过对重菌株发酵过程分析发现,过表达基因noxA提高了谷氨酸棒杆菌产L-丝氨酸的能力。重组菌ΔSSAAI-noxAOD562最大值为51.38,较出发菌ΔSSAAI提高6.6%,L-丝氨酸产量达到28.93 g/L,较出发菌提高9.0%,糖酸转化率提高7.4%,由此可以看出,基因noxA的过表达能够提高重组菌的L-丝氨酸产量及糖酸转化率,促进重组菌的生长及加快碳源的消耗。利用过表达NADH氧化酶编码基因noxA调控菌株NADH的策略,为提高相关氨基酸产量提供了参考。
[1] JIANG Wei, XIA Bin-hao, LIU Zi-duo. A serine hydroxymethyltransferase from marine bacteriumShewanellaalgae: Isolation, purifcation, characterization andL-serine production[J]. Microbiological Research, 2013, 168(8): 477-484.
[2] LAI Shu-juan, ZHANG Yun, LIU Shu-wen, et al. Metabolic engineering andux analysis ofCorynebacteriumglutamicumforL-serine production[J]. Science China Life Sciences, 2012, 55(4): 283-290.
[3] 刘岩, 王慧, 史吉平, 等. 微生物法生产L-丝氨酸代谢工程研究进展[J]. 生物技术通报, 2015, 31(8): 44-49.
[4] MUNDHADA H, SCHNEIDER K, CHRISTENSEN H B, et al. Engineering of high yield production ofL-serine inEscherichiacoli[J]. Biotechnology and Bioengineering, 2015, 113(4): 807-816.
[5] PETERS-WENDISCH P, STOLZ M, ETTERICH H, et al. Metabolic engineering ofCorynebacteriumglutamicumforL-serine production[J]. Applied and Environmental Microbiology, 2005, 71(11): 7 139-7 144.
[6] BECKER J, WITTMANN C. Systems and synthetic metabolic engineering for amino acid production the heartbeat of industrial strain development[J]. Current Opinion in Biotechnology, 2012, 23(5): 718-726.
[7] STOLZ M, PETERS-WENDISCH P, ETTERICH H, et al. Reduced folate supply as a key to enhancedL-serine production byCorynebacteriumglutamicum[J]. Applied and Environmental Microbiology, 2007, 73(3): 750-755.
[8] ZHU Qin-jian, ZHANG Xiao-mei, LUO Yu-chang, et al.L-serine overproduction with minimization of byproduct synthesis by engineeredCorynebacteriumglutamicum[J]. Applied Microbiology and Biotechnology, 2015, 99(4): 1 665-1 673.
[9] XU Guo-qiang, ZHU Qin-jian, LUO Yu-chang, et al. Enhanced production ofL-serine by deletingsdaA combined with modifying and overexpressingserA in a mutant ofCorynebacteriumglutamicumSYPS-062 from sucrose[J]. Biochemical Engineering Journal, 2015, 103: 60-67.
[10] HEUX S, CACHON R, DEQUIN S. Cofactor engineering inSaccharomycescerevisiae: Expression of a H2O-forming NADH oxidase and impact on redox metabolism[J]. Metabolic Engineering, 2006, 8(4): 303-314.
[11] 董志姚, 李秀芬, 刘立明,等. 过量表达NADH氧化酶加速光滑球拟酵母合成丙酮酸[J]. 微生物学报, 2008, 48(8): 1 061-1 066.
[12] PARK J C, KIM Y, LEE H. Involvement of the NADH oxidase encodingnoxAgene in oxidative stress responses inCorynebacteriumglutamicum[J]. Applied Microbiology and Biotechnology, 2015, 99(3): 1 363-1 374.
[13] XU Da-qing, TAN Yan-zhen, SHI Feng, et al. An improved shuttle vector constructed for metabolic engineering research inCorynebacteriumglutamicum[J]. Plasmid, 2010, 64(2): 85-91.
[14] 诸葛鑫. 代谢工程改造詹氏丙酸杆菌和过程优化提高丙酸产量[D]. 无锡: 江南大学, 2014.
[15] LIU Jie, LI Yong-tao, SHI Zhong-ping, et al. Enhancement of pyruvate productivity inTorulopsisglabrata: Increase of NAD+availability[J]. Journal of Biotechnology, 2006, 126(2): 173-185.
[16] BERRIOS-RIVERA S J, SAN K Y, BENNETT G N. The effect of NAPRtase overexpression on the total levels of NAD, the NADH/NAD+ratio, and the distribution of metabolites inEscherichiacoli[J]. Metabolic Engineering, 2002, 4(3): 238-247.
The effect of NADH/NAD+regulation onL-serine production by recombinantCorynebacteriumglutamicum
ZHU Jia-fen1, CHEN Zi-wei1, ZHANG Xiao-mei1, SHI Jin-song1, XU Zheng-hong2*
1(School of Pharmaceutics Science, Jiangnan University, Wuxi 214122, China)2(School of biotechnology, Jiangnan University, Wuxi 214122, China)
TheL-serine is produced by a three-step reaction of a glycolytic intermediate 3-phosphoglycerate, 2 molecules of NADH were generated in the production ofL-serine from sugars byCorynebacteriumglutamicum. However, no NAD+was generated in this process. Did NADH affectL-serine production and cell growth ofCorynebacteriumglutamicumThis study aimed to investigate the effects of regulation of NADH/NAD+onCorynebacteriumglutamicumSYPS-062 33aΔSSAAI growth, sugar consumption andL-serine accumulation by exogenous addition of niacin and endogenous overexpression of NADH oxidase. The results showed that exogenous addition of niacin had slightly enhanced the cell growth, sugar consumption andL-serine accumulation. When NADH oxidase was overexpressed, the recombinant strainCorynebacteriumglutamicumSYPS-062 33aΔSSAAI-noxA was constructed. The NADH oxidase activity in the recombinant strain was 11.6 folds higher than that of the parent strain. The production ofL-serine in recombinant strain was 28.93 g/L,increased by 9.0%, and the yield was 0.29 g/g sugar, increased by 7.4%. Its OD562was 51.38, increased by 6.6%. The results indicated that the overexpression of NADH oxidase could increase the cell growth, sugar consumption andL-serine production.
Corynebacteriumglutamicum;L-serine; NADH oxidase; NADH; NAD+
硕士研究生(许正宏教授为通讯作者,E-mail:zhenghxu@jiangnan.edu.cn)。
2017-02-03,改回日期:2017-03-04
10.13995/j.cnki.11-1802/ts.201706009
