生长素释放肽对心力衰竭大鼠心肌细胞抗凋亡机制的初步研究
2017-07-31曹劲松邢宇彤刘俊琰汪高磊周刚肖明第
曹劲松,邢宇彤,刘俊琰,汪高磊,周刚,肖明第
基础与实验研究
生长素释放肽对心力衰竭大鼠心肌细胞抗凋亡机制的初步研究
曹劲松,邢宇彤,刘俊琰,汪高磊,周刚,肖明第
目的:探讨生长素释放肽(GHRP)对心力衰竭(心衰)大鼠心肌细胞抗凋亡机制。
方法:40只雄性SD大鼠,随机分为4组:正常对照组、假手术组、心衰模型组、GHRP治疗组,每组10只。通过结扎冠状动脉左前降支缺血诱导大鼠建立心衰模型。术后各组大鼠正常饲养4周,检测心脏功能,观察各组大鼠心肌细胞形态学改变。免疫蛋白印迹(Western blot)方法检测各组心肌细胞Smac/DIABL0蛋白和B型白细胞/2型淋巴细胞样蛋白(Bcl-2)表达情况。应用流式细胞(FCM)技术检测各组大鼠心肌细胞凋亡情况。比较各组间各指标差异,探讨GHRP对心衰大鼠心肌细胞抗凋亡机制。
结果:GHRP治疗组大鼠的心脏扩张程度较心衰模型组轻,而左心室射血分数比心衰模型组高(P<0.05)。GHRP治疗组的心肌细胞病理改变程度较心衰模型组轻(P<0.05)。GHRP治疗组Smac/DIABLO表达水平较心衰模型组显著降低(P<0.05),心衰模型组Bcl-2水平较其余三组明显降低(P<0.05)。GHRP治疗组Bcl-2表达水平较正常对照组明显增高(P<0.05)。心衰模型组与GHRP治疗组心肌细胞FCM凋亡指数比较,差异有统计学意义(P<0.05)。
结论:GHRP具有抑制心肌细胞凋亡的抗心衰作用,其机制可能部分通过促进Bcl-2抗凋亡蛋白表达,抑制由Smac/DIABLO介导的线粒体途径的心肌细胞凋亡实现。
心力衰竭;生长素释放素;细胞;凋亡
(Chinese Circulation Journal, 2017,32:692.)
心力衰竭(心衰)是多种原因导致心肌收缩和(或)舒张功障碍,心脏泵血功能降低,导致心输出量减少,是各种器质性心脏疾病的共同结局。心衰一直是临床上治疗难题,不断提出相关治疗方案,但一直没有取得明显效果,目前医学上仍没有治疗心衰的特效药物。心肌细胞凋亡导致心肌细胞数量减少,心肌收缩力下降,并使存活心肌细胞负荷加重,导致心室重构,被认为是心衰发病的重要机制[1]。同时《中国心衰诊断和治疗指南》2014版中明确指出心肌细胞凋亡是导致心衰的关键因素之一。
生长素释放肽(GHRP)是一种人工合成的促分泌肽类物质。它能促使垂体生长素的释放。相关研究证实,GHRP能促进心脏功能和心肌细胞损伤后的修复、抗心肌细胞凋亡等多方面的心肌保护作用[2-4]。最新的国际相关研究表明,GHRP可减轻心肌损害,抑制心肌细胞凋亡,且能增强心肌梗死大鼠心肌收缩力[5-8]。目前GHRP在抗心肌细胞凋亡的具体分子作用机制尚不明确。
Smac/DIABLO是一种与凋亡相关的线粒体蛋白质,在细胞受损时经线粒体凋亡途径发挥促凋亡作用。近年来相关研究发现,心肌细胞内存在Smac/ DIABLO蛋白,并且参与心肌细胞凋亡的发生发展过程,心肌缺血缺氧和一些刺激因素诱导心肌细胞线粒体释放Smac/DIABLO,其结合凋亡抑制蛋白(XIAP),导致天冬氨酸特异性半胱氨酸蛋白酶(Caspase)-9和Caspase-3活化,促进细胞凋亡[9]。
B型白细胞/2型淋巴细胞样蛋白(Bcl-2)基因是目前公认的重要抗凋亡蛋白,能抑制凋亡蛋白从线粒体中释放[10,11];同时Caspase-8在细胞凋亡过程中发挥重要作用,能激活几乎所有凋亡相关级联反应下游的Caspase,从而导致细胞凋亡[12]。因此本研究通过心肌缺血诱导大鼠建立心衰模型,通过检测及观察Smac/DIABLO、Bcl-2及Caspase-8等相关凋亡相关因子表达水平及GHRP干预后的变化,探讨GHRP对心衰心肌细胞保护作用的可能分子机制,以期为心衰的进一步治疗及研究提供理论依据。
1 材料与方法
1.1实验材料及分组
采用3月龄SD大鼠40只,雄性,SPF级,体重(220±20)g,实验动物来源于佳木斯大学实验动物中心,所有动物的使用均遵循美国国立健康研究所出版的《实验动物照料和使用指南》及佳木斯大学实验动物照料和使用规则,普通饲料饲养,自由饮水。随机分为正常对照组10只、假手术组10只、心衰模型组10只、GHRP治疗组10只。试剂:GHRP购自大连美仑生物技术有限公司;抗Smac/ DIABLO、抗Bcl-2抗体(美国Santa cruz公司);Caspase-8活性测定试剂盒(中国普利莱公司)。仪器:HX-300动物呼吸机(中国成都泰盟公司);BL-420F生物机能实验系统(中国成都泰盟公司);Leica DM4000B型生物显微镜(德国徕卡公司)。
1.2动物模型制备与药物干预
(1)心衰大鼠模型的建立:采用结扎冠状动脉左前降支方法,制作大鼠心衰模型。腹腔注射乌拉坦(1 g/kg)麻醉大鼠。将大鼠固定于动物实验台上,四肢皮下插入针形心电图电极并与心电图机连接,监测心率、心律、心电图变化。留置针气管插管连接呼吸机,呼吸机参数:潮气量7~9 ml,呼吸频率60次/min,呼吸比2:3。开胸,钝性分离胸部肌肉,暴露第四肋间,剥开心包,在肺动脉圆锥与左心耳交界处下方3 mm穿过5-0带针缝线,结扎左冠脉前降支。心电监测见Ⅱ导联ST段明显抬高,证实结扎成功,关胸。假手术组接受同样的手术步骤,冠状动脉左前降支只穿线不结扎。术后腹腔注射青霉素20万U/d×3 d抗感染。(2)药物干预:术后各组大鼠正常饲养4周,与此同时GHRP治疗组经尾静脉GHRP 100 μg/(kg·d),每天1次,持续4周;假手术组、心衰模型组给予等量生理盐水尾静脉注射,正常对照组不予处理。
1.3指标检测
(1)M超声心动图观察心脏功能:分别测量左心室舒张末期内径(LVEDD)、左心室收缩末期内径(LVESD)、左心室舒张末期容积(LVEDV)、左心室收缩末期容积(LVESV)和左心室射血分数(LVEF)。评价术后各组大鼠心脏功能状态的改变情况。(2)心肌组织形态学观察:各组大鼠处死后立即摘取心脏,距离心尖5 mm处横断心脏,福尔马林固定36 h后,将组织块依次脱水、二甲苯透明,石蜡包埋、连续切片(厚约3~5 μm),采用苏木素伊红(HE)染色。封片后,用普通光学显微镜观察各组心肌细胞的形态学改变。(3)应用蛋白免疫印迹(Western blot)法检测各组大鼠心肌细胞Smac/ DIABLO和Bcl-2蛋白表达情况:各组大鼠处死后立即摘取心脏,生理盐水冲洗,距离心尖5 mm处横断心脏,取适量左心室肌组织,按说明书提取蛋白,并进行蛋白定量。蛋白样品经常规电泳分离后转移于聚偏氟乙烯(PVDF)膜,封闭。抗体使用方法严格按照试剂盒说明操作步骤进行,电化学发光试剂盒发光显影,X线胶片压片曝光。用NIH图像软件分析蛋白表达量,以β-肌动蛋白(β-actin)为参考,测定Smac/DIABLO和Bcl-2的相对表达量。(4)Caspase-8活性的测定:按照Caspase-8活性测定试剂盒说明书,检测心肌组织Caspase-8活性,用比色法在405 nm处测得吸光度值。根据标准品检测所得的吸光度建立标准曲线,得到Caspase-8活性值。(5)应用流式细胞(FCM)技术检测各组大鼠心肌细胞凋亡情况:心脏取材后,0℃生理盐水冲洗,取左心室肌和室间隔。用显微手术剪将心肌剪成约1 mm3的小块,加0.5%胶原酶Ⅱ溶液(DMEM高糖液体培养基配制)10 ml,37℃水浴5 min后,轻轻吹打,吸取上层混悬液,放入DMEM中终止反应。重复消化细胞3次,800 rpm离心5 min,弃上清,加DMEM高糖液体培养基,差速培养24 h,备用。收集细胞悬液,800 rpm离心5 min;PBS液(0.2 mmol PH7.4)洗涤2次,在50μl的结合缓冲液中加入5 μl 7-AAD染液,混匀;室温、避光,10 min;反应后再加入450 μl的Binding Buffer混匀;加入1 μl细胞凋亡检测试剂(Annexin V-PE)混匀,室温、避光,15 min;流式细胞仪分析。
1.4统计学处理
所有实验数据全部采用SPSS Statistics 17.0进行统计。计数资料采用均数±标准差表示,采用t检验/方差分析。计量资料采用卡方(χ2)检验。以P<0.05为差异有统计学意义。
2 结果
2.1各组大鼠术后4周心功能检测结果(表1)
心衰模型组及GHRP治疗组的LVEDD、LVESD、LVEDV、LVESV均较对照组及假手术组明显增加(P<0.05);GHRP治疗组与心衰模型组比较,LVEDD、LVESD、LVEDV、LVESV均有显著改善(P<0.05);GHRP治疗组LVEF较心衰模型组明显增高(P<0.05)。
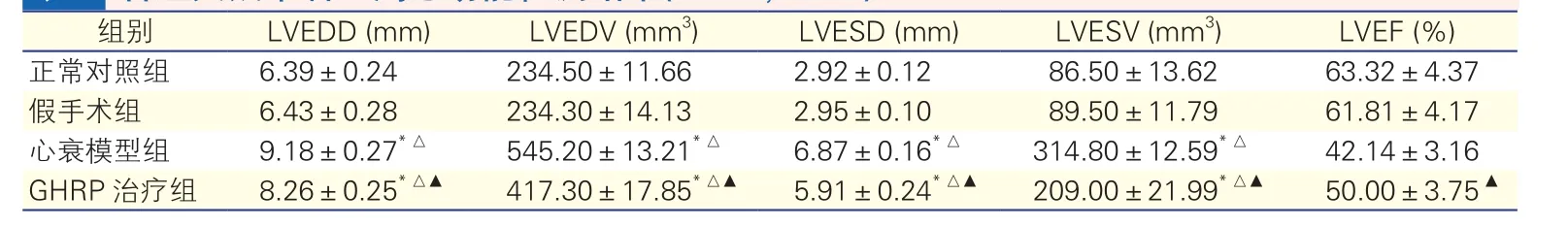
表1 各组大鼠术后4周心功能检测结果(n=10,±s)
2.2各组大鼠术后4 周心肌形态学表现(图1)
正常对照组和假手术组心肌细胞排列规律,核多位于细胞中部,无溶解。心衰模型组左心室前壁心肌细胞溶解消失,大量炎性细胞浸润,胶原纤维增生;GHRP治疗组左室前壁多可见残存的心肌细胞,细胞核少见,肌浆红染无结构,炎性细胞浸润,胶原纤维增生。

图1 各组大鼠术后4周左心室前壁苏木素伊红染色光镜下图片(×400)
2.3各组大鼠心肌细胞Smac/DIABLO和Bcl-2蛋白相对表达情况及Caspase-8活性比较(表2、图2)
Western blot分析显示,GHRP治疗组Smac/ DIABLO表达水平较心衰模型组显著降低(P<0.05),心衰模型组Bcl-2水平较其余三组明显降低(P<0.05);GHRP治疗组Bcl-2表达水平较正常对照组明显增高(P<0.05)。心衰模型组大鼠心肌组织Caspase-8活性较正常对照组及假手术组均显著升高(P<0.05);GHRP治疗组心肌Caspase-8活性较心衰模型组显著降低(P<0.05)。

表2 各组大鼠心肌细胞Smac/DIABLO和Bcl-2蛋白相对表达情况及Caspase-8活性比较(n=10,±s)

图2 各组大鼠心肌Smac/DIABLO与Bcl-2蛋白水平比较的蛋白免疫印迹图
2.4各组大鼠心肌凋亡指数比较
FCM结果显示,心衰模型组(15.10±1.08)与正常对照组(5.20±0.52)、假手术组(5.78±0.63)比较,凋亡率均显著升高(P均<0.05);GHRP治疗组(10.44±0.86)与心衰模型组比较,凋亡率明显降低(P<0.05),差异具有统计学意义。
3 讨论
本研究通过结扎大鼠冠状动脉左前降支的方法,心肌缺血诱导大鼠出现心衰,来模仿心肌梗死后导致的心衰的临床事件。本研究显示,心衰模型建立4周后,心衰模型组大鼠心功能明显降低,说明心衰模型造模成功。
本研究通过GHRP干预大鼠的心衰模型,证明了GHRP能有效降低心衰大鼠的心肌细胞凋亡率,改善心衰大鼠的心脏功能,同时促进抗凋亡蛋白Bcl-2的表达,维持线粒体膜的稳定性,抑制凋亡蛋白Smac/DIABLO及Caspase-8的表达,抑制心肌细胞的凋亡。
GHRP在抑制心肌细胞凋亡的具体分子作用机制尚不明确。在心肌细胞凋亡过程中,线粒体发挥着重要作用,是一条重要的细胞凋亡途径,Bcl-2抗凋亡蛋白在其中发挥着重要作用[13]。Bcl-2 是一种抑制细胞凋亡的基因,凋亡相关基因Bcl-2相关X蛋白(Bax)则促进细胞凋亡,凋亡细胞内 Bcl-2 和Bax 的平衡状态与凋亡调控直接相关[14]。线粒体膜通透性和凋亡蛋白的释放受Bcl-2家族蛋白的调节。在心肌细胞中,氧化应激能够使Bax的表达增加,Bcl-2表达下降,导致线粒体膜通透性增高,使细胞发生凋亡[15]。既往研究证实,Smac/DIABLO与其他凋亡调节因子在线粒体调控凋亡的途径中,Bcl-2表达的降低及Bax的升高会导致线粒体膜通透性转换孔的开放,从而释放前凋亡因子及细胞色素C等至胞浆中,细胞色素C释放的同时,Smac/DIABLO也从线粒体的膜间隙中释放出来,Caspase-8激活,使线粒体是通过凋亡细胞蛋白酶激活因子(Apaf-1)的多聚化,进而激活Caspase-9和Caspase-3,使Caspase-3酶原水解形成具有分解蛋白质活性的Caspase-3发挥凋亡执行功能,启动凋亡程序,最终导致线粒体途径的细胞凋亡[16-18]。Smac的高表达可促进Apo-2L/TRAIL诱导的Caspase-8的加工和线粒体细胞色素C的释放,同时Caspase-8通过级联反应能促使成熟的Smac蛋白迅速释放到细胞浆中,进一步引起Caspase-3的激活促进细胞凋亡的恶性循环。本研究发现,经GHRP治疗后的大鼠,Bcl-2表达增高,同时伴有Smac/DIABLO及Caspase-8表达的降低,通过Bcl-2稳定线粒体膜稳定性,抑制细胞色素C及Smac/DIABLO蛋白向胞浆的转位,抑制线粒体途径的心肌细胞凋亡,从而改善心衰大鼠的心功能。
既往研究证实,Caspase-8在细胞凋亡过程中处于核心地位,几乎能激活所有凋亡级联反应下游的Caspase而诱发凋亡,可同时参与外源性(死亡受体途径)和内源性(线粒体途径)细胞凋亡途径。本研究结果显示,心衰模型组大鼠心肌细胞Caspase-8活性明显增强,经GHRP干预后活性明显下降,不除外GHRP可通过抑制外源性细胞凋亡途径发挥抗心衰作用,需进一步的研究证实。本研究还通过光镜观察各组心室前壁梗死区心肌细胞结构发现,GHRP治疗组的心肌细胞结构较心衰模型组更为完整,炎性细胞浸润相对减少,间质胶原纤维增生较少,说明GHRP能减轻心肌细胞的损伤。
GHRP最早是由Bowers[19]领导的研究组合成的一种5~7个氨基酸的短肽,它具有很强的刺激生长素释放的功能,同时还有许多其他神经内分泌活性,这些作用主要是通过分布于垂体和下丘脑的特异性受体,这些受体亦存在于中枢神经系统的其他区域及心脏等一些外周组织。相关研究表明,长期给予GHRP可以保护由于缺血再灌注引起的正常和生长激素(GH)缺乏大鼠的心肌损害且能增强心肌梗死大鼠心肌收缩力。给予正常和有严重GH缺乏的患者GHRP可增加其LVEF。结合本研究结果说明,GHRP可通过提高Bcl-2的表达,抑制细胞内Smac/ DIABLO及细胞色素C经线粒体中释放至胞浆,通过线粒体相关的凋亡通路起促进心肌细胞存活的保护作用。
综上所述,GHRP具有抑制心肌细胞凋亡的抗心衰作用,其机制可能部分通过抑制线粒体介导的内源性心肌细胞凋亡的途径实现。本研究通过GHRP治疗大鼠心肌缺血诱导的心衰,取得了满意的效果,可为进一步的临床防治心力衰竭提供新的靶点及思路。
[1] 吴振军, 何建国, 李莉, 等. 慢性心力衰竭大鼠心肌细胞凋亡与心功能的关系及福辛普利和氯沙坦的干预作用. 中国循环杂志, 2006, 21: 193-197.
[2] Wu DX, Chen C, Zhang J, et al. Effects in vitro of new growth hormone releasing peptide (GHRP-1) on growth hormone secretion from ovine pituitary cells in primary culture. J Neuroendocrinol, 1994, 6: 185-190.
[3] Deghenghi R, Cananzi MM, Torsello A, et al. GH-releasing activity of hexarelin, a new growth hormone releasing peptide, in infant and adult rats. Lief Sciences, 1994, 54: 1321-1328.
[4] Muccioli G, Broglio F, Valetto MR, et al. Growth hormone-releasing peptides and the cardiovascular system. Ann Endocrinol, 2000, 61: 27-31.
[5] Locatelli V, Rossoni G, Sehweiger F, et al. Growth hormoneindependent cardioprotective effects of hexarelin in the rat. Endoerinology, 1999, 140: 4024-4031.
[6] Bisi G, Podio V, Valetto MR, et al. Acute cardiovascular and hormonal effects of GH and hexarelin, a synthetic GH-releasing peptide, in humans. J Endocrinol Invest, 1999, 22: 266-272.
[7] Filigheddu N, Fubini A, Baldanzi G, et al. Hexarelin protects H9c2 cardiomyocytes from doxorubicin-induced cell death. Endoerine, 2011, 14: 113-119.
[8] 庞锦江, 许荣焜, 徐向斌, 等. Hexarelin对血管紧张素Ⅱ诱导离体心肌细胞凋亡的抑制作用. 中国应用生理学杂志, 2013, 19: 44.
[9] Li J, Li Y, Qin D, et al. Mitochondrial fission leads to Smac/DIABLO release quenched by ARC. Apoptosis, 2010, 15: 1187-1196.
[10] Kuwana T, Newmeyer DD. Bcl-2-family proteins and the role of mitochondria in apoptosis. Curr Opin Cell Biol, 2003, 15: 691-699.
[11] 谢亚芹, 赵娟, 李秀华, 等. 福辛普利对慢性心力衰竭大鼠心肌细胞凋亡及相关基因表达的影响. 中国循环杂志, 2016, 31: 285-288.
[12] Vaishnav M, MacFarlane M, Dickens M. Disassembly of the JIP1/JNK molecular scaffold by caspase-3-mediated cleavage of JIP1 during apoptosis. Exp Cell Res, 2011, 317: 1028-1039.
[13] 于丽芳, 周大亮, 耿硕, 等. 曲美他嗪对心肌缺血再灌注损伤后大鼠Bcl-2及Caspase-3蛋白表达影响. 中华实用诊断与治疗杂志, 2015, 29: 855-861.
[14] 刘丹, 王高频, 常清华, 等. 原花青素对缺血再灌注大鼠心肌细胞凋亡及凋亡相关基因蛋白表达的影响. 中国循环杂志, 2016, 31: 696-700.
[15] Biala AK, Kirshenbaum LA. The interplay between cell death signaling pathways in the heart. Trends Cardiovasc Med, 2014, 24: 325-331.
[16] Guo YF, Zhang XX, Liu Y, et al. Neuregulin-1 attenuates mitochondrial dysfunction in a rat model of heart failure. China Med, 2012, 125: 807-814.
[17] He Q, Pu J, Yuan A, et al. Activation of liver-X-receptor alpha but not liver-X-receptor beta protects against myocardial ischemia/ reperfusion injury. Circ Heart Fail, 2014, 7: 1032-1041.
[18] 殷明, 乔世刚, 曹建方, 等. 线粒体通透性转换孔介导的胀忘和凋亡对七氟醚后处理保护大鼠心肌缺血再灌注的作用. 中华老年心脑血管病杂志, 2015, 17: 178-182.
[19] Bowers CY, Momnay F, Reynolds GA, et al. Structure-activity relationships of a synthetic pentapeptide that specifically releases growth hormone in vitro. Endocrinology, 1980, 106: 663-667.
Preliminary Research for the Effect of Growth Hormone Releasing Peptide on Myocardial Cell Apoptosis in Heart Failure Rats
CAO Jin-song, XING Yu-tong, LIU Jun-yan, WANG Gao-lei, ZHOU Gang, XIAO Ming-di.
Department of Cardiac Surgery, The First Affiliated Hospital of Jiamusi University, Jiamusi (154007), Heilongjiang, China
XING Yu-tong, Email: Email: xingyt@163.com
Objective: To explore the effect of growth hormone releasing peptide (GHRP) on myocardial cell apoptosis in heart failure (HF) rats.
Methods: Rat’s HF model was established by the ligation of left anterior descending coronary artery induced ischemia. 40 male SD rats were randomly assigned into 4 groups: Normal control group, Sham operation group, HF group and GHRP treated HF group. n=10 in each group and the rats were fed for 4 weeks after the operation. Cardiac function was examined and myocardial cell morphology was observed; protein expressions of Smac/DIABL0 and Bcl-2 were measured by Western blot analysis; cell apoptosis was evaluated by FCM technique. The differences for above parameters were compared among groups to explore the effect of GHRP on myocardial cell apoptosis in HF rats.
Results: Compared with HF group, GHRP treated HF group showed the less heart dilation, higher LVEF, lighter pathological changes in myocardial cells and decreased protein expression of Smac/DIABL0, all P<0.05. Bcl-2 level was lower in HF group than the other 3 groups, P<0.05. Compare with Normal control group, GHRP treated HF group had elevated Bcl-2 level, all P<0.05. Myocardial cell apoptosis index was different between HF group and GHRP treated HF group, P<0.05.
Conclusion: The effect of GHRP on anti-HF should be via inhibiting myocardial cell apoptosis; the mechanism may partly be through promoting Bcl-2 protein expression and depressing Smac/DIABLO mediated mitochondrial pathway of apoptosis.
Heart failure; Growth hormone releasing peptide; Cells; Apoptosis
2016-09-17)
(编辑:王宝茹)
佳木斯大学研究生科技创新项目(YZ2016_027)
黑龙江省佳木斯市,佳木斯大学附属第一医院 心脏外科(曹劲松、邢宇彤、刘俊琰、汪高磊、周刚);上海远大心胸医院(肖明第)
曹劲松 硕士研究生 主要从事心脏外科方面研究 Email:630282877@qq.com 通讯作者:邢宇彤 Email:xingyt@163.com
R54
A
1000-3614(2017)07-0692-05
10.3969/j.issn.1000-3614.2017.07.017
