安徽巢湖二叠系—三叠系界线微生物岩研究
2017-07-24张红剑周跃飞谢巧勤陈天虎合肥工业大学资源与环境工程学院安徽合肥230009
张红剑, 周跃飞, 谢巧勤, 陈天虎(合肥工业大学 资源与环境工程学院,安徽 合肥 230009)
安徽巢湖二叠系—三叠系界线微生物岩研究
张红剑, 周跃飞, 谢巧勤, 陈天虎
(合肥工业大学 资源与环境工程学院,安徽 合肥 230009)
文章对安徽巢湖地区二叠系—三叠系界线微生物岩进行了化学成分和矿物组合分析,同时探索了盐酸溶解法分离样品中不同种类碳酸盐矿物的方法。结果表明,界线微生物岩成分均一,具有较高的Si、Al和Mn含量,主要由方解石、石英、黏土矿物和铁白云石组成,岩性上为泥质、白云质灰岩;岩石中的铁白云石自形程度较高,截面呈正三角形或菱形,晶粒大小在10 μm左右;采用0.3%HCl(固液质量比1∶50)可以有效区分微生物岩中的方解石和铁白云石(前者溶解,后者不溶)。研究认为:二叠系—三叠系界线层微生物岩形成于缺氧条件下;微生物促进了黏土矿物的生成,对碳酸盐矿物的生成无影响;铁白云石的生成经历了含铁碳酸盐沉积—碳酸盐去Mg、Fe作用—铁白云石化过程。
二叠系—三叠系界线层;铁白云石;氧化还原条件;沉积;成岩
距今约2.52亿年的二叠纪—三叠纪(Permian-Triassic,P-T)过渡期发生了显生宙历史上规模最大的生物群体灭绝事件(Permian-Triassic mass extinction event,PTME),大约80%的海洋生物门类在20万年的短暂时间内消失[1-2]。大量证据表明在这一时期地球最重要的特征是缺氧[3-7],围绕缺氧和生物灭绝之间的关系,研究者开展了广泛研究,主要关注点包括:地球缺氧的程度和持续性[4-5];生物灭绝的特征(间歇多次灭绝还是持续灭绝)[1,8-9];地球缺氧和生物灭绝之间的因果关系[3,7];地球缺氧和生物灭绝与其他环境条件的耦合关系,例如,高温、高甲烷和硫化氢含量、海水酸化及高碱度等[10-13]。尽管采用的地球化学和生物学指标(微量元素、同位素、生物种类、生物标记物等)有所差别,同时研究地层的空间位置也不尽相同,但总体上认为缺氧条件贯穿PTME始终,而对该时期氧气含量的微小变化,尚缺乏足够关注。
在跨越P-T界线的较短一段时间内(约10万年),特提斯洋周围陆缘广泛沉积了一套岩性为碳酸盐岩的微生物岩,厚度0.05~15 m[14-15]。厘清浅海微生物岩形成的氧化还原条件,有助于阐明PTME时期海水还原程度及变化特征。然而,前人的观点出现较大分歧:大部分研究认为微生物岩形成于缺氧、富CO32-的深层海水向大陆架入侵条件下,因此在P-T之交,浅海主要表现为缺氧[16-17];基于自生黄铁矿的研究则表明微生物岩形成于贫氧条件下[18-19];此外,根据微量及稀土元素特征,文献[20]认为微生物岩形成于氧化条件下。可见,采用不同方法和不同地点样品开展研究时,得出的结论会有很大差异。
中国的扬子地块广泛发育该微生物岩[15-21],根据化石及黄铁矿特征,文献[15]认为其形成于缺氧条件下。值得注意的是,与下伏及上覆碳酸盐岩不同,微生物岩中的碳酸盐矿物除方解石外,还有少量铁白云石[22-23]。铁白云石与白云石晶体结构相同,只是其中的Mg位被少量Fe替代。该矿物主要产出于碳酸岩、变质碳酸盐岩、条带状铁建造、热液交代岩石中,在碳酸盐岩的成岩过程中也可生成,依据成分和结构特征可知铁白云石的形成需具备还原、高碱度、高盐度的条件。可见,依据铁白云石的矿物学特征反演其形成过程,进而推测微生物岩的形成环境,是研究P-T过渡期浅海氧化还原条件的有益尝试。
本研究采集巢湖地区P-T界线层的样品,通过X射线衍射(X-ray diffraction,XRD)及扫描电子显微镜(scanning electron microscope,SEM)等方法对微生物岩及其中的铁白云石进行表征,依据铁白云石的矿物学特征推测其形成机制和沉积环境的氧化还原条件;探索采用酸溶法分离碳酸盐岩中方解石和铁白云石的方法,为进一步开展铁白云石研究(Fe、C同位素、碳酸盐结合态硫酸盐、微量元素等)提供可行的矿物分离手段。
1 样品采集与分析
巢湖地区广泛分布扬子陆块的上元古界—中三叠统地层,岩性以碳酸盐岩为主,次为碎屑岩。本研究关注的上二叠统—下三叠统地层在巢湖市北郊的平顶山—马家山一带出露良好,分布于平顶山向斜两翼。巢湖市北部地区地层分布及样品采集层位野外照片如图1所示。图1中,地层符号含义如下:Z为震旦系;S为志留系;D为泥盆系;C为石炭系;P为二叠系;T为三叠系;J为侏罗系。

图1 巢湖市北部地区地层分布及层位野外照片
上二叠统大隆组(P3d)与下三叠统殷坑组(T1y)呈整合接触,岩性上两者差别较大,大隆组岩性主要为硅质岩,殷坑组以泥岩、碳酸盐为主。大隆组和殷坑组以一层厚约15 cm的微生物岩(岩性为泥灰岩)为界,该微生物岩在扬子陆块不同地区的P-T界线位置均有沉积,浙江煤山的全球P-T界线金钉子(全球二叠系—三叠系界线层型剖面和点)穿该层而过,该层被细分为4个亚层(分别为27a~27d),依据牙形石Hindeodusparvus的首次出现(27c),P-T界线被划为27b与27c之间[24]。
在巢湖市北郊平顶山东坡和西坡分别采集了1套样品。该地区出露的微生物岩与普通泥灰岩在结构和构造上没有差别,样品表面风化后呈黄褐色,表明其中含有一定量的Fe,球状风化特征和泥质风化产物的存在表明样品具有较高的泥质成分。未风化的新鲜样品为浅灰色泥晶灰岩。选取新鲜未风化样品开展本研究,将样品按厚度四等分,每份厚度约4 cm,自下层至上层编号分别为S1~S4,分别对应浙江煤山金钉子处的27a~27d层[22]。
(1) 粉末样制备。样品经破碎、缩分后磨制为粉末(<200目),2个采样点各制备粉末样60 g;制备尺寸为1 cm×1 cm×0.3 cm的光片若干。
(2) 成分分析。称取10 g粉末样,在1 mol/L的MgCl2溶液中超声清洗10 min,待样品干燥后在马弗炉中1 000 ℃煅烧2 h,自然冷却后称质量,计算烧失量。采用X射线荧光光谱法对煅烧后的样品进行成分分析。仪器为日本岛津XRF-1 800。
(3) 物相分析。采用XRD测定样品物相组成。仪器型号为丹东浩元DX-2700;分析条件:Cu靶Kα线(波长0.154 nm),40 mA,30 kV,扫描速率2.4(°)/min,扫描角度(2θ)为3°~70°。
(4) 酸溶实验。经XRD分析,发现样品中有方解石和铁白云石2种碳酸盐矿物,为了探索分离2种矿物的化学条件,特设计本实验。
实验1 分别配制质量分数为20%、10%、1%和0.3%的HCl溶液;称取1 g粉末样品加入50 mL HCl溶液中,同时加入1片同样品光片;反应24 h后收集溶解残渣和光片,超声清洗2种样品;共进行16组实验,每组实验设置2个重复。
实验2 配制pH=3.5的HCl溶液;称取粉末样品0.5 g,用滤纸包裹后加入5 L酸液中,同时加入同样品光片1片;反应48 h后收集酸溶残渣和光片,超声清洗2种样品。
采用XRD测定粉末经酸溶后的物相组成,测试方法同前,扫描角度(2θ)为29°~32°;采用SEM对酸溶前后光片表面微形貌进行观察,SEM型号为FEI Sirion 200,分析在中国科学技术大学理化中心进行。
2 结果与讨论
2.1 化学成分
样品S1~S4主量元素质量分数及微量元素质量比分别见表1、表2所列。
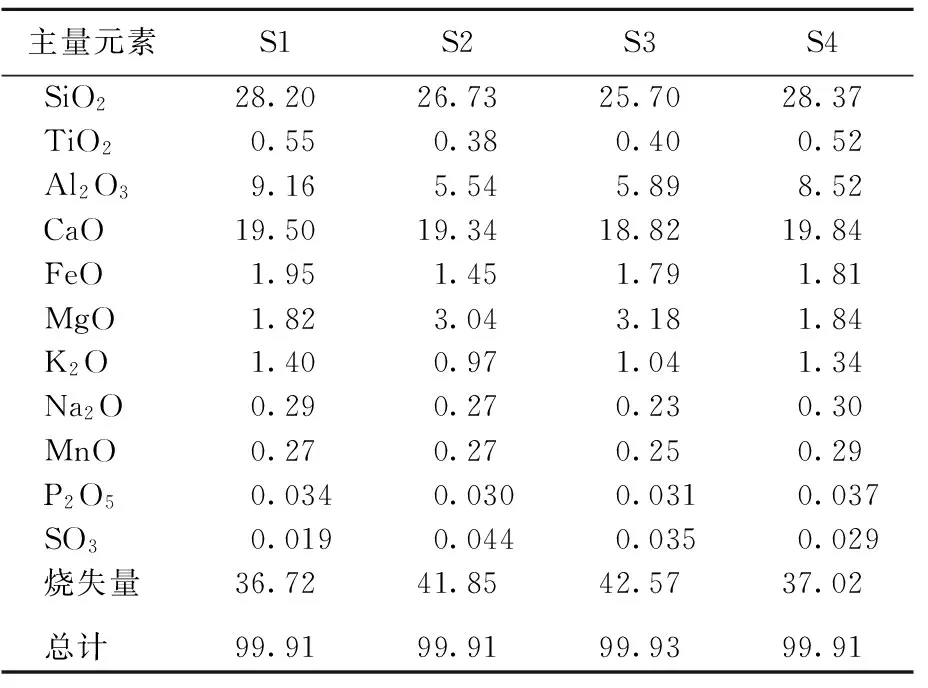
表1 样品主量元素质量分数 %
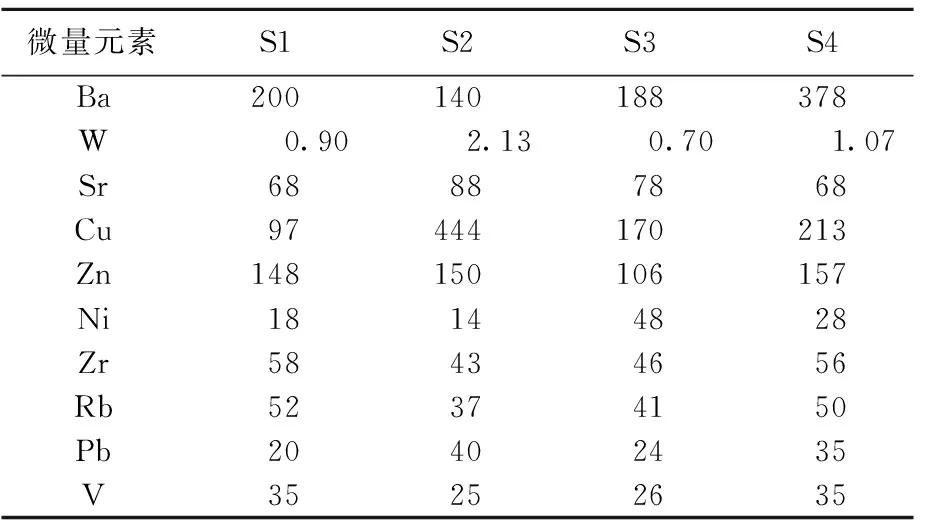
表2 样品微量元素质量比 mg/kg
各样品化学成分含量变化不大,且Si和Al的含量都较高,表明微生物岩的泥质成分含量较高。地层由老到新,主量元素中Si、Al、Fe、K、Ti的含量及微量元素中Ba、Rb的质量比均表现出先降低后升高的变化特征,而w(Mg)明显表现为先升高后降低,结合烧失量结果,初步判定微生物岩中碳酸盐岩含量先升高后降低;由w(Sr)/w(Ca)和w(Sr)/w(Ba)先升高再降低的变化趋势可知海水深度先变浅再变深。值得注意的是,各样品中w(Mn)均较高。文献[25]认为w(Mn)<300 mg/kg时,碳酸盐岩保存了原始地球化学特征;文献[26]认为w(Mn)/w(Sr)<3时,碳酸盐岩没有或很少受到成岩作用改造;当2个条件同时成立时,可认为碳酸盐岩的同位素或微量元素可代表沉积环境的海水化学条件。本研究中w(Mn)及w(Mn)/w(Sr)值均远大于临界值,表明微生物岩在成岩过程中成分发生了较大改变。此外,由于低价态Mn易于进入碳酸盐,因此若微生物岩沉积于还原条件下,则碳酸盐岩中w(Mn)可能会较高。可见,本研究微生物岩中w(Mn)及w(Mn)/w(Sr)值均较高可能反映了较强的成岩改造作用和/或微生物岩形成于还原条件下[26]。
本研究样品中一些成分与纯碳酸盐岩相比存在较大差异,例如,高烧失量对应高SiO2含量、较低的Sr含量和较高的Cu含量等。可能的原因为:本研究样品中具有较多的黏土矿物及其他次生含水矿物(伊利石、蛋白石、水铝石等),这些矿物在煅烧过程中的脱水作用导致出现高烧失量、高SiO2含量的现象;低Sr现象可能与白云石化过程中Sr丢失有关[27];样品中高含量的黏土矿物可能在沉积过程中吸附了较多的Cu,其在成岩过程中进一步被固定(转化为Cu的硫化物),因而样品表现出Cu含量较高的特征。
2.2 物相组合
原始样品的XRD分析结果如图2所示。微生物岩在各个位置没有发生矿物种类和含量的明显变化,主要物相均为石英、方解石和铁白云石。由微生物岩表面的土状风化物质及化学成分可知样品中应该含有一定量的黏土矿物,但由于其结晶度比石英和方解石差,同时可能含量也较低,致使其衍射峰没有出现。尽管关于白云石的成因还存在很大争议[27],但相关研究一致认为白云石需要高的w(Mg)/w(Ca)和碱度(HCO3-浓度)。另外,由于铁白云石中为Fe2+,铁白云石的形成需要较还原的条件。可见,微生物岩中铁白云石的出现指示岩石经历了高碱、高盐和还原条件,但现有证据并不能阐明这些条件出现的时间。
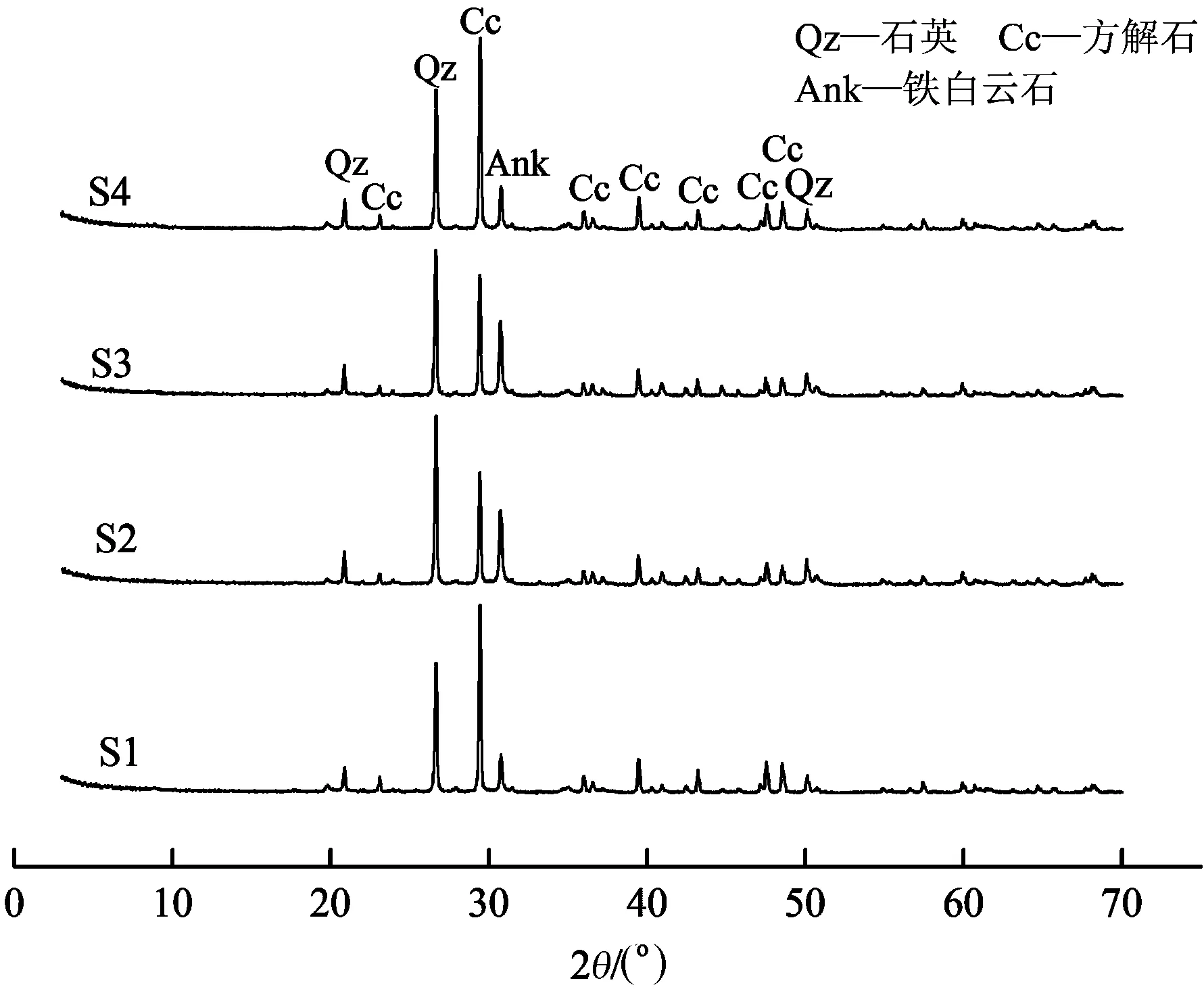
图2 原样XRD结果
2.3 溶解实验结果
采用不同质量分数HCl溶解样品后的残渣物相分析结果如图3所示。
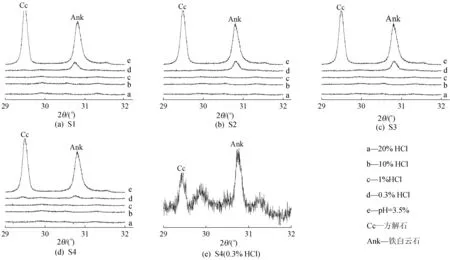
图3 样品溶解残渣的XRD结果
当w(HCl)≥1%时,方解石和铁白云石的(104)晶面(2θ值分别为29.4°和30.7°)衍射峰全部消失,表明酸质量分数过高,不能选择性溶解方解石,残留铁白云石;pH=3.5实验中,2种物相(104)晶面的衍射峰均存在,表明酸质量分数过低,不能达到去除方解石的目的;当w(HCl)=0.3%时,方解石(104)晶面衍射峰消失,铁白云石相应衍射峰存在,表明该质量分数的HCl可以选择性溶解方解石,残留少量铁白云石。对S4样品,w(HCl)=0.3%时残渣中还有少量方解石,表明该方法受样品初始成分或结构影响较大,但总体上w(HCl)=0.3%、固液比1∶50、反应时间24 h可作为分离碳酸盐岩中方解石和(铁)白云石的有效方法。
碳酸盐岩中Mn、Sr、Fe、S、稀土元素等的质量分数及其比值(w(Mg)/w(Ca)、w(Sr)/w(Ca)、w(U)/w(Ca)、w(I)/w(Ca)、w(Y)/w(Ho)、w(Nd)/w(Yb)等)、同位素(如δ34S、δ13C、δ18O、δ56Fe)等是指示沉积和成岩环境的重要指标[28],这些指标的有效性受制于元素提取及测定方法的准确性。以往的研究习惯于采用HCl或醋酸提取碳酸盐结合态元素[29],但这些方法目前看来尚不成熟,主要体现为:采用HCl时,过多的酸(w(HCl)>10%)可能会导致非碳酸盐相(如绿泥石)溶解,使结果偏大,同时也无法区分各种类型碳酸盐矿物(如方解石和白云石);采用醋酸时,则往往不能完全分解碳酸盐矿物(如铁白云石)[30],致使结果偏小。
由本研究可知,采用低质量分数HCl(w(HCl)=0.3%),不仅可以克服过度溶解或溶解不完全的问题,而且也能有效区分碳酸盐岩中的方解石和铁白云石。
溶解前、后光片的SEM观察结果如图4所示。

图4 微生物岩(S3)酸溶前后SEM观察结果
由矿物形态、成分(图4d)及背散射图像的明暗特征判定图4a中亮度最高的矿物为铁白云石,其截面呈菱形或三角形,晶粒具有大致相等的粒径(~10 μm),零星分布于样品中。由图4b可见,光片表面出现大量溶蚀孔洞,大多数孔洞在形态上呈菱形,表明其原为方解石所充填;铁白云仍然存在于样品中,且大小和形态都没有发生改变,表明该溶解条件可以有效区分样品中的方解石和铁白云石。
从图4c可见大量具有球状形貌(直径约为1 μm)的物质,背散射图像中其亮度低于铁白云石,结合岩石成分分析结果(表1、表2)及SEM能谱分析结果,推测其主要由黏土矿物组成。微球粒在尺寸上远小于文献[15]在同一层位的发现,与一些单细胞原核生物(细菌、蓝藻等)接近,推测其形成受到微生物的诱导作用。关于自生黏土矿物的微生物诱导成矿作用早有报道,文献[31]认为基本成矿过程为:微生物及其代谢产物表面带负电,易于吸附阳离子或带正电的矿物(如铁氧化物);这些物质的吸附中和了微生物表面的电荷,相应促进硅质成分(通常带负电)的吸附;微生物吸附的物质在成岩作用过程中转化为黏土矿物。
氧化环境中,(氢)氧化物是铁的重要存在形式,在中性水溶液中这些物相表面通常带一定量的正电荷,因而倾向于附着于微生物表面并在微生物诱导黏土矿物成矿中起到重要作用。然而在本研究中,主要的含铁物质是铁白云石而不是疑似生物成因的微球粒,加之两者并没有空间上的相关性,因而推测沉积环境为缺氧条件。在这种条件下,铁主要以溶解态Fe2+离子的形式存在,方解石或高镁方解石在生成过程中大量固定Fe2+,相比之下,微生物吸附Fe2+的量要少得多;成岩过程中方解石发生溶解或转化,伴随Mg和Fe释放;2种元素在岩石孔隙局部富集,在温度和水活度条件具备的条件下进入方解石晶格,致使部分方解石向铁白云石转化。
3 结 论
本文综合利用多种分析手段对巢湖P-T界线微生物岩进行了成分、物相和微结构特征分析,同时采用HCl溶解法探讨了分离微生物岩中方解石和铁白云石的方法,初步获得如下结论:
界线微生物岩形成于缺氧条件下;微生物岩中碳酸盐矿物的形成没有微生物的参与,微生物主要参与黏土矿物的形成;铁白云石在成岩过程中形成;0.3%HCl能有效区分微生物岩中的方解石和铁白云石。
[1] SHEN S Z,CROWLEY J L,WANG Y,et al.Calibrating the end-Permian mass extinction[J].Science,2011,334(6061):1367-1372.
[2] SCHOBBEN M,STEBBINS A,GHADERI A,et al.Flourishing ocean drives the end-Permian marine mass extinction[J].Proceedings of the National Academy of Sciences,2015,112(33):10298-10303.
[3] WIGNALL P,HALLAM A.Anoxia as a cause of the Permian/Triassic mass extinction:facies evidence from northern Italy and the western United States[J].Palaeogeography,Palaeoclimatology,Palaeoecology,1992,93(1/2):21-46.
[4] KUMP L R,PAVLOV A,ARTHUR M A.Massive release of hydrogen sulfide to the surface ocean and atmosphere during intervals of oceanic anoxia[J].Geology,2005,33(5):397-400.
[5] MEYER K M,KUMP L R.Oceanic euxinia in Earth history:causes and consequences[J].Annual Review of Earth and Planetary Sciences,2008,36:251-288.
[6] ALGEO T J,HINNOV L,MOSTER J.Changes in productivity and redox conditions in the Panthalassic Ocean during the latest Permian[J].Geology,2010,38(2):187-190.
[7] BRENNECKA G A,HERRMANN A D,ALGEO T J,et al.Rapid expansion of oceanic anoxia immediately before the end-Permian mass extinction[J].Proceedings of the National Academy of Sciences,2011,108(43):17631-17634.
[8] XIE S C,PANCOST R D,YIN H F,et al.Two episodes of microbial change coupled with Permo/Triassic faunal mass extinction[J].Nature,2005,434(7032):494-497.
[9] YIN H F,FENG Q L,LAI X L,et al.The protracted Permo-Triassic crisis and multi-episode extinction around the Permian-Triassic boundary[J].Global and Planetary Change,2007,55(1):1-20.
[10] KNOLL A H,BAMBACH R K,PAYNE J L,et al.Paleophysiology and end-Permian mass extinction[J].Earth and Planetary Science Letters,2007,256(3):295-313.
[11] RETALLACK G J,JAHREN A H.Methane release from igneous intrusion of coal during Late Permian extinction events[J].The Journal of Geology,2008,116(1):1-20.
[12] SUN Y,JOACHIMSKI M M,WIGNALL P B,et al.Lethally hot temperatures during the early Triassic greenhouse[J].Science,2012,338(6105):366-370.
[13] CLARKSON M O,KASEMANN S A,WOOD R A,et al.Ocean acidification and the Permo-Triassic mass extinction[J].Science,2015,348(6231):229-232.
[14] KERSHAW S,CRASQUIN S,LI Y,et al.Microbialites and global environmental change across the Permian-Triassic boundary:a synthesis[J].Geobiology,2012,10(1):25-47.
[15] 吴亚生,姜红霞,WAN Y.二叠纪-三叠纪之交缺氧环境的微生物和微生物岩[J].中国科学 D辑:地球科学,2007,37(5):618-628.
[16] LEHRMANN D J,PAYNE J L,FELIX S V,et al.Permian-Triassic boundary sections from shallow-marine carbonate platforms of the Nanpanjiang Basin,South China:implications for oceanic conditions associated with the end-Permian extinction and its aftermath[J].PALAIOS,2003,18(2):138-152.
[17] GROVES J R,ALTINER D,RETTORI R.Extinction,survival,and recovery of lagenide foraminifers in the Permian-Triassic boundary interval,central Taurides,Turkey[J].Journal of Paleontology,2005,79:33-38.
[18] BOND D P G,WIGNALL P B.Pyrite framboid study of marine Permian-Triassic boundary sections:a complex anoxic event and its relationship to contemporaneous mass extinction[J].Geological Society of America Bulletin,2010,122(7/8):1265-1279.
[19] LIAO W,WANG Y B,KERSHAW S,et al.Shallow-marine dysoxia across the Permian-Triassic boundary:evidence from pyrite framboids in the microbialite in south China[J].Sedimentary Geology,2010,232(1/2):77-83.
[20] LOOPE G R,KUMP L R,ARTHUR M A.Shallow water redox conditions from the Permian-Triassic boundary microbialite:the rare earth element and iodine geochemistry of carbonates from Turkey and South China[J].Chemical Geology,2013,351(15):195-208.
[21] 王永标,童金南,王家生,等.华南二叠纪末大绝灭后的钙质微生物岩及古环境意义[J].科学通报,2005,50(6):552-558.
[22] 杨大兵.浙江煤山剖面P/T界线附近地层的XRD和XRF分析及其意义[J].矿物学报,2009,29(增刊1):149-150.
[23] 罗雷,洪天求,殷延端,等.川东北地区晚二叠世碳酸盐岩成岩作用[J].合肥工业大学学报(自然科学版),2017,40(1):101-109,116.
[24] YIN H F,ZHANG K X,TONG J N,et al.The global stratotype section and point (GSSP) of the Permian-Triassic boundary[J].Episodes,2001,24(2):102-114.
[25] DENISON R E,KOEPNICK R B,FLETCHER A,et al.Criteria for the retention of original seawater87Sr86Sr in ancient shelf limestones[J].Chemical Geology,1994,112(1/2):131-143.
[26] DEHLER C M,ELRICK M,BLOCH J D,et al.High-resolutionδ13C stratigraphy of the Chuar Group (ca.770-742 Ma),Grand Canyon:implications for mid-Neoproterozoic climate change[J].Geological Society of America Bulletin,2005,117(1/2):32-45.
[27] WARREN J.Dolomite:occurrence,evolution and economically important associations[J].Earth-Science Reviews,2000,52(1):1-81.
[28] ZHAO M Y,ZHENG Y F.Marine carbonate records of terrigenous input into Paleotethyan seawater:geochemical constraints from Carboniferous limestones[J].Geochimica et Cosmochimica Acta,2014,141:508-531.
[29] WOTTE T,SHIELDS-ZHOU G A,STRAUSS H.Carbonate-associated sulfate:experimental comparisons of common extraction methods and recommendations toward a standard analytical protocol[J].Chemical Geology,2012,326(11):132-144.
[30] POULTON S W,CANFIELD D E.Development of a sequential extraction procedure for iron:implications for iron partitioning in continentally derived particulates[J].Chemical Geology,2005,214(3):209-221.
[31] KONHAUSER K O,URRUTIA M M.Bacterial clay authigenesis:a common biogeochemical process[J].Chemical Geology,1999,161(4):399-413.
(责任编辑 张淑艳)
Study of the microbialite from Permian-Triassic boundary in Chaohu, Anhui Province
ZHANG Hongjian, ZHOU Yuefei, XIE Qiaoqin, CHEN Tianhu
(School of Resources and Environmental Engineering, Hefei University of Technology, Hefei 230009, China)
Mineralogical and geochemical properties of microbialites collected from the Permian-Triassic boundary in Chaohu, Anhui Province were studied. Besides, experiments on the dissolution of microbialites by HCl were carried out for probing the separation condition between calcite and ankerite. The results show that the samples are homogeneous in composition, with high Si, Al and Mn contents. Calcite, quartz, clay minerals and ankerite are the main phases. Most of the ankerite particles are euhedral, showing either triangle or diamond forms on cross section, and their sizes are roughly equal(~10 μm). Under the conditions that HCl concentration was 0.3% and solid-to-liquid ratio was 1∶50, calcite in microbialites was dissolved totally, while leaving ankerite undissolved. It is suggested that microbialites in the Permian-Triassic boundary was formed under anoxic condition; microorganisms promoted the formation of clay minerals, while had no effect on the formation of carbonates; ankerite was formed through three stages: Fe-carbonate was formed during sedimentation, Fe and Mg was released during diagenesis, Fe and Mg entered into calcite, leading to local dolomitization.
Permian-Triassic boundary stratum; ankerite; redox condition; sedimentation; diagenesis
2016-01-04;
2016-03-16
国家自然科学基金资助项目(41372046;41130206)
张红剑(1990-),男,安徽定远人,合肥工业大学硕士生; 谢巧勤(1970-),女,江苏宿迁人,博士,合肥工业大学教授,硕士生导师; 陈天虎(1962-),男,安徽界首人,博士,合肥工业大学教授,博士生导师.
10.3969/j.issn.1003-5060.2017.06.020
P571
A
1003-5060(2017)06-0822-07
