巴戟天寡糖抗大鼠子宫缺血再灌注损伤作用的观察
2017-07-24王志红程亮星王武亮张海玲
王志红,程亮星,王武亮#,王 芳,徐 臻,王 冰,张海玲,耿 介,方 莹
1)郑州大学第二附属医院妇产科 郑州 450014 2)郑州大学第一附属医院《肿瘤基础与临床》编辑部 郑州 450052
巴戟天寡糖抗大鼠子宫缺血再灌注损伤作用的观察
王志红1),程亮星2),王武亮1)#,王 芳1),徐 臻1),王 冰1),张海玲1),耿 介1),方 莹1)
1)郑州大学第二附属医院妇产科 郑州 450014 2)郑州大学第一附属医院《肿瘤基础与临床》编辑部 郑州 450052
#通信作者,男,1952年10月生,本科,主任医师,教授,研究方向:妇科肿瘤的基础与临床,E-mail:wangwuliang888@sina.com
巴戟天寡糖;子宫缺血再灌注损伤;超氧化物歧化酶;丙二醛;高能磷酸化合物;大鼠
目的:观察巴戟天寡糖(MOO)对大鼠子宫缺血再灌注损伤的作用。方法:Wistar大鼠50只,随机分为假手术组、子宫缺血再灌注损伤模型组以及3个MOO组[0.7、1.4、2.8 g/(kg·d)],每组10只,采用线栓法制备大鼠子宫缺血再灌注损伤模型,造模前各组进行相应处理:假手术组和子宫缺血再灌注损伤模型组给予10 mL/kg双蒸水,3个MOO组分别给予相应浓度的药液10 mL/kg,实验结束后取出大鼠子宫,并检测组织中超氧化物歧化酶(SOD)、丙二醛(MDA)及高能磷酸化合物(HEP)的水平。结果:与子宫缺血再灌注损伤模型组比较,MOO 0.7 g/(kg·d)组、MOO 1.4 g/(kg·d)组、MOO 2.8 g/(kg·d)组SOD水平升高,而MDA水平降低(P<0.05);MOO 0.7 g/(kg·d)组、MOO 1.4 g/(kg·d)组、MOO 2.8 g/(kg·d)组三磷酸腺苷(ATP)、二磷酸腺苷(ADP)、一磷酸腺苷(AMP)、总腺嘌呤核苷酸(TAN)水平升高(P<0.05)。3个MOO组SOD、MDA、ATP、ADP、AMP、TAN水平两两比较,差异均有统计学意义(P<0.05)。结论:MOO对子宫缺血再灌注损伤具有明显保护作用,这可能与其能够改善组织的抗氧化能力和能量代谢有关。
目前,缺血再灌注损伤的研究[1-2]多集中于心脏、脑、肝脏、肾脏等器官,而生殖系统器官缺血再灌注损伤的研究较少,但是缺血再灌注损伤对生殖系统造成的损伤也是非常严重的,在子宫肿瘤、卵巢肿瘤等疾病的治疗过程中均可能发生缺血再灌注损伤,这一过程中出现的自由基过剩、能量代谢障碍、钙超载、细胞凋亡等严重威胁着女性的生命健康安全。由子宫内膜缺失、子宫畸形、子宫纵隔等导致的女性不孕是目前已有的辅助生殖技术所无法解决的,而子宫移植则可能为这类患者提供自身生育的可能,但是子宫移植仍然存在很多尚未解决的问题,这其中就包括子宫缺血再灌注损伤[2]。为了寻找解决这一问题的方案,该研究采用线栓法制备大鼠子宫缺血再灌注损伤模型,并用已经被证实在多种器官的缺血再灌注损伤过程中具有保护作用的巴戟天寡糖(morinda officinalis oligose,MOO)在造模前进行干预,以便观察、分析子宫缺血再灌注损伤模型制备过程、发生机制及MOO对其的保护作用等。
1 材料与方法
1.1 材料
1.1.1 主要药品与试剂 超氧化物歧化酶(superoxide dismutase,SOD)、微量丙二醛(malondialdehyde,MDA)及考马斯亮蓝试剂盒均购自南京建成生物工程研究所,批号分别为20150723、20150720、20150717;三磷酸腺苷(ATP)、二磷酸腺苷(ADP)及一磷酸腺苷(AMP)的钠盐均购自美国Amresco公司,批号分别为0220、0160、0634;MOO的提取由河南大学药学院完成,具体方法参考文献[3];其他试剂均为国产分析纯。
1.1.2 主要仪器 721型分光光度计为上海第三分析仪器厂产品;LC-6A型高效液相色谱仪、SPD-6A型紫外检测器均为日本Shimadzu公司产品;Scienhome C18色谱柱(250 nm×4.6 nm, 5 μm)为江苏淮安市恒天公贸有限公司产品。
1.2 动物分组及给药方法 50只健康雌性Wistar大鼠,体重为350~412(378±23) g,购自河南省实验动物中心,动物合格证号为SCXK(豫)2010-0002。50只Wistar大鼠采用随机数字表法分为假手术组、子宫缺血再灌注损伤模型组、MOO 0.7 g/(kg·d)组、MOO 1.4 g/(kg·d)组、MOO 2.8 g/(kg·d)组5组,每组10只。3个MOO组按体重给予含相应浓度MOO的10 mL/kg的药液灌胃,假手术组和子宫缺血再灌注损伤模型组大鼠按体重给予10 mL/kg的双蒸水灌胃,每天1次,连用7 d,末次给药1 h后按照分组进行处理。
1.3 大鼠子宫缺血再灌注损伤模型的制备 出假手术组外,各组大鼠末次给药后1 h采用线栓法制备大鼠子宫缺血再灌注损伤模型[4]:质量分数1%的戊巴比妥钠(0.4 μL/g)腹腔注射麻醉,腹部正中切口,充分暴露子宫及周围脏器,经大隐静脉注射50 U/kg肝素钠后,钝性分离腹主动脉,在髂总动脉分叉处上0.5 cm处结扎腹主动脉,结扎30 min后,解除结扎线再灌注60 min,然后取出子宫并放置于-80 ℃冰箱中,以便进行后续实验。
1.4 子宫组织中SOD、MDA的检测 每例子宫标本称取100 mg制成生理盐水匀浆,4 ℃、4 000 r/min离心15 min,取上清液,按试剂盒说明书,采用黄嘌呤氧化酶法检测SOD,采用硫代巴比妥酸法检测MDA,采用考马斯亮蓝法检测组织总蛋白量。
1.5 子宫组织中高能磷酸化合物(high energy phosphates,HEP)的检测 每例子宫标本称取100 mg,用预冷的0.42 mol/L高氯酸将子宫组织制成匀浆;并用1.00 mol/L氢氧化钾进行中和;超声波细胞粉碎器粉碎线粒体膜,使能量物质释放于溶液中。4 ℃、15 000 r/min离心15 min;取上清液,用0.2 μm微孔滤膜过滤;吸取20 μL滤液上柱分析,色谱条件:流动相由215 mmol/L KH2PO4与质量分数3.5%乙腈组成,三乙胺调pH值至6.1,流速为0.5 mL/min,检测波长为210 nm,柱温30 ℃。经过分析得出组织中所含ATP、ADP、AMP水平,并以ATP+ADP+AMP计算子宫总腺嘌呤核苷酸(total adenine nucleotides,TAN)。
1.6 统计学处理 采用SPSS 17.0进行数据分析,各组间SOD、MDA、ATP、ADP、AMP、TAN水平的比较采用单因素方差分析和LSD-t检验,检验水准α=0.05。
2 结果
2.1 各组大鼠子宫组织生化指标比较 与假手术组比较,模型组SOD水平降低,而MDA水平升高。与模型组比较,MOO 0.7 g/(kg·d)组、MOO 1.4 g/(kg·d)组、MOO 2.8 g/(kg·d)组SOD水平升高,而MDA水平降低。3个MOO组SOD、MDA水平两两比较,差异均有统计学意义。见表1。
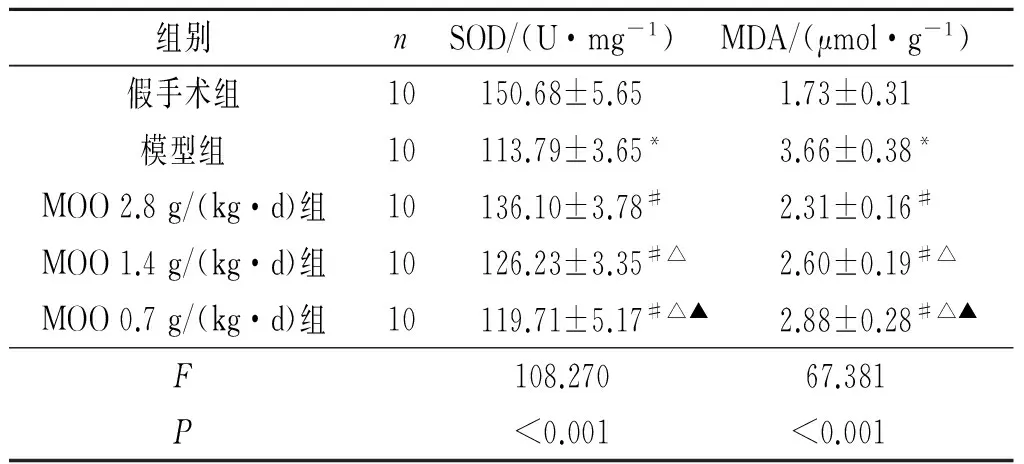
表1 各组大鼠子宫组织生化指标比较
*:与假手术组比较,P<0.05;#:与模型组比较,P<0.05;△:与MOO 2.8 g/(kg·d)组比较,P<0.05;▲:与MOO 1.4 g/(kg·d)组比较,P<0.05。
2.2 各组大鼠子宫组织HEP水平比较 与假手术组比较,模型组ATP、ADP、AMP、TAN水平降低。与子宫缺血再灌注损伤模型组比较,MOO 0.7 g/(kg·d)组、MOO 1.4 g/(kg·d)组、MOO 2.8 g/(kg·d)组ATP、ADP、AMP、TAN水平升高。3个MOO组ATP、ADP、AMP、TAN水平两两比较,差异均有统计学意义。见表2。
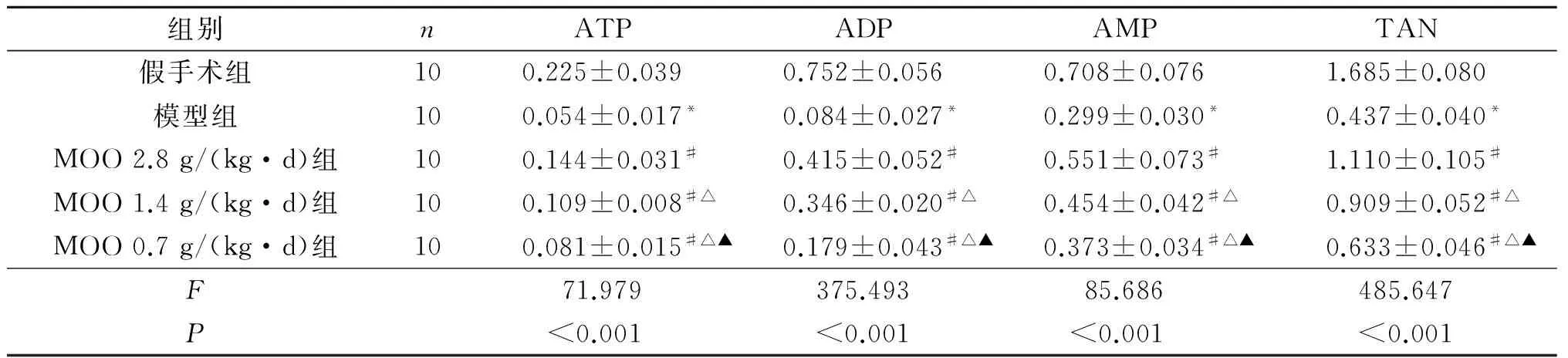
表2 各组大鼠子宫组织HEP水平比较 mg/g
*:与假手术组比较,P<0.05;#:与模型组比较,P<0.05;△:与MOO 2.8 g/(kg·d)组比较,P<0.05;▲:与MOO 1.4 g/(kg·d)组比较,P<0.05。
3 讨论
子宫缺血再灌注损伤常见于子宫外伤或子宫手术过程中,因其对子宫的危害较为严重,目前已成为妇产科学和病理生理学相关领域研究的热点问题。子宫缺血再灌注损伤的发生是一个多因素参与、多机制共同作用的复杂病理生理学过程,目前研究[5]较多的方面是钙超载、细胞凋亡、自由基过剩、免疫状态异常等,关于能量代谢障碍在子宫缺血再灌注损伤过程中的作用尚未有研究报道。
MOO提取自中药巴戟天,后者为茜草科植物,根可入药,具有强筋骨、补肾壮阳、祛风湿的作用,研究[6-8]证实,其在抗衰老、抗抑郁、抗凋亡、促进血管生成等方面具有重要价值。汪宝军等[3]研究证实,MOO有抗心肌缺血再灌注损伤作用,且这可能与其能够提高心肌SOD等抗氧化酶活性及减少脂质过氧化反应有关。但MOO在子宫缺血再灌注损伤中是否也具有相同的保护作用,尚未有报道。
子宫缺血再灌注损伤发生时,黄嘌呤氧化酶激活、中性粒细胞呼吸爆发等使氧自由基生成增加,而且内源性自由基清除酶类活性降低,机体清除氧自由基的能力降低,从而氧自由基开始攻击细胞膜中的不饱和脂肪酸等,引起一系列的自由基链式反应,生成多种脂质过氧化物,从而进一步导致细胞结构和功能的损伤。SOD作为主要的细胞内源性氧自由基清除剂,其水平能够直接反映清除自由基的能力[9]。MDA是主要的脂质过氧化产物之一,其水平能够反映机体的脂质过氧化程度,也可间接反映机体损害程度[10]。吉小微等[4]研究证实,子宫缺血再灌注损伤发生时,子宫组织中的SOD水平下降,MDA水平上升,提示子宫缺血再灌注损伤的发生有机体氧自由基过剩导致的脂质过氧化的参与。
有研究[11]认为,能量代谢障碍是缺血再灌注损伤的始动因子,ATP的生成和保存是保护器官组织结构和功能完整的重要前提,而当组织或器官缺血后,脂肪酸和葡萄糖的有氧氧化受阻,该途径的能量供应减少,甚至中断,仅靠糖的无氧酵解来提供ATP,后者提供ATP的量很少,且效率很低,这一现象将引发细胞代谢紊乱、功能异常以及组织结构的破坏。由于ATP水平降低,不能提供组织所需能量时,机体将依次降解ADP、AMP、腺苷、次黄嘌呤以提供组织所需能量,这进一步造成体内ATP、ADP、AMP及TAN水平的降低。
该研究结果显示:与假手术组比较,子宫缺血再灌注损伤模型组SOD水平降低,而MDA水平升高,提示子宫缺血再灌注损伤后氧自由基的过剩以及抗氧化能力的降低。与子宫缺血再灌注损伤模型组比较,MOO 0.7 g/(kg·d)组、MOO 1.4 g/(kg·d)组、MOO 2.8 g/(kg·d)组SOD水平升高,而MDA水平降低,提示MOO能够改善子宫缺血再灌注损伤组织的抗氧化能力。与假手术组比较,子宫缺血再灌注损伤模型组ATP、ADP、AMP、TAN水平降低,提示子宫缺血再灌注损伤发生后,子宫的能量代谢出现障碍。与子宫缺血再灌注损伤模型组比较,MOO 0.7 g/(kg·d)组、MOO 1.4 g/(kg·d)组、MOO 2.8 g/(kg·d)组ATP、ADP、AMP、TAN水平升高,提示MOO能够改善子宫缺血再灌注损伤后的能量代谢障碍。3个MOO组SOD、MDA、ATP、ADP、AMP、TAN水平两两比较,差异均有统计学意义,提示这种作用具有一定的剂量依赖性。
综上所述,MOO对子宫缺血再灌注损伤具有明显保护作用,这可能与其能够改善组织的抗氧化能力和能量代谢有关。
[1]庞磊,孙小婷,魏骐,等.前列腺素受体EP4在心肌肥厚和心肌缺血/再灌注损伤中作用的研究进展[J].吉林大学学报(医学版),2016,42(6):1249
[2]LI YT,YEH CC,CHAO HT,et al.Preservation of the uterus[J].Taiwan J Obstet Gynecol,2015,54(6):799
[3]汪宝军,付润芳,岳云霄,等.巴戟天寡糖对大鼠心肌缺血再灌注损伤的影响[J].中国医药导刊,2009,11(4):625
[4]吉小微,王冬,张爽,等.子宫缺血再灌注损伤大鼠模型的建立[J].中国组织工程研究,2012,16(33):6164
[5]SAHIN S,OZAKPINAR OB,AK K,et al.The protective effects of tacrolimus on rat uteri exposed to ischemia-reperfusion injury: a biochemical and histopathologic evaluation[J].Fertil Steril,2014,101(4):1176
[6]赖满香,阮志燕,许意平.补肾中药巴戟天药理作用研究进展[J].亚太传统医药,2017,13(1):63
[7]徐德峰,宓为峰,张素贞,等.巴戟天寡糖抗抑郁作用机制研究[J].中国临床药理学杂志,2015,31(15):1539
[8]郭爱民,曹建民,周海涛.巴戟天配伍维生素C对大鼠运动性肾脏缺血再灌注的保护作用[J].天然产物研究与开发,2013,25(10):1352
[9]UMUL M,CAL AC,TURNA B,et al.Effect of complete hilar versus only renal artery clamping on renal histomorphology following ischemia/reperfusion injury in an experimental model[J].Eur Rev Med Pharmacol Sci,2016,20(4):589
[10]TAGHIZADIEH M,HAJIPOUR B,ASL NA,et al.Combination effect of melatonin and dexamethasone on liver ischemia/reperfusion injury[J].Bratisl Lek Listy,2016,117(1):47
[11]SALVADORI M,ROSSO G,BERTONI E.Update on ischemia-reperfusion injury in kidney transplantation:pathogenesis and treatment[J].World J Transplant,2015,5(2):52
(2016-09-13收稿 责任编辑姜春霞)
Protective effect of morinda officinalis oligose on uterine ischemia-reperfusion injury in rats
WANGZhihong1),CHENGLiangxing2),WANGWuliang1),WANGFang1),XUZhen1),WANGBing1),ZHANGHailing1),GENGJie1),FANGYing1)
1)DepartmentofGynecologyandObstetrics,theSecondAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450014 2)EditorialDepartmentofJournalofBasicandClinicalOncology,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
morinda officinalis oligose;uterine ischemia-reperfusion injury;superoxide dismutase;malondialdehyde;high energy phosphate;rat
Aim: To investigate the protective effect of morinda officinalis oligose(MOO) on uterine ischemia-reperfusion injury in rats. Methods: A total of fifty Wistar rats were randomly divided into 5 groups: the sham operation group, the uterine ischemia-reperfusion injury model group(model group), the MOO 0.7 g/(kg·d) group, the MOO 1.4 g/(kg·d) group, the MOO 2.8 g/(kg·d) group, and each group had 10 rats. The suture method was used to establish the uterine ischemia-reperfusion injury model. The rats in the sham operation group and the model group were given double steaming water at 10 mL/kg; the rats were given MOO solution accordingly at 10 mL/kg in the three MOO groups. Then the superoxide dismutase(SOD), malondialdehyde(MDA) and high energy phosphates(HEP) in uterine tissue were determined. Results: Compared with the model group, the SOD level was increased significantly in the 3 MOO groups, and the MDA level was decreased significantly(P<0.05); the adenosine triphosphate(ATP), adenosine diphosphate(ADP), adenosine monophosphate(AMP) and total adenine nucleotides(TAN) levels were increased significantly in the 3 MOO groups(P<0.05). There were significant differences in the SOD, MDA, ATP, ADP, AMP and TAN levels between the three MOO groups(P<0.05). Conclusion: MOO could improve the antioxidation and energy metabolism of the ischemia-reperfusion injured uteruses, and protect the uterine tissue from ischemia-reperfusion injury.
10.13705/j.issn.1671-6825.2017.04.023
R711