DGCR8在先天性心脏病患者血液及心肌组织中的表达*
2017-07-24李保平赵冠男武海英岳军明范太兵任琛琛郭玉琪
李保平,田 捧,李 莉,赵冠男,武海英,岳军明,李 群,范太兵,任琛琛,郭玉琪
1)郑州大学第三附属医院妇产科 郑州 450052 2)田纳西大学健康科学中心病理医学实验室 孟菲斯,田纳西州,美国 38163 3)河南省人民医院儿童心脏中心 郑州 450003 4)河南省妇科肿瘤纳米医学国际联合实验室 郑州 450003
DGCR8在先天性心脏病患者血液及心肌组织中的表达*
李保平1),田 捧1),李 莉1),赵冠男2),武海英3),岳军明2),李 群1),范太兵3),任琛琛1),郭玉琪1,4)#
1)郑州大学第三附属医院妇产科 郑州 450052 2)田纳西大学健康科学中心病理医学实验室 孟菲斯,田纳西州,美国 38163 3)河南省人民医院儿童心脏中心 郑州 450003 4)河南省妇科肿瘤纳米医学国际联合实验室 郑州 450003
#通信作者,女,1964年1月生,博士,教授,研究方向:出生缺陷、卵巢癌,E-mail:yuqi-guo@163.com
迪乔治综合征危象区基因 8;先天性心脏病;室间隔缺损;法洛四联症
目的:探讨迪乔治综合征危象区基因8(DGCR8)与先天性心脏病(CHD)发生的关系及临床意义。方法:收集CHD患儿及健康儿童血液样本各40份,采用qRT-PCR方法检测DGCR8 mRNA的表达;收集室间隔缺损(VSD)患儿心肌组织25份,法洛四联症(TOF)患儿心肌组织16份,采用qRT-PCR和Western blot方法检测DGCR8 mRNA和蛋白的表达,分析间隔缺损患儿血液中DGCR8的表达水平与心脏间隔缺损大小的相关性。结果:与健康儿童相比,CHD患儿血液中DGCR8 mRNA的表达量降低(P=0.037);与VSD患儿相比,TOF患儿心肌组织中DGCR8 mRNA和蛋白的表达量降低(P<0.05);DGCR8与心脏间隔缺损无明显相关性(rS=-0.022,P=0.917)。结论:DGCR8基因的缺失与CHD的发生有关,影响心脏的正常发育。
先天性心脏病(congenital heart disease,CHD)是胎儿的心脏和大血管在胚胎发育时期因各种原因导致发育缺陷或部分发育停顿所造成的心脏及(或)大血管形态、结构等的异常改变。CHD是导致新生儿、婴儿致残、致死的重要原因。目前CHD 发病率整体呈上升趋势,发病率已上升至10‰~12‰[1]。据中国出生缺陷防治报告(2012)报道,2011年全国CHD发生率为2000年的3.56倍,城市为4.41倍,农村为2.97倍,居我国出生缺陷首位。在CHD患儿中,约30%在妊娠期间胎死宫内,40%~60%在新生儿期死亡,CHD成为影响儿童身心健康及人口生存质量的重大公共卫生问题。研究[2-3]表明,miRNA在心脏形态发生、心肌细胞生长及分化过程中发挥着极其重要的作用,与心血管疾病的发生有着密切的联系,可成为今后临床治疗的靶点。迪乔治综合征危象区基因 8(DGCR8)是参与miRNA合成与成熟的重要蛋白,其通过与Drosha相互作用和稳定微处理器复合物来促进Drosha的切割,调控miRNA的生成,进而影响miRNA对基因的调控作用[4]。研究发现,DGCR8的异常表达可影响癌症的发生发展[5-6],影响胚胎干细胞的分化,导致脏器发育异常[7]、性染色体异常[8],损害机体免疫系统功能[9],引起迪格奥尔格综合征(chromosome 22q11.2 deletion syndrome,22q11DS)表象等[10],由此可见,DGCR8参与了人类多种疾病的发生。该研究通过对DGCR8与CHD的发生关系进行研究,以期为CHD的产前诊断提供新的筛查指标,为临床决策提供新的依据。
1 资料与方法
1.1 临床资料 收集2015 年7月至2016年7月就诊于郑州大学第三附属医院和河南省人民医院的40例CHD患儿[包括室间隔缺损(ventricular septal defect,VSD)16例,房间隔缺损5例,房间隔合并室间隔缺损9例,房室间隔缺损2例,法洛四联症4例,动脉导管未闭4例]和40例健康儿童静脉血液(每例2 mL),置于EDTA抗凝管中,30 min内分离出单个核细胞,放入-80 ℃冰箱备用。用冻存管收集上述两家医院心脏外科手术治疗的CHD患儿术中修剪下来的心肌组织41份,立即放入液氮罐中,并及时转移至-80 ℃冰箱冻存备用,其中VSD患儿心肌组织25份,法洛四联症(tetralogy of Fallot,TOF)患儿心肌组织16份。所有CHD患儿均经彩色多普勒超声心动图、心电图检查确定诊断,并经外科手术证实诊断。该研究组别的性别、年龄差异无统计学意义(P>0.05)。该研究经郑州大学第三附属医院和河南省人民医院伦理评审委员会批准,且均在患儿家属知情同意的情况下取得标本。
1.2 主要试剂和仪器 红细胞裂解液(北京索莱宝科技有限公司),Quant Script RT试剂盒、Real Master Mix(SYBR Green)(上海天根科技有限公司),DGCR8引物、GAPDH引物(上海生工生物科技有限公司),兔抗DGCR8抗体、兔抗GAPDH抗体(ABcam 公司),Trizol总RNA提取试剂、BCA蛋白定量试剂盒、SDS-PAGE凝胶制备试剂盒(北京康为世纪生物科技有限公司)。
1.3 DGCR8 mRNA的检测 采用qRT-PCR法。使用Trizol方法提取血液及组织总RNA,并经琼脂糖凝胶电泳检查总RNA的完整性,采用A(260 nm)/A(280 nm)检测提取的总RNA纯度合格。严格按照Quant Script RT试剂盒说明书操作。将总RNA反转录合成cDNA,并将cDNA放入-20 ℃冰箱保存,以备后续qRT-PCR反应。qRT-PCR反应条件:95 ℃ 2 min;95 ℃ 20 s,55 ℃ 30 s,68 ℃ 1 min,40个循环。采用2-ΔΔCt方法,以GAPDH为内参,计算DGCR8 mRNA的表达水平。引物序列见表1。每个样本均重复测定3次。
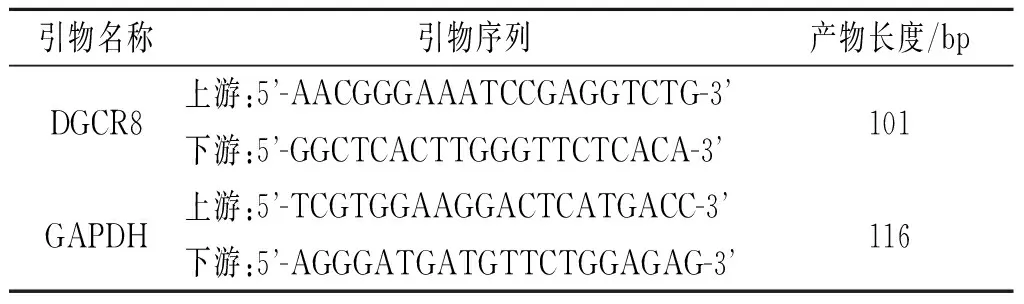
表1 qRT-PCR引物序列和产物长度
1.4 DGCR8蛋白的Western blot法检测 称取100 mg心肌组织,细胞裂解液裂解后用超声细胞破碎仪匀浆,BCA 法测定蛋白含量,取样50 μg进行SDS-PAGE电泳,电泳后切取目标蛋白条带,采用湿转法转移至PVDF膜,50 g/L脱脂奶粉液封闭1 h后加入相应一抗,4 ℃过夜,洗涤后扫描图像,用Image J软件计算各条带的灰度值,以GAPDH为内参。每个样本均重复测量3次。
1.5 统计学处理 采用SPSS 17.0进行分析,应用两独立样本的Wilcoxon秩和检验比较CHD患儿与健康儿童血液中DGCR8 mRNA表达的差异、不同类型CHD患儿心脏组织中DGCR8 mRNA和蛋白表达水平的差异,应用Spearman秩相关分析CHD间隔缺损患儿血液中DGCR8的表达与间隔缺损大小的相关性。 检验水准α=0.05。
2 结果
2.1 CHD患儿与健康儿童血液中DGCR8 mRNA表达水平的比较 CHD患儿血液中DGCR8 mRNA的表达水平[1.010(0.327,2.647)]低于健康儿童[1.870(0.617,4.252)],差异有统计学意义(Z=2.085,P=0.037)。
2.2 不同类型CHD患儿心脏组织中DGCR8 mRNA及蛋白表达水平的比较 与VSD组患儿比较,TOF组患儿DGCR8 mRNA表达水平降低[1.280(1.037,1.640)vs0.960(0.630,1.610)],差异有统计学意义(Z=2.000,P=0.046);DRCG8蛋白的表达水平亦降低[0.039(0.005,1.200)vs0.004(0.001,0.023)],差异具有统计学意义(Z=2.145,P=0.034),见图1。
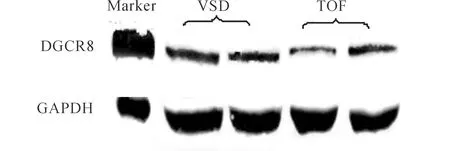
图1 VSD和TOF患儿心肌组织中DGCR8蛋白的表达
2.3 间隔缺损患儿血液中DGCR8的表达水平与心脏间隔缺损大小的相关性 CHD患儿心脏间隔缺损大小为8.15(6.08,11.5)mm,DGCR8 mRNA相对表达量为1.61(0.64,8.6)两者无明显相关性(rS=-0.022,P=0.917)。
3 讨论
CHD的病因多种多样,有遗传危险因素、环境危险因素、 遗传-环境因素共同作用,随着研究水平的提高,遗传因素越来越受到研究者的重视。已有研究[11-14]表明,相关转录因子基因异常与CHD的发生密切相关,如GATA4、ZIC3、NKX2.5、TBX1等。
DGCR8是位于人类22号染色体q11.2区域的一个等位基因,是双链miRNA结合蛋白,它与RNA酶Ⅲ Drosha相互作用,促进miRNA的成熟。研究显示miRNA可作用于特定蛋白介导CHD的发生,通过促进心肌细胞异常增生参与心脏重构过程[15-16],还可调控通道蛋白表达促使神经-颅面-心脏缺陷的发生[17],是导致CHD-肺动脉高压形成的重要诊断依据[18]。
目前单纯性的针对DGCR8在CHD中的研究较少。Sellier等[10]研究发现,22q11DS CHD患者血液中DGCR8表达不足,DGCR8低表达可阻止神经嵴细胞中相关miRNA的形成,导致心血管疾病和颅面部畸形,如VSD损、心室双出口和主动脉弓缺陷。Chapnik等[7]发现DGCR8的缺失可导致心脏畸形的发生,如永存主动脉干、主动脉弓畸形及间隔缺损。 然而,Borgmann等[19]对157例单纯性心脏缺陷患者和25例患有心脏缺陷的22q11DS患者进行研究,发现单纯性的心脏畸形与22q11微缺失并无必然联系。该研究发现CHD患儿血液中DGCR8表达水平低于健康儿童,表明DGCR8与CHD的发生有关,DGCR8低表达阻碍了心脏、血管的发育。
Chen等[20]发现敲除小鼠DGCR8基因后可能导致了血管平滑肌细胞的凋亡,血管腔变大,管壁变薄,心脏变大,心脏腔室变大,室壁变薄,与临床晚期心力衰竭症状相似,证实DGCR8对血管平滑肌细胞甚或整个机体的发育都发挥着重要的作用。Rao等[21]发现敲除心脏横纹肌中DGCR8可诱导左心室重塑,促进心力衰竭的发展。作者的研究结果显示,TOF患儿心肌组织中DGCR8的表达低于VSD患儿,一方面提示DGCR8与CHD发生关系密切,另一方面提示DGCR8基因的表达越低导致的CHD类型越复杂,阻碍胎儿早期心脏正常结构的形成。
间隔缺损的大小、缺损位置、肺动脉高压等因素是评估CHD患儿手术的重要指标,关系到手术的成败、术后的恢复及最终的结局。该研究对DGCR8表达水平与间隔缺损大小的相关性进行了分析,发现DGCR8表达水平与CHD患儿心脏间隔缺损大小无明显相关性,表明虽然DGCR8参与了CHD的形成,但并不直接影响CHD患儿间隔缺失的大小。
总之,通过对DGCR8基因表达水平的临床研究,了解DGCR8基因与CHD之间的关系,可提高对CHD胎儿的产前诊断,提高出生人口质量,降低不能矫正的缺陷儿的出生。
[1]HOFFMAN JIe.The global burden of congenital heart disease[J].Cardiovasc J Afr,2013,24(4):141
[2]XIE WQ,ZHOU L,CHEN Y,et al.Circulating microRNAs as potential biomarkers for diagnosis of congenital heart defects[J].World J Emerg Med,2016,7(2):85
[3]SMITH T,RAJAKARUNA C,CAPUTO M,et al.MicroRNAs in congenital heart disease[J].Ann Transl Med, 2015,3(21):333
[4]WANG Y,MEDVID R,MELTON C,et al.DGCR8 is essential for microRNA biogenesis and silencing of embryonic stem cell self-renewal[J].Nat Genet,2007,39(3):380
[5]KIM B, LEE JH, PARK JW, et al.An essential microRNA maturing microprocessor complex component DGCR8 is up-regulated in colorectal carcinomas[J].Clin Exp Med,2014,14(3):331
[6]KWON, SY, LEE JH, KIM B, et al.Complexity in regulation of microRNA machinery components in invasive breast carcinoma[J].Pathol Oncol Res,2014,20 (3):697
[7]CHAPNIK E,SASSON V,BLELLOCH R,et al.Dgcr8 controls neural crest cells survival in cardiovascular development[J].Dev Biol,2012,362(1):50
[8]MODZELEWSKI AJ,HILZ S,CRATE EA,et al.Dgcr8 and Dicer are essential for sex chromosome integrity during meiosis in males Dgcr8 and Dicer are essential for sex chromosome integrity during meiosis in males[J].J Cell Sci,2015,128(12):2314
[9]BEZMAN NA,CEDARS E,STEINER DF,et al.Distinct requirements of microRNAs in NK cell activation,survival,and function[J].J Immunol,2010,185:(7):3835
[10]SELLIER C,HWANG VJ,DANDEKAR R,et al.Decreased DGCR8 expression and miRNA dysregulation in individuals with 22q11.2 deletion syndrome[J].PLoS One,2014,9(8):e103884
[11]尤涛,兆红,刘兴光,等.GATA4基因多态性与先天性心脏病相关研究[J].兰州大学学报(医学版),2015,41(1):60
[12]WARE SM, PENG JL, ZHU LR,et al.Identification and functional analysis of ZIC3 mutations in heterotaxy and related congenital heart defects[J].Am J Hum Genet,2004,74(1):93
[13]ELLESØE SG,JOHANSEN MM,BJERRE JV,et al.Familial Atrial Septal Defect and Sudden Cardiac Death:Identification of a Novel NKX2-5 Mutation and a Review of the Literature[J].Congenit Heart Dis,2016,11(3):283
[14]邱广蓉,周静怡,刘培燕,等.TBX1基因T 350M多态性与法洛四联症的相关性[J].实用儿科临床杂志,2011,26(12):946
[15]SHEEHY NT,CORDES KR,WHITE MP,et al.The neural crest-enriched microRNA miR-452 regulates epithelial-mesenchymal signaling in the first pharyngeal arch[J].Development,2010,137(24):4307
[16]BOETTGER T,BRAUN T.A new level of complexity: the role of microRNAs in cardiovascular development[J].Circ Res,2012,110(7):1000
[17]HUANG ZP,CHEN JF,REGAN JN,et al.Loss of microRNAs in neural crest leads to cardiovascular syndromes resembling human congenital heart defects[J].Arterioscler Thromb Vasc Biol,2010,30(12):2575
[18]QIAN Z,ZHANG L,CHEN J,et al.MiR-328 targeting PIM-1 inhibits proliferation and migration of pulmonary arterial smooth muscle cells in PDGFBB signaling pathway[J].Oncotarget,2016,7(34):54998
[19]BORGMANN S,LUHMER I,ARSLAN-KIRCHNER M,et al.A search for chromosome 22q11.2 deletions in a series of 176 consecutively catheterized patients with congenital heart disease: no evidence for deletions in non-syndromic patients[J].Eur J Pediatr,1999,158(12):958
[20]CHEN Z,WU J,YANG C,et al.DiGeorge syndrome critical region 8 (DGCR8) protein-mediated microRNA biogenesis is essential for vascular smooth muscle cell development in mice[J].J Biol Chem,2012,287(23):19018
[21]RAO PK,TOYAMA Y,CHIANG HR,et al.Loss of cardiac microRNA-mediated regulation leads to dilated cardiomyopathy and heart failure[J].Circ Res,2009,105(6):585
(2016-10-10收稿 责任编辑赵秋民)
Expression of DGCR8 in blood samples and myocardial tissue from children with congenital heart disease
LIBaoping1),TIANPeng1),LILi1),ZHAOGuannan2),WUHaiying3),YUEJunming2),LIQun1),FANTaibing3),RENChenchen1),GUOYuqi1,4)
1)DepartmentofGynecologyandObstetrics,theThirdAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052 2)DepartmentofPathologyandLaboratoryMedicine,UniversityofTennesseeHealthScienceCenterMemphis,TN,USA38163 3)PediatricHeartCenter,HenanProvincialPeople’sHospital,Zhengzhou450003 4)InternationalJointLaboratoryforGynecologicalOncologyNanomedicineofHenanProvince,Zhengzhou450003
DGCR8;congenital heart disease;ventricular septal defect;tetralogy of Fallot
Aim: To explore the expression and clinical significance of DGCR8 in children with congenital heart disease(CHD). Methods: The blood samples of 40 children with CHD and 40 healthy children were collected,respectively.qRT-PCR method was used to detect the expression of DGCR8 mRNA. The expression of DGCR8 in myocardial tissue from 25 children with ventricular septal defect(VSD) and 16 children with tetralogy of Fallot(TOF) was detected by qRT-PCR and Western blot,and the correlation between DGCR8 and septal defect was analyzed.Results: Compared with healthy children, the expression of DGCR8 in blood from children with CHD was decreased(P=0.037).The expressions of DGCR8 mRNA and protein in myocardial tissue from those with TOF were lower compared with VSD(P<0.05).There was no significant correlation between DGCR8 and the septal defect (rS=-0.022,P=0.917).Conclusion: The deletion of DGCR8 gene is associated with the development of CHD and affects the normal development of the heart.
10.13705/j.issn.1671-6825.2017.04.014
*国家自然科学基金面上项目 81572574;河南省高校科技创新团队项目 16IRTSTHN018;郑州大学创新项目 DYCX053
R725.4