母牛卵泡期和黄体期子宫颈6种β-防御素的变化
2017-07-19张贵学
王 皓,王 雪,王 晨,张贵学
(东北农业大学 动物科学技术学院,黑龙江 哈尔滨 150030)
实验研究
母牛卵泡期和黄体期子宫颈6种β-防御素的变化
王 皓,王 雪,王 晨,张贵学*
(东北农业大学 动物科学技术学院,黑龙江 哈尔滨 150030)
为了解母牛生殖道β-防御素的表达及与发情周期的关系,实验采用荧光定量PCR检测卵泡期和黄体期母牛子宫颈6种β-防御素的变化。实验发现,在子宫颈中卵泡期和黄体期BNBD-4、BNBD-5的表达量无差异(P>0.05),而卵泡期TAP、LAP1、BNBD-1、BNBD-10的表达量高于黄体期(P<0.05)。母牛子宫颈中6种β-防御素均有表达,其中TAP、LAP1、BNBD-1、BNBD-10的表达量呈周期变化,可能与发情周期中子宫颈口开张程度有关。
母牛;子宫颈;β-防御素
防御素是机体抵御环境微生物侵袭的重要屏障,可参与机体的适应性免疫和先天性免疫[1]。1991年Diamond[2]在牛的气管黏膜内发现了第一种β-防御素,即气管上皮抗菌肽(TAP),后来相继在牛舌的鳞状上皮细胞、呼吸道、胃肠道、结膜和泌尿生殖道以及脑和胎盘中发现舌抗微生物肽(LAP)[3, 4],在牛的嗜中性粒细胞中发现了13种β-防御素即BNBD-1~13[5]。有研究证实,LAP、TAP、BNBD-4在牛子宫内膜上皮细胞中表达[6],雌性牦牛卵巢、输卵管、子宫、阴道等组织均可表达LAP基因[7]。王桂荣等[8]从乳牛子宫内膜中扩增出防御素BNBD-5基因,证实乳牛子宫内膜中有防御素基因的表达。牛发情周期由卵泡期和黄体期组成,防御素的变化是否与发情周期变化有关在牛还未见报道。很有必要对牛生殖道β-防御素发情周期中的变化进行研究,为提高母牛繁殖率提供理论和实践依据。
1 材料与方法
1.1 实验动物与样品采集
实验动物选取成年健康中国荷斯坦母牛,来自哈尔滨市道外区屠宰场。屠宰后立刻选取4头正常火山口型黄体(黄体期)和4头卵巢上有明显卵泡(卵泡期)的母牛的生殖器官,取子宫颈,将样品横切成约1 cm×1 cm小块,冰冷的生理盐水漂洗除去附着物,放入EP管,液氮中冷冻保存备用。
1.2 仪器与试剂
1.2.1 试剂与药品
FastStart Universal SYBR Green Master (Rox),购自德国罗氏公司;Trizol试剂,购自哈尔滨英俊生物技术有限公司;oligo dT引物、PrimeSTAR HS (Premix)、Easy Taq酶、dNTP、DNA Marker、RNase Inhibitor和各种内切酶,购自宝生物工程(大连)有限公司;2×Taq PCR MasterMix,购自北京天根公司;琼脂糖(Agarose)购自北京原平皓生物技术公司;ImProm-II reverse transcriptase,购自Promega公司;其他常规化学试剂源自东北农业大学设备处。
1.2.2 引物设计与合成
6种牛β-防御素cDNA序列通过GenBank查找,引物用Primer Premier 5.0和oligo 6设计得到。内参基因为GAPDH2基因,用GAPDH1基因检测反转录结果,引物序列见表1。引物合成自北京华大基因生物技术有限公司。

表1 基因特异性引物信息Table 1 List of gene specific primers
1.3 方法
1.3.1 提取子宫颈总RNA
本实验通过Trizol法提取母牛子宫颈总RNA,用DEPC水溶解RNA沉淀,后放置于-80℃保存备用。
1.3.2 子宫颈总RNA反转录
子宫颈总RNA经1.2%琼脂糖凝胶电泳(120 V,30 min),分析合格后进行反转录。反转录过程按照试剂盒说明书进行操作,反转录得到的cDNA放置于-20℃保存备用。
1.3.3 实时荧光定量PCR检测
以1.3.2步骤得到的 cDNA 稀释液为模板,对实验目的基因和内参基因(GAPDH2)进行荧光定量PCR检测,采用罗氏FastStart Universal SYBR Green Master(Rox)试剂盒和ABI Prism 7500 sequence detection system,10 μl体系,在冰上配制,反应体系及反应条件参考于娜[9]。
1.3.4 2-ΔΔCt的计算方法
ΔCt=目的基因的Ct值—内参基因的Ct值。
ΔΔCt=(实验组目的基因Ct值—实验组内参基因Ct值)—(对照组目的基因Ct值—对照组内参基因Ct值)。
目的基因相对表达量=2-ΔΔCt。
1.3.5 数据统计
数据表示为平均值(Means)±标准差(SD),统计分析使用SPSS 13.0软件T检验单因素方差分析(LSD)法进行显著性检验,P<0.05表示两组数有统计学意义的显著性差异。试验重复4×3次。
2 实验结果
2.1 总RNA提取结果
用1.2%琼脂糖凝胶电泳检测所提取子宫颈的总RNA(图1),实验得到清晰且无拖尾的三条带,说明母牛子宫颈样品 RNA是完整的。
图1 总RNA提取结果M.DL-2000 Marker;1.RNA产物;2.RNA产物
2.2 内参电泳结果
以样品反转录得到的cDNA为模板,进行内参基因表达的鉴定。凝胶电泳得到样品反转录的清晰、单一条带(图2),即全部样品的内参均在子宫颈中有所表达。
图2 组织样品内参电泳结果M.DL-2000 Marker;1. PCR产物;2. PCR产物
2.3 β-防御素基因表达
由图3可知:在子宫颈中,卵泡期和黄体期BNBD-4、BNBD-5的表达量无差异(P>0.05),而卵泡期TAP、LAP1、BNBD-1、BNBD-10的表达量高于黄体期(P<0.05)。
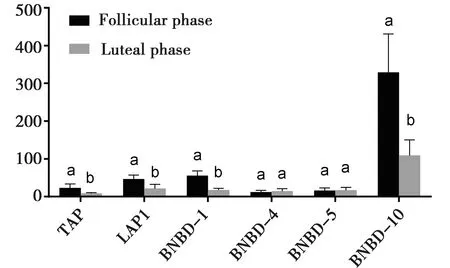
图3 发情周期子宫颈β-防御素表达
3 讨论与分析
Quayle AJ 等[10]研究发现,雌性生殖道防御素受雌激素的影响,在不同生理周期呈现不同的表达量。本实验表明,TAP、LAP1、BNBD-1、BNBD-4、BNBD-5、BNBD-10这6种β-防御素在母牛子宫颈中均有表达,且TAP、LAP1、BNBD-1、BNBD-10的表达量呈周期变化。
另外,6种防御素中BNBD-10明显高于其他,推测BNBD-10可能在子宫颈防御机制中起主要作用。卵泡期雌二醇升高,子宫颈舒张有利于精子进入[11,12]。此时期子宫受外界环境影响较大,可能导致各种防御素相较黄体期表达较高。
4 结论
母牛子宫颈中TAP、LAP1、BNBD-1、BNBD-4、BNBD-5、BNBD-10这6种β-防御素均有表达,BNBD-10在其中发挥主要作用。其中TAP、LAP1、BNBD-1、BNBD-10的表达量呈周期变化,可能与发情周期中子宫颈口开张程度有关。
[1] Ganz T. Lehrer Author information Defensins[J]. Pharmacol Ther. 1995,66(2):191-205.
[2] Cornet B, Bonmatin J M, Hertru C, et al. Refined three-dimensional solution structure of insect defensin A[J]. Structure, 1995, 3 (5): 435-448.
[3] Valore E V, Ganz T. Posttranslational processing of defensins in immature human myeloid cells[J]. Blood , 1992, 79: 1538-1544.
[4] Valore E V, Park C H, Quayle A J, et al. Human β defensin-1: an antimicrobial peptide of urogenital tisses[J]. J Clin Invest, 1998, 101: 1633-1642.
[5] Leonova L, Kokryakov VN, Aleshina G,et al. Circular minidefensins and posttranslational generation of molecular diversity[J]. J Leukoc Biol, 2001, 70:461-464.
[6] Davies D,Meade K G,Herath S,et al.Toll-like receptor and antimicrobial peptide expression in the bovine endometrium[J].Reprod Biol Endocrinol,2008,18(6):53.
[7] 栾红雨,姚学萍,曹随忠,等. 牦牛舌抗菌肽基因cDNA的克隆及其在生殖系统中的表达[J].中国兽医科学,2010,40(01):83-88.
[8] 王桂荣,严作廷,王东升,等.乳牛子宫内膜抗菌肽BNBD5基因的克隆及其原核表达[J].中国兽医科学,2009,39(6):538-542.
[9] Yu N,Yang Z,Lin X,et al. Bovine Sertoli Cells defensive response after transfection pEGFP-N3-HNP-1 Plasmid [D].Harbin: The Northeast Agricultural University,2014,36-37.[10]Quayle A J, Porter E M, Nussbaum A A, et al. Gene expression, immunolocalization, and secretion of human defensin-5 in human female reproductive tract[J]. The American journal of pathology, 1998, 152(5): 1247.
[11]Falchi L, Scaramuzzi RJ. The expression of ERα, OTR, cPLA(2), COX-2, and PPARγ in the cervix of the ewe during the estrous cycle[J]. Theriogenology. 2013, 79(1):40-47.
2017-04-14
国家国际科技合作项目子课题(项目号:2011DFA30760-2-1)。
王皓(1993-),男,硕士研究生。
*通信作者:张贵学,男,博士,教授。 Email:Gxzhang@neau.edu.cn
S823.3
A
1005-2739(2017)04-0003-04
