红曲米中桔霉素、淀粉、水分含量的快速测定
2017-07-19张晓伟王加华李培睿
张晓伟 王加华 李培睿
(许昌学院食品与生物工程学院,许昌 461000)
红曲米中桔霉素、淀粉、水分含量的快速测定
张晓伟 王加华 李培睿
(许昌学院食品与生物工程学院,许昌 461000)
采用近红外光谱技术构建红曲米中桔霉素、淀粉、水分含量的快速测定预测模型。分别采用偏最小二乘回归(PLS)、主成分回归(PCR)、多元线性回归(SMLR)构建所测组分的数学模型,以相关系数(R)、预测相对分析偏差(RPD)、预测均方根误差(RMSEP)、校正均方根误差(RMSEC)值来评价模型的综合性能。结果表明,MSC、SNV方法可以消除样品颗粒不均对光谱的散射影响;导数处理能够消除基线漂移问题;对于水分含量,只有PLS和PCR模型可用于较准确定量测定(RPD = 2.45和2.81);对于淀粉,只有SMLR模型可用于较准确定量测定(RPD=2.58);对于桔霉素,3种模型的RPD值均小于2,虽然不能用于准确定量测定,但能满足定性分析或分级。为红曲米生产过程中桔霉素、淀粉、水分含量的快速检测提供新的方法,为红曲米质量的智能化控制提供新的途径。
近红外光谱 桔霉素 淀粉 水分含量 预测模型
红曲色素作为一种具有多种生理功能(抗氧化、抗肿瘤、抗菌、降血压、降血脂等多种功效)[1-3]的天然食用色素,在中国乃至全世界的食品产业中被广泛使用[4-5]。随着1995年,法国科学家Blanc课题小组[6-7]通过对具有抗菌活性的Monascidin A的分子结构的鉴定证实,Monascidin A就是对人等哺乳动物肾脏和肝脏有毒害作用的桔霉素。随着对桔霉素研究的深入,发现桔霉素还具有生殖毒性、免疫毒性、致癌性等毒性[8-10]。在我国和日本,为了避免桔霉素的危害,都对红曲色素中桔霉素的含量制定了限量标准。桔霉素的存在严重制约了我国红曲产业的发展。除桔霉素外红曲米中的淀粉及水分含量也决定着红曲米品质的高低。目前,有关红曲米中这些指标的定性和定量测定,主要采用化学分析测定法或高效液相色谱法。这些方法往往需要对样品进行有机溶剂提取等前处理,需要耗费大量化学试剂,且每种方法只能测定一个指标,不能同时对红曲米中桔霉素、淀粉及水分含量的综合指标进行测定,这严重限制了对红曲米品质的在线检测,也无法对市场上的红曲米进行准确分级。如何克服目前检测方法的不足,探寻红曲米中桔霉素等指标的快速无损检测成为我国红曲产业质量控制的重要任务之一。
近红外光谱检测技术由于其具有绿色、快速、环保、无损及适用范围广等优点,在农业[11-12]、医药[13]、尤其是食品生产[14-17]等领域被广泛应用。近红外光谱检测技术主要利用被检测有机物质中的官能团吸收光能后,从基态向高能级跃迁,并记录分子中单个化学键[含氢基团X-H(X,C、N、O)]基频振动的倍频和合频信息,通过测量近红外光谱范围内含氢基团X-H振动的倍频和合频吸收信息来对样品中的目标成分进行快速无损检测。红曲米中桔霉素、淀粉及水分的分子结构多由这些基团构成,这些成分的含量多少可通过基团的吸收频谱表征。本试验主要探究了近红外光谱技术在红曲米中桔霉素、淀粉及水分含量快速测定中的应用。对红曲米中这些主要成分含量的快速无损近红外光谱检测模型的建立,将在红曲米品质的快速测定、红曲米的分级销售等方面发挥重要作用。
1 材料与方法
1.1 样品与仪器
所用80 个红曲米样品,部分由实验室自制,部分购自市场(武汉佳成生物制品有限公司、杭州禾田生物技术有限公司、杭州博大生物技术有限公司等),样品经粉碎机粉碎后过60目筛子,收集样品供光谱采集及桔霉素、淀粉、水分含量的测定。
ANTARISⅡ型傅里叶变换近红外光谱仪:美国Thermo Nudet公司。
1.2 基础数据采集
1.2.1 桔霉素测定
参照GB/T 5009.222—2008,红曲类产品中桔青霉素的测定。参照固态红曲制品的方法,并做适当修改。
准确称取粉碎混合均匀的样品2.000 g,加100 mL体积分数为70%的乙醇,60 ℃保温浸提60 min,每隔10 min振荡1次,冷却至室温后定容至100 mL,经真空抽滤后,收集滤液。滤液经0.45 μm有机滤膜过滤后进行HPLC分析。样品中桔霉素的含量按式(1)计算:
(1)
式中:S为试样中桔霉素含量/mg/kg;c为HPLC检测的浓度/mg/L;n为试样的稀释倍数。
1.2.2 水分测定
参照GB 5009.3—2010食品中水分的测定:直接干燥法。
1.2.3 淀粉测定
参照GB/T 5009.9—2008食品中淀粉的测定:酸水解法。
采用以上方法所测得的红曲米中桔霉素、淀粉及水分的含量,统计如表1所示。

表1 红曲米中所测成分含量统计表
1.2.4 光谱测定
利用傅里叶变换近红外光谱仪对所测红曲米样品进行近红外光谱图谱采集,采用仪器自带的TQ Analyst 8.0软件进行数据处理和数学模型构建。
经试验分析确定红曲样品光谱采集的最优参数分别为:样品杯直径大小约50 mm,偏心距10 mm,光谱范围12 000~3 800 cm-1,分辨率8 cm-1,光谱采集累积16 次平均输出。红曲米样品的漫反射光谱图谱如图1所示。

图1 红曲米样品原始近红外光谱图谱
由图1可知,所有样品的近红外光谱图趋势一致,在8 318、6 764、5 786、5 154、4 733、4 325、4 015 cm-1附近有显著吸收峰,主要表征了C-H、N-H、O-H等基团的倍频和合频吸收。但光谱散射现象明显,主要是红曲米粉颗粒引起散射,在后续光谱处理中要进行预处理。
1.3 数据处理方法
1.3.1 异常样本剔除
建模前,采用Chauvenet检验在95%的置信度下来识别异常光谱。计算所有样品光谱的马氏距离(Mahalanobis distance,MD),并从小到大排列。依据TQ 8.0分析软件(Thermo Nicolet Co., 美国)的推荐,当置信度在95%时,MD阈值为1.652,根据MD阈值对所有样品的光谱图进行异常检验,结果如图2所示,其中有2条光谱MD值超过阈值(灰色线右侧),被判定为异常光谱图。

图2 光谱异常检验
样品化学值异常的判别是通过样品杠杆值与学生残差进行判断分析。样品杠杆值的大小表明了样品对模型的影响程度,通常位于被测组分浓度和性质两端(高端和低端)的样品具有较大的杠杆值,位于被测组分和性质均值附近的样品杠杆值较小。学生残差说明了与样品杠杆值对应的样品浓度预测能力好坏,样品只有同时具备高的杠杆值和学生残差,该样品才被判别为异常样本化学值。
以杠杆值3 倍和学生残差值3 作为异常判定阈值。如图3所示,当样本淀粉的杠杆值和学生残差值大于阈值(0.109 3),即被判为异常。通过杠杆值和学生残差计算分析,有8 个样品具有较高的杠杆值和学生残差被剔除。同理,经计算分析桔霉素和水分分别有4和6 个样品异常,异常样品剔除后进行建模。

图3 红曲米中淀粉杠杆值和学生残差散点图
1.3.2 样本分集
采用上述方法进行淀粉及水分含量成分异常样本的识别。余下的样品以其含量从低到高进行排序,按照3∶1比例将正常样品分为校正集和预测集,其中最大值和最小值均应在校正集。表2为本试验样品中桔霉素、淀粉及水分含量的统计参数。样品值具有较大的差异性,变异系数(Coefficients of variation,CV)范围较宽。

表2 红曲米中各成分化学值的统计结果
1.3.3 光谱预处理
样品近红外光谱图谱不仅受被检测物化学成分浓度的影响,还受其物理特性的影响,且样品光谱间差异主要是由于其物理特性引起的[17]。为了提高检测目标的光谱信息有必要对样品光谱图谱进行预处理。样品的均匀程度、粒径大小和光程远近往往影响样品近红外光谱图谱的形状,在解决由样品的粒径不均匀或测样容器不一致对样品近红外光谱的影响上,多采用多元散射校正技术(MSC)和标准归一化(SNV)处理。经过MSC和SNV处理后,光谱如图4a和图4b所示,基本消除了因红曲米颗粒不均匀而引起的样品光谱图谱散射现象。
消除基线和其他背景的干扰通常采用导数处理,从而分辨重叠峰,提高分辨率和灵敏度。常用的导数处理方法有一阶导数处理(First derivative, 1D)和二阶导数处理(Second derivative, 2D)。经过1D和2D处理后,红曲样品的近红外光谱图谱如图5所示,经导数处理后虽然消除了光谱基线漂移,但同时局部噪声也被放大,在实际应用时,往往在后续进行Savitzky-Golay (S.G)卷积平滑或Norris导数滤波(NDF)处理,以消除高频噪声。

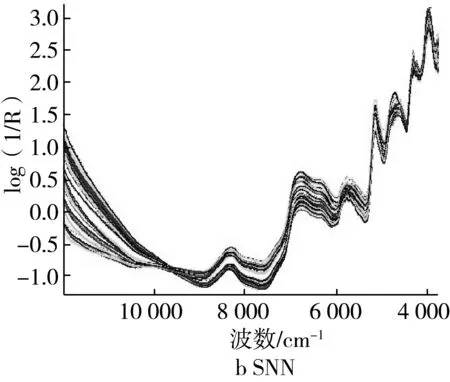
图4 经MSC和SNV处理后红曲米近红外光谱


图5 经一阶导和二阶导处理后红曲米近红外光谱
1.4 模型构建方法与评价参数
1.4.1 建模方法
主要采用多元线性回归(Stepwise Multiple Linear Regression, SMLR)、 偏最小二乘回归(Partial least squares, PLS)、主成分回归(Principal Component Regression, PCR)3种方法构建近红外光谱对红曲米中桔霉素、淀粉及水分含量测定的预测模型。
1.4.2 模型评价参数
近红外光谱模型的稳健性及适应性评价通常采用相关系数(Correlation coefficient of calibration,R)、校正均方根误差(Root mean square error of calibration,RMSEC)、预测均方根误差(Root mean square error of predication,RMSEP)、预测相对分析偏差(Ratio of prediction to deviation,RPD)等指标来进行评定。
当R≥0.90时,说明模型具有良好精度;当0.70≤R<0.89时,模型具有较好精度;当0.50≤R<0.69时,模型可用于定性测定评价;当R<0.49时,模型稳健性较差。RMSEP值越小,RPD值越大,表明所建模型对未知样品的预测性能越好。
2 结果与分析
2.1 SMLR模型的建立
采用TQ Analyst 8.0软件建立红曲米中桔霉素、淀粉及水分含量的SMLR模型。光谱数据处理方法相互独立,采用正交处理,以RMSECV为评价标准,确定数据预处理最优组合方法。依照相关性大小选择变量数,当变量逐渐增加时入选信息增加,模型的RMSECV值减小,当过渡引入变量时(引入了部分噪声等非目标信息),其RMSECV值又增加,因此以最小的RMSECV值确定最优变量数。模型输出结果如相关系数(R)、建模标准偏差(RMSEC)及预测标准偏差(RMSEP)值如表3所示。

表3 红曲色素的SMLR模型结果统计表
注:*1D为一阶导数光谱,MSC为多元散射校正,S.G为卷积平滑。
由表3可知,红曲米中桔霉素、淀粉和水分的相关系数均大于0.85,表明SMLR模型具有较好的稳健性。从RPD 值来看,淀粉、水分模型可用于精确定量预测;桔霉素素模型可以满足定量分级。
利用红曲米中各组分的SMLR模型对未知红曲样品中桔霉素、淀粉和水分含量进行预测时,预测结果具有较高的线性和良好预测精度(RPD = 1.18~ 3.25)。红曲米中桔霉素、淀粉和水分的SMLR模型的校正集和预测集样品的真实值与预测值分别如图6所示。

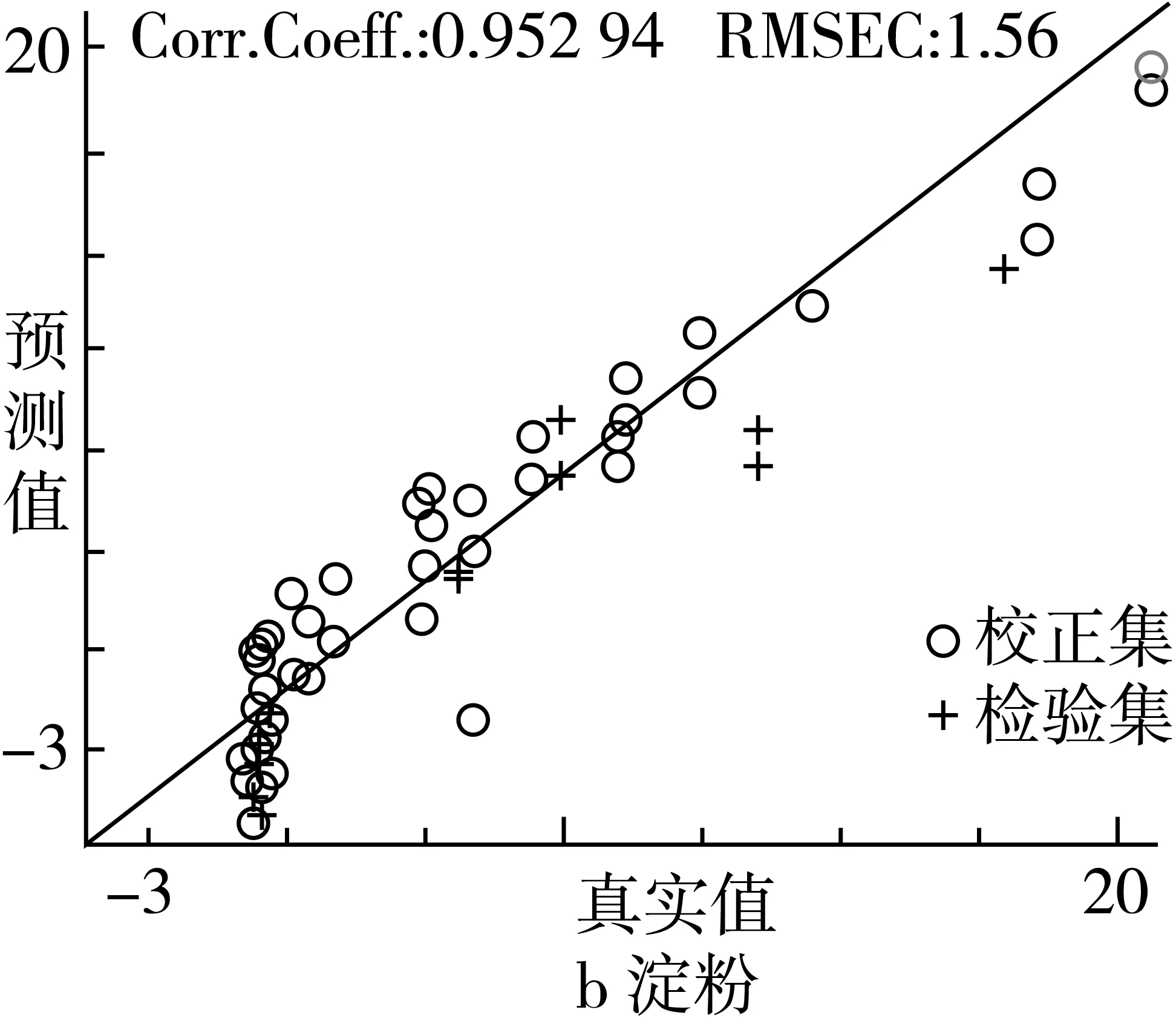

图6 红曲米成分的SMLR模型预测结果
2.2 PLS模型的建立
采用内部交叉验证法,在各成分的最佳主因子条件下,建立了桔霉素、淀粉及水分含量的PLS模型,如表4所示。

表4 红曲米成分的PLS模型结果统计表
注:*1D为一阶导数光谱,SNV为标准正交化,S.G为卷积平滑。
由表4可知,红曲米中桔霉素、淀粉、水分PLS模型的相关系数均大于0.8,表明红曲米中这些成分的PLS模型具有较好的稳健性。水分PLS模型(RPD=2.45)可以满足定量分级;桔霉素(RPD=1.29)和淀粉(RPD=1.95)模型相对较差,只能满足一般定性分级。
采用红曲米各组分PLS模型对未知红曲样品中桔霉素、淀粉和水分含量进行预测时,预测结果具有良好的线性关系和预测精度(RPD=1.29~2.45)。红曲米中桔霉素、淀粉和水分的PLS模型的校正集和预测集样品的真实值与预测值分别如图7所示。

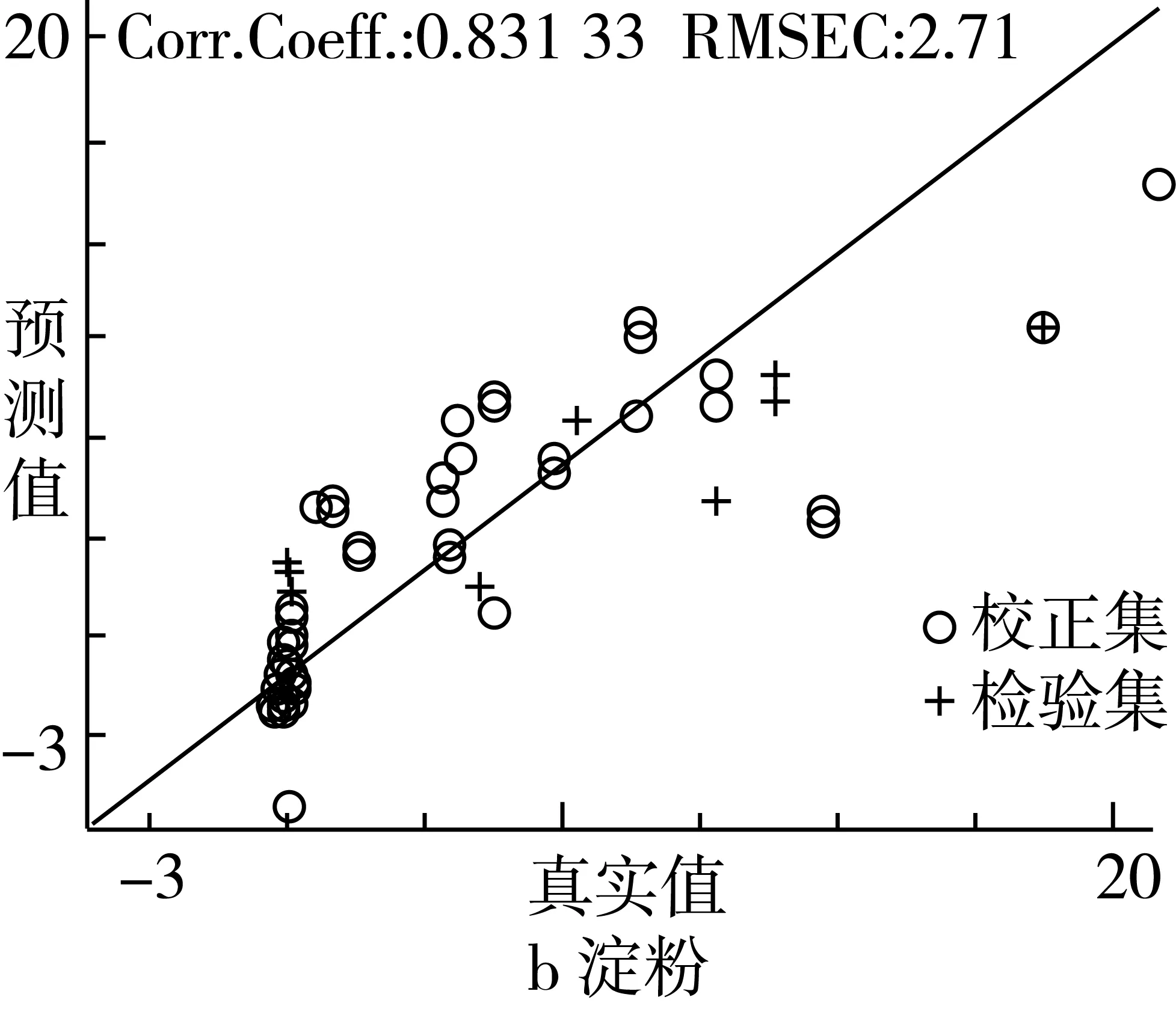

图7 红曲米成分的PLS模型预测结果
2.3 PCR模型的建立
采用全谱数据进行数学模型构建时,计算量大,而且在有些光谱区域内样品的光谱信息很弱,与样品成分含量间的相关性较差。采用主成分分析可以压缩数据,将较多变量转化为较少的新变量,且变量相互独立。采用主成分分析构建模型时选取最佳主成分数至关重要,当选取的主成分数过多时,可能引入噪声;当选取的主成分数过少时,可能丢失部分信息。在红曲米中各成分最佳主因子数条件下,得到了红曲米中桔霉素、淀粉、水分含量的PCR模型,如表5所示。

表5 红曲米成分的PCR模型结果统计表
注:1D为一阶导数光谱,MSC为多元散射校正,S.G为卷积平滑。
由表5可知,红曲米中桔霉素、淀粉和水分PCR模型的相关系数均大于0.7,表明红曲米中3种成分的PCR模型具有较好的稳健性。水分PCR模型(RPD=2.81)可以满足定量分级;桔霉素(RPD=1.43)和淀粉(RPD=1.52)模型相对较差,只能满足一般定性分级。
采用红曲米中各组分的PCR模型对未知红曲样品中桔霉素、淀粉和水分含量进行预测时,预测结果具有良好的线性关系和预测精度(RPD=1.43~2.81)。红曲米中桔霉素、淀粉和水分PCR模型的校正集和预测集样品的真实值与预测值分别如图8所示。

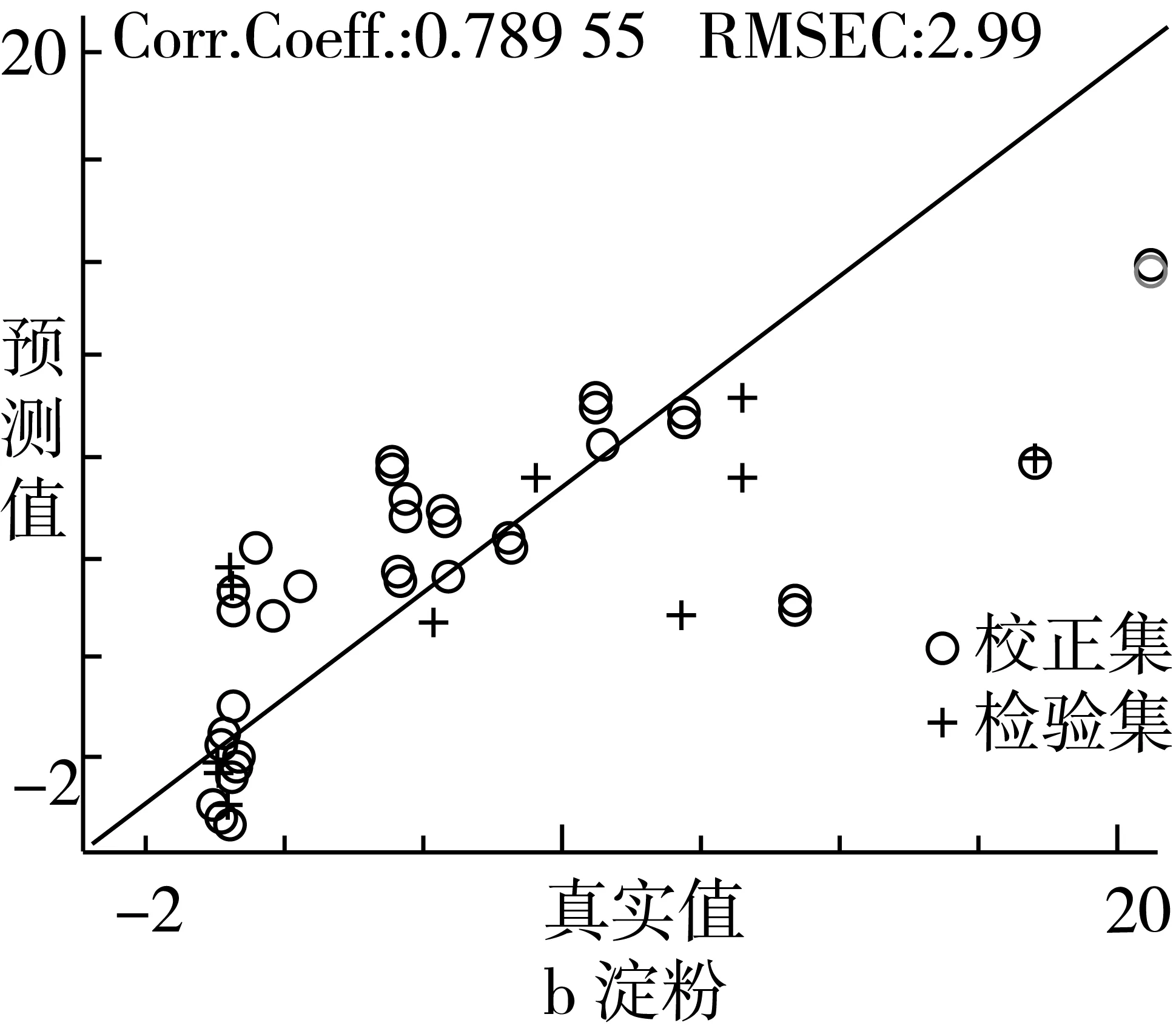

图8 红曲米成分的PCR模型预测结果
3 结论
分别采用SMLR、PLS、PCR构建了红曲米中桔霉素、淀粉和水分含量的近红外光谱快速检验预测模型。在对光谱预处理上,通过MSC、SNV方法消除红曲米粉颗粒不均对光谱的散射影响;通过对光谱的导数处理消除了样品近红外光谱的基线漂移现象;对于光谱高频噪声的消除,采用S-G卷积平滑和Norris导数滤波的方法。通过马氏距离(MD)识别光谱异常样本,对于样品中化学异常值的识别是通过杠杆值和学生残差来实现的。结果表明,桔霉素、淀粉和水分含量的3种预测模型均具有良好的稳健性,且预测性能较好。对于水分含量,只有PLS和PCR模型可用于较准确定量测定(RPD=2.45和2.81);对于淀粉,只有SMLR模型可用于较准确定量测定(RPD=2.58);对于桔霉素,3种模型的RPD值均小于2,虽然不能用于准确定量测定,但能满足定性分析或分级。此模型的建立将为红曲米中桔霉素、淀粉、水分含量的快速检测提供新的方法。
[1]Kim C, Jung H, Kim Y O, et al. Antimicrobial activities of amino acid derivatives of Monascus pigments[J]. FEMS Microbiology Letters, 2006, 264(1): 117-124
[2]Hong S, Lee I, Kim S, et al. Improved functionality of soft soybean curd containing Monascus fermented soybean ethanol extract[J]. Food Science and Biotechnology, 2012, 21(3): 701-707[3]Lee C L, Pan T M. Development of Monascus fermentation technology for high hypolipidemic effect[J]. Applied Microbiology and Biotechnology, 2012, 94(6):1449-1459
[4]Lin Y L,Wang T H,Lee M H,et al.Biologically active components and nutraceuticals in the Monascus-fermented rice:a review[J].Applied Microbiology and Biotechnology,2008,77(5):965-973
[5]Mohan Kumari H P,Akhilender Naidu K,Vishwanatha S,et al.Safety evaluation of Monascus purpureus red mould rice in albino rats[J].Food and Chemical Toxicology,2009,47(8):1739-1746
[6]Pattanagul P,Pinthong R,Phianmongkhol A,et al.Review of angkak production (Monascus purpureus)[J].Chiang Mai Journal of Science,2007,34(3):319-328
[7]Wua T S,Yang J J,Yub F Y,et al.Evaluation of nephrotoxic effects of mycotoxins,citrinin and patulin,on zebrafish(Danio rerio)embryos[J].Food and Chemical Toxicology,2012,50(12):4398-4404
[8]Han Q Q,Yu L B,Guo Y Q,et al.Toxic effects of citrinin on the male reproductive system in mice[J].Experimental and Toxicologic Pathology,2012,64(5):465-469
[9]Islam Mohammad Rafiqul,Roh Yoon-Seok,Cho Ara,et al.Immune modulatory effects of the foodborne contaminant citrinin in mice[J].Food and Chemical Toxicology 2012,50(10):3537-3547
[10]Lee C I,Hwang J F.Monascus-fermented red mold rice exhibits cytotoxic effect and induces apoptosis on human breast cancer cells[J].Applied Microbiology and Biotechnology,2013,97(3):1269-1278
[11]丁海泉, 卢启鹏. 近红外光谱技术在土壤养分分析中的研究进展及应用前景[J]. 光谱学与光谱分析, 2012, 32(1): 88-91 Ding Haiquan, Lu Qipeng. Research progress and application prospect of near infrared spectroscopy in soil nutrition analysis[J]. Spectroscopy and Spectral Analysis, 2012, 32(1): 88-91
[12]Cozzolino D. Use of near infrared spectroscopy(NIRS)to analyse animal feeds[J]. Agrociencia, 2002, 6: 25-32
[13]钱慧敏, 陈海燕, 王旻, 等. 近红外标记技术在生物医药领域的应用[J]. 药物生物技术, 2006, 13(4): 306-309 Qian Huimin, Chen Haiyan, Wang Min, et al. The near-infrared labeling conjugates and their application in biopharmaceutics[J]. Pharmaceutical Biotechnology, 2006, 13(4): 306-309
[14]Nicolaï B M, Beullensa K, Bobelyna E, et al. Nondestructive measurement of fruit and vegetable quality by means of NIR spectroscopy: a review[J]. Postharvest Biology and Technology, 2007, 46(2): 99-118
[15]王田子, 郑丽敏, 田立军, 等. 近红外在乳及乳制品质量检测中的研究进展[J]. 光谱学与光谱分析, 2010, 30(12): 3208-3212 Wang Tianzi, Zheng Limin, Tian Lijun, et al. Analysis of milk and dairy products by near-infrared spectroscopy: a review[J]. Spectroscopy and Spectral Analysis, 2010, 30(12): 3208-3212
[16]徐霞, 成芳, 应义斌. 近红外光谱技术在肉品检测中的应用和研究进展[J]. 光谱学与光谱分析, 2009, 29(7): 1876-1880 Xu Xia, Cheng Fang, Ying Yibin. Application and recent development of research on near-infrared spectroscopy for meat quality evaluation[J]. Spectroscopy and Spectral Analysis, 2009, 29(7): 1876-1880
[17]张晓伟, 王加华, 王昌禄, 等. 基于近红外光谱技术检测红曲米中的红曲色素含量[J]. 现代食品科技, 2014, 30(5):273-279 Zhang Xiaowei, Wang Jiahua, Wang Changlu, et al. Determination of monascus pigments inred yeast rice using near infrared spectroscopy (NIR). Modern Food Science and Technology , 2014, 30(5):273-279
Rapid Determination of Citrinin, Starch and Moisture Content in Red Yeast Rice
Zhang Xiaowei Wang Jiahua Li Peirui
(College of Food Science and Engineering, Xuchang University1, Xuchang 461000)
Prediction models about the rapid determination of citrinin, starch, and moisture content in red yeast rice was built using Near Infrared Spectroscopy (NIR). Principal component regression (PCR), partial least squares (PLS) and Stepwise multiple linear regression (SMLR) were used to develop the prediction model, and correlation coefficient (R), ratio of prediction to deviation (RPD), root mean square error of predication (RMSEP) and root mean square error of calibration (RMSEC) were suggested to evaluate the performance of models. The results showed that MSC, SNV could eliminate spectral scattering causing by uneven red yeast rice parcels. Derivative treatment could eliminate the baseline drift. For moisture content, only PLS and PCR models were available for accurate quantitative determination (RPD were 2.45 and 2.81). For starch, only SMLR model can be used accurate quantitative determination (RPD were 2.58). For citrin, RPD value of the three models were less than two, so it could not be used to accurate quantitative determination, but could be used to qualitative analysis or classification. The studies had shown that near-infrared spectroscopy technology has the potential beneficial for measure eitrinin, stach and moisture content in red yeast rice online and is conducive to intelligent quality control of red yeast rice.
NIR, citrinin, starch, moisture, prediction model
河南省教育厅科技攻关项目(13B180242),河南省高等学校重点科研项目(16A550005),许昌学院重点科研项目(2016080)
2015-10-05
张晓伟,男,1982年出生,博士,食品微生物。
王加华,男,1979年出生,博士,农产品无损检测
TS201.3
A
1003-0174(2017)06-0152-07
