利用鱼油制备甘油二酯的研究
2017-07-19童记强黄惠莉
童记强 黄惠莉 汪 泳 梁 芮
(华侨大学化工学院1,厦门 361021)(惠安瑞芳食品有限公司2,泉州 362131)
利用鱼油制备甘油二酯的研究
童记强1黄惠莉1汪 泳2梁 芮1
(华侨大学化工学院1,厦门 361021)(惠安瑞芳食品有限公司2,泉州 362131)
以鱼油为原料,研究了各因素对甘油二酯含量的影响。在无溶剂体系中,采用固定化脂肪酶Lipozyme RM IM甘油解法合成甘油二酯,考察反应温度、底物摩尔比(甘油:粗鱼油)、酶添加量、反应时间对甘油二酯含量的影响。通过响应面设计优化试验条件,确定最佳合成条件为:反应温度50 ℃、酶添加量为底物总质量0.7%、底物摩尔比(甘油:粗鱼油)为2.3∶1、反应时间6 h,甘油二酯质量分数达到48.07%。通过对比粗鱼油与甘油二酯的脂肪酸含量及组成,发现鱼油甘油二酯既可以较好地保持鱼油脂肪酸的组成优势,又可同时具有甘油二酯的特殊营养学特性。
鱼油 甘油二酯 甘油解法 脂肪酸
甘油二酯(DAG)是一种新型的功能性油脂,具有防止肥胖、降低餐后血脂含量、防治高血脂、高血压、心脑血管病等多项生理活性和功能[1-2]。甘油二酯与普通食用油在口感、外观以及脂肪酸组成上基本相同[3-4],富含甘油二酯的产品已被美国食品及药物管理局(FDA)批准为公认安全物质(GRAS)。甘油二酯作为一类多功能添加剂,在食品、医药和化工等领域有着广泛的应用[5]。
目前市场上甘油二酯食用油主要是以菜籽油、大豆油、棕榈油、橄榄油和花生油等甘油三酯(TAG)型油脂制备而来[6-11],以鱼油为原料制备而成的甘油二酯还鲜有报道[12-15]。Kuroki等[16]研究表明,富含二十碳五烯酸 (EPA)的DAG能降低血糖水平,有可能作为防止与糖尿病相关的血管并发症的临床试剂;Eom等[17]的研究发现富含n-3 多不饱和脂肪酸(PUFA)的DAG可以有效地防止小鼠增重。因此,富含n-3 PUFA的DAG同时具备甘油二酯与n-3 PUFA的有益之处,不仅可以替代TAG食用油作为健康人群的保健用油,也可以用于肥胖人群以及相关并发症人群的营养治疗[15]。目前甘油解反应合成甘油二酯所用催化剂一般有化学催化剂(如:氢氧化钠、乙醇钠、氧化镁)和脂肪酶(常用的有Novozym 435、Lipozyme RM IM、Lipozyme TL IM),采用化学催化剂的工艺简单,但是对环境不友好,而且副产物多,后期纯化成本高。利用酶催化制备甘油二酯,反应条件温和,能量消耗少,对环境友好,得到产物的颜色、风味、口感等均具有良好品质。
本研究以粗鱼油为原料,用Lipozyme RM IM脂肪酶作为催化剂,在无溶剂体系中甘油解法合成甘油二酯,在分析各反应因素对甘油二酯含量影响的基础上,利用响应面试验设计获得甘油二酯最佳制备工艺条件,为提高鱼类加工副产品的附加值提供技术支撑。
1 材料与方法
1.1 材料和仪器
粗鱼油:厦门台迈生物科技有限公司;油酸甘油单酯标准品、油酸甘油二酯标准品、油酸甘油三酯标准品:美国SIGMA公司;固定化脂肪酶Lipozyme RM IM:丹麦诺维信公司。
LC solution 15C高效液相色谱仪:日本岛津公司;RID检测器:色谱柱Sepax Bio-C18(4.6 mm×250 mm,5 μm);GCMC-QP 2010 Plus气相质谱联用仪:日本岛津公司。
1.2 试验方法
1.2.1 固定化脂肪酶Lipozyme RM IM催化鱼油甘油解反应
准确称取一定底物摩尔比的甘油和鱼油于100 mL烧杯中,将烧杯置于恒温磁力搅拌器上预热到一定温度的水浴体系中,搅拌速度为150 r/min,并加入一定量的固定化脂肪酶Lipozyme RM IM,反应一段时间后,将反应产物在8 000 r/min下离心5 min,除去固定化脂肪酶,取上层油样低温保存备用。
1.2.2 高效液相色谱法检测
取30 mg甘油二酯样品,用1 mL乙腈∶异丙醇(60∶40,V/V)溶解,进行高效液相色谱检测其甘油二酯含量。色谱条件:流动相为乙腈∶异丙醇(V/V)为60∶40;采用等浓度梯度洗脱,柱温40 ℃,流速0.8 mL/min,洗脱时间为37 min;进样量20 μL。
以样品峰的保留时间与油酸甘油酯标准品的保留时间定性,按峰面积归一法计算甘油二酯和甘油三酯的含量。
1.2.3 气质联用测脂肪酸组成
样品甲酯化[18]:取2滴样品于10 mL试管,加0.5 mol/L氢氧化钾—甲醇溶液1.0 mL,摇匀,在60 ℃水浴中反应30 min。取出冷却至室温,加入3 mL 14% 硫酸—甲醇溶液,摇匀,60 ℃水浴加热5 min,冷却至室温,加入3 mL正己烷提取上层溶液用于气相色谱分析。
气相色谱条件:色谱柱为Rtx-5Ms,载气为高纯氦(He),柱箱温度100 ℃,进样温度 260 ℃,柱流量2.05 mL/min,分流比30∶1。质谱条件:电离方式EI,离子源温度230 ℃,接口温度250 ℃,质荷比范围:45.00~400.00 m/z,检测器电压:1 kV。升温程序为:120 ℃保持1 min,以10 ℃/min升温到200 ℃,保持5 min,再以10 ℃/min升温到240 ℃,保持5 min。
2 结果与讨论
2.1 单因素试验
2.1.1 酶解温度对甘油二酯的影响
由于甘油很难溶解在油脂中,对合成甘油二酯的反应是不利的,为提高甘油与鱼油的互溶性,促进甘油解反应的进行,可以适当地提高反应温度。但温度过高,则会影响酶的空间结构和构象,从而降低酶活力,所以试验需控制适宜的反应温度。在底物摩尔比(甘油:粗鱼油)为1∶1,加酶量为底物质量的1%,反应时间为10 h的条件下,调节反应温度分别为30、40、50、60、70 ℃时进行试验,考察反应温度对甘油解反应中DAG含量及TAG含量的影响,试验结果如图1所示。
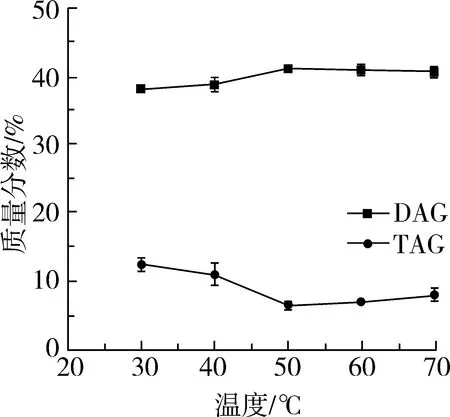
图1 反应温度对DAG含量及TAG含量的影响
由图1可知,反应温度从30~50 ℃时,产物中DAG的含量逐渐增加,TAG含量减少,这是由于升高温度促进了底物之间的互溶,促进甘油解程度的增大,合成产物甘油二酯含量随温度的升高而增大。从50 ~70 ℃,DAG的含量变化不大。当温度在70 ℃,脂肪酶的酶活力还没明显丧失,主要是由于在几乎没有水的反应体系中,由温度升高而引起的酶因受热失活在反应体系中被大大削弱了,这也是非水相酶催化反应的一个显著的优点[19]。随着温度的升高,甘油在反应体系中的溶解度会有很大提高,但是酶长时间处于较高温度下,容易达到酶变性的活化能,酶活性下降。综合考虑底物的互溶性以及酶的活性,故试验适宜反应温度选择为50 ℃。
2.1.2 底物摩尔比对合成甘油二酯的影响
在脂肪酶催化合成反应中,甘油与粗鱼油的比例是决定甘油解产物组成的重要因素,底物摩尔比的改变会影响体系的稳定性及产物的扩散速率与含量。在反应温度为40 ℃,加酶量为底物质量的1%,反应时间为10 h的条件下,调节底物摩尔比(甘油:粗鱼油)分别为1∶2、1∶1、2∶1、3∶1、4∶1时进行试验,考察底物摩尔比对甘油解反应中 DAG含量以及TAG含量的影响,试验结果如图2所示。

图2 底物摩尔比对DAG含量及TAG含量的影响
在底物摩尔比(甘油∶粗鱼油)为1∶2~2∶1范围内,随着底物摩尔比的增加,DAG的含量明显增加。说明当甘油的含量逐渐增加时,促进更多的鱼油甘油解,过量的甘油增加酯化程度,使得反应平衡向产物甘油二酯的方向移动。当甘油和粗鱼油的摩尔比达到2∶1以后,继续增加甘油含量,DAG含量没有明显变化。Eom等[17]研究发现,甘油和金枪鱼鱼油的最佳摩尔比为3∶1,这与本研究结果较为接近。在试验过程中,发现当底物摩尔比达到4∶1时,明显有甘油剩余,因此继续增加的甘油没有参与反应,故最适的底物摩尔比(甘油:粗鱼油)选择2∶1。
2.1.3 加酶量对合成甘油二酯的影响
在无溶剂体系中,脂肪酶的添加量是影响DAG合成率的一个因素。在反应温度为40 ℃,底物摩尔比(甘油∶粗鱼油)为1∶1,反应时间为10 h的条件下,调节固定化脂肪酶Lipozyme RM IM的添加量分别为底物总质量的0.1%、0.5%、1%、2%、3%进行试验,考察加酶量对甘油解反应中DAG含量以及TAG含量的影响,试验结果如图3所示。

图3 加酶量对DAG含量及TAG含量的影响
当加酶量从0.1%加到2%时,TAG质量分数从30.68%下降到了5%。当加酶量超过2%之后,DAG和TAG含量变化不明显。加酶量在0.1%~0.5%范围内,甘油二酯的含量明显增加,这是因为随着脂肪酶用量的增加,甘油解的速度加快,因此甘油二酯含量增加。当加酶量超过1%后,产物中甘油二酯的含量却不断下降,Kristensen等[20]研究发现当加酶量过多时,DAG的含量反而下降,这是因为过量的酶的降低了甘油解的程度,过量的酶可能会导致无规律的混合,从而增加对传质的限制。Duan等[21]认为过量的酶导致生物催化剂结块和可能存在扩散问题,因此酶过量会使得DAG含量下降。当加酶量为2%时,TAG含量最少,但此时的DAG含量却不是很高,综合考虑DAG含量以及经济问题,最适加酶量选择0.5%。
2.1.4 酶解时间对合成甘油二酯的影响
当体系反应时间不同时,底物的甘油解反应程度也不相同,因此反应时间也是影响DAG合成率的因素之一。在反应温度为40 ℃,底物摩尔比(甘油∶粗鱼油)为1∶1,加酶量为底物质量的1%,调节反应时间分别为2、4、6、8、10、12 h进行试验,考察酶解时间对甘油解反应中 DAG含量以及TAG含量的影响,试验结果如图4所示。

图4 反应时间对DAG含量及TAG含量的影响
反应时间在2~6 h范围内,DAG的含量明显增加,TAG含量减少,DAG质量分数达到40.92%。当反应时间超过8 h后,整个反应趋于平衡,TAG的和DAG含量都没有明显变化。这是由于甘油解反应遵循化学平衡反应的规律,反应进行一定时间后即达到平衡,在反应体系达到平衡之后即使再增加反应时间,转化率也不会增加。当反应时间为6 h时,虽然DAG质量分数比较高,但此时TAG的质量分数比较高,为16.06%;10 h时TAG质量分数最少,仅有8.02%。但是反应时间越长,试验的能耗越大,故在合理范围内应尽量缩短反应时间。因此综合考虑DAG以及TAG的含量问题,最适反应时间选择8 h。
2.2 响应面设计方案及结果
根据单因素试验的试验结果,选取反应时间、反应温度、底物摩尔比(甘油∶粗鱼油)、加酶量4个影响因素为自变量,以反应产物中DAG的含量作为响应值,根据Box-Behnken中心组合试验设计原理,运用Design Expert 8.0进行响应面设计。+1、0、-1分别代表四因素的高、中、低水平,设计响应面因子及水平如表1所示,试验设计及试验结果如表2所示。

表1 响应面因子和水平
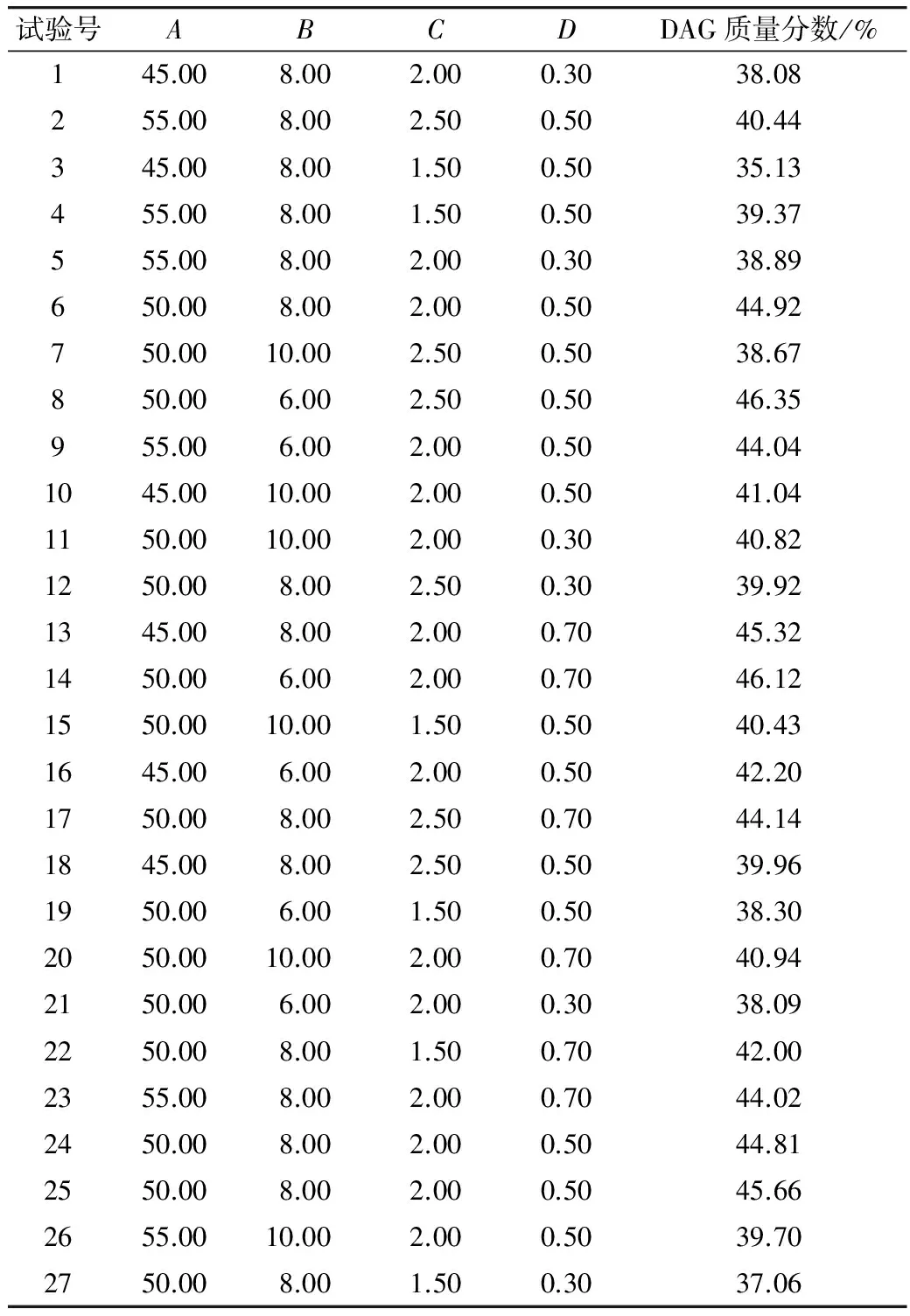
表2 响应面设计及结果
对表2的试验数据进行回归分析,得DAG含量的二次回归方程为:
Y=45.13+0.39A-1.13B+1.43C+2.47D-0.79AB-0.94AC-0.53AD-2.45BC-1.98BD-0.18CD-2.42A2-1.35B2-3.22C2-1.52D2
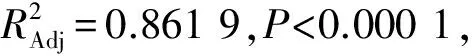
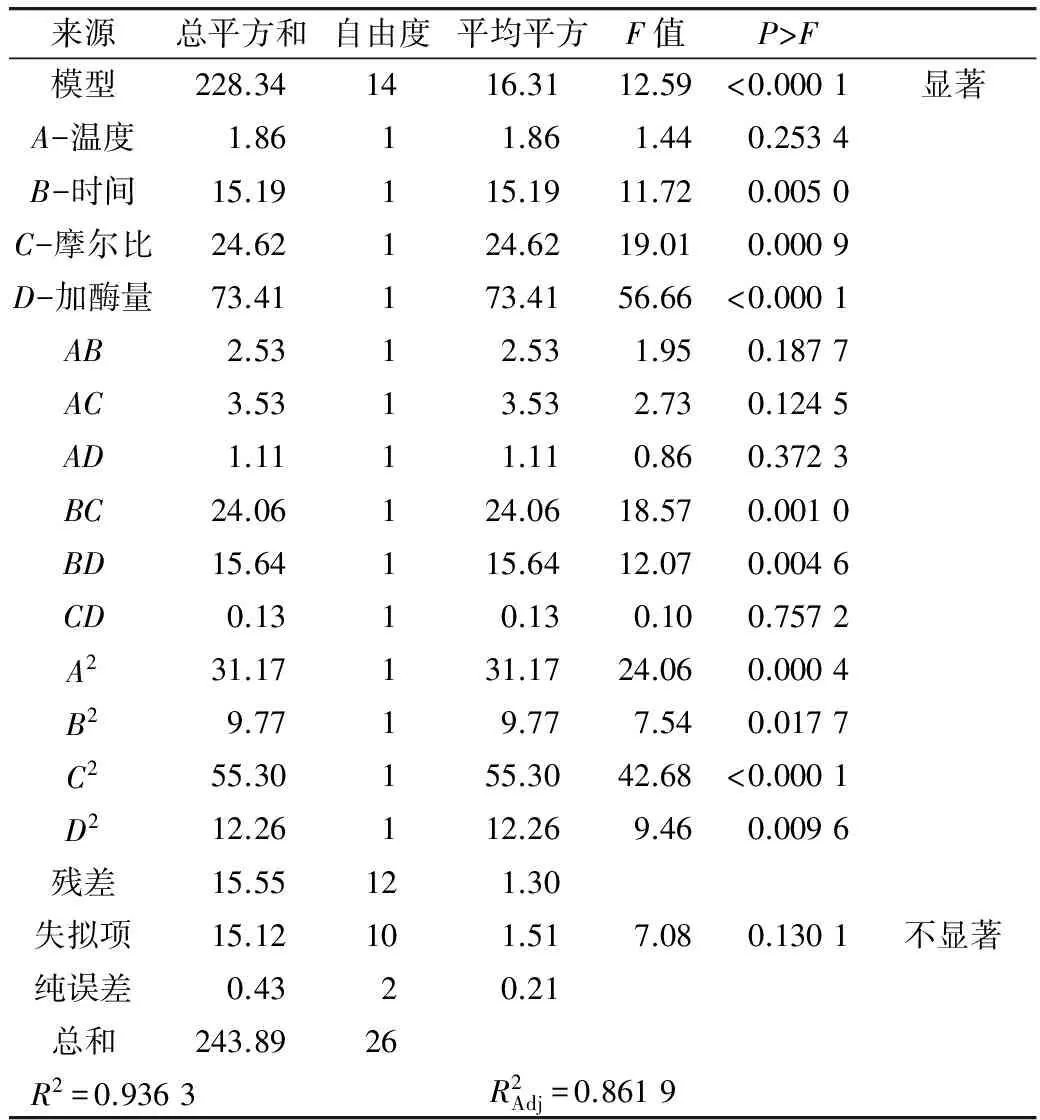
表3 回归模型方差分析表
2.3 最佳条件预测与验证
根据Box-Behnken方法分析,得到甘油二酯含量最佳反应条件为:反应温度50.13 ℃、脂肪酶添加量0.7%、底物摩尔比(甘油:粗鱼油)为2.29∶1、时间6.00 h,此时DAG质量分数预测值为48.90%。将其最佳反应条件调整为:反应温度50 ℃、脂肪酶添加量为0.7%、底物摩尔比(甘油∶粗鱼油)2.3∶1、时间6 h,在此条件下进行3次平行试验,得到平均值为48.07%,与理论值接近。说明采用响应面优化得到的DAG含量数据可靠,具有预测使用价值。
2.4 甘油酯脂肪酸分析
粗鱼油以及合成后DAG的脂肪酸如表4所示。

表4 粗鱼油及甘油二酯的脂肪酸组成
从表4可看出,鱼油的脂肪酸主要组分为棕榈酸、油酸和棕榈油酸。从粗鱼油与合成的DAG的脂肪酸组成及含量可以看出,二者的种类及含量几乎没有变化,说明通过本试验制备甘油二酯没有破坏其中脂肪酸的组成,合成的鱼油DAG能够保持鱼油原有的脂肪酸组成,这对鱼油DAG的营养价值有重要的意义。
3 结论
本研究在无溶剂体系中,采用甘油解法,用固定化脂肪酶Lipozyme RM IM催化鱼油制备甘油二酯,所得产物采用高效液相分析其甘油二酯含量。通过对影响DAG产率反应温度、底物摩尔比、酶添加量、反应时间的单因素试验考察,结合Box-Behnken方法进行响应面试验设计,确立了甘油解法制备鱼油甘油二酯的最佳工艺条件:反应温度50 ℃、时间6 h、脂肪酶添加量0.7%、底物摩尔比2.3∶1,甘油二酯质量分数为48.27%。通过对比粗鱼油与甘油二酯的脂肪酸含量,发现脂肪酸含量及组成几乎没有变化,因此鱼油甘油二酯既可以较好地保持鱼油脂肪酸的组成优势,又可同时具有DAG的特殊营养学特性,为进一步研究鱼油甘油二酯提供参考,同时也可提高鱼油的附加值。
[1]Saito S, Yamaguchi T, Shoji K, et al. Effect of low concentration of diacylglycerol on mildly postprandial hypertriglyceridemia[J]. Atherosclerosis, 2010, 213(2): 539-544
[2]Zheng M, Huang Q, Huang F, et al. Production of novel “Functional oil” rich in diglycerides and phytosterol esters with “One-pot” enzymatic transesterification[J]. Journal of Agricultural and Food Chemistry, 2014, 62(22): 5142-5148
[3]Morita O, Soni M G. Safety assessment of diacylglycerol oil as an edible oil: A review of the published literature[J]. Food and Chemical Toxicology, 2009, 47(1): 9-21
[4]刘小如,张超,胡蒋宁,等. 酶催化茶油合成甘油二酯工艺及脂肪酸变化[J]. 食品科学,2013, 34(2): 36-41 Liu X R, Zhang C, Hu J N,et al. Lipase-catalyzed synthesis of diacylglycerol from camellia oil and fatty acid profile change[J]. Food Science, 2013, 34(2): 36-41
[5]Guo Z, Sun Y. Solvent-free production of 1,3-diglyceride of CLA: Strategy consideration and protocol design[J]. Food Chemistry, 2007, 100(3): 1076-1084
[6]Daniela V D H, Andreas S, Rolf W, et al. Enzyme-assisted process for DAG synthesis in edible oils[J]. Food Chemistry, 2015, 176: 263-270
[7]Wang W, Li T, Ning Z, et al. Production of extremely pure diacylglycerol from soybean oil by lipase-catalyzed glycerolysis[J]. Enzyme and Microbial Technology, 2011, 49(2): 192-196
[8]Zulkurnain M, Lai O M, Latip R A, et al. The effects of physical refining on the formation of 3-monochloropropane-1,2-diol esters in relation to palm oil minor components[J]. Food Chemistry, 2012, 135(2): 799-805
[9]Craft B D, Nagy K, Seefelder W, et al. Glycidyl esters in refined palm (Elaeisguineensis) oil and related fractions. Part II: Practical recommendations for effective mitigation[J]. Food Chemistry, 2012, 132(1): 73-79
[10]吴克刚,孙敏甜,柴向华. 酶法制备花生油甘油二酯研究[J]. 粮食与油脂,2012(8): 16-19 Wu K G, Su M T, Cai X H, et al.Research on production of diacylglycerol from peanut oil using enzymatic process[J], Cereals & Oils, 2012(8): 16-19
[11]Krueger R L, Valerio A, Balen M, et al. Improvement of mono and diacylglycerol production via enzymatic glycerolysis in tert-butanol system[J]. European Journal of Lipid Science and Technology, 2010, 112(8): 921-927
[12]Miranda K, Baeza-Jiménez R, Noriega-Rodríguez J A, et al. Optimization of structured diacylglycerols production containing ω-3 fatty acids via enzyme-catalysed glycerolysis of fish oil[J]. European Food Research and Technology, 2013, 236(3): 435-440
[13]Feltes M M C, Villeneuve P, Baréa B, et al. Enzymatic production of monoacylglycerols (MAG) and diacylglycerols (DAG) from fish oil in a solvent-free system[J]. Journal of The American Oil Chemists’ Society, 2012, 89(6): 1057-1065
[14]Feltes M M C, Oliveira J V, Treichel H, et al. Assessment of process parameters on the production of diglycerides rich in omega-3 fatty acids through the enzymatic glycerolysis of fish oil[J]. European Food Research and Technology, 2010, 231(5): 701-710
[15]葛玲,姚丽,周志阳,等. 富含n-3多不饱和脂肪酸的甘油二酯制备研究[J]. 食品工业, 2013(10): 107-110 Ge L, Yao L,Zhou Z Y, et al.Study on the production of diglycerides rich in n-3 polyunsaturated fatty acids[J]. The Food Industry, 2013(10): 107-110
[16]Kuroki T, Inoguchi T, Umeda F, et al. Effect of eicosapentaenoic acid on glucose-induced diacylglycerol synthesis in cultured bovine aortic endothelial cells [J]. Biochemical and Biophysical Research Communications, 1998, 247(2): 473-477
[17]Eom T, Kong C, Byun H, et al. Lipase catalytic synthesis of diacylglycerol from tuna oil and its anti-obesity effect in C57BL/6J mice[J]. Process Biochemistry, 2010, 45(5): 738-743
[18]郝苗,金黎明,姜波. 气相色谱法测定鲅鱼脂肪酸的含量[J]. 食品与药品, 2007(10): 22-23 Hao M, Jin L M, Jiang B, et al.Determination of fatty acids in spanish mackerel by capillary gas chromatography[J]. Food and Drug, 2007(10): 22-23
[19]王卫飞. 酶法甘油解合成甘油二酯工艺的研究[D]. 广州:华南理工大学,2012 Wang W F. Study on synthesis of diacylglycerol by Lipase-catalyzed glycerolysis[D]. Guangzhou: South China University of Technology, 2012
[20]Kristensen J B, Xu X B, Mu H. Process optimization using response surface design and pilot plant production of dietary diacylglycerols by lipase-catalyzed glycerolysis[J]. Journal of Agricultural and Food Chemistry, 2005(53): 7056-7066[21]Duan Z, Du W, Liu D. Novozym 435-catalyzed 1,3-diacylglycerol preparation via esterification in t-butanol system[J]. Process Biochemistry, 2010, 45(12): 1923-1927.
The Preparation of Diacylglycerol from Fish Oil
Tong Jiqiang1Huang Huili1Wang Yong2Liang Rui1
(College of Chemical Engineering, Huaqiao University1, Xiamen 361021)(Huian Ruifang Food Co., Ltd.2, Quanzhou 362131)
The fish oil was used as raw material and the influence of various factors on the diacylglycerol content was investigated. An immobilized lipase Lipozyme RM IM glycerinum solution was used to compound diacylglycerol.The influence of reaction temperature, substrate molar ratio (glycerol: fish oil), enzyme dosage and reaction time on diglyceride was investigated. The optimal synthesis condition were determined by response surface design test condition as follows: reaction temperature of 50 ℃, enzyme dosage accounting for 0.7% of total substrate mass, substrate molar ratio (glycerol: fish oil) 2.3∶1,and reaction time of 6 h. Under these conditions, the diacylglycerol mass fraction was 48.07%. Fish oil diacylglycerol could maintain better composition advantage of fish oil fatty acids and also had the special nutritional properties of the diacylglycerol by comparing fatty acid content and composition of crude fish oil and diacylglycerol.
fish oil, diacylglycerol, glycerolysis, fatty acids
福建省科技计划重点项目(2013N0022),泉州市科技计划项目(2016N87)
2015-08-17
童记强,女,1989年出生,硕士,海洋水产资源开发利用
黄惠莉,女,1962年出生,教授,海洋水产资源开发利用
TS255.6
A
1003-0174(2017)04-0081-06
