响应面法优化酶法降低小麦粉致敏性的研究
2017-07-19路雪蕊欧阳伶俐刘蓉蓉李慧静河北农业大学食品科技学院保定071001
路雪蕊 欧阳伶俐 刘 壮 刘蓉蓉 李慧静(河北农业大学食品科技学院,保定 071001)
响应面法优化酶法降低小麦粉致敏性的研究
路雪蕊 欧阳伶俐 刘 壮 刘蓉蓉 李慧静
(河北农业大学食品科技学院,保定 071001)
采用酶联免疫技术分析6种酶制剂处理对小麦粉致敏性的影响,以过敏原含量为指标,筛选出能够降低小麦粉致敏性的酶制剂为菠萝蛋白酶和木瓜蛋白酶,确定了同步酶解路线,通过单因素试验和响应面法优化了酶解工艺参数。结果表明:菠萝蛋白酶和木瓜蛋白酶按酶活比为2∶5复配,料液比6.64%,酶解pH 6.53,酶解温度47.7 ℃,酶解时间2.47 h,加酶量0.395 g/100 g蛋白质,过敏原含量为0.593 μg/g蛋白质,与理论值相差7.8%,致敏性降低了36.1%。因此,中心组合设计响应面法建立酶法降低小麦粉致敏性的模型设计合理,能够预测制备低致敏性小麦粉的过敏原含量。
小麦粉 菠萝蛋白酶 木瓜蛋白酶 过敏原含量 响应面法
小麦是我国主要的粮食作物之一,然而小麦中存在诱发过敏反应的过敏原蛋白,1995年联合国粮农组织(FAO)指出90%的食物过敏反应是因8类食物引起,小麦位列第5[1]。Emmett等[2]与Venter等[3]研究表明,世界上有0.2%~0.9%的成人和0.4%~1.3%的儿童患有小麦过敏。小麦过敏可以引发多种过敏性疾病,如小麦运动激发过敏症、乳糜泻肠炎、职业哮喘、鼻炎、荨麻症等,严重影响过敏患者内脏、呼吸道与皮肤的健康,甚至危及生命[4]。酶法改性是利用酶制剂在温和的条件下使蛋白质进行水解和交联,改变原有蛋白质的线性表位或空间结构,从而影响食物过敏原的致敏性。酶法改性以反应条件温和、高效专一和可控性等优点已应用于牛乳、鸡蛋、花生、大豆、海产品等食品的脱敏技术研究当中[5-9]。目前,酶制剂也作为一类高效的面粉改良剂,在面粉的品质改良方面起着重要作用。尽管国外对小麦过敏方面做了相应的研究,然而我国开展小麦过敏的方面研究鲜有报道,双酶复配同步法酶解小麦粉并对酶解后小麦粉致敏性的相关研究几乎为空白。
本试验以小麦粉为研究对象,采用蛋白酶和非蛋白酶处理小麦粉,以过敏原含量为指标,通过酶联免疫技术分析了酶解后小麦粉致敏性的变化,筛选了有效的降低小麦粉致敏性的酶制剂,探讨了酶解路线,研究了复配酶最适的酶解参数以及采用响应面法优化酶解工艺参数,旨在通过酶法改性食品脱敏技术降低小麦粉的致敏性,改善小麦粉的品质特性和提高食品安全性。
1 材料与方法
1.1 材料与试剂
小麦:邢台市粮食贸易有限公司;菠萝蛋白酶(1 200 000 u/g)、木瓜蛋白酶(3 000 000 u/g):广西南宁庞博生物公司;脂肪酶(10 000 Lu/g)、葡萄糖氧化酶(10 000 GODU/g)、中性蛋白酶(1.5 AU/G):诺维信公司;转谷氨酰胺酶TG-M(1 000 U/g):泰兴一鸣生物制品有限公司;小麦过敏原检测试剂盒:Nippon Meat Packers公司;其他试剂均为分析纯。
1.2 仪器设备
PHS-3C型pH计:上海仪电科学仪器股份有限公司;电热恒温培养箱:天津市泰斯特仪器有限公司;真空冷冻干燥机:新阳速冻设备制造有限公司;酶标仪:Thermo scientific公司;H3018DR离心机:上海知信实验仪器技术有限公司。
1.3 试验方法
1.3.1 小麦粉的酶解反应
称取一定质量的小麦粉,按照料液比加入蒸馏水不断搅拌混匀,调制成浆液,用0.1 mol/L的NaOH溶液或0.1 mol/L HCl调整到酶制剂所需的pH,置于恒温酶解装置中,各种酶最适酶解反应条件见表1。按照酶与底物中所含蛋白的比值,加入酶制剂,开始水解计时。酶解过程中搅拌转速为300 r/min,到达酶解反应时间后,立即将酶解液放入100 ℃沸水浴灭酶5 min,真空冷冻干燥后备用。

表1 不同酶的酶解反应最适条件
1.3.2 酶解路线的确定
同步法:选用菠萝蛋白酶和木瓜蛋白酶按照酶活比2∶5复配,双酶同时加入反应体系,在最适的酶解条件下反应2 h后,立即将酶解液放入100 ℃沸水浴灭酶5 min,其他步骤同1.3.1。
分步法:在最适的酶解条件下,先加入菠萝蛋白酶酶解反应1 h后,立即将酶解液放入100 ℃沸水浴灭酶5 min。再加入木瓜蛋白酶酶解反应1 h后,立即将酶解液放入100 ℃沸水浴灭酶5 min,其他步骤同1.3.1。
1.3.3 双酶复配的影响试验
菠萝蛋白酶和木瓜蛋白酶按照酶活比1∶5、2∶5、4∶5添加,以过敏原含量为测定指标。
1.3.4 中心组合设计响应面法优化双酶复配酶解试验
先将菠萝蛋白酶和木瓜蛋白酶进行复配,确定双酶复配比例为2∶5(按照酶活比)。在料液比、酶解pH、温度、时间、加酶量等单因素对小麦粉过敏原含量影响的基础上,采用Design Expert 8.0.6软件中的中心组合设计五因素五水平的响应面试验,以五因素为自变量对双酶同步法酶解工艺进行优化,以小麦粉过敏原含量为响应值。本试验按五因素五水平实施,共26个处理,其中中心点重复5次。各因素水平试验设计方案见表2。
1.3.5 小麦粉酶解物过敏原含量的测定
酶联免疫法是利用连接到抗体上的酶来检测结合到一起的抗原和抗体;酶催化一种无色的底物(色原体)转化为有色的产物,指示抗原-抗体复合物的存在。本试验采用商业试剂盒夹心式酶联免疫法测定小麦粉过敏原的含量,小麦粉过敏原是抗原。
取1 mg酶处理后的样品于2 mL磷酸盐缓冲溶液中,4 ℃静置48 h,4 ℃ 12 000 g离心5 min,收集上清液,用于ELISA测定,用考马斯亮蓝法[10]测定所取样品中总蛋白质含量。将所需的酶标板在室温下放置20 min,平衡至室温。在酶标板上每孔加入上述样品液10 μL,轻轻振荡混匀,37 ℃孵育30 min。反应完毕,弃溶液,每孔加入250 μL洗涤液,重复洗涤5次,拍干。将生物素标记的抗体溶液按每孔100 μL加入各孔,37 ℃反应30 min,反应完毕,弃去溶液,洗涤5次。然后将辣根过氧化物酶标记的链霉亲和素溶液每孔加入100 μL,37 ℃反应30 min,反应完毕,弃去溶液,洗涤5次。加入底物四甲基联苯胺缓冲溶液和H2O2溶液各50 μL,37 ℃避光孵育15 min显色,加2 mol/L H2SO4终止液,每孔50 μL,在酶标仪上测定450 nm的吸光度值。
1.3.6 数据统计方法
使用SPSS 17.0软件进行方差分析(ANOVA),数据间的差异比较采用Duncan检验,显著水平为P<0.05;采用Design Expert 8.0.6统计分析软件进行响应面分析。
2 结果与分析
2.1 不同酶处理对小麦粉致敏性的影响
由图1可以看出,6种酶处理后的小麦粉致敏性相对空白均有所下降,其中木瓜蛋白酶处理后小麦粉的过敏原含量最低,致敏性降低了13.8%(P<0.05);菠萝蛋白酶次之,致敏性降低了11.2%(P<0.05);其他几种酶降低效果低于这2种酶。故本试验选用菠萝蛋白酶和木瓜蛋白酶进行复配及酶解路线分析,以期达到更佳的脱敏效果。
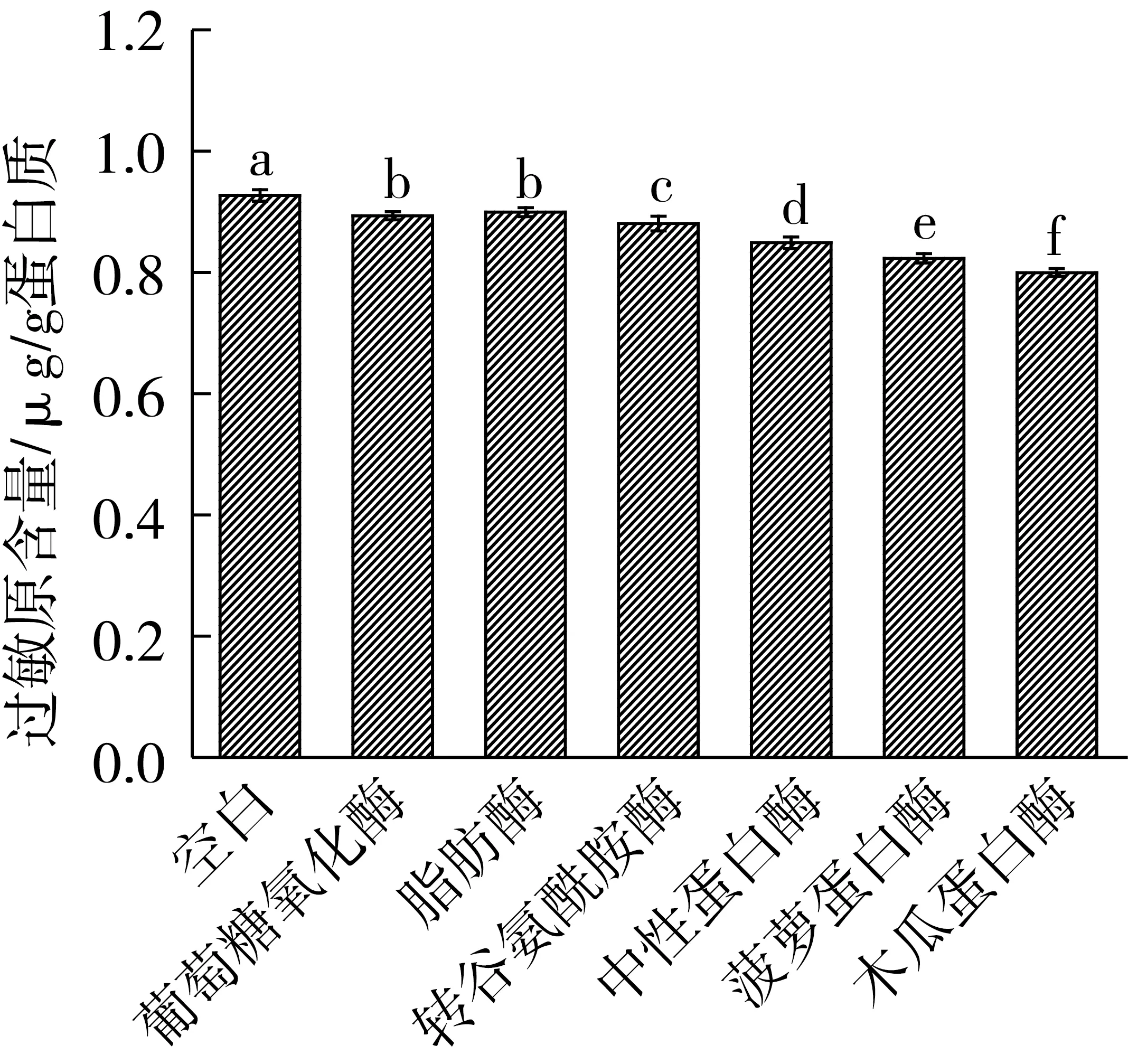
图1 不同酶处理对小麦粉过敏原含量的影响
2.2 酶解路线确定结果
由表3可以看出,同步法酶解路线过敏原含量显著低于分步法。由于分步法酶解路线中间灭酶过程,溶液糊化,导致黏度增加,溶液流动性降低,不利于酶与底物分子充分接触,酶解效率降低;另外所用的2种蛋白酶酶解工艺参数接近,具备同步法酶解路线的条件。因此,选用同步法酶解路线为最佳酶解路线。

表3 酶解路线对小麦粉过敏原含量的影响
2.3 各种因素对双酶复配的影响
2.3.1 温度对双酶复配的影响
称取5 g小麦粉,按照料液比为1∶10配制溶液,酶解条件为:温度45、50、55 ℃,pH 6.65,加酶量按照E/S=1∶100,双酶(菠萝蛋白酶和木瓜蛋白酶)按照酶活比1∶5、2∶5、4∶5添加,酶解2 h。对双酶复配的温度进行选择,以过敏原含量为测定指标,结果如图2所示。

注:同一曲线上不同字母表示差异显著(P<0.05),余同。
图2 温度对双酶复配酶解小麦粉过敏原含量的影响
从图2可以看出,当菠萝蛋白酶和木瓜蛋白酶复配比例为1∶5、2∶5、4∶5时,随着温度的升高,过敏原含量均呈现先下降后上升的趋势。菠萝蛋白酶和木瓜蛋白酶复配比例为1∶5、2∶5、4∶5在酶解温度为50 ℃时,过敏原含量达到最小,分别为0.777 4、0.735 1、0.780 9 μg/g蛋白质。
2.3.2 pH对双酶复配的影响
称取5 g小麦粉,按照料液比为1∶10配制溶液,酶解条件为:温度50 ℃,pH 6.5~6.8,加酶量按照E/S=1∶100,双酶(菠萝蛋白酶和木瓜蛋白酶)按照酶活比1∶5、2∶5、4∶5添加,酶解2 h。对双酶复配的pH进行选择,以过敏原含量为测定指标,结果如图3所示。
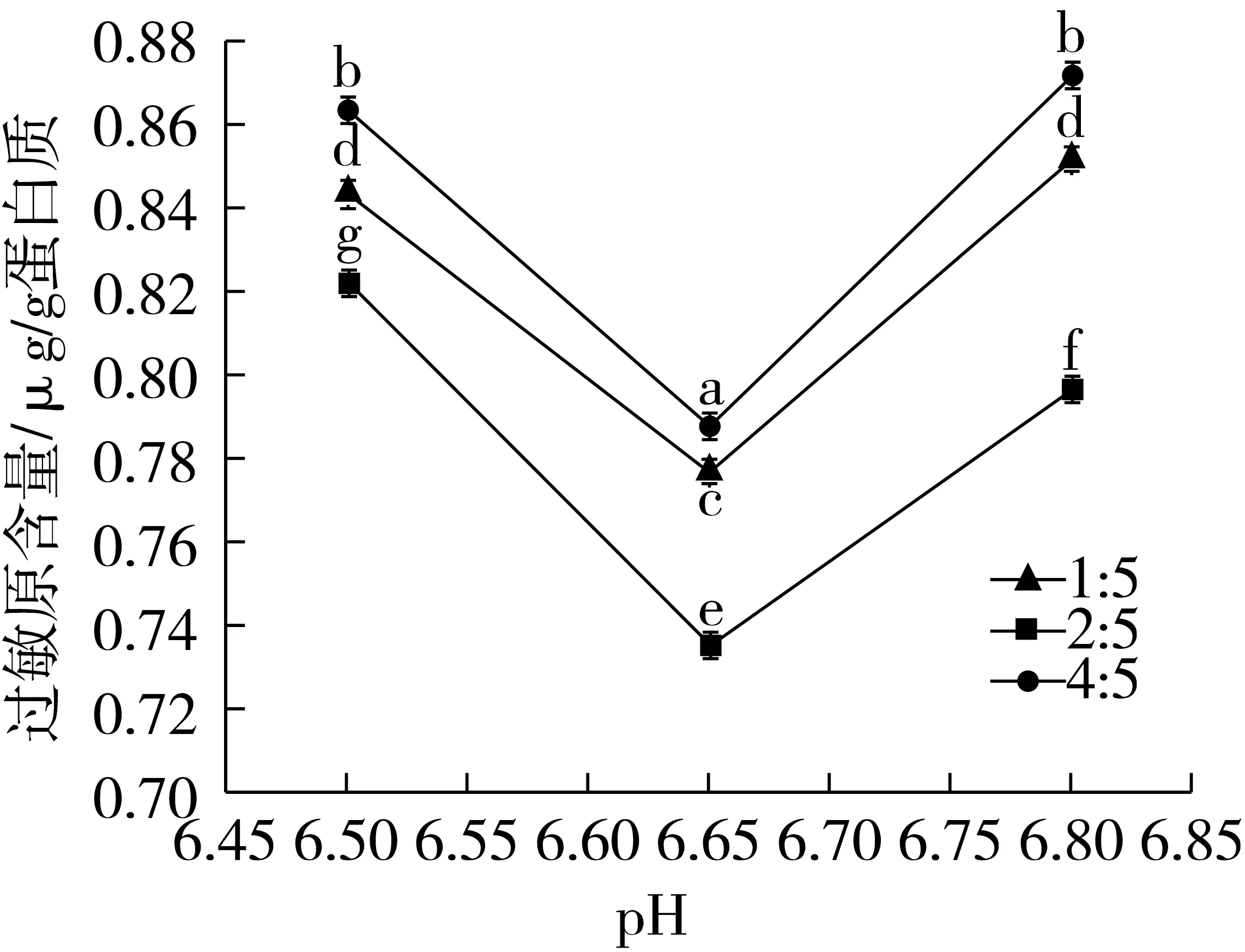
图3 pH对双酶复配酶解小麦粉过敏原含量的影响
从图3可以看出,当菠萝蛋白酶和木瓜蛋白酶复配比例为1∶5、2∶5、4∶5时,随着pH的增大,过敏原的含量均呈现先下降后上升的趋势。但是,当菠萝蛋白酶和木瓜蛋白酶复配比例为2∶5时,pH 6.65,过敏原含量显著低于双酶复配比例1∶5和4∶5。因此,确定菠萝蛋白酶和木瓜蛋白酶复配比例为2∶5,酶解温度为50 ℃,酶解pH为6.65进行试验。
2.3.3 料液比对双酶复配的影响
称取5 g小麦粉,按照料液比为6%、8%、10%、12%配制溶液,酶解条件为:温度50 ℃,pH 6.65,加酶量按照E/S=1∶100,菠萝蛋白酶和木瓜蛋白酶按照酶活比2∶5添加,酶解2 h。对双酶复配2∶5时料液比进行选择,以过敏原含量为测定指标,结果如图4所示。
随着料液比的增大,过敏原含量先下降后升高。当料液比为10%时,过敏原含量达到最低。当料液比低时,溶液流动性好,有利于酶与底物充分接触,有利于酶解反应,过敏原含量降低;当料液比为12%,溶液黏稠,不利于酶与底物充分接触,限制了酶解反应,过敏原含量升高。故选择料液比为10%。
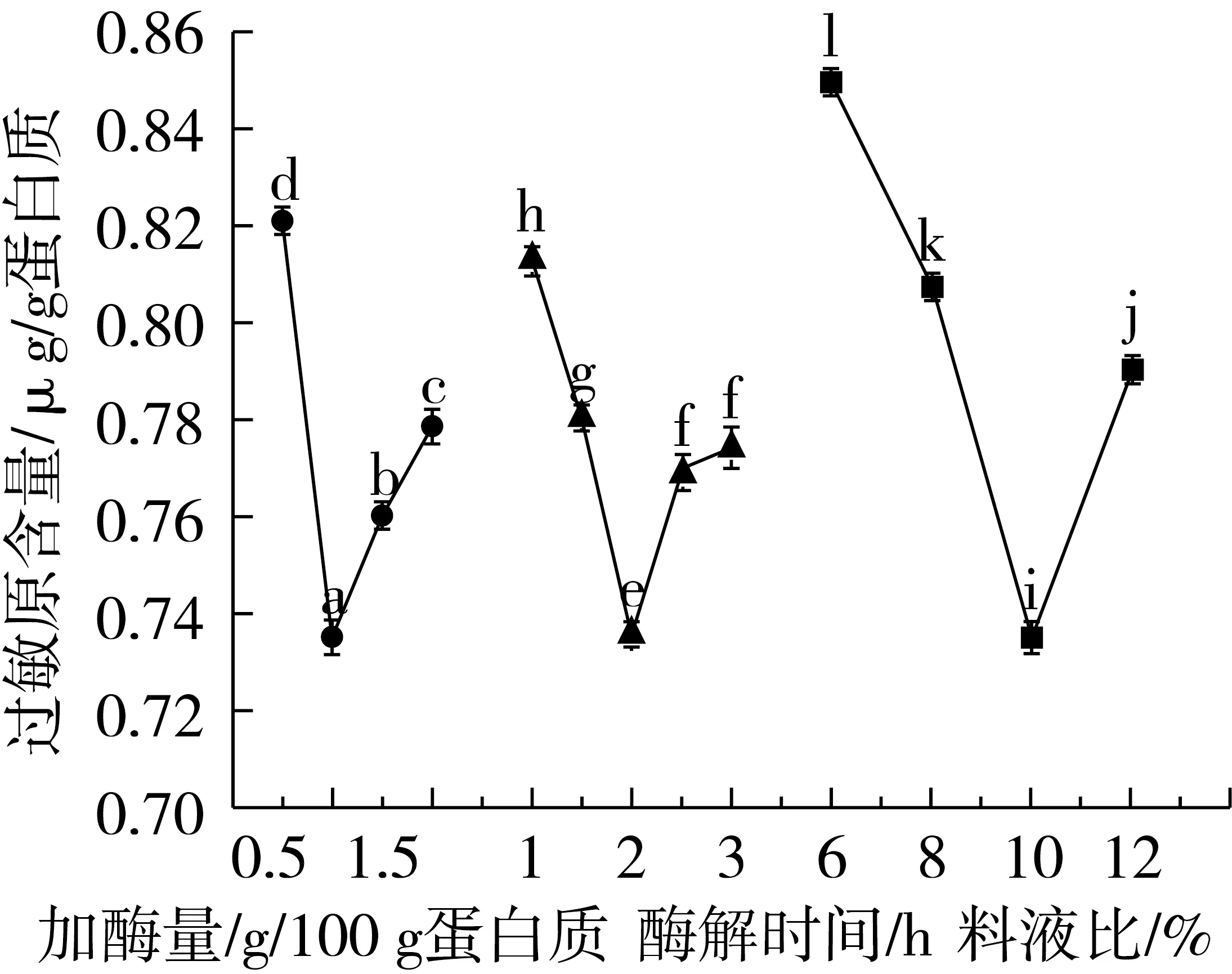
图4 加酶量、酶解时间和料液比对双酶复配酶解小麦粉过敏原含量的影响
2.3.4 酶解时间对双酶复配的影响
称取5 g小麦粉,按照料液比为10%配制溶液,酶解条件为:温度50 ℃,pH 6.65,加酶量按照E/S=1∶100,菠萝蛋白酶和木瓜蛋白酶按照酶活比2∶5添加,酶解1~3 h。对双酶复配2∶5时酶解时间进行选择,以过敏原含量为测定指标,结果如图4所示。
随着酶解时间的延长,过敏原含量呈现先下降后上升趋于平缓的趋势,说明酶解时间的适当延长,可能导致酶的活性增加,使过敏原含量降低;酶解时间的充分延长并不能使小麦粉过敏原完全消除。因此,在上述酶解反应条件下最适的酶解时间是2 h。
2.3.5 加酶量对双酶复配的影响
称取5 g小麦粉,按照料液比为10%配制溶液,酶解条件为:温度50 ℃,pH 6.65,菠萝蛋白酶和木瓜蛋白酶按照酶活比2∶5添加,其中加酶量0.5%~2%,酶解2 h。对双酶复配2∶5时加酶量进行选择,以过敏原含量为测定指标,结果如图4所示。
图4表明,随着加酶量的增加,过敏原含量先下降后缓慢升高。可能是因为加酶量较小时,酶未被底物饱和,酶解反应不够完全,从而过敏原含量较高;当加酶量较大时,酶与底物作用的位点达到饱和,虽继续增加酶量也不会有更多的中间复合物生成,酶分子相互聚集,反而影响酶解效果,同时造成酶资源的浪费。综合考虑,所取加酶量为1 g/100 g蛋白质。
2.4 双酶复配酶解小麦面粉的响应面优化试验
本试验在双酶复配基础之上进行单因素试验,确定了料液比、酶解pH、酶解温度、酶解时间、加酶量等优化条件。采用Design Expert 8.0.6软件中的中心组合设计五因素五水平的响应面试验,优化双酶复配酶解工艺,试验设计方案及结果见表4。

表4 酶解条件优化的响应面设计方案及结果
过敏原含量与料液比、酶解pH、酶解温度、酶解时间、加酶量之间方差分析结果见表5。该数学模型F值10.47(P=0.008 1<0.01),达到了极显著水平。失拟项F值1.81(P=0.249 8>0.05),差异不显著。方差分析结果表明,过敏原含量回归模型的拟合度良好。
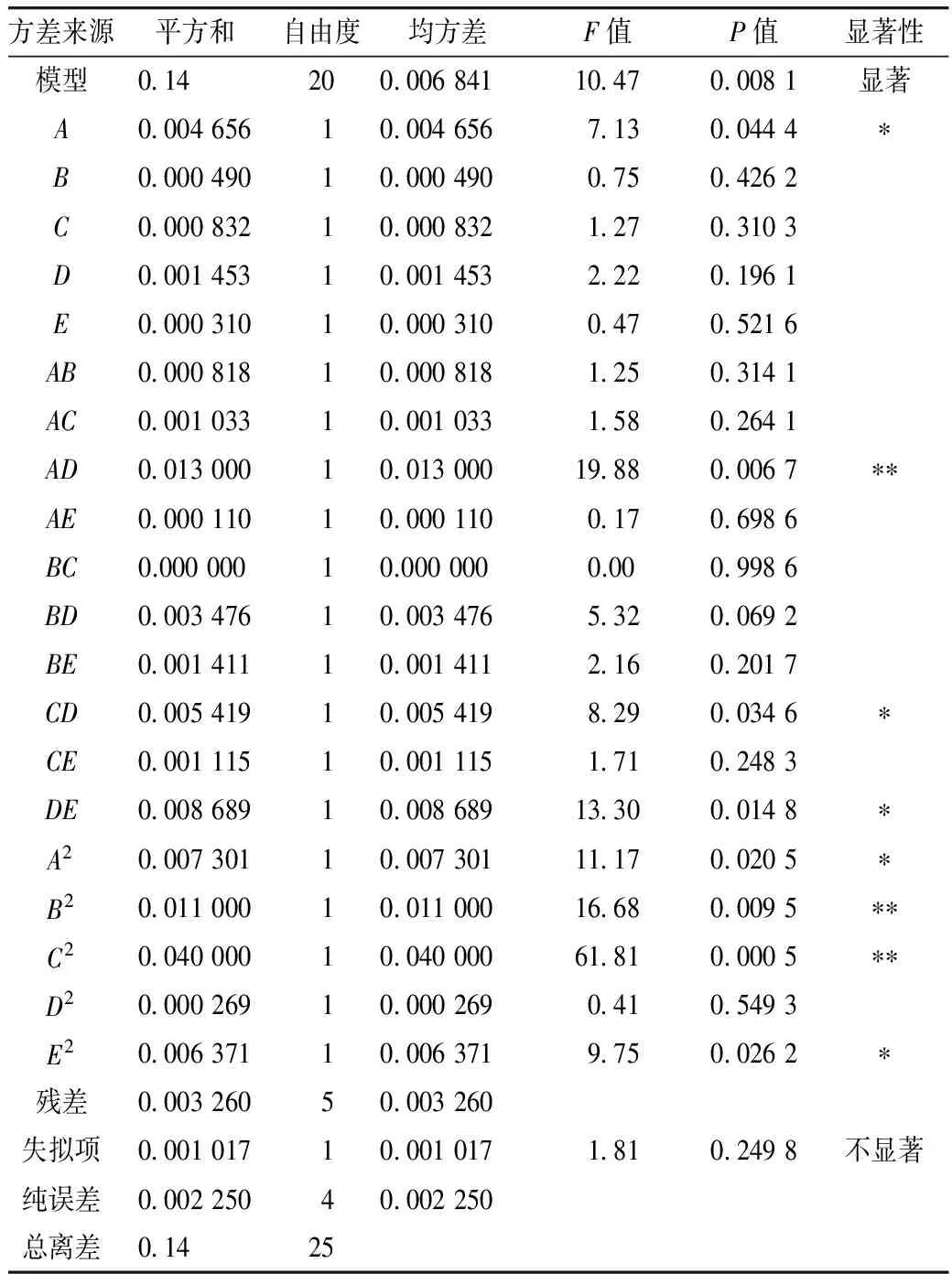
表5 酶法以过敏原含量为响应值的优化方差分析表
注:P<0.05为影响显著,P<0.01为影响极显著。
通过Design Expert 8.0.6统计分析软件对表4中试验数据进行回归拟合。根据方差分析结果,将不显著的的因子去除,得到过敏原含量的回归方程为:
Y=0.743 24+0.026 494A+0.065 186AD+0.042 107CD+0.053 319DE+0.018 769A2+0.022 930B2+0.044 142C2+0.017 533E2
由表5可得,回归模型的一次项A(初始底物浓度,P=0.044 4)影响显著;二次项B2、C2影响极显著,A2、E2影响显著;交互项AD对过敏原含量的影响极显著,表明酶解可能使得过敏原的线性表位暴露,使得其致敏性极显著增加;CD、DE对过敏原含量的影响显著,表明酶解可能使得过敏原的线性表位暴露,使得其致敏性显著增加。从F值可以看出,各个因素对过敏原含量影响的主次顺序为初始底物浓度>酶解时间>酶解温度>酶解pH>加酶量。
2.5 最佳试验条件的确定及验证
在所选的各因素范围内,通过Design Expert 8.0.6统计分析软件对过敏原含量这个评价指标进行条件优化,得出双酶同步法酶解小麦粉的最佳酶解条件为料液比为6.64%,酶解pH为6.53,酶解温度为47.7 ℃,酶解时间为2.47 h,加酶量为0.395g/100 g蛋白质,理论预测值过敏原含量为0.550μg/g蛋白质。在最优条件下进行酶解试验的验证,3次验证试验结果表明过敏原含量为0.593 μg/g蛋白质,与理论预测值相差7.8%,在上述参数下,致敏性降低了36.1%。因此,响应面法优化酶解小麦粉模型设计合理,适用于建立制备低致敏性小麦粉的回归分析及参数优化。
3 讨论
本研究结果表明不同酶处理后的小麦粉过敏原含量不同,其原因是酶与底物作用的位点不同,使得小麦蛋白水解断裂或者交联,改变了原有蛋白质的空间结构,造成了小麦蛋白与抗体识别能力的差异。葡萄糖氧化酶和脂肪酶处理后小麦粉致敏性分别降低了3.6%和3.0%。转谷氨酰胺酶处理后小麦粉致敏性降低了5.0%,而Leszczyńska等[11]采用转谷氨酰胺酶处理小麦粉后,用兔血清测定了产物中谷蛋白的过敏原性,间接ELISA结果表明致敏性降低了30%,与本研究结果不相符,可能是由于本试验测定产物中总蛋白的过敏原。Watanabe等[12]先用纤维素酶混合小麦粉再用链霉蛋白酶处理,从而得到了适合小麦过敏患者的低致敏性的小麦粉。其原理是纤维素酶降解小麦粉碳水化合物,链霉蛋白酶进一步降低小麦粉蛋白过敏原。Watanabe等[12-13]用纤维素酶、链酶蛋白酶处理小麦粉,表明该方法可以有效抑制小麦过敏反应且不产生副作用。Tanabe等[14]采用高专一性水解脯氨酸残基附近肽段的菠萝蛋白酶处理小麦粉,通过水解作用破坏过敏原的线性表位,来降低小麦面筋谷蛋白的致敏性。Ying等[15]研究6种蛋白酶处理小麦粉,测定小麦粉酶解物中醇溶蛋白过敏原,结果表明碱性蛋白酶和木瓜蛋白酶更加有能力的降低小麦粉醇溶蛋白过敏原。但是碱性蛋白酶处理小麦粉,产生苦味物质,不利于低致敏性小麦粉的制备。麦谷蛋白和麦醇溶蛋白是小麦蛋白的主要成分,麦谷蛋白分子质量在80~120 u(高分子质量谷蛋白亚基)和40~80 u(低分子质量谷蛋白亚基),麦醇溶蛋白分子质量在30~80 u,通过菠萝蛋白酶和木瓜蛋白酶协同作用可更有效地降低小麦粉致敏性。国内外鲜见菠萝蛋白酶和木瓜蛋白酶复配同步法酶解小麦粉及酶解后小麦粉致敏性的研究。此外,菠萝蛋白酶和木瓜蛋白酶处理的小麦粉筋力减弱,适用于蛋糕、饼干等食品的制作[16],为开发低致敏小麦制品提供了一个很好的途径。
4 结论
本试验筛选出有效降低小麦粉致敏性的酶制剂为菠萝蛋白酶和木瓜蛋白酶,确定了同步法酶解路线,优化了双酶复配酶解工艺参数,通过响应面分析软件得到了最佳的酶解条件:料液比6.64%,酶解pH 6.53,酶解温度47.7 ℃,酶解时间2.47 h,加酶量0.395 g/100 g蛋白质。在上述最佳条件下酶解得到过敏原含量为0.593 μg/g蛋白质,致敏性显著降低了36.1%(P<0.05)。
[1]甄宇江.食物致敏原与食品安全[M].北京:中国标准出版社,2011 Zhen Y J.Food allergens and food safety[M].Beijing:China Standards Press,2011
[2]Emmett S E,Angus F J,Fry J S,et al.Perceived prevalence of peanut allergy in Great Britain and its association with other atopic conditions and with peanut allergy in other house-hold members[J].Allergy,1999,54(4):380-385
[3]Venter C,Pereira B,Grundy J,et al.Prevalence of sensitization reported and objectively assessed food hypersensitivity amongst six-year-old children:a population-based study[J].Pediatric Allergy and Immunology,2006,17(5):356-363
[4]Susanna S,Prabhasankar P A comparative study of different bio-processing methods for reduction in wheat flour allergens[J].European Food Research and Technology,2011,233:999-1006
[5]Lakshman P L N,Toyokawa Y,Tachibana S,et al.Reducing the antigenicity of milk whey protein using acid proteinases from Monascus pilosus[J].Process Biochemistry,2011,46(3):806-810
[6]毕井辉,汪何雅,钱和,等.不同酶处理对鸡蛋清中卵白蛋白致敏性的影响[J].食品工业科技,2012,33(19):72-75 Bi J H,Wang H Y,Qian H, et al. Effect of enzymatic proteolysis by different enzyme on the antigenicity of ovalbumin in egg white[J].Science and Technology of Food Industry,2012,33(19):72-75
[7]丛艳君,薛文通.降低烘烤花生致敏性的蛋白酶筛选[J].北京工商大学学报,2010,28(5):24-28 Cong Y J,Xue W T.Decreasing the allergenicity of roasted peanut by hydrolysis[J].Journal of Beijing Technology and Business University, 2010,28(5):24-28
[8]李慧静.超高静压协同酶法降低专用大豆分离蛋白致敏性的研究[D].无锡:江南大学,2013:64-81 Li H J.Study about allergenicity reducing of special soy protein isolate by high hydrostatic pressure assisting enzymatic approach[D].Wuxi:Jiangnan University,2013:64-81
[9]张悦,胡志和,谢丹丹,等.高压结合酶法消减南美白对虾虾仁致敏性[J].食品科学,2014,35(04):6-10 Zhang Y,Hu Z H,Xie D D,et al.Reducing allergenicity ofPenaeusvannameishelled fresh shrimp by high static pressure in combination with enzyme treatment[J].Food Science,2014,35(4):6-10
[10]沈丽燕.食品过敏原压电型免疫传感快递检测技术的研究[D].无锡:江南大学,2008:14-16 Shen L Y.Determination of food allergen by Piezoelectric Immunosensor Detecting Assay[D].Wuxi:Jiangnan University,2008:14-16
[11]Leszczyńska J,ącka A,Bryszewska B.The use of transglutaminase in the reduction of immunoreactivity of wheat flour[J].Food and Agricultural Immunology,2006,17(2):105-113
[12]Watanabe M,Watanabe J,Sonoyama K, et al. Novel method for producing hypoallergenic wheat flour by enzymatic fragmentation of the constituent allergens and its application to food processing[J].Bioscience Biotechnology and Biochemistry,2000,64(12):2663-2667
[13]Watanabe J,Tanabe S,Watanabe M, et al.The production of hypoallergenic wheat flour and the analysis of its allergy suppressive effects[J].BioFactors,2004,22(1-4):295-297[14]Tanabe S,Arai S,Watanabe M.Modification of wheat flour with bromelain and baking hypoallergenic bread with added ingredients[J].Bioscience Biotechnology and Biochemistry,1996,60(8):1269-1272
[15]Ying L,Jianmei Y,Ipek G,et al.The potential of papain and alcalase enzymes and process optimizations to reduce allergenic gliadins in wheat flour[J].Food Chemistry,2016,196(1):1338-1345
[16]孔祥珍,周惠明,吴刚.酶在面粉品质改良中的作用[J].粮油食品科技,2003,11(2):4-6 Kong X Z,Zhou H M,Wu G.The effects of enzymes in wheat flour improvement[J].Science and Technology of Cereals,Oils and Foods,2003,11(2):4-6.
Allergenicity Reduction of Wheat Flour by Response Surface Methodology to Optimize Enzymatic Method
Lu Xuerui Ouyang Lingli Liu Zhuang Liu Rongrong Li Huijing
(College of Food Science and Technology,Agricultural University of Hebei,Baoding 071001)
Enzyme-linked immunosorbent assay was adopted to analyze the sensitization of wheat flour treated by six kinds of enzyme preparations.Based on the indexes of the allergen content,bromelain and papain were screened as enzymic preparations to reduce the allergenicity of wheat flour effectively and the synchronization enzymatic hydrolysis route was determined.Single factor experiment and response surface methodology were utilized to optimize enzymatic hydrolysis processing parameters.The results showed that the optimal parameters were as follows:bromelain and papain in enzyme activity ratio of 2∶5,feed liquid ratio of 6.64%,hydrolysis pH of 6.53,hydrolysis temperature of
47.7 ℃,hydrolysis time of 2.47 h,enzyme addition dosage of 0.395 g/100 g protein.Under the above optimal parameters,the allergen content reached to 0.593 μg/g protein,which indicated that there was a 7.8% difference with the theoretical value and the allergenicity was reduced by 36.1%.Therefore,the model design of enzymic method establishment and wheat flour sensitization by response surface methodology of central composite design was a feasible and reasonable mode,which could predict and prepare the allergen content of wheat flour with low sensitization.
wheat flour,bromelain,papain,allergen content,response surface methodology
国家自然科学基金(31171687),河北农业大学中青年骨干教师境外研修项目(201611),河北省食品科学与工程学科“双一流”建设基金项目(2016SPGCA18)
2015-09-28
路雪蕊,女,1989年出生,硕士,粮油深加工与资源开发
李慧静,女,1973年出生,教授,粮油深加工与资源开发
TS201.6
A
1003-0174(2017)04-0018-07
