冷榨花生粕蛋白多肽-亚铁螯合物制备工艺优化及结构分析
2017-07-19李玉珍肖怀秋赵谋明林亲录
李玉珍 肖怀秋, 赵谋明 林亲录
(湖南化工职业技术学院制药与生物工程学院1,株洲 412004)(华南理工大学轻工与食品学院2,广州 510640) (中南林业科技大学食品科学与工程学院3,长沙 410004)
冷榨花生粕蛋白多肽-亚铁螯合物制备工艺优化及结构分析
李玉珍1肖怀秋1,2赵谋明2林亲录3
(湖南化工职业技术学院制药与生物工程学院1,株洲 412004)(华南理工大学轻工与食品学院2,广州 510640) (中南林业科技大学食品科学与工程学院3,长沙 410004)
以酶法水解冷榨花生粕蛋白质粉制备得到的花生多肽液(<3 000 u)为原料,以氯化亚铁为金属螯合剂,在单因素试验基础上,利用Box-Behnken响应面优化技术对多肽-亚铁螯合条件进行优化分析并获得最优螯合工艺参数,即多肽-亚铁质量比为4.31∶1(g/g),螯合温度为25.4 ℃,螯合时间28.5 min和螯合pH 7.5,在此优化条件下,多肽-亚铁螯合率为(85.68±1.27)%(n=3),与模型预测值89.653 1%接近,偏差为4.64%。花生粕蛋白多肽-亚铁螯合物经紫外光谱和红外光谱分析发现,Fe2+与多肽中的NH2+以及COO-形成共价配位键并形成稳定的共轭结构,是一种新型有机金属螯合物。
冷榨花生粕 多肽 多肽-亚铁螯合物 响应面优化
食物来源中的铁元素大部分以高价铁(Fe3+)形式存在,吸收效率低,当以亚铁(Fe2+)形式存在时,生物利用率更高且结构更稳定,易被人体胃肠道消化、吸收和转运。铁元素在蛋白质和酶的合成、物质与能量代谢以及生理免疫等生理过程中发挥重要作用。缺铁严重时会导致缺铁性贫血(IDA)、细胞色素和含铁酶活性降低、供氧不足、电子传递和能量代谢过程紊乱、机体免疫功能下降和生长发育迟缓等生理疾病[1]。20世纪80年代就开始了铁补充剂的研究,但主要以无机铁盐或有机铁盐作为铁补充剂,存在稳定性差、胃肠刺激大、易受到肠内容物干扰、生物利用率低、价格高和存在一定毒副作用等不足[2]。蛋白质经酶法水解获得的多肽片段其一级结构上存在大量键合金属离子的配位基团,与亚铁螯合后,消化吸收率可得到明显改善,且金属螯合肽可利用小肽配位体转运系统进行转运(非金属转运系统吸收),具有转运耗能低、转运速度快和不易被饱和等优点,有利于促进亚铁元素的吸收利用[1, 3]。同时,当金属离子和多肽螯合后能抑制小肠刷状缘细胞上肽酶的水解活性,抑制多肽水解,有助于完整多肽作为金属元素的载体通过小肽转运系统进入肠黏膜细胞,提高金属营养补充剂的稳定性[1]。此外,在胃肠道中金属与多肽配位体结合形成脂溶性的络合物有机表面,借此形式吸收并通过肠黏膜细胞的类脂屏障转运入细胞,可减少金属元素间的拮抗作用[4]。因此,以蛋白多肽为载体螯合金属离子作为金属营养补充剂(或强化剂)成为了当前多肽营养研究的重点和热点,且具有广阔的市场前景和应用潜力。
当前,亚铁蛋白多肽载体主要集中在猪血多肽、乌鸡肽、酪蛋白磷酸肽、米蛋白肽、鱼类蛋白肽等方面,对冷榨花生粕蛋白多肽与亚铁螯合的研究较少[1]。
本试验以酶法水解冷榨花生粕蛋白质粉制备得到的花生粕蛋白多肽液(<3 000 u)为原料,以氯化亚铁为金属螯合剂,在单因素试验基础上,利用Box-Behnken响应面优化技术对多肽-亚铁螯合条件进行优化分析,并利用UV和FT-IR对螯合物结构进行分析,研究结果为花生多肽-亚铁螯合营养补充剂的制备提供理论与技术支持。
1 材料与方法
1.1 材料与试剂
冷榨花生粕蛋白多肽液:自制[5];碱性蛋白酶:Ruitaibio公司;其它试剂均为国产分析纯。
1.2 仪器与设备
LABCONCO冷冻干燥仪:美国labconco公司;HERMLE Z323K冷冻离心机:德国Hermle公司;R508B旋转蒸发仪:国京上海实验室设备有限公司;可见分光度计:上海舜宇恒平仪器有限公司;UV-2500紫外可见分光光度计:日本岛津公司;IRPrestige-21岛津傅里叶变换红外光谱仪:日本岛津公司。
1.3 试验方法
1.3.1 <3 000 u花生粕蛋白多肽液的制备
将制备得到的花生粕蛋白多肽液[5]在0.25 MPa压力条件下依次透过分子质量为5 000 u和3 000 u的超滤膜,收集分子质量<3 000 u的超滤液经旋转蒸发浓缩、冷冻干燥后备用。
1.3.2 花生粕蛋白多肽-亚铁螯合工艺
配制一系列不同蛋白多肽-亚铁质量比的混合液,用0.1 mol/L的NaOH或HCl调节溶液至合适pH,在一定温度下混合反应一定时间,反应完成后用无水乙醇沉淀,离心(2 000 r/min,15 min),收集滤渣,备用。
1.3.3 花生粕蛋白多肽-亚铁螯合条件的优化1.3.3.1 单因素试验
1)蛋白多肽-亚铁质量比对螯合率的影响:将花生粕蛋白多肽与氯化亚铁按预定质量比(0.5∶1~5∶1,g/g)混合,调节pH至7.0,30 ℃反应30 min,无水乙醇沉淀,离心,收集滤渣,测定并计算螯合率。
2)螯合温度对螯合率的影响:将花生粕蛋白多肽与氯化亚铁按质量比4∶1混合,调节pH至7.0,在20~45 ℃下反应30 min,无水乙醇沉淀、离心、收集滤渣,测定并计算螯合率。
3)螯合pH对螯合率的影响:将花生粕蛋白多肽与氯化亚铁按质量比4∶1混合,在pH 3.0~11.0条件下25 ℃反应30 min,无水乙醇沉淀、离心、收集滤渣,测定并计算螯合率。
4)螯合时间对螯合率的影响:按花生粕蛋白多肽与亚铁配比4∶1进行混合,在25 ℃,pH为7.0,反应10~50 min,无水乙醇沉淀、离心、收集滤渣,测定并计算螯合率。
1.3.3.2 响应面优化
在单因素试验基础上,利用Design-Expert 8.0.6的Box-Behnken响应面优化模块进行多肽-亚铁螯合条件优化。试验因素及编码如表1所示。

表1 试验因素水平和编码
注:xi=(Xi-X0)/Δx(xi为自变量编码值,Xi为自变量真实值,X0为中心点处自变量真实值,Δx为自变量变化步长。
1.3.4 花生肽-亚铁螯合率的计算
铁含量测定采用邻菲罗琳比色法[6]。
亚铁螯合率=m1/m0×100%。
式中:m1为螯合物中铁的质量/mg;m0为加入反应体系中的铁质量/mg。
1.3.5 水解度的测定
采取pH-stat[7]法,水解度计算公式为:


式中:B为消耗NaOH的体积/mL;Nb为碱当量;mp为水解使用的冷榨花生粕蛋白粉的质量/g;htot为蛋白质底物中的总肽键数,对于花生蛋白,htot为7.13 meq/g[8];1/α为pH-stat法的校正因子,即α-氨基解离度的倒数。pK为α-氨基的平均解离度,可由Gibbs-Helmholz方程计算,在50 ℃时,1/α为1.13。
1.3.6 多肽-亚铁螯合物结构分析
利用紫外光谱对氯化亚铁、蛋白多肽及蛋白多肽-亚铁螯合物进行紫外扫描并进行结构解析。此外,将蛋白多肽液和蛋白多肽-亚铁螯合物提纯后,除去样品结晶水和游离水,准确称取2 mg放入玛瑙研钵中与干燥光谱纯KBr 200 mg混合研磨均匀(红外灯下进行)、压片并进行红外光谱扫描和结构解析。
2 结果与分析
2.1 单因素试验
考察了多肽-亚铁质量比(0.5∶1~5∶1,g/g)、螯合温度(20~45 ℃)、螯合pH(3.0~11.0)和螯合时间(10~50 min)对螯合率的影响,结果如图1所示。

图1 多肽-亚铁质量比、螯合温度、螯合pH和螯合时间对螯合率的影响
多肽-亚铁质量比是影响螯合率的重要因素。质量比太小,无法形成稳定环状多肽-亚铁螯合结构且稳定性较差,而质量比太大,则反应不完全,易造成多肽浪费。螯合率随多肽-亚铁质量比的增大呈先升后降趋势,当质量比为4∶1时,螯合率达到最大;金属离子配位反应通常为快速反应,反应温度对其影响不大[6]。当螯合温度为25 ℃时螯合率达到最大,温度进一步提高对螯合率影响不大,螯合温度以25 ℃较好,试验结果与蔡冰娜等[6]一致;pH是影响多肽-金属螯合的重要因素,在酸性和碱性条件下均不利于多肽与金属的螯合,主要原因是由于在较低pH条件下,H+与金属离子竞争性争夺供电子基团,降低了多肽-亚铁螯合率,而在碱性环境中,OH-将与供电子基团竞争性的抢夺亚铁离子,易形成氢氧化物沉淀,降低螯合率。pH 7.0左右螯合率相对较高。研究结果与孙莉洁等[9]研究一致;一般金属离子螯合反应为快速反应,反应时间的影响较小[6]。螯合时间达到25 min时,螯合率趋于平缓,继续延长螯合时间,螯合率无明显增加,因此,选择25 min为较优的螯合时间。
2.2 蛋白多肽与亚铁螯合条件的响应面优化
对多肽-亚铁质量比(X1)、螯合温度(X2)、螯合时间(X3)和螯合pH(X4)进行响应面优化分析。试验设计与结果见表2。为减少试验误差,试验次序随机安排。

表2 响应面优化设计与试验结果(含模型预测值)
2.2.1 模型序贯分析与数学模型构建
在方差分析和回归分析基础上进行模型序贯分析(model sequential analysis, MSA)[10]以找寻最优适配模型,结果如表3所示。
由MSA可知,一阶线性模型显著性分析为极显著(P<0.01),失拟项也极显著(P<0.01),表明数据拟合效果较差,需用更高阶数值模型进行数据拟合;二因素交互关系模型失拟项也极显著(P< 0.01),也不宜用来进行数值模拟;二阶模型显著性分析为极显著(P<0.01),失拟项不显著(P>0.05)。因此,用二阶模型对数据进行拟合是可行的。三阶模型显著性分析不显著(P>0.05),失拟项也不显著(P>0.05),用三阶模型进行数值模拟并不合适且三阶模型回归方程较为复杂,应用不便。因此,选择二阶非线性回归方程对表2数据进行回归拟合,拟合得到回归方程为:
y=85.72+11.07x1+2.95x2+5.96x3+5.64x4-2.35x1x2+1.02x1x3-0.85x1x4-7.94x2x3+4.39x2x4+4.01x3x4-17.74x12-7.65x22-10.40x32-9.24x42
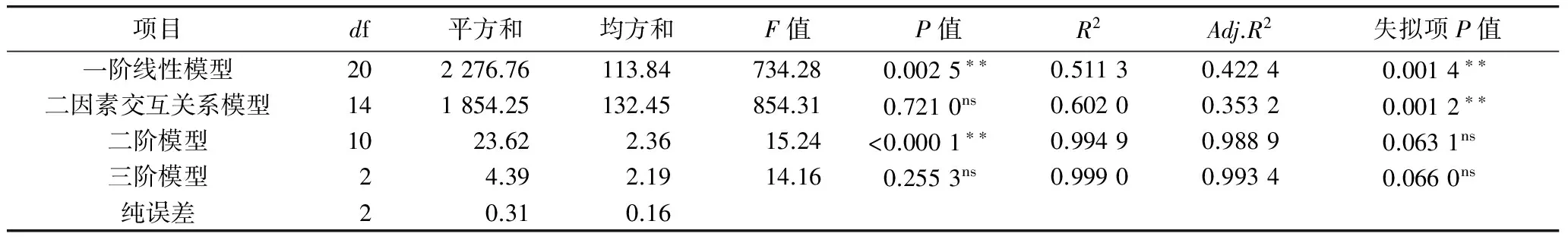
表3 响应面模型构建序贯分析
注:**表示极显著(P<0.01);*表示显著(P<0.05);ns表示不显著(P>0.05),余同。
2.2.2 回归模型方差分析
方差分析表明(表4),回归模型极显著(P<0.01),R2=0.994 9,Adj.R2=0.988 9,表明用该模型进行数值分析是可靠的,能解释98.89%的总变异。模型Adj.R2数值越大,表示模型预测值与实测值间拟合度越好,必须要大于0.80[11]。本模型Adj.R2=0.988 9>0.80,表明模型是可靠的。模型失拟项不显著,表明用此二阶模型进行数值预测不会造成数值模拟的失真。模型变异系数(CV)是衡量模型精密度和可靠性的重要评价指标,数值越小代表模型越可靠,本模型CV为2.15%,表明模型是高度可靠的。通常情况下,可靠模型信躁比(signal to noise ratio, SNR)要求数值要大于4[11]。本模型SNR=42.313>4,表明模型信躁比是合理的。模型各系数项显著性检验发现,一次项X1、X2、X3和X4影响极显著(P<0.01),交互作用项X1X2、X2X3、X2X4和X3X4影响极显著(P<0.01)、X1X3和X1X4影响不显著(P>0.05);二次项X12、X22、X32和X42影响均极显著(P<0.01)。

表4 回归模型方差分析表
2.2.3 响应面优化模型诊断
残差分析是借助图形分析工具并基于模型无法完全解释总变异基础上进行的[11]。开展误差方差齐性检验对于模型诊断是必需的。若预测值内部t化残差分布呈随机散点分布,则残差方差齐性是符合要求的。由图2可看出,模型残差分布呈随机散点分布。残差正态分布也是检验模型准确性的重要工具,若模型残差呈正态概率分布,则残差拟合曲线呈线性[11]。由图3可看出,模型残差分布呈正态分布且相互独立。
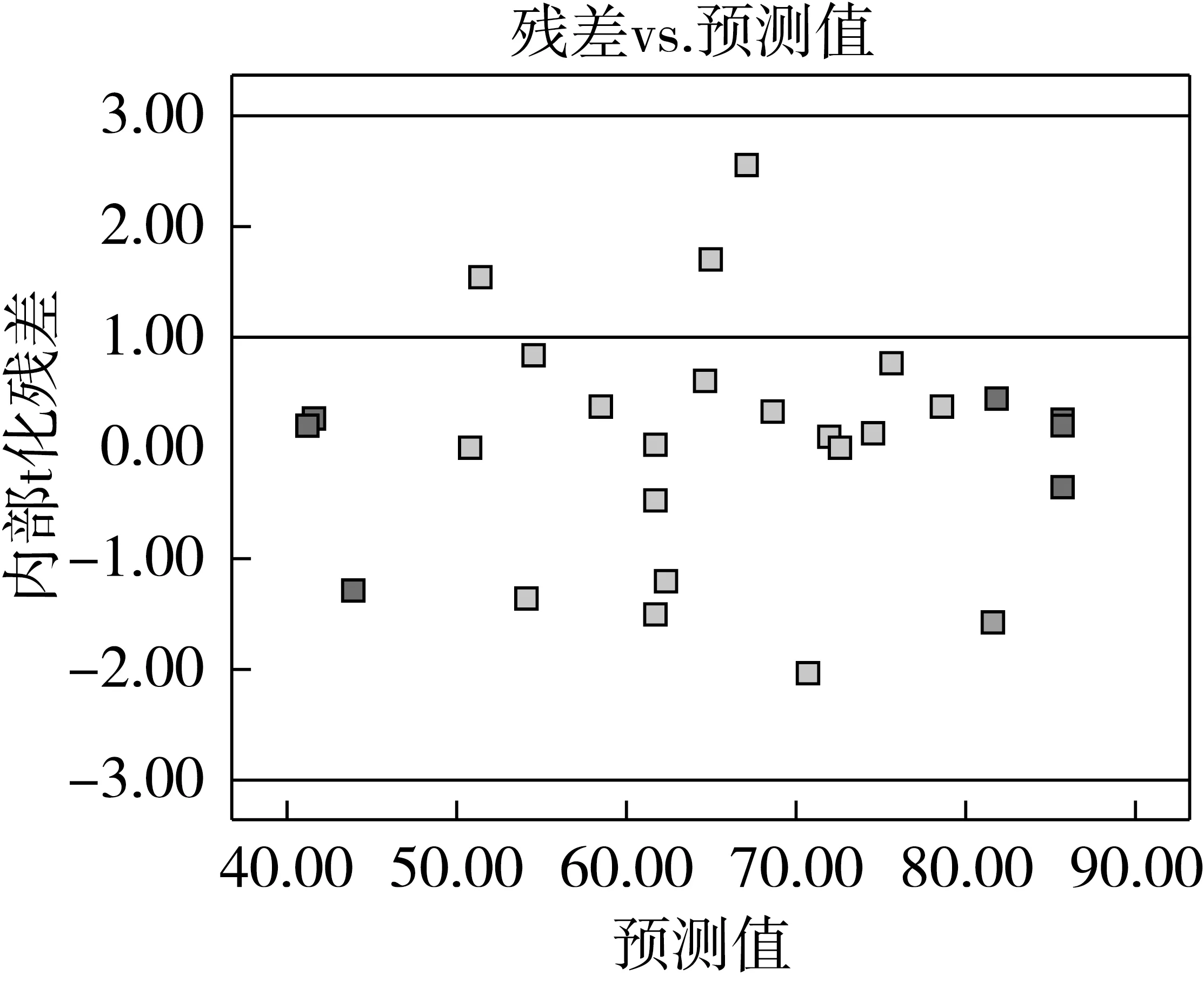
图2 预测值内部t化残差分布图
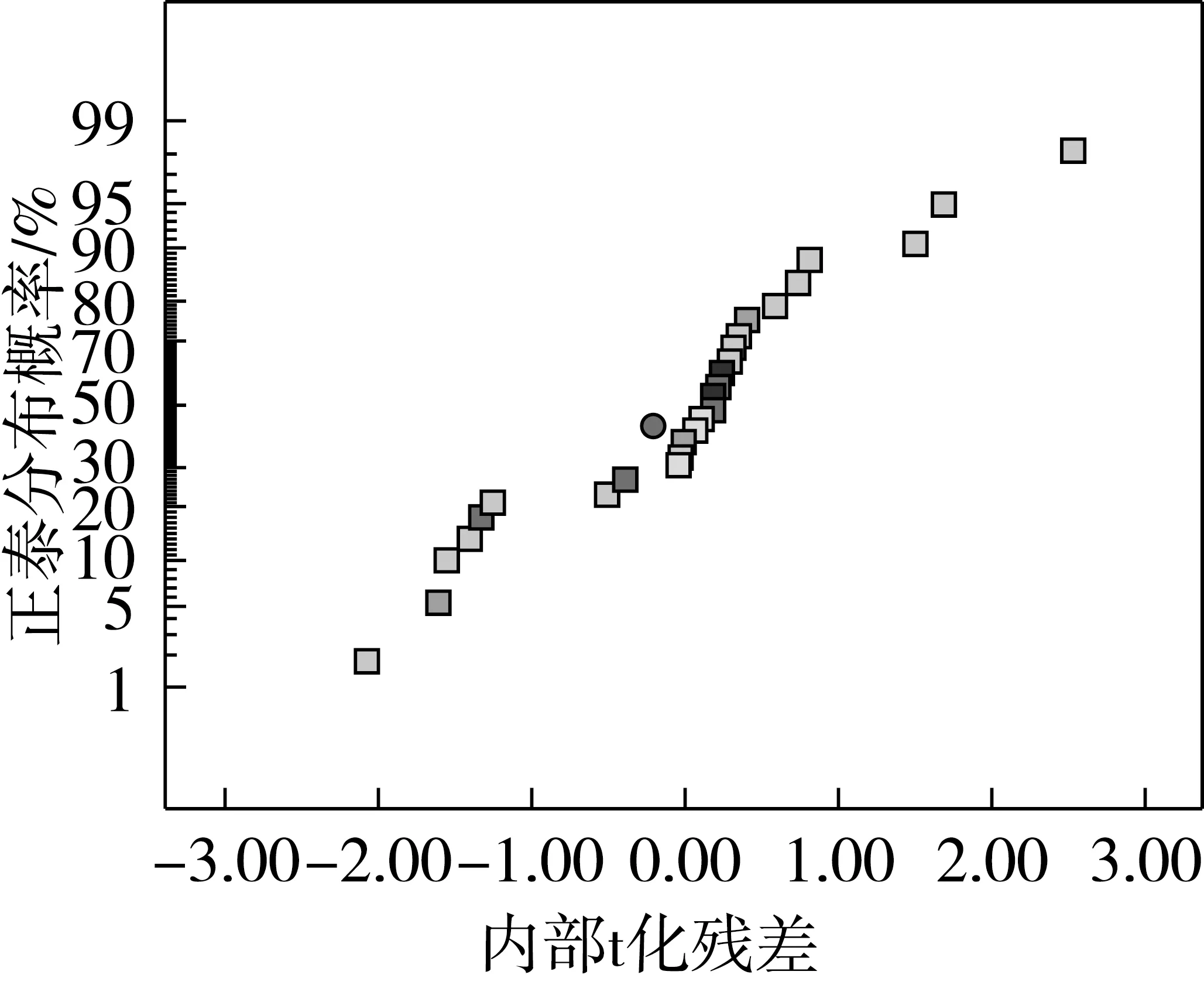
图3 内部t化残差正态分曲线
2.2.4 回归方程求最优解
将回归方程分别对各自变量求偏导并令结果为零,联立可得到方程组,通过规划求解可求出方程组编码水平最优解,即x1=0.308、x2=0.075、x3=0.347和x4=0.385,转换后得到对应因素实际水平,即多肽-亚铁质量比为4.308∶1,螯合温度为25.375 ℃,螯合时间28.47 min和螯合pH为7.385。为应用方便,将优化条件修约为多肽-亚铁质量比为4.31∶1,螯合温度为25.4 ℃,螯合时间28.5 min和螯合pH 7.5。优化条件下验证试验结果为(85.68±1.27)%(n=3),与模型预测值89.653 1%接近,偏差为4.64%。
2.3 多肽-亚铁螯合物的结构分析
为分析花生粕蛋白多肽是否与亚铁离子有效螯合,对氯化亚铁、蛋白多肽和蛋白多肽-亚铁螯合物分别进行紫外扫描。由图4可以看出,氯化亚铁在310 nm区间有吸收峰,未螯合多肽样品在200~400 nm没有明显吸收峰,而多肽-亚铁螯合物在215 nm处明显吸收峰。其原因是由于多肽与亚铁螯合后,使紫外吸收发生了位移,由此可推断,多肽与亚铁进行了有效螯合。
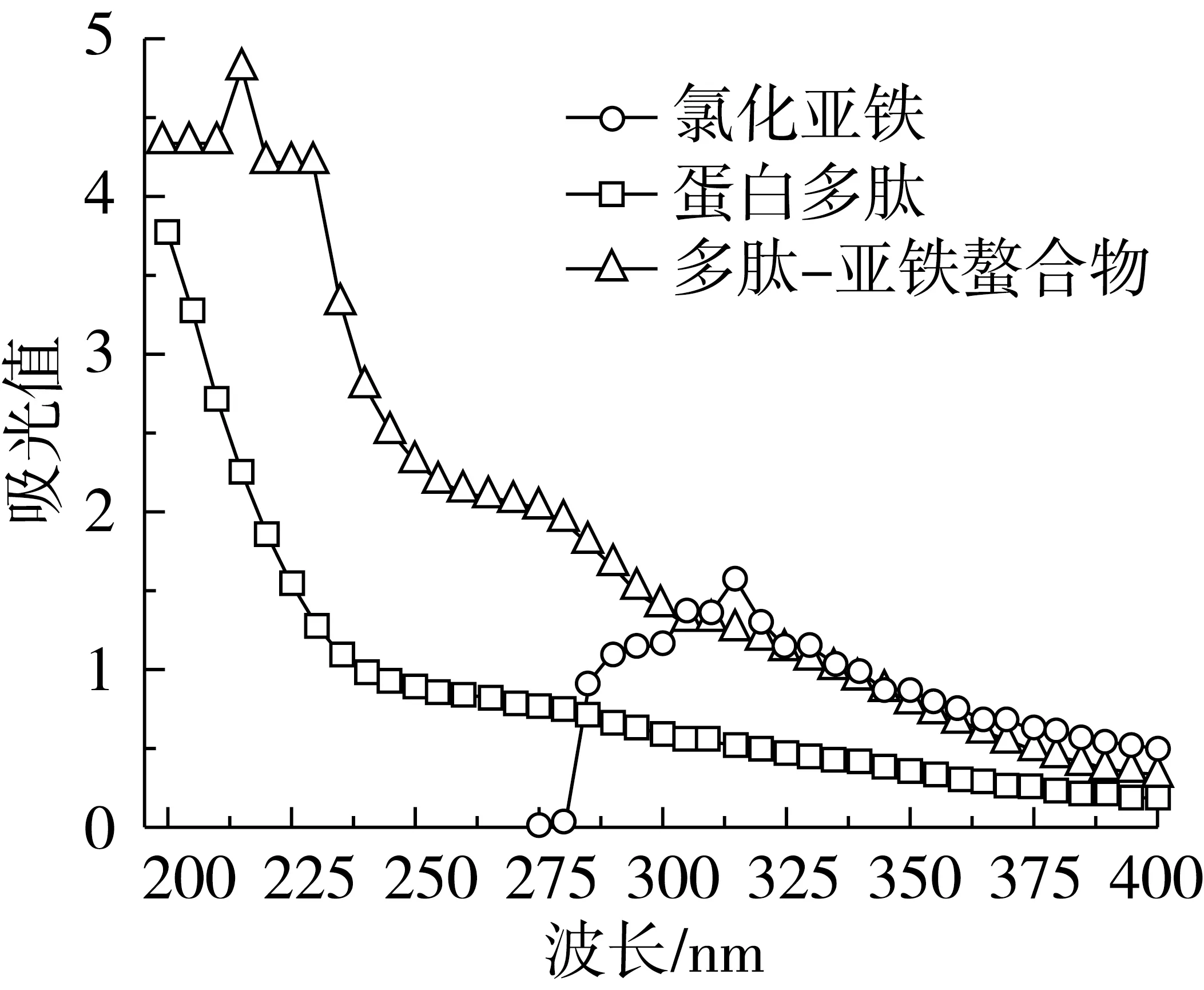
图4 FeCl2、多肽和多肽-亚铁螯合物紫外吸收光谱
对多肽和多肽-亚铁螯合物进行了红外光谱扫描。从图5可看出,多肽与亚铁螯合后,一些主要吸收峰发生明显改变。在花生粕蛋白多肽的红外光谱图的特征区,由于N-H的伸缩振动,-NH2在3 404 cm-1处具有吸收峰[12],当多肽与亚铁螯合后,3 404 cm-1处的-NH2峰消失,而在1 110 cm-1处出现了PtNH2吸收峰,说明,亚铁离子与多肽中的氨基进行了有效结合;此外,在1 654.92 cm-1(Υascoo-)和1 226.73 cm-1(rscoo-)处有2个强的羰基吸收峰,其波数差Δσ为428.19 cm-1,其可能原因是由于花生肽螯合亚铁后,伸缩振动和变角振动等受到了遏制[13],表明螯合物中亚铁离子可能与羰基通过共价配位键形成共轭结构环,由此可以说明,蛋白多肽氨基中的N和羧基中的O参与了与亚铁的金属配位螯合反应。螯合物可能结构如图6所示。
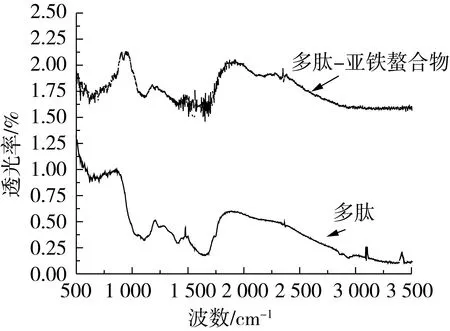
图5 多肽和多肽-Fe2+螯合物红外吸收光谱

图6 多肽-亚铁螯合物可能结构
3 讨论与结论
霍健聪等[14]研究发现,多肽与亚铁离子以环状结构进行螯合,配位螯合可改善螯合环和羰基电子分布,增强其生物学功能。由于花生粕蛋白多肽-亚铁螯合物无水乙醇等有机溶剂中的溶解度极小[15],试验选择水溶液体系进行多肽-金属螯合反应,反应完成后用无水乙醇进行沉淀析出,从而分离得到纯净的多肽-亚铁螯合物。为获得多肽与亚铁最佳螯合参数,利用单因素试验和响应面优化技术对多肽-亚铁螯合工艺参数进行了优化分析并获得了优化条件,即多肽-亚铁质量比为4.31∶1、25.4 ℃、pH 7.5和螯合时间28.5 min,在此优化条件下验证试验结果为(85.68±1.27)%,基本接近模型预测值。紫外光谱和红外光谱分析发现,花生粕蛋白多肽与亚铁有效螯合,Fe2+与花生粕蛋白多肽中的NH2+以及COO-形成共价配位键,形成稳定的多肽-Fe2+配合物共轭结构。
[1]方细娟,曾庆祝,战宇,等.多肽-金属元素配合物的研究进展及发展前景[J].食品工业科技,2012,33(4):413-416 Fang Xijuan,Zeng Qingzhu,Zhan Yu,et al.Review on the development and application of peptide-element complexes[J].Science and Technology of Food Industry,2012,33(4):413-416
[2]Fairweather-Tait S J,Teucher B.Iron and calcium bioavailability of fortified foods and dietary supplements[J]. Nutrition Reviews,2002, 60(11):360-367
[3]黄薇,邓尚贵, 唐艳,等.鳕鱼皮复合肽的制备工艺研究[J].浙江海洋学院学报:自然科学版,2011,30(5):401-404 Huang Wei,Deng Shang Gui,Tang Yan,et al.Preparation conditions of code skin peptides by compound enzyme[J].Journal of Zhejiang Ocean University:Natural Science, 2011, 30(5):401-404
[4]Lin Changjun, Huang Hanchang, Jiang Zhaofeng.Cu(II) interaction with amyloid-beta peptide: a review of neuroactive mechanisms in AD brains[J].Brain Research Bulletin,2010,82(5-6):235-242
[5]肖怀秋,李玉珍,林亲录,等.响应面优化冷榨花生粕酶法制备多肽工艺的研究[J].中国粮油学报,2013,28(9): 50-55 Xiao Huaiqiu,Li Yuzhen,Lin Qinlu,et al. Response surface methodology optimization for peptide preparation from cold pressed peanut meal by enzymatic hydrolysis[J]. Journal of the Chinese Cereals and Oils Association, 2013,28(9):50-55
[6]蔡冰娜,陈忻,潘剑宇,等.响应面法优化鳕鱼皮胶原蛋白肽螯合铁工艺[J].食品科学,2012,33(2):48-52 Cai Bingna,Chen Xin,Pan Jianyu,et al.Optimization of preparation process for cod skin collagen peptide-iron (II) chelate via response surface methodology[J]. Food Science,2012,33(2):48-52
[7]Dong Xinhong, Zhao Mouming, Shi John,et al.Effects of combined high-pressure homogenization and enzymatic treatment on extraction yield, hydrolysis and function properties of peanut proteins[J].Innovative Food Science & Emerging Technologies, 2011,12(4): 478-483
[8]张宇昊,王强.Alcalase酶水解花生蛋白制备花生短肽的研究[J].农业工程学报, 2007,23(4):258-263 Zhang Yuhao,Wang Qiang.Peanut protein hydrolyzing by Alcalase to prepare peanut oligopeptides[J]. Transactions of the CSAE, 2007,23(4):258-263
[9]孙莉洁,梁金钟.响应面法优化大豆肽与钙离子螯合的研究[J].中国粮油学报,2010,25(1):22-27 Sun Lijie,Liang Jinzhong.Optimization of chelation of soybean peptides with calcium using response surface method[J].Journal of the Chinese Cereals and Oils Association, 2010,25(1):22-27
[10]Myers R H, Montgomery D C,Anderson-Cook C M. Response surface methodology: process and product optimization using designed experiments[M]. New York:John Wiley & Sons,2009
[11]Bezerra M A,Santelli R E, Oliveira E P, et al.Response surface methodology (RSM) as a tool for optimization in analytical chemistry[J].Talanta,2008,76(5):965-977
[12]Surewicz W K, Mantsch H H ,Chapman D.Determination of protein secondary structure by Fourier transform infrared spectroscopy: a critical assessment[J].Biochemistry,1993, 32(2):389-394
[13]宋莎莎,高菲,任迪峰,等.乌鸡肽铁(II)螯合物的制备及红外光谱鉴定[J].食品与发酵工业,2013,39(6):13-17 Song Shasha,Gao Fei,Ren Difeng,et al.Preparation and infrared spectrum identification of black-bone silky fowl oligopeptide-iron (II) chelates[J].Food and Fermentation Industries, 2013,39(6):13-17
[14]霍健聪, 邓尚贵,童国忠.鱼蛋白酶水解物亚铁螯合修饰物抑菌特性及机理研究[J].中国食品学报,2010,10 (5):83-89 Huo Jiancong,Deng Shanggui,Tong Guozhong.Studies on antibacterial activity and mechanism of Fe2+chelate modifier of hydrolysate by proteinase fromTrichiurusHaumelaoffal[J].Journal of Chinese Institute of Food Science and Technology, 2010,10 (5):83-89
[15]陈国章,谢超.带鱼下脚料水解螯合物制备及其生物特性研究[J].浙江海洋学院学报:自然科学版,2010,29 (1):49-54 Chen Guozhang,Xie Chao.Studies on the functionality of protein hydrolysates of chelate by enzymolysis from Hairtail Waste[J]. Journal of Zhejiang Ocean University: Natural Science, 2010,29 (1):49-54.
Optimization of Preparation Technology for Cold-Pressed Peanut Meal Albumen Polypeptide-Ferrous Chelator and Structure Analysis
Li Yuzhen1Xiao Huaiqiu1,2Zhao Mouming2Lin Qinlu3
(Pharmaceutical and Bioengineering School, Hunan Chemical Industry and Vocational Technology College1, Zhuzhou 412004)(College of Light Industry and Food science, South China University of Technology2, Guangzhou 510640)(College of Food Science and Engineering,Central South University of Forestry and Technology3,Changsha 410004)
Peanut polypeptide liquid (<3 000 u) that prepared by enzymatic hydrolysis of peanut protein power from cold-pressed peanut meal (CPPM) was raw metarial and the ferrous chloride was metal chelator. The optimal chelate technological parameters was obtained after the the optimized analysis to the polypeptide-ferrous chelator by using Box-Behnken response surface optimization technique based on single factor experiment, ie., polypeptide-ferrous mass ratio was 4.31∶1(g/g),chelating temperature was 25.4 ℃,chelating time was 28.5 min and chelating pH was 7.5. Under the optimization condition, the polypeptide-ferrous chelation rate was (85.68±1.27)% (n=3), which was well agreement with the model predicted value (89.653 1%), and the deviation between the confirmative result and the predicted result was 4.64%. Through ultraviolet spectroscopy (UV) and infrared spectrometer(FT-IR) analysis, peanut meal albumen polypeptide-ferrous chelate was found, the Fe2+and NH2+in the polypeptide and COO-form covalence coordinate bond and form stable conjugated structure, which was a new-type organic metal-chelator.
cold-pressed peanut meal (CPPM), polypeptide, polypeptide-ferrous chelator (PFC), response surface optimization.
湖南省高校科研项目(12C1049),湖南化工职业技术学院院级项目(HNHY2015002),2016年湖南教育厅科学研究项目(16C0550)
2015-09-19
李玉珍,女,1981年出生,硕士,植物蛋白质资源精深加工技术
肖怀秋,男,1981年出生,副教授,植物蛋白多肽及多肽金属营养补充剂
TS202.3
A
1003-0174(2017)04-0064-06
