生物学本科核心课程“生物化学”的结课内容浅析
2017-07-18赵东旭许立新
赵东旭, 许立新
(北京理工大学 生命学院, 北京 100081)
生物学本科核心课程“生物化学”的结课内容浅析
赵东旭, 许立新
(北京理工大学 生命学院, 北京 100081)
课程“生物化学”是生物科学及多种相关学科的核心基础课,内容庞杂。对结课总结的内容进行了梳理,包括生命由基于普通有机化学基团组成的复杂生物大分子和小分子构成,生物大分子的高级结构由低级结构所决定,螺旋结构是生物大分子高级结构的主要基元,高级结构的组建动力源自分子的内在属性,这种内在属性也同时赋予分子间的自组织特征以及生命的“耗散”特征;生物分子结构的复杂程度决定了其功能的复杂程度,生物超分子体系是生物功能的主要载体形式,分子起作用的过程即是分子间相互作用过程或分子识别过程,反应结果及生命过程遵循“蝴蝶效应”;对生命现象本质的理解已进入分子生物学水平。
生物化学;螺旋结构;生物超分子;结构与功能的统一性;分子识别
大学课程“生物化学”是生物科学及相关学科如医学、林学、农学等相关专业最重要的专业基础课,在国外的相关院校,该课也是大学的最重要课程之一,比较受欢迎的教材LehningerPrinciplesofBiochemistry(《生物化学原理》)已再版到第6版(第3版有中译本),Berg、Tymoczko和Stryer 3人编著的Biochemistry(国际版,Palgrave macmillan出版社)已再版到第7版,国内针对不同专业的教材也颇丰。该课程以化学为基础,详细介绍了生物体内的生物分子的组成、基本结构、生物分子间相互作用的机制以及基于相互作用的代谢过程及调节机制,学好并达到融会贯通对于其他课程如“细胞生物学”、“微生物学”、“分子生物学”、“遗传学”等的学习很有帮助。近20年来,每年都有数10篇相关的教学研究和教学改革报道[1-10]。作者给本科生、硕士研究生讲授过“生物化学”或相关课程,也对研究生“高级生物化学”的教学进行了比较深入的思考[11],反过来咀嚼本科生课程“生物化学”的内容时,顿生一些感悟。为此,我们对课程内容进行一次较为系统的宏观性总结以帮助学生从宏观和微观角度理解其内涵。本文从纯化学角度、分子间相互作用及机制、结构与功能的关系和进化等方面进行归纳,并提出要用辩证的、发展的观点理解生物化学的内容。
1 生命体的构建源于化学、高于化学
1.1 从纯化学分子的角度理解生命体的组成
森林由一棵棵的树木构成,树木由不同的系统和组织构成,后者由不同的细胞构成,最高级的生命——人的构成也是如此;细胞则有包括蛋白质、核酸、糖类和脂类等生物大分子和一些生物小分子如单糖、核苷酸、氨基酸、上述小分子的衍生物(如维生素、抗生素等)、无机盐和水构成。进一步从成分的构成方面看,上述生物大分子都由提及的生物小分子等结构单元构成,如单糖构成聚糖或多糖,氨基酸聚合成多肽或蛋白质,核苷酸聚合成寡核苷酸或核酸。而且,这些小分子内的活性基团如羟基、羧基、氨基、巯基、咪唑基、苯环等与普通有机化学中的相关基团一样,同样,成键时也是遵循普通的化学键成键规则。由此,生物分子之间的反应也与最基本的化学基团之间的反应一样,如亲核攻击、亲电子反应、酸碱反应等。这正如诺贝尔奖获得者亚瑟·肯伯格(Arthur Kornberg)1982年10月12日在哈佛大学医学院建校200周年时所说的那样,“所有的生命体都有一个共同的语言,这个语言就是化学”,或者说生物分子只是更复杂的化学分子而已。对生命科学源于化学的另外一个非常贴切的注解是,从1901年的第一届诺贝尔化学奖至今,1/3的工作都是围绕生物大分子所展开的。
1.2 螺旋结构是生物大分子高级结构的主要形式
在构建生物大分子高级结构的过程中,螺旋结构是主要的或典型的构建基元(单元,motif)。如淀粉的螺旋结构、蛋白质二级结构中的α螺旋、DNA二级结构中的双螺旋结构、RNA分子的局部双螺旋结构。现以蛋白质的α螺旋为例进行介绍,由氨基酸分子通过缩水作用形成了多肽链,而多肽链的核心结构是由6个原子(羰基C和O、氨基N和H、两侧的两个α-C)构成的具有一定刚性结构的肽平面。如此多的肽平面如何折叠?按照化学热力学的熵理论,应该是向熵最大或体积最大的方向进行,按照分子结构稳态理念,应该是向体积最小的方向进行,实际情况是,蛋白分子采用基于手性碳原子(α-C)的有限垛叠即借助分子内在属性、有规律地将其体积最小化。在肽平面内α-C原子是手性C原子,所连接的两个肽平面只得以合适的平面夹角(二面角)的形式存在,因而促使了螺旋结构的形成(如图1-A、B所示,仿北京大学医学部刘新文老师的“生物化学”课件)。淀粉的二级结构即螺旋结构的形成过程与此相似。由于生物大分子组成的“简单性”势必造成其二级结构的“单调性”,因此螺旋结构既体现了结构的简单性,更为重要的是也满足了分子在自然环境下的体积最小化需求,也就是满足了分子的最基本或最天然的属性。螺旋结构的形成多是基于手性C原子的四面体结构(在按sp3杂化方式成键时),因此在介绍生物化学的内容时,要首先强调手性C原子的四面体结构或SP杂化理论。
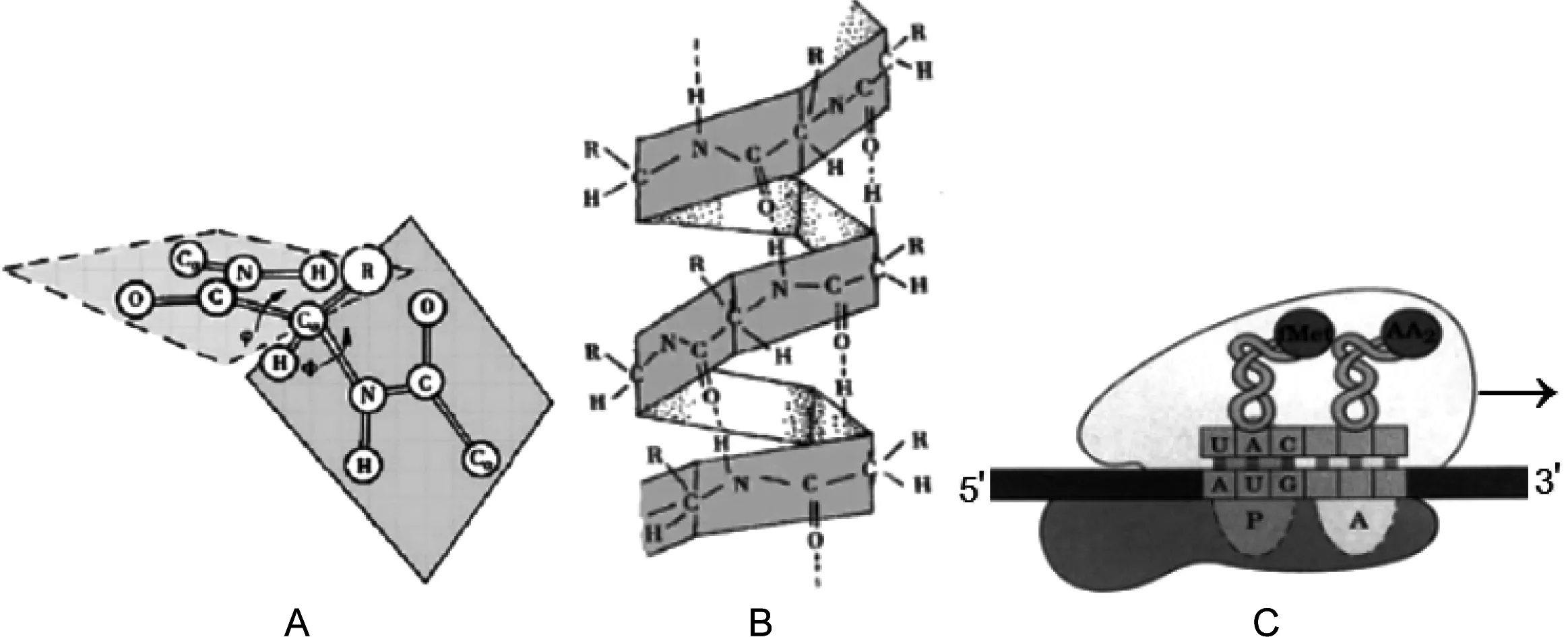
图1 生物大分子的空间结构与方向(仿文献12)
A:两个肽平面;B:多个平面连续折叠成α螺旋;C:mRNA的方向以及与tRNA、核糖体的相对位置。A显示两个各由6个原子构成的肽平面以Cα(手性碳)为连接点时的空间相对位置,以一定的夹角形式存在,多个连续的肽平面便形成了α-螺旋结构的形状即B;核糖体沿mRNA的5′→ 3′方向、依照其上的三核苷酸密码子合成新的肽链
1.3 协同现象是生物大分子高级结构形成时的普遍现象
生物大分子在构建自身二级结构过程中存在非常普遍的协同现象,也就是常说的协同作用。基于分子内在属性形成最初的螺旋结构后,会诱导后续单元的有序、快速“垒加”,如蛋白质的α螺旋的形成、DNA双螺旋的形成、淀粉的螺旋形成等,关键在于“起始”环节。二级结构的崩解或去螺旋化过程也存在协同现象。同样,生物大分子的三级结构的形成和崩解(折叠和去折叠)过程也是一协同过程,最典型的实验结果就是牛胰核糖核酸酶的变性曲线以及核酸的变性曲线[13]。目前的一些社会现象也是如此,如不同类型的服务窗口外的排队情况,一旦最前面有几个人排队,“队伍”会迅速增大。
与上述高级结构形成时的协同现象一样,生物大分子在发挥生物功能时也常体现出协同作用。如血红蛋白在传递氧的过程中,一旦4个亚基中的一个血红素辅基结合O2,则其他3个亚基对O2分子的结合速度迅速增加,表现出协同现象,同样,O2分子的释放过程也一样;再如,在DNA复制过程中,双链解开成为两个单链模板,前导链的模板因长度很短且很快形成双链,故不需要保护(以防止酶切或其他不利因素的影响),而滞后链的模板因需要一定的长度才能合成引物并进一步合成双链,故需要稳定单链模板以防酶切、自身的局部双螺旋化等,此时单链结合蛋白(single strain binding protein,SSB)就完成此保护功能,单链结合蛋白也有4个亚基组成,重要的是,前面的SSB与单链的结合会促进后续的SSB的结合,也呈现出协同现象。
1.4 自组织(self-organization)现象是生物大分子在聚集成超分子体系时的共同特征
相同的生物大分子之间或不同的生物大分子之间在形成超分子体系过程中表现出明显的自组织行为,也就是说当分子浓度达到一定限度后或者在合适的外界条件下,分子间开始以基于最和谐的方式进行组装。自组织现象中最典型的例子便是大家熟知的磷脂双分子层(或原生质膜)的形成,其他例子也很多,如多酶复合体的形成(如动物细胞的丙酮酸脱氢酶复合体等);染色体的形成过程;植物细胞壁中纤维素微晶区的合成(纤维素分子一边合成,一边由60~70条纤维素链自我组装成微原纤维);蛋白聚集体的构建(如烟草花叶病毒的螺旋形排列的蛋白外壳的形成、镰刀型红细胞中突变的血红蛋白的聚集、胞内细胞骨架部分的形成等)。当然,如果把上文提到的SSB与DNA单链的结合作为一种自组织现象理解,也有一定道理。
1.5 生命体及生物界的构建特征——耗散特征
前面提到的自组织现象是否可延伸到生命的生长和发育过程?细胞分裂到一定次数后,如此庞大的细胞群如何管理?营养成分如何输送?代谢废物或垃圾如何释放?这就迫使细胞间发生一定的分工(分化),形成不同的细胞群、组织以及更高级的器官、系统等架构。此时,细胞或生命的生长过程便与经典的热力学第二定律在理论上发生了冲突。根据热力学第二定律,一个开放系统的进化规律应该是趋于最大的无序状态即趋于最大熵值,而生命体却是在有限的时空下形成愈来愈精细的化学结构[14]。普利高津(Prigogine I)于 1969年创立的耗散结构理论可以较好地解释这个有机过程。耗散结构中的有序表现为宏观上的有序,是一种处于运动变化中的“活”结构[15]。同种分子间或异种分子间的自组装过程受到环境条件的制约,在一定的条件范围内(通过摄取一定的能量或物质)逐渐变化并保持一定的(暂时)稳态,当条件变化到一定的尺度时,摄取的能量或物质不足以保持现有的结构(耗散结构)时,结构(生命)即告解体,也就是说,在短程时间内,生命过程不遵循热力学第二定律,长程时间内吻合热力学第二定律。目前的社会进化过程莫不如此,如村庄从小到大、从无序到有序等都具有耗散结构的属性。
2 生物超分子体系是生物功能的主要载体
2.1 分子结构的复杂性决定了其功能的复杂性
如DNA双链的单调重复决定其作为遗传物质的稳定性、淀粉结构与纤维素结构的相对单一决定其只能作为结构或能量储存的载体,胶原蛋白也是如此。磷脂结构的相对单一性由此决定了其作为生物膜的主要成分,起重要的结构作用(“围墙”)。蛋白质具有多种生物功能与其结构多样性、复杂性有关。淀粉结构似乎也呈多种多样的状态,实质是简单分支或体积的大小不同而已。由于单糖分子上有多个羟基,均可参与糖苷键的形成,赋予寡糖链结构多样化和功能多样化,这一点在糖蛋白的功能的展现方面表现得尤为突出,如参与新生肽链的折叠、影响糖蛋白的分泌及稳定性、参与分子识别与细胞识别等。
2.2 生物超分子体系是生物大分子发挥功能的主要载体
典型的生物超分子体系如负责DNA复制的DNA聚合酶体系,负责蛋白质合成的核糖体,对真核生物内的内含子进行切除的内含子剪接体,负责胞外信号传递的G蛋白信号转运体系,负责生物有氧氧化中的丙酮酸脱氢酶复合体,负责脂肪酸合成的酰基载体蛋白多酶复合体,对胞内短寿命蛋白及异常蛋白进行降解的泛素降解酶体系,植物细胞光能利用的核心结构之一的光反应中心,线粒体内膜上的电子传递链(呼吸链)的4个复合体,参与胞内外信号传递和细胞蛋白的运转的脂筏(Lipid raft)等。
2.3 分子间相互作用过程即是分子识别过程
分子本身无意识但分子的基团之间有感应,如酶与底物、激素与受体、抗原与抗体。生物大分子间或生物大分子与小分子间的选择性相互作用即为分子识别。分子识别的基础有两点:1)物理空间上的互补,几乎全部的生物分子间的识别均是如此;2)化学基团之间的相互作用(吸引),这些作用力即是寻常的疏水基团之间的疏水相互作用、正负电荷之间的静电引力、范德华力和氢键。分子识别的过程一般会伴随着分子移动现象发生,这种移动不是扩散,而是分子间甚至是分子内由于基团摆动所造成的相对位移,一般来说,大分子占主导地位,它决定了分子间相对位移的方向和强度。如DNA聚合酶体系沿DNA链的移动、核糖体沿mRNA的移动。生化反应的最初事件是分子识别,包括底物与酶的识别、底物分子之间的识别,底物识别之后便会发生一系列的空间位移,由物理空间上的分子之间变为物理空间的分子内作用,进而引起电子、原子或基团的转移。
细胞间的识别是以位于细胞表面的糖蛋白或其他分子之间的识别为基础的,同样组织或器官之间的识别又是以细胞识别为基础,归根结底还是以分子识别为基础的。
2.4 大分子内的小基团的改变导致整体结构的改变,甚至影响细胞的形态
一些与酶活性或蛋白活性有关的基团磷酸化后,可以导致活性的丧失或呈现,这方面的例子很多。小基团的改变除影响结构和活性外,甚至影响细胞形态,如分子病镰刀型贫血病的产生。该病即是由蛋白质上的一个氨基酸变化所引起的。正常成人的血红蛋白是由两条α链和两条β链相互结合成的四聚体,镰状细胞贫血患者因β链第6位的酸性氨基酸谷氨酸被疏水性氨基酸缬氨酸所代替,形成了异常的血红蛋白S(hemoglobin S,HbS),取代了正常血红蛋白(HbA)。在生理pH值条件下,不但每个HbS分子所带负电荷比HbA要少,而且还多了两个疏水性氨基酸残基。这两个存在于HbS分子表面的缬氨酸的侧链R基可以与脱氧HbS 分子上的互补部位结合。因而在氧分压降低,脱氧HbS增多时,6个Hb分子便组成了螺旋状聚合体,呈纤维状且不溶于水,导致了红细胞内渗透压降低,引起细胞脱水萎陷成镰刀状。
生命的进化与分化过程也莫不如此。受精卵细胞初期分裂时细胞的微小差异的逐步放大,以致出现细胞分化、组织分化及系统方面的巨大差异,也就是说蝴蝶效应(简述为系统对初始条件的敏感依赖性,即初始条件十分微小的变化经过不断放大,对其未来状态可能造成极其巨大的差别)在生物分子的代谢、作用过程中是一普遍现象,再如极微量的肾上腺素的升高在短时间内即可引起至少105倍葡萄糖分子的产生(糖原的水解),进而促使血糖快速升高以应对外界刺激。
3 从分子层面更容易理解生命现象的本质
3.1 从分子结构和作用机制角度能更客观地阐明生命的本质
生物大分子的空间结构或分子作用的机制是研究人员基于所获得资料的总结、推测和升华,实际情况可能比想象要复杂得多,或简单得多。下面以20世纪50年代初对DNA二级结构模型的提出为例进行介绍[13]。
当时科学界至少有3个实验室对DNA的空间结构的研究很有兴趣,它们是剑桥大学卡文迪研究室的劳伦斯·布拉格领导的小组(实际研究人员是博士后沃森和研究生克里克)、伦敦大学国王学院的威尔金斯(M. H. F. Wilkins)和女科学家罗莎琳德·富兰克林(R.Franklin)以及美国加州理工学院的国际著名化学家莱纳斯·鲍林(Pauling)所负责的实验室。20世纪50年代初,科研人员对包括蛋白质、核酸等生物大分子的空间结构的认识还不清楚,能给出核酸的结构仍是科研人员的一个了不起的“企图”。鲍林也提出过三螺旋模型或磷酸基团位于螺旋内部、碱基伸向四周的模型,但最后以名不见经传的沃森和克里克二人基于查戈夫规则、碱基互补配对理论和X射线晶体衍射结果提出或搭建的双螺旋模型得到广泛认可,并且使用至今。目前,先进的晶体衍射、信号的模拟分析等技术可以较好地呈现或再现蛋白质的三维结构,甚至与其他分子相互作用机制或过程。
3.2 现代分子生物学更好地诠释生物化学的内涵
现代分子生物学的重要领域——结构生物学能够比较清楚地阐释生物大分子作用的具体细节。比如GluT1 是存在于脑细胞和血红细胞膜上的葡萄糖转运蛋白,在转运胞外的葡萄糖到胞内过程发挥重要作用。颜宁课题组已经对其类似物即大肠杆菌中木糖转运蛋白(XylE)的结构及可能的转运过程进行了比较深入的研究,如图2所示。在XylE上与木糖结合部位的(氨基酸残基的侧链基团)一些基团(尤其是芳香基团和极性基团)通过DNA重组技术使其发生突变(即换成其他残基),其酶活性迅速降低[16]。
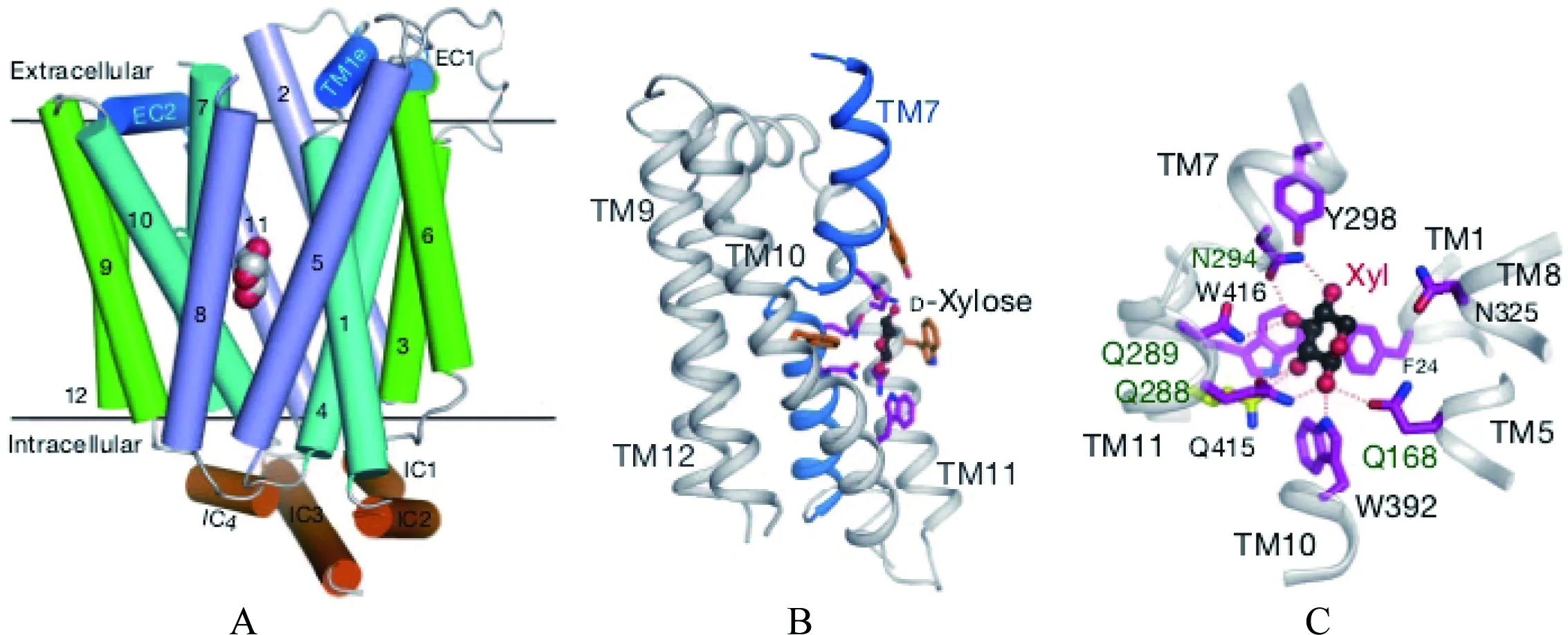
图2 大肠杆菌中XylE与木糖结合时的情况
A:4个由3α螺旋束跨膜成垂直状排列,木糖填充其中,大肠杆菌中XylE中木糖周围的极性残基与芳香族残基被染成品红、桔黄色;B、C:示酶与木糖结合时的局部结构,在木糖周围的残基中,不变的残基被染成品红色
再如在G蛋白介导的信号传递过程中,从生物化学层面看,G蛋白受到肾上腺素受体-激素复合物的诱导或作用后,自身结构发生变化,从无活性的G蛋白-ATP状态变成α亚基-ADP,后者激起相邻的腺苷酸环化酶的活性,催化ATP脱磷酸并环化成cAMP及后续级联反应。若从分子水平上考虑就是肾上腺素结合受体后,在受体部分到底发生了哪些变化,哪些基团参与识别和作用,如何引起自身结构的改变?改变后的受体如何引起相邻接的G蛋白的空间结构的改变,以及后续的系列反应,必须给出其参与反应的基团、推测反应过程并后续发生在分子内的结构变化等环节。因此,随着高端研究技术的深入,生物化学及其他传统课程如细胞生物学、遗传学、微生物学都将会在分子层面进行交汇并科学解释生命的机制。
3.3 生物进化的本质是分子结构的进化,分子结构的改变源于功能所需
在生物进化过程中,到底由何种动力推动?从对众多生命体的基因进行解析的数据看,生命的进化过程是存在于生命体内的某个或某类分子的进化所致。如Cyt c、转铁蛋白的进化。铁是动物和微生物所必需的一种重要的金属元素,动物血液中负责转运铁的转铁蛋白能将铁元素包裹起来,以避免被一些致病菌(包括引起脑膜炎、淋病和败血症的细菌)所“偷走”。科学家们对21种灵长类动物(从松鼠、猴子到人)通过DNA检测表明,这些致病菌演化出了转铁蛋白结合蛋白(TbpA),TbpA能抓住转铁蛋白并“偷走”它的铁。转铁蛋白和TbpA累积的大多数改变集中在这两个蛋白的接触区,这里就是这场进化“战争”的发生地。研究发现,致病菌的TbpA发生改变以抓牢转铁蛋白,而转铁蛋白通过序列和结构的改变来逃避TbpA[17],这就印证了“分子结构的改变源于功能所需,生物进化的本质是分子结构的进化”。蛋白质的功能保守性高于序列保守性,而结构保守性又高于功能保守性[18],用其他表述形式即为:生命过程的稳定则要求各生物分子要各司其职(即完成各自相对保守的功能,如前面提到的转铁蛋白),进而要求相关分子的空间结构(至少包括活性部位在内)的相对稳定,即功能保守是基于空间结构的保守。由于局部氨基酸序列具有相似情形,在形成高一级结构时具有一定的柔性,因而,相似的氨基酸序列均可形成相似甚至一样的空间结构,所以比较而言,序列的保守层次是比较低的。
4 关于生物分子的大小、形状与方向问题[13]
4.1 生物分子的大小比较
生物大分子结构单元的分子质量一般都很小,如单糖在200 u以内,氨基酸的平均分子质量为128 u,核苷酸对(碱基对)为650 u或660 u,脂类分子一般在500~1000 u范围内,其他如维生素、核苷酸衍生物、氨基酸衍生物、单糖衍生物等小分子的大小与母体相近。但多糖、脂类、蛋白质和核酸等生物大分子间的大小却有非常明显的区别,甚至在同一类分子中也有很大的区别。如蛋白质的分子质量一般在6.0×103~1.2×105u范围内,直链淀粉的分子质量在1.0×104~2.0×106u范围内,而支链淀粉的分子质量高达1.0×105~6.0×106u;核酸的分子量与链的长短有关,如模式生物大肠杆菌基因组为4.6×106bp,约3.0×109u。因核酸的分子量太大,其大小多用其沉降系数S表示,如5S、5.8S rRNA。脂类分子的分子量一般在数百到103范围内。
生物大分子的体积与其分子量的大小有关。对于分子质量约6×104左右的蛋白质分子,其大小在几个nm范围内,而相近分子量的寡聚核苷酸则有31 nm(直径2 nm)左右。
4.2 生物大分子的形状、方向是研究人员为便于理解和记忆所人为设定的
生物大分子的形状差别很大,这主要与分子的结构有关,在某些情况下也与其功能有关。蛋白质一般呈不规则的球形或棒状,如大多数的存在于血液中的可溶性蛋白、胞浆中的可溶性蛋白等,少数蛋白如结构蛋白呈纤维状,如胶原蛋白、角蛋白、肌动蛋白;支链淀粉、糖原分子常呈球形,而另一类多糖分子—纤维素起结构作用,呈纤维状。从短程界限看,处于分裂间期的细胞核内的DNA分子呈由双螺旋组成的纤维状,但在细胞分裂前,逐步盘绕、折叠成短的棒状结构。
为便于理解、书写生物大分子的结构,研究人员根据其组成单元上的活泼基团的位置对所形成的生物大分子的末端进行了设定。单糖在形成寡糖或多糖时,多以1位羟基与另一个单糖的4位羟基缩合形成α-1,4(或β-1,4)糖苷键,在一些具有分支结构的多糖中也存在α-1,6糖苷键,而在低聚合的寡糖中(如糖蛋白上的寡糖链),α-1,2糖苷键、α-1,3糖苷键的存在是比较普遍的。书写时,常把参与反应的4位上的羟基碳放到左侧,参与反应的1位羟基(或羟基碳、还原端)放到右侧,实际上在细胞内,无论是多糖链还是寡糖链,以及其他的分子如蛋白质或多肽、核酸与寡核苷酸链等,是没有左右、上下之分的。在书写蛋白质或多肽的一级结构时,把未参与成肽反应的氨基端(N末端、N端)放到左侧,未参与成肽反应的羧基端(C末端、C端)放到右侧。至于核酸或寡聚核苷酸片段,将携带有未参与磷酸酯键形成的游离磷酸基放到左侧,该磷酸基连在核糖的5′羟基上,故这一端又称为5′端,实际上参与核酸形成的原料——三磷酸水平的核苷正是磷酸基团连在核糖的5′羟基上,对应的是未参与形成磷酸二酯键的3′羟基放到链的右侧,又称为3′端。根据mRNA转录和蛋白质翻译时的情况,mRNA的5′端先转录出来,3′端后转录出来,核糖体与mRNA的5′端附近的SD序列结合,然后沿5′→3′方向翻译出新生肽链(图1C),再根据从左至右的书写习惯,书写mRNA时,将5′端放到左侧,3′端放到右侧,同时也规定,链的方向为5′→3′,由此也解释了DNA双螺旋结构是由两个反向平行的链所构成。对于脂类,一般多以磷脂作为代表进行描述,其为兼性分子,分为极性的头部和疏水性的尾部。
4.3 左手螺旋与右手螺旋之分仅与形成螺旋时的最初走向有关,与起点选择无关
一般生活中的螺旋(如螺丝钉等)都会有一个前进的方向,多以自己的手(左手或右手)为基点,以即将要到达的前方(或远方)位置为终点(箭头指向方位)。前已述及,许多生物大分子的二级结构呈螺旋状态,即线性分子并非以完全的线性形式存在而是以类似于筒状的形式存在,即便考虑生物大分子的两个端点的基团情况有区别,实际上,无论从哪个端点看,都是螺旋状结构。那么,如何理解左手螺旋和右手螺旋?这主要与形成螺旋时的最初走向有关。如下的例子可以帮助理解左手螺旋与右手螺旋的区别。修一条盘山公路到山顶,在出发点有两个方向可以选择,一个是向右上方,再转到出发点的对面(即山背后),然后从左后方绕到出发点的正上方(注意:海拔升高了),周而复始,直至顶点,这是按右手螺旋的方式行进的。向前水平伸出右手,让大姆指指向螺旋的前进方向(山顶),另外4个指头握拳,手掌到4个指尖即是一“前进”方向,盘山方向与右手手指的前进方向一致,故为右手螺旋(从山顶看,是逆时针方向)。同理,在出发点如果向左上方盘绕,从右上方绕出,也可以到达顶点,此时的盘山方向与伸出的左手握拳的指尖前进方向一致,故为左手螺旋(从山顶看,是顺时针方向)。
蛋白质的局部的多个肽平面由于Cα的原因进行盘绕折叠时,设想把起点肽平面垂直立起,第2个肽平面是向右上方前进的,故属于右手螺旋。此时,无论从羧基端到氨基端,还是从氨基端到羧基端,都是按右手螺旋的方向折叠的。单糖残基在形成淀粉的螺旋结构来说,如果把游离的4位羟基端放到最下端(或放到最远处),单糖残基是向左上方旋转(螺旋旋向自己,即顺时针旋转),故淀粉的螺旋结构是左手螺旋,且与起点的设定无关。在DNA形成双螺旋结构时,把核酸链或寡聚核苷酸链的5′-磷酸基团置于螺旋的最底端,则螺旋的走向按右手螺旋方向进行,只是两条链是反向平行而已,同样,螺旋的走向与端点的设定无关。综上,右手螺旋或左手螺旋是基于分子的内在结构,而非人为设定,这一点与我们对一级结构书写时的人为规定是不同的。
另外一个与形状有关的问题是对于方向或形状的描述上。典型的例子是对tRNA二级结构与三级结构的描述,一般将tRNA的颈环结构即二级结构描述成三叶草型,而将其三级结构描述为“倒L”型。实际上这里有一个潜在的假设,即为便于解释蛋白质的合成过程,将核糖体的小亚基放到下部,大亚基放到上部,中间部位从左至右贯穿了mRNA分子,如前所述,5′帽子端在左侧,3′羟基端在右侧(见图1C)。以此图为参考,在描述tRNA二级结构时,5′端与3′端形成颈环结构朝上,二级结构应为倒置的三叶草型(一般教材常称之为三叶草型),三级结构为倒置的L型(以确保反密码子与底部的mRNA上的密码子配对)是比较贴切的[13]。如果单独对tRNA二级结构、三级结构进行描述,加与不加“倒置”二字均是可以的。国外的教科书一般不加“倒置”二字的,如前所述,在细胞内是无方向而言的。
5 用辩证的、发展的理念来理解“生物化学”
5.1 生命科学发展迅速,一些传统概念正在被颠覆
进入21世纪以来,得益于物理和化学分析技术和设备的发展以及生命科学已有理论的积淀,研究人员已经能够在分子层面逐步认识生物大分子的结构、基于结构的分子间作用的过程、生命代谢的机制等,一些观点正在被“颠覆”,如核糖体在mRNA的非翻译区内合成蛋白质、tRNA的新家族(衍生物)促使癌细胞的增殖、tRNA拥有自我较读功能、蛋白质不依赖于mRNA随机拼接氨基酸成短肽链、蛋白激酶C具有抑癌作用而非传统的促癌作用、中心粒具有自我“复制”能力[19-24]。下面仅举一例进行说明。
美国约翰霍普金斯大学的研究表明,在所有细胞中负责构建蛋白质的分子机器——核糖体有时候甚至会在信使RNA的非翻译区内合成蛋白质[19],当核糖体到达mRNA的“终止”信号处而无法被“回收利用”时就会发生一些非典型的蛋白质合成,“淘气”的核糖体在没有“启动”信号的情况下重启,生成了一些功能未知的小蛋白。这不同于长期以来我们所接受的生物学理论。
5.2 诺贝尔奖获得者的研究极大丰富和指引了生物化学学科的发展
经过100多年的发展,众多的诺贝尔奖获得者的成果犹如皇冠上璀璨的明珠,构成了本学科内容的骨架和核心,如蛋白质的一级结构决定高级结构(安芬森、莫尔,1972年);DNA的双螺旋结构模型(沃森、克里克、威尔金斯,1962年);核酸是遗传物质,病毒的复制机制(1969年,德尔布鲁克等3人);遗传密码的解释以及与蛋白质合成的关系(霍利等3人,1968年);遗传信息流动的中心法则即遗传信息总是从DNA到RNA(1975年,巴尔的摩等3人);G蛋白及其介导的信息传递(G Gilman,M Rodbell,1994年);依赖于泛素的蛋白降解(A Ciechanover,A Hershko,Rose IA Irwin,2004年);ATP酶及能量产生机制(P Mitchell,1978年);三羧酸循环(H A Krebs,1953年)、卡尔文循环等(M Calvin,1961年)等。
6 结束语
作为生命科学及相关学科的最重要的基础课程,“生物化学”内容多且繁杂,能否讲授好反映了授课教师对课本内容的掌握和消化程度,也折射出对相关专业知识的熟悉情况。虽然本课程颇受各高校及学院的重视,但对具体细节性的教学研讨仍很不充分。学生通过近两个学期的学习,是否能够领会生物化学的内涵,则是一个检验教学水平的试金石,因此,“生物化学”课程的讲授水平在某种程度上也反映了高校生命学院的学生对生命科学理解的水平。因本文内容并未对全部的“生物化学”内容进行梳理和总结,仅是对其中的核心内容的共性问题(如生物大分子结构与功能的统一性、代谢的反应基础等)进行了归纳或提炼。因此,我们也恳请授课老师能进一步对其他共性内容进行总结,也希望本篇内容对于学生学完本课程后的“反刍”起帮助作用。
[1]王艳君, 陈 盛. 生物化学教学改革的实践探索[J]. 生物学杂志, 2012, 29(5):100-103.
[2]张部昌, 余嗣明, 李平生. 生物化学课程教学方法改革初探[J]. 生物学杂志, 2008, 25(1): 67-68.
[3]彭 仁. 生物化学课程教学范式改革初探[J]. 高校生物学教学研究(电子版), 2015, 5(3):21-24.
[4]赵 越. 生物化学课程教学改革的几点尝试[J]. 东北农业大学学报(社会科学版), 2007, 5(3):108-109.
[5]李 强, 刘荣梅, 赫福霞. 生物化学第一堂课教学方法的思考[J]. 高教学刊, 2015(19):88-89.
[6]冯晓帆, 柳 春, 王艳杰, 等. 生物化学绪论教学中激发学生学习兴趣的实践[J]. 基础医学教育, 2015, 17(7):587-588.
[7]孙厚良, 江秀娟, 熊 书, 等. 生物化学主题教学法的主题设计[J]. 高校医学教学研究(电子版), 2015, 5(3):41-43.
[8]李 霞, 王立锋, 赵 晶, 等. 讨论课教学模式在生物化学教学中的优化[J]. 现代生物医学进展, 2015, 15(19):3755-3757.
[9]李新莹, 刘兴利, 冯豫川. 巧用探究式教学和多样化考核, 提高生物化学教学质量[J]. 高等教育研究, 2015, 32(2):22-25.
[10]杨 艳, 刘晨光. 如何改革生物化学的研究型教学[J]. 生命的化学, 2015, 35(2):294-297.
[11]赵东旭, 谢海燕, 庆 宏. 关于研究生教学的思考——以生物学硕士生课程“高等生物化学”的教学为例[J]. 大学教育, 2016(5):95-97.
[12]NELSON D L, COX M M. Lehninger 生物化学原理(第3版)[M]. 北京:高等教育出版社, 2005:916.
[13]王镜岩, 朱圣庚, 徐长法. 生物化学(第3版)(上、下册)[M]. 北京:高等教育出版社, 2009, 上册: 234-235, 486-487; 下册: 528-532.
[14]黄德民. 耗散结构与生物学中的自组织[J]. 蚌埠医学院学报, 1979, 4(2):8-12.
[15]张彭拜, 沈永红. 生命现象中的耗散导致有序性[J]. 生物学通报, 2005, 40(8):8-9.
[16]SUN L, ZENG X, YAN C,et al. Crystal structure of a bacterial homologue of glucose transporters Glut 1-4[J]. Nature,2012, 490(7420):361-366.
[17]BARBER M F, ELDE N C. Nutritional immunity. Escape from bacterial iron piracy through rapid evolution of transferrin[J]. Science, 2014, 346(6215):1362-1366.
[18]罗辽复. 分子进化的几个普适性质—全国理论生物物理研讨会 (武汉, 1999)上的报告[J]. 内蒙古大学学报(自然科学版), 2000, 31(1):41-46.
[19]YOUNG D J, GUYDOSH N R, ZHANG F, et al. Rli1/ABCE1 recycles terminating ribosomes and controls translation reinitiation in 3’ UTRs In Vivo[J]. Cell, 2015, 163(4):872-884.
[20]HONDA S, LOHER P, SHIGEMATSU M, et al. Sex hormone-dependent tRNA halves enhance cell proliferation in breast and prostate cancers[J]. Proceedings of the National Academy of Sciences(USA), 2015, 112(29):E3816-E3825.
[21]KUHN C D, WILUSZ J E, ZHENG Y X, et al. On-enzyme refolding permits small RNA and tRNA surveillance by the CCA-adding enzyme[J]. Cell, 2015, 160(4):644-658.
[22]SHEN P S, PARK J, QIN Y D, et al. Rqc2p and 60S ribosomal subunits mediate mRNA-independent elongation of nascent chains[J]. Science, 2015, 347(6217):75-78.
[23]ANTAL C E, HUDSON A M, KANG E, et al. Cancer-associated protein kinase C mutations reveal kinase′s role as tumor suppressor[J]. Cell, 2015, 160(3):489 502.
[24]BALESTRA F R, VON TOBEL L, GÖNCZY P. Paternally contributed centrioles exhibit exceptional persistence inC.elegansembryos[J]. Cell Research, 2015, 25(5):642-644.
Contents of the last class of key lesson “biochemistry ” for undergraduate of biology
ZHAO Don-gxu, XU Li-xin
( School of Life Sciences, Beijing Institute of Technology, Beijing 100081, China )
The course of biochemistry for undergraduate was the key basic course of biological field and other relevant fields. The present paper gave some suggestions about the contents in the last class including that the life consisted of complicated bio-macro-molecules and small molecules based on the ordinary organic molecules, the high grade structure of bio-macro-molecules relied on its low grade structure, the helix structure was the main motif of bio-macro-molecules, the natural instincts of bio-macro-molecules were the power to construct its high grade structure, and consequently gave the self-organization characteristics inter molecules and the dissipative characteristics for life. The complicated structure level of bio-molecule decided its complicated level of functions, the complex of bio-super-molecules was the main form while functioning, the functioning process of bio-molecules was the interaction or recognition among the molecules, and the results from the interaction and life process obeyed the "butterfly effect". At present, the characteristic of life was elucidated with using the knowledge of molecular biology.
biochemistry; helix structure; bio-super-molecular; function corresponding to the structure; bio-molecule recognition
2016-08-08;
2016-08-25
本文获北京理工大学第十批教育教学改革项目(第三批次)(09号)的支持(2015年)
赵东旭,博士,副教授,研究方向为生物活性成分的分离分析,E-mail:zhaodx@bit.edu.cn
G642;Q5
C
2095-1736(2017)03-0108-07
doi∶10.3969/j.issn.2095-1736.2017.03.108
