小球藻净化沼液的预处理方法
2017-07-18孙中亮冯雪珂孙利芹盛清凯朱昌雄
孙中亮, 冯雪珂, 李 丹, 孙利芹, 盛清凯, 朱昌雄
(1. 烟台大学 生命科学学院, 烟台 264005; 2. 山东省农业科学院 畜牧兽医研究所, 济南 250100;3. 中国农业科学院 农业环境与可持续发展研究所, 北京 100081)
小球藻净化沼液的预处理方法
孙中亮1, 冯雪珂1, 李 丹1, 孙利芹1, 盛清凯2, 朱昌雄3
(1. 烟台大学 生命科学学院, 烟台 264005; 2. 山东省农业科学院 畜牧兽医研究所, 济南 250100;3. 中国农业科学院 农业环境与可持续发展研究所, 北京 100081)
沼液组分复杂,极易滋生细菌等微生物,影响微藻对污染物的去除。研究采用添加次氯酸钠、氯化钠、氨水和高压蒸汽灭菌4种方法对沼液进行预处理,通过对比沼液中小球藻的生长状况和污染物的去除情况,同时通过PCR-DGGE技术监测培养液中微生物群落结构的变化,考察了预处理方法对小球藻净化沼液的影响。研究结果表明,添加次氯酸钠的处理方法操作简单、成本低廉,并且可以显著减少沼液中微生物的种类和数量;在使用60%的沼液作为培养基时,藻细胞密度可达4.78×107个/mL;培养7 d后,总氮去除率为76.9%,总磷去除率为46.6%,氨氮去除率为97.1%,COD去除率为72.8%,达到畜禽养殖业水污染物排放标准。
小球藻; 沼液净化; 灭菌方法; 微生物群落
Different pretreatment methods for biogas slurry
purification byChlorellavulgaris
SUN Zhong-liang1, FENG Xue-ke1, LI Dan1,
SUN Li-qin1, SHENG Qing-kai2, ZHU Chang-xiong3
(1. College of Life Sciences, Yantai University, Yantai 264005; 2. Institute of Animal Science and Veterinary
Medicine, Shandong Academy of Agricultural Sciences, Jinan 250100; 3. Institute of Environment and
Sustainable Development in Agriculture, Chinese Academy of Agricultural Sciences, Beijing 100081, China)
近年来,集约化畜禽养殖业迅速发展,产生的大量动物排泄物对环境产生了一定的破坏,如滋生细菌病毒、产生恶臭、污染饮用水以及引起自然水体的富营养化等[1-2]。目前,国家大力推广沼气工程(厌氧消化技术),虽然在一定程度上缓解了畜禽养殖粪便给环境带来的压力,但是产生的沼液仍含有大量的有机物、氮和磷等,被视为高浓度污水[3-5]。处理沼液的主要方法有好氧微生物处理、生物塘法、人工湿地以及膜处理等,但是限于处理成本和对沼液中氮、磷脱除效果不佳等问题,上述方法在养殖企业中推广缓慢[2,6-7]。
微藻种类多样,适应性强,能够在复杂的生态系统中生长[8-9]。沼液中富含碳、氮、磷等元素,可以为微藻生长提供营养。将沼液作为培养基培养微藻,不仅可以降低污染物浓度,而且收获的藻细胞利用途径多样,如生产生物柴油、藻多糖和动物饲料等[1]。Craggs验证了在示范规模的跑道池条件下,微藻不但能够有效净化污水,而且能够实现生物柴油的经济性生产[10]。谭芬等利用小球藻处理猪粪发酵后的沼液,经过培养基优化,可将其中氨氮去除93.5%,藻细胞生物量产率达675.06 mg/L·d,其中藻多糖含量为44.3%[11]。刘雪等发明了将废水培养、收集、沉淀的微藻与玉米皮作为发酵的底物生产生猪饲料的方法[12]。目前,由微藻介导的新型畜禽养殖污水处理技术以其经济性、环保性、可操作性强等优势,已逐渐成为污水处理领域中重要的研究方面。
沼液中除含有微藻生长所需的营养元素外,还含有较多的悬浮颗粒,具有较高的浊度,组分和理化性质随厌氧消化的批次不同而变化很大,极易滋生细菌等微生物,进而影响后续微藻净化的效果[13]。因此,对沼液进行预处理是整个净化过程的重要组成部分。目前,已有较多关于污水前处理和微藻培养基预处理的报道。如巫小丹等使用漂白粉处理养猪沼液以杀灭食藻害虫[14];黄园等对比了苦皮藤素等植物源杀虫剂对微藻培养液中轮虫的杀灭效果[15];王伟伟等对比了加热法、臭氧消毒法和次氯酸钠消毒法对海水养殖废水的处理效果,结果表明次氯酸钠消毒养殖废水较适宜微藻的生长[16];Soletto等研究了批式和补料-批式培养模式下,铵根对螺旋藻及培养基中其他微生物菌群的影响[17];高斌对比了5种消毒剂处理微藻培养基对小球藻和三角褐指藻生长的影响,结果显示在消毒剂的作用下,微藻生长延滞期延长[18]。尽管上述方法都取得了一定的效果,但是多数研究忽略了消毒剂的二次污染问题,且缺乏处理过程中微生物尤其是细菌群落结构变化的监测。Huang等研究了细菌对微藻净化沼液效果的影响,结果显示多数细菌的存在降低了氮、磷的去除效率[19]。因此,监测微藻净化沼液过程中微生物群落的结构特征,找到简单、方便、高效、环保的防控方法至关重要。
本研究选择次氯酸钠消毒法、氨水消毒法以及实验室常用的氯化钠消毒和高压蒸汽灭菌方法,对比了不同预处理方法对养猪场沼液的灭菌效果和对微藻生长、污染物去除情况的影响,并通过分子生物学的手段分析了灭菌前后和微藻处理过程中微生物群落的结构特征,以期为微藻净化沼液的规模化应用提供参考。
1 材料与方法
1.1 主要材料
本实验所用藻种为小球藻(Chlorellavulgaris),原种从中国科学院武汉水生生物研究所淡水藻种库购得,编号为FACHB-31,后经本实验室按照梯度沼液培养的方式驯化得到。
沼液取自烟台市牟平区某养猪场。
实验所用的主要试剂包括次氯酸钠、氨水、氯化钠、氧化钙、盐酸等。DNA的提取采用上海金畔生物科技有限公司的FastDNA土壤样品提取试剂盒。
1.2 主要仪器
752S紫外可见分光光度计(上海棱光技术有限公司生产)、 LXJ-IIB低速大容量离心机(上海安亭科学仪器厂生产)、显微镜(上海光学仪器厂)、血球计数板(上海医疗器械有限公司生产)、PCR仪(德国Biometra公司)、电泳仪(北京市六一仪器厂)、凝胶图像处理系统(UVP)。
1.3 实验方法
1.3.1 沼液的预处理
猪场沼液中含有大量的不溶物,致使水体十分浑浊,透光性差,因此在使用前需要进行固液分离。具体操作为:将沼液曝气处理2 h(过滤空气,通气量为0.3 vvm),静置沉降一段时间后用脱脂棉进行简单过滤,取过滤液待用。
根据先期试验的结果,本实验选取预处理方法的具体操作为:1)高压蒸汽灭菌:在蒸汽压为103.4 kPa、温度为121 °C的条件下,将沼液灭菌20 min;2)次氯酸钠:向沼液中添加3 mL/L的次氯酸钠(有效氯含量为390 mg/L),混合均匀后静置24 h,然后通入过滤空气,用淀粉碘化钾试纸检测余氯,并用硫代硫酸钠中和;3)氯化钠:向沼液中添加0.2 mol/L氯化钠,混合均匀后待用;4)氨水:向沼液中添加体积分数为0.04%的氨水。各预处理方式分别设置3组平行。
1.3.2 小球藻的培养方法
在振荡光培养箱中采用三角瓶进行微藻的扩培。以BG11为培养基,使用1000 mL三角瓶(培养体积为500 mL)在培养箱中振荡培养,振荡速率为100 r/min;调节培养箱温度为25°C,由日光灯管提供光强为100 μmol/m2·s的24 h连续光照。待扩培的小球藻达到对数生长期后,于无菌条件下离心,待用。
将离心后的小球藻接种于5 L的三角瓶中,培养体积为3 L,沼液浓度为60%,并使得接种后的藻细胞密度约为1.5×107个/mL,调节培养液的pH值至7.0左右。培养过程中通入过滤空气(滤膜孔径为0.22 μm,通气量为0.1 vvm),控制室温在(25±3)℃,由日光灯管提供光强为100 μmol/m2·s的24 h连续光照,每天定时使用盐酸调节培养液pH值至7.0左右。
培养过程中取样观察藻细胞形态并计数;离心除藻后测定总氮、总磷、氨氮和COD的浓度。
1.3.3 水质指标的测定方法
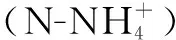
1.3.4 微生物群落分析方法
1)培养液的预处理。
分别取由不同方法处理的沼液50 mL,并借助玻璃砂芯的抽滤装置,先用高温灭菌过的滤纸过滤掉沉淀杂质,再用孔径为0.45 μm的微孔过滤薄膜过滤大颗粒杂质,最后用孔径为0.22 μm微孔过滤薄膜将水体中的细菌抽滤在滤纸上,然后将滤纸用无菌剪刀剪切到FastDNA土壤样品提取试剂盒的Lysing Matrix E Tube中,于-20℃冰箱保存备用。
在培养的不同阶段取培养液50 mL,按照同样的方法进行预处理后备用。
2)DNA的提取和分析。
利用上海金畔生物科技有限公司的FastDNA土壤样品提取试剂盒,并按照其说明书提取不同阶段的DNA。提取后电泳检测DNA的完整性,并将提取后的DNA稀释作为PCR实验的模板,将V3区片段进行扩增,采用的V3区特异性引物为341f(5′-CCTACGGGAGGCAGCAG-3′),并且在其5′端加入一段GC夹子(CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGG)和518r (5′- ATTACCGCGGCTGCTGG -3′),采用1%琼脂糖凝胶电泳检测PCR产物。以PCR产物为模板,利用DGGE技术分析样品中的微生物群落,并用凝胶成像系统拍照和Image Lab软件分析图谱。
2 结果与分析
2.1 不同预处理方法对沼液组成的影响及灭菌效果
利用微藻处理沼液的关键是保证微藻在处理系统中始终保持竞争优势,因此,在进行微藻培养之前,对沼液进行灭菌有利于缩短接种后的延滞期,提高微藻细胞的竞争优势[21]。采用不同的预处理方法可能对沼液组成产生一定的影响,表1对比了沼液处理前后各污染物的浓度变化。可以看出,经氨水处理之后,沼液中总氮和氨氮浓度有了显著增加,分别提高了15.8%和20.2%,在一定程度上增加了沼液的污染负荷;而高压灭菌处理、次氯酸钠处理和氯化钠处理前后,沼液各污染物浓度变化并不明显。
本研究发现,石河子大学本科生学习动机居中等程度。经过对数据的进一步分析发现,总平均分小于临界的比例相当大,共96人,即有52.17%的大学生学习动机水平不高;总平均分高于4分的(学习动机较强)仅4人,占总人数的2.17%。从总体上看,本研究证实了当今大学生学习动机偏低,只有在能力追求维度上得分接近4分,其余均不到3分。因此,需要在教育教学中重视石河子大学本科生的学习动机。

表1 不同预处理方法对沼液组成的影响
为了更加清晰地对比不同方法处理前后沼液中微生物群落结构的变化,对不同处理的样品进行了DNA的提取和DGGE图谱比较(图1)。应用Image Lab软件自动检测不同方法处理的沼液中菌群DGGE图谱上条带的位置及亮度(图谱上处于不同水平线上的条带代表不同的细菌,条带亮度反映单一细菌在细菌群落中的含量),检测灵敏度为25%。如图1所示,经4种方式预处理后的沼液,微生物组成不一样,与1号未处理样品相比,经高压蒸汽灭菌处理的5号沼液中不含任何细菌,经次氯酸钠处理的2号沼液中细菌种类相对较少,然而经氨水及氯化钠处理的3、4号沼液中细菌种类没有太大变化,由此可以说明高压蒸汽灭菌、添加次氯酸钠处理沼液具有较好的杀菌效果。
2.2 不同预处理方法对小球藻生长的影响
经固液分离后,将不同方法预处理的沼液作为培养基培养小球藻(沼液浓度为60%),藻细胞的生长曲线如图2所示。总体上,高压蒸汽灭菌和添加次氯酸钠处理的沼液作为培养基时,小球藻生长较快,积累的藻细胞浓度较高;而在添加氯化钠或氨水处理的条件下,虽然小球藻生物量也有一定的积累,但是接种后延滞期长,且较早进入衰退期,说明沼液使用前灭菌越彻底,对小球藻的生长越有利。
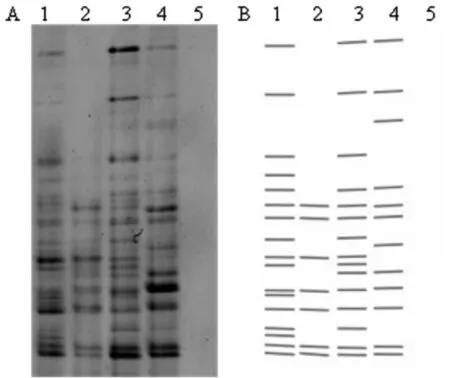
图1 不同灭菌处理后沼液中微生物群落结构
A:DGGE指纹图谱, B:DGGE模式图。1:未处理;2:NaClO处理;3:氨水处理;4:NaCl处理;5:高压灭菌处理
如图2所示,处于对数生长期的小球藻藻种在接入新的培养环境后,都经历了一定时间的延滞期。由于沼液使用前灭菌彻底,高压蒸汽灭菌处理后小球藻的生长延滞期最短,为1 d;次氯酸钠处理后,延滞期为2 d,这一方面是由于培养液中仍有少量细菌与小球藻细胞形成生长竞争,另一方面,中和不彻底可能导致培养液中存在次氯酸根离子,也会对藻细胞生长产生抑制作用;在沼液中添加氯化钠后,培养液的离子强度增加,一些细菌因为细胞内外离子强度的差异导致细胞失水或者溶胀而死亡,小球藻细胞在进入新生境后,为了适应培养液中离子强度的变化,经历了4 d的延滞期;与其他3种预处理方法相比,添加氨水的副作用最大,主要是因为氨对小球藻的生长有显著的抑制作用,文献报道,当培养基中铵根离子浓度达到5 mmol/L时,小球藻的生长速率显著降低[22],实验中添加0.04%的氨水(折算为铵根浓度为5.34 mmol/L),导致小球藻生长的延滞期较长(4 d)。
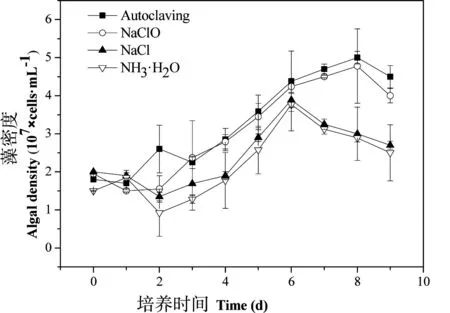
图2 不同灭菌方法对小球藻生长的影响
经历不同时长的延滞期后,小球藻进入快速生长期,高压蒸汽灭菌处理和添加次氯酸钠处理条件下,小球藻生长较快,获得的最高藻细胞密度分别为5.00×107个/mL和 4.78×107个/mL。具体是当培养至第6天时,两种处理方法条件下的藻细胞密度分别达到4.38×107个/mL和 4.24×107个/mL,之后小球藻生长进入稳定生长期,最终在第8天获得最大藻细胞密度,并于第9天开始衰亡期,观察发现此时培养液开始变黄。分别取第6天和第9天的培养液,过滤除藻后提取微生物DNA,分析在稳定期和衰亡期的细菌群落结构的变化,结果如图3所示。可以看出,在高压蒸汽灭菌处理后,小球藻生长过程中仍不可避免地受到了细菌的污染(图3中4号),推测是源自空气中的细菌。对比稳定期和衰亡期的细菌结构可以发现,衰亡期的培养液中细菌种类明显增多,主要是因为小球藻在培养后期生长缓慢,在沼液系统中竞争优势减弱,导致细菌增多,而其他微生物的生长进一步影响了小球藻的增殖,是致使藻细胞开始衰亡的重要原因。

图3 小球藻生长稳定期和衰亡期培养液中微生物群落结构
A:DGGE指纹图谱;B:DGGE模式图。1:NaClO处理组生长消亡期;2:高压灭菌处理组生长消亡期;3:NaClO处理组生长稳定期;4:高压灭菌处理生长稳定期
添加氯化钠或氨水处理条件下,获得的最高藻细胞密度较低,分别为3.89×107个/mL和 3.77×107个/mL,并且与高压蒸汽灭菌和添加次氯酸钠处理相比,二者较早地进入了衰亡期(第7天)。在小球藻生长过程中,能够消耗沼液中的碳、氮和磷等元素,因此小球藻的生长速率越快,沼液净化的效率越高。对比不同预处理条件下的小球藻生长曲线(图2)可以发现,高压蒸汽灭菌和添加次氯酸钠处理较有利于小球藻的生长。
在微藻培养过程中,尤其是将沼液等污水作为培养基使用时,较易出现细菌的滋生。Wang等从自然条件下筛选出与栅藻共生的多种细菌,并设计单种细菌与栅藻的混合培养[23],结果显示,Brevundimonasaurantiaca、Rhizobiumsp.、Pseudomonassp.、Acidovoraxfacilis和Diaphorobactersp.分别与栅藻共同培养时能够促进微藻生长,主要原因是这些细菌有效地降低了微藻的胞外分泌物,减少了对生长的抑制,但是在其他单个细菌或多种细菌与栅藻的共培养体系中,微藻生长速率均降低。Halfhide等研究了无菌和有菌条件下,微藻对水产养殖废水的处理效率,结果显示,有菌条件下小球藻的生长受到明显抑制,可能与藻类和细菌竞争营养元素(如N元素)有关[24]。尽管部分有益菌可以通过分解培养液中有机物的方式降低对微藻生长的抑制作用,或者为微藻生长提供无机营养元素和CO2等,但是单一有益菌和微藻共生的体系构建和维持的难度较大。因此,在微藻处理沼液等污水时,预处理过程应尽量减少细菌的种类和数量,保证微藻的生长优势。
2.3 不同预处理方法对微藻去除污染物的影响
图4描述了小球藻在净化沼液的过程中,总氮、总磷、氨氮和化学需氧量的消减情况。从图4中可以看出,无论采用哪种预处理方法,沼液中的污染物浓度都随时间的延长而出现不同程度的降低。总体而言,在小球藻的快速生长期,污染物去除速率较快,主要是因为该阶段小球藻代谢旺盛,相对净化能力强。对比4种沼液预处理方法可以发现,高压蒸汽灭菌和添加次氯酸钠条件下,污染物去除率较高(表2)。
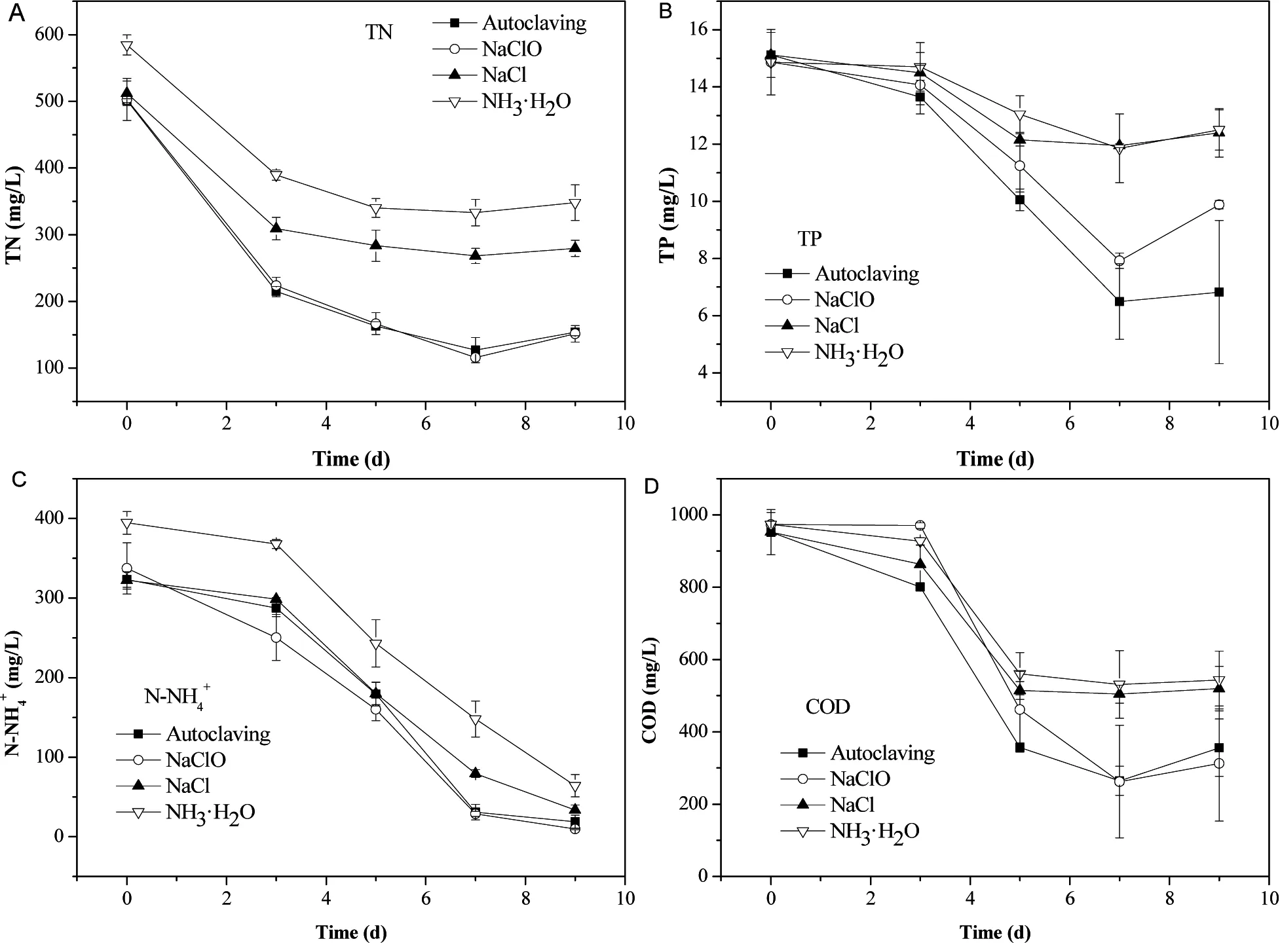
图4 不同灭菌方法对污染物去除的影响
具体地,当培养至第7天时,高压蒸汽灭菌和添加次氯酸钠处理条件下的小球藻生长处于稳定期,培养液中的总氮、总磷和COD浓度降至最低,分别为126.77 mg/L、6.50 mg/L、356.00 mg/L和115.50 mg/L、7.92 mg/L、312.5 mg/L,氨氮浓度分别降至18.85 mg/L和9.72 mg/L。虽然小球藻于第9天进入衰亡期,但是氨氮浓度继续降低,主要原因是在碱性条件下,铵态氮主要以氨分子形态存在,受曝气操作影响,较易挥发。不同的是,培养液中总氮、总磷和COD浓度在衰亡期有增加的趋势,主要是因为细胞自溶,胞内有机物等释放到培养液中。
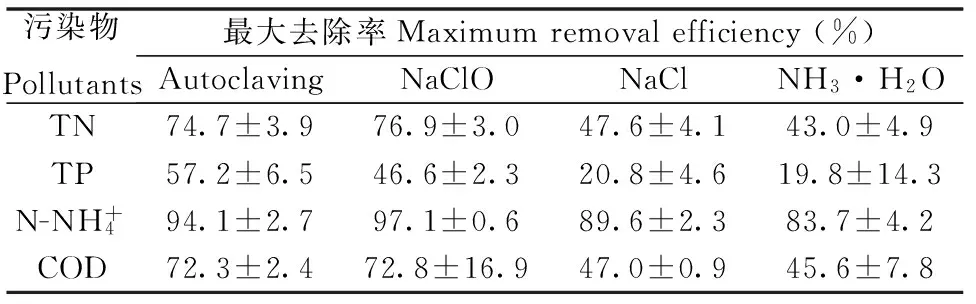
表2 小球藻对污染物的最大去除率
从图4中还可以看出,添加氯化钠或氨水处理条件下污染物去除速率较慢,这主要与小球藻的生长情况有关。尤其是添加氨水的操作会增加沼液中氮的含量,进一步恶化了水质,而且残留氨对微藻生长产生不利影响(图2),增加了小球藻去除污染物的难度。表2中列出了不同预处理条件下,沼液中各污染物的最高去除率,可以得出高压蒸汽灭菌和添加次氯酸钠处理条件下污染物的去除率较高,如用次氧酸钠处理总氮去除率76.9%、总磷46.6%、氨氮97.1%、COD 72.8%,与畜禽养殖业水污染物最高允许排放浓度(氨氮80 mg/L、总磷8.0 mg/L、化学需氧量400 mg/L)对比[25],沼液经过高压蒸汽灭菌和添加次氯酸钠预处理后,小球藻可以迅速代谢掉其中的污染物,并经过7 d的净化即可达到排放标准。

表3 不同预处理方法的成本比较
表3对不同文献报道的沼液预处理方法的成本进行了比较。可以看出,使用漂白粉处理养猪沼液的成本最低,为0.05元/t,其次是使用次氯酸钠处理,成本为0.14元/t,而采用氢氧化钙和高压蒸汽灭菌的方法成本较高。然而,采用添加漂白粉的方法,沼液需至少放置4 d,才可进行接种、培养微藻,此外该方法引入了钙离子,造成水的硬度增加,形成二次污染。高压蒸汽灭菌效果虽然最为理想,但是由于处理成本较高(65.3元/t),操作难度较大,在实际情况下是不可能实现的。综合不同预处理方法的灭菌效果、对小球藻生长情况和污染物去除率的影响以及成本,优选添加次氯酸钠作为沼液预处理的方法。
3 结论
通过对比4种沼液的预处理方法,考察了对沼液的灭菌情况、小球藻的生长以及污染物的去除情况,综合实验结果,得到以下结论:
1)DGGE分析说明高压蒸汽灭菌和添加次氯酸钠处理沼液的方法,可以显著减少培养系统中的细菌种类和数量,有利于小球藻保持生长优势;
2)高压蒸汽灭菌和添加次氯酸钠处理条件下,小球藻生长延滞期分别为1 d和2 d,并且经过8 d的生长获得了最大藻细胞密度,分别为5.00×107个/mL和 4.78×107个/mL;
3)经过7 d的净化处理,在高压蒸汽灭菌和添加次氯酸钠处理条件下,沼液中污染物的去除率相近,如次氯酸钠处理总氮去除率76.9%、总磷46.6%、氨氮97.1%、COD 72.8%,达到畜禽养殖业污水排放标准;
4)综合分析沼液预处理方法的成本和操作难度,在由微藻介导的沼液净化工艺中,优选添加次氯酸钠的预处理方法。
[1]赵立欣,宋成军,董保成,等.基于微藻养殖的沼液资源化利用与高价值生物质生产耦合技术研究[J]. 安全与环境学报, 2012, 12(3): 61-65.
[2]冯星莲. 畜禽养殖的污染防治与应对策略[J]. 畜牧兽医科技信息, 2015(7): 41-42.
[3]武深树,谭美英,刘 伟. 沼气工程对畜禽粪便污染环境成本的控制效果[J]. 中国生态农业学报, 2012, 20(2): 247-252.
[4]李宝玉,毕于运,高春雨,等. 我国农业大中型沼气工程发展现状、存在问题与对策措施[J]. 中国农业资源与区划, 2010, 31(2): 57-61.
[5]韩 芳,林 聪. 畜禽养殖场沼气工程厌氧消化技术优化分析[J]. 农业工程学报, 2011, 27(S1): 41-47.
[6]税 勇,川岸朋树,宋小燕,等. 两种膜生物反应器处理养猪沼液的比较研究[J]. 环境科学, 2015, 36(9):3319-3328.
[7]白晓凤,李子富,闫园园,等. 吹脱与鸟粪石沉淀组合工艺处理中温厌氧发酵沼液研究[J]. 农业机械学报, 2015, 46(12): 218-225.
[8]杜 奎,梁 芳,耿亚洪,等. 利用烟道气培养微藻的机制与应用[J]. 生物技术通报, 2015, 31(2): 1-9.
[9]梅 帅,赵凤敏,曹有福,等. 利用污水养殖微藻研究进展[J]. 农业工程, 2013, 3(5): 12-16.
[10]CRAGGS R J, HEUBECK S, LUNDQUIST T J, et al. Algal biofuels from wastewater treatment high rate algal ponds[J]. Water Science & Technology, 2011, 63(4):660-665.
[11]谭 芬. 小球藻利用猪粪发酵沼液产碳水化合物的研究[C]. 2015年中国化工学会年会论文集,2015:122.
[12]刘 雪,盛清凯,耿 兵,等. 一种废水微藻加工饲料的方法[P]. 北京: CN104982731A, 2015-10-21.
[13]杨 祎,陈立文,陈必链,等. 微藻净化沼液产业化研究进展[J]. 中国沼气, 2015, 33(4): 49-53.
[14]巫小丹,刘 伟,阮榕生,等. 不同预处理方法对沼液养殖微藻的影响[J]. 环境污染与防治, 2014, 36(1): 9-12.
[15]黄 园. 微藻培养过程中轮虫污染防治研究[D]. 青岛: 中国科学院研究生院(海洋研究所), 2014:30-41.
[16]王伟伟, 陈书秀, 钱 瑞,等. 海水养殖废水预处理方法与微藻藻种筛选[J]. 水产科学, 2014(3):181-185.
[17]SOLETTO D, BINAGHI L, LODI A, et al. Batch and fed-batch cultivations ofSpirulinaplatensisusing ammonium sulphate and urea as nitrogen sources[J]. Aquaculture, 2005, 243(1-4):217-224.
[18]高 斌. 五种消毒剂对海水微藻生长及营养盐动态变化的影响[D]. 福州: 福建农林大学, 2005:30-50.
[19]HUANG W, LI B, CHAO Z, et al. Effect of algae growth on aerobic granulation and nutrients removal from synthetic wastewater by using sequencing batch reactors[J]. Bioresource Technology, 2015, 179:187-192.
[20]国家环境保护总局,水和废水监测分析方法编委会.水和废水监测分析方法[M]. 北京: 中国环境科学出版社, 2002:200-284.
[21]王少沛,曹煜成,李卓佳,等. 水生环境中细菌与微藻的相互关系及其实际应用[J]. 南方水产, 2008, 4(1): 76-80.
[22]陈 峰,姜 悦. 微藻生物技术[M]. 北京: 中国轻工业出版社, 1999:55-91.
[23]WANG R, XUE S, ZHANG D, et al. Construction and characteristics of artificial consortia ofScenedesmusObliquus-bacteria forS.Obliquusgrowth and lipid production[J]. Algal Research, 2015, 12(6): 436-445.
[24]HALFHIDE T, KERSTR M A, LEKANG O I, et al. Production of algal biomass,Chlorophyll, starch and lipids using aquaculture wastewater under axenic and non-axenic conditions[J]. Algal Research, 2014, 6: 152-159.
[25]GB 18596-2001. 畜禽养殖业污染物排放标准[S]. 北京:中国标准出版社,2003.
[26]LEI X, SUGIURA N, FENG C, et al. Pretreatment of anaerobic digestion effluent with ammonia stripping and biogas purification [J]. Journal of Hazardous Materials, 2007, 145(3): 391-397.
[27]徐嘉杰. 沼液规模化培养小球藻的能源利用技术研究[D]. 北京: 中国农业大学, 2014: 39-46.
Chlorellavulgaris; biogas slurry purification; sterilization methods; microbial community
2016-05-30;
2016-06-27
国家“十二五”水专项湖泊主题-巢湖项目(编号:2013ZX07103006-007);山东省农业重大应用技术创新项目(编号:鲁财农指[2016] 36号)
孙中亮,讲师,主要从事微藻净化沼液的研究工作,E-mail: zlsun2015@163.com
孙利芹,教授,主要从事废水微藻资源化利用技术研究,E-mail: sliqin2005@163.com
Q949.21+7;X703
B
2095-1736(2017)03-0099-06
doi∶10.3969/j.issn.2095-1736.2017.03.099
