糖尿病周围神经病变临床特征及相关因素
2017-07-18杨骏倪桂莲
杨骏 倪桂莲
[摘要] 目的 探讨糖尿病周围神经病变临床特征及相关因素。 方法 选择2012年6月~2015年12月在我院门诊的2型糖尿病患者130例的临床资料进行回顾性分析。合并周围神经病变组(DPN)82例,未合并周围神经病变组(非DPN)48例。比较两组患者一般资料及临床资料,分析糖尿病周围神经病变临床特征以及影响因素。 结果DPN组年龄显著大于非DPN组,病程显著长于非DPN组,HDL-C水平显著低于非DPN组,差异有统计学意义(P<0.05)。DPN组尺神经、正中神经以及腓总神经运动神经潜伏期较非DPN组长,MCV较非DPN组低,腓总神经波幅较非DPN组低,差异有统计学意义(P<0.05)。DPN組尺神经、正中神经以及腓浅神经感觉神经SCV较非DPN组低,正中神经以及腓浅神经潜伏期较非DPN组长,差异有统计学意义(P<0.05)。DPN患者神经病变临床分布:感觉神经:尺神经22例,正中神经29例,腓浅神经22例;运动神经:尺神经15例,正中神经6例,腓总神经17例。糖尿病周围神经病变相关因素包括年龄、病程、HDL-C(OR=2.3、1.7、2.1,P<0.05)。 结论 年龄大、病程长、HDL-C水平低的糖尿病患者容易发生周围神经病变,感觉神经以及运动神经均存在潜伏期延长、传导速度下降;感觉神经发生异常的比例更高。
[关键词] 糖尿病;周围神经病变;临床特征;相关因素
[中图分类号] R587.2 [文献标识码] B [文章编号] 1673-9701(2017)17-0088-04
[Abstract] Objective To investigate the clinical characteristics and related factors of diabetic peripheral neuropathy. Methods The clinical data of 130 patients with type 2 diabetes mellitus in our hospital from June 2012 to December 2015 were retrospectively analyzed. There were 82 patients in diabetic peripheral neuropathy (DPN) group, and 48 cases in the non-peripheral neuropathy(non-DPN) group. The general data and clinical data of between the two groups were compared. The clinical characteristics of diabetic peripheral neuropathy and the influencing factors were analyzed. Results The age of DPN group was significantly older than that of non-DPN group, and the course of DPN group was significantly longer than that of non-DPN group. The level of HDL-C in the DPN group was significantly lower than that of non-DPN group, and the difference was significant(P<0.05). The latency of ulnar nerve, median nerve and peroneal motor nerve in the DPN group was higher than that of non-DPN group. And the MCV and peroneal nerve amplitude in the DPN group was lower than that of the non-DPN group, and the difference was significant(P<0.05). The SCV of the ulnar nerve, the median nerve and the superficial peroneal nerve sensory nerve in the DPN group was lower than that in the non-DPN group, and the latency of median nerve and superficial peroneal nerve in the DPN group was longer than that of non DPN group,and the difference was statistically significant(P<0.05). The clinical distribution of neuropathy in DPN patients was as followed: sensory nerve: 22 cases of ulnar nerve, 29 cases of median nerve, 22 cases of superficial peroneal nerve; motor nerve: ulnar nerve in 15 cases, median nerve in 6 cases, 17 cases of common peroneal nerve.Diabetic peripheral neuropathy related factors included age, duration, HDL-C(OR=2.3, 1.7, 2.1, P<0.05). Conclusion The patients with advanced age, long course of disease and low level of HDL-C are prone to peripheral neuropathy,and their sensory nerves and motor neurons have extended latency and the decrease of conduction velocity.The proportion of sensory nerve abnormalities is higher.
[Key words] Diabetes mellitus; Peripheral neuropathy; Clinical features; Related factors
临床上因为对糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)认识不足以及处理不当,每年导致不必要的患者死亡及巨额医疗费用浪费。足部溃疡是糖尿病周围神经病变的晚期表现,如果处理得当,有50%的患者是可以避免足部溃疡的发生的,但是在临床工作中因多种原因,患者常常未能得到及时的处理,进而发生难以挽回的结果。本研究回顾分析总结糖尿病周围神经病变的临床特征,分析相关因素,以期为临床上的预防、诊断及治疗提供依据,现报道如下。
1 资料与方法
1.1 一般资料
选择2012年6月~2015年12月在我院门诊的2型糖尿病患者130例的临床资料进行回顾性分析。其中男75例,女55例。采用神经传导速度结果评价患者是否存在周围神经病变,并根据结果分为合并周围神经病变组与未合并周围神经病变组。纳入标准:符合WHO的2型糖尿病诊断标准;年龄≥18岁;合并周围神经病变的患者诊断符合“糖尿病周围神经病变诊疗规范”标准。排除标准:合并黑棘皮病、高胰岛素血症、肥胖患者。合并周围神经病变组(diabetic peripheral neuropathy,DPN)82例,其中男49例,女33例,年龄43~77岁,平均(57.1±11.3)岁;未合并周围神经病变组(非DPN)48例,其中男26例,女22例,年龄41~73岁,平均(51.9±12.1)岁。本研究经过医院医学伦理会同意。
1.2 诊断标准
糖尿病周围神经病变:有明确糖尿病病史,在诊断糖尿病时或者诊断之后出现神经病变,符合糖尿病周围神经病变症状及体征;踝反射异常、针刺痛觉异常、振动觉异常、压力觉异常,有上述异常任一;排除其他原因导致的神经病变,排除因药物导致的神经毒性作用而发生的损伤。
1.3 研究方法
统计患者一般资料及临床资料,包括性别、年龄、病程、BMI、静息心率、SBP、DBP、空腹血糖、HbA1c、TC、TG、LDL-C以及HDL-C。空腹血糖采用葡萄糖氧化酶法检测,HbA1c采用高效液相色谱法检测,血脂采用西门子全自动生化分析仪检测。神经传导速度采用肌电诱发电位仪检测,测定部位包括双侧正中神经、尺神经、腓总神经的运动神经的潜伏期、动作电位波幅、运动神经传导速度(Motor nerve conduction velocity,MCV);检测正中神经、尺神经与腓浅神经感觉神经的潜伏期、动作电位波幅以及感觉神经传导速度(Sensory nerve conduction velocity,SCV)。
1.4 统计学方法
采用SPSS11.0统计学软件对数据进行分析,计数资料采用χ2检验,计量资料采用均数±标准差(x±s) 表示,采用t检验。P<0.05为差异有统计学意义。
2 结果
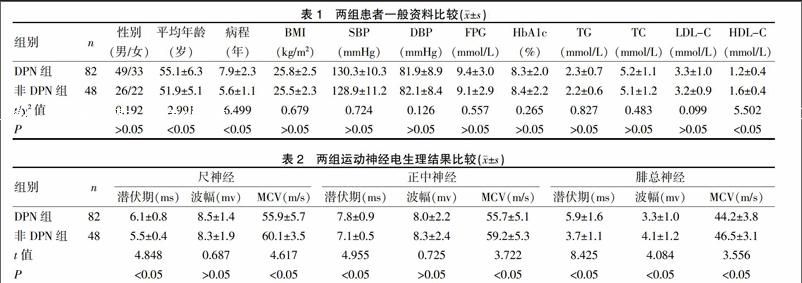
2.1 DPN组与非DPN组患者一般资料及临床资料比较
DPN组年龄显著大于非DPN组,病程显著长于非DPN组,HDL-C水平显著低于非DPN组,差异有统计学意义(P<0.05)。见表1。
2.2 两组运动神经电生理结果比较
见表2。DPN组尺神经、正中神经以及腓总神经运动神经潜伏期较非DPN组长,MCV较非DPN组低,腓总神经波幅较非DPN组低,差异有统计学意义(P<0.05)。
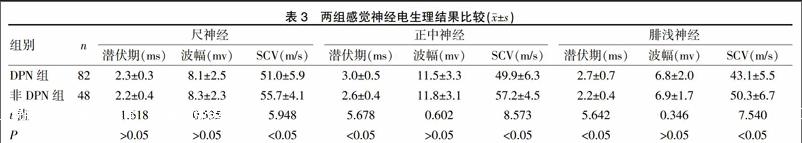
2.3两组感觉神经电生理结果比较
见表3。DPN组尺神经、正中神经以及腓浅神经感觉神经SCV较非DPN组低,正中神经以及腓浅神经潜伏期较非DPN组长,差异有统计学意义(P<0.05)。
2.4 DPN患者神经病变临床分布
感觉神经:尺神经22例,正中神经29例,腓浅神经22例;运动神经:尺神经15例,正中神经6例,腓总神经17例。
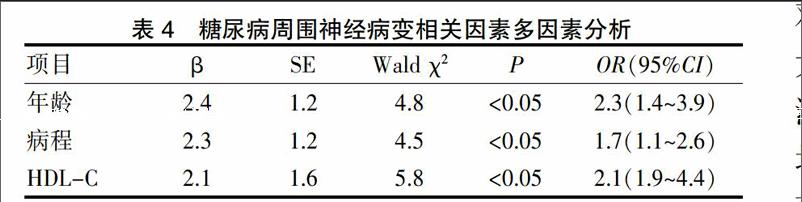
2.5 糖尿病周围神经病变相关因素多因素分析
见表4。糖尿病周围神经病变相关因素包括年龄、病程、HDL-C(OR=2.3、1.7、2.1,P<0.05)。
3讨论
神经病变研究组为糖尿病周围神經病变提出了三个指南,建立糖尿病周围神经病变及自主神经病变流行病变学研究指南,建立实施糖尿病神经病变临床试验指南,建立针对糖尿病周围神经病变临床处理指南。《糖尿病周围神经病变门诊处理国际指南》是基于上述第三项指南要求完成,旨在为糖尿病周围神经病变初级及医院处理提供一个国际广泛接受的清晰的临床诊断与治疗指导,其广泛应用将使此并发症得到更早的诊断、更佳的处治,减少晚期不良预后。糖尿病周围神经病变包括末梢感觉运动多神经病变、自主神经病变和单神经病变等。其中感觉运动多神经病变是最为常见的形式,也是本指南重点关注的对象。尽管发病率因条件不同而有所差异,但多数观点支持周围神经病变在糖尿病患者中的发病率约为30%。在美国,神经病变的晚期并发症足溃疡的发病率为每年3%。神经病变也是截肢/趾的主要因素之一,不同的国家报道的截肢/趾率不尽相同,这是因为其糖尿病和糖尿病足病的处理方法及效果存在很大差异。据估计,40%的成人非外伤性下肢或足截肢/趾是由糖尿病引起。至少一半以上的患者截肢/趾是可以设法避免的,因此,在初级医疗体系中,迫切需要改善神经病变的诊治状况。许多患者都已经发生足溃疡了,其糖尿病还没能得到及时的诊断,更别说神经病变的诊断了。神经病变会给医疗花费带来巨大负担,在美国,神经病变晚期并发症,如足部溃疡、截肢/趾,其医疗花费相当于糖尿病其他相关花费的总和。糖尿病周围神经病变是在排除了其他原因的情况下,糖尿病患者出现周围神经功能障碍相关的症状、体征表现。
糖尿病周围神经病变是糖尿病常见的、严重的并发症之一,临床表现不一,神经受累可呈局灶性,也可呈弥漫性。有报道糖尿病患者有50%有周围神经病变,致残率高,影响患者生活质量,加重经济负担。糖尿病周围神经病变包括非对称性周围神经病变以及对称性周围神经病变。后者临床常见,患者发病年龄大,女性多见,自足趾、足底始发,随着病情的发展,逐渐向上发展,至上肢、躯干、面部,呈对称性,大小神经均可被累及。温度觉异常提示小纤维受累,其可单独存在,也可与振动觉异常同时存在,而后者提示大纤维神经受累。小纤维受累的患者主要表现为疼痛,呈灼烧样以及异常性疼痛,神经受累的程度与疼痛程度无明显的相关性,至后期,疼痛可减轻,可有排汗减少等自主神经功能紊乱,无髓神经介导的温度觉、痛觉异常,触压觉减退,肌力以及反射可正常。大纤维受累的患者可有疼痛,主要为深部钝痛,位置觉、振动觉、反射、肌力异常,到疾病后期,患者可出现严重的肌无力以及感觉缺失,甚至部分老年患者因行走困难而导致摔倒几率增加。临床上最常见的是大小纤维均受累,但只有30%~40%的患者出现麻木、疼痛、走路不稳等症状,因此临床上应排除其他原因导致的周围神经病变,并且需要借助于相应的方法明确诊断。在本次研究中,患者运动神经及感觉神经均有损伤,而其中感觉神经损伤的比例更高,而感觉神经损伤,感觉异常是导致患者发生糖尿病足的主要机制之一。
糖尿病周围神经病变发病机制还不十分明确,目前认为与微血管病变有关,微血管病变导致微循环障碍,神经内膜缺氧,神经纤维受损,形成糖基化终末产物,多元醇通路亢进,肌醇代谢异常,自由基损伤,脂代谢障碍,神经营养因子缺乏,这些均可导致周围神经损伤。糖尿病存在脂代谢异常,促进了糖尿病周围神经病变的发生及发展。糖尿病患者LDL氧化、糖基化增加,具有较强的细胞毒性,破坏内皮细胞,损害其功能,导致局部微血管病变,促进糖尿病周围神经损伤。在本次研究中也显示,HDL-C水平下降是周围神经病变的独立影响因素。
病程是糖尿病周围神经病变的独立危险因素。糖尿病病程越长,患者代谢紊乱时间越长,葡萄糖毒性等因素促使糖尿病微血管病变,促进周围神经病变的发生。在本次研究中,周围神经病变患者平均年龄更大。既往也有研究显示,患者年龄小,病程则通常相对较短,预后相对较好。但也有研究结果与本次结果并不一致,年龄小的患者周围神经病变的发生率反而较高,认为年龄小者大多初次诊断糖尿病,血糖控制相对较差,更容易发生神经损害,而年龄较大的患者已经进行了较好的干预治疗,血糖控制较好,因此神经损害发生率相对较低。因此对于年龄对糖尿病周围神经病变的影响结果并不统一。我们的研究显示,年龄越大的患者周围神经病变风险越大,一是年龄大,病程常常较长,脂代谢紊乱时间较长,老年人本身因机体功能下降,脂代谢紊乱机率更高,因此微血管病变、周围神经损伤的机率也更高。在本次研究中,HDL-C水平下降是糖尿病周围神经病变的独立影响因素。长期的血浆游离脂肪酸浓度升高影响胰岛素分泌,有学者认为糖尿病及并发症机制与脂代谢障碍有关。脂代谢紊乱能够通过多血管活性因子直接损害神经细胞结构与功能。高脂血症还会损伤血管内膜细胞,损害微血管,血液灌注下降,血液黏滞度增加,血流速度减缓,微血栓形成,神经供血下降,神经细胞损伤。在本次研究中,两组患者空腹血糖并没有显著的统计学差异。既往研究显示,高血糖可导致细胞内线粒体电子传递链产生大量过氧化产物,这些产物影响局部代谢以及局部的循环障碍,导致缺血缺氧。高血糖还会导致蛋白质发生非酶促糖基化,导致神经鞘膜蛋白以及微管蛋白糖基化,在体内蓄积,导致巨噬细胞发生特异性反应,导致低密度脂蛋白水平升高,刺激血管壁,引发动脉粥样硬化,损害神经鞘完整性。非酶促糖基化蛋白质能够抑制细胞基质对神经的营养作用。神经细胞长期处于高血糖环境中,而不能利用高血糖中的果糖,使大量的果糖堆积,局部渗透压升高,导致神经纤维肿胀,变性,直至坏死。有研究显示,糖尿病周围神经病变患者空腹血糖、HbA1c水平较无周围神经病变的患者要高,认为血糖水平促进了周围神经病变。以期在今后的研究中进一步证实血糖与周围神经病变的关系。
综上所述,糖尿病周围神经病变是糖尿病常见的并发症,年龄大、病程长、HDL-C水平低的糖尿病患者容易发生周围神经病变,感觉神经以及运动神经均存在潜伏期延长、传导速度下降;感觉神经发生异常的比例更高。
[参考文献]
[1] 张宏颖,苏海玉,王永锟,等. 神经传导速度检测在糖尿病周围神经病变疾病诊断及效果评估的应用价值[J].中国实验诊断学,2016,20(12):2112-2114.
[2] 趙珩,余江毅. 糖尿病周围神经病变发病机制研究进展[J]. 药学与临床研究,2013,21(3):264-267.
[3] Kumar HK,Kota S,Basile A,et al. Profile of microvascular disease in type 2 diabetes in a tertiary health care hospital in India[J]. Ann Med Health Sci Res,2012,2(2):103-108.
[4] Shimoshige Y,Enomoto R, Aoki T, et al. The involvement of aldose reductase in alterations to neurotrophin receptors and neuronal cytoskeletal protein mRNA levels in the dorsal root ganglion of streptozotocin-induced diabetic rats[J]. Biol Pharm Bull,2010,33(1):67-71.
[5] 李兴梅,王艳妮. 老年2型糖尿病患者周围神经病变与25-羟维生素D3的相关性研究[J]. 中国医学前沿杂志(电子版),2016,8(5):107-110.
[6] Bouhassira D,Letanoux M,Hartemann A. Chronic pain with neuropathic characteristics in diabetic patients:A French crosssectional study[J]. PLoS One,2013,8(9):e74195.
[7] 丁昉,劉邦忠,贾月霞,等. 2型糖尿病患者并发周围神经病变的影响因素分析[J]. 中国临床康复,2003,7(3):440-441.
[8] 李海莎,李才锐,孙曙光. 糖尿病周围神经病变的影响因素[J]. 世界最新医学信息文摘(电子版), 2016,16(26):37-38.
[9] 孙卓浩,刘妍,周冬梅,等. 阿米替林治疗痛性糖尿病周围神经病变的临床研究[J]. 山东大学学报:医学版,2015,53(5):81-84.
[10] Habib AA,Brannagan TH 3rd. Therapeutic strategies for diabetic neuropathy[J]. Curr Neurol Neurosci Rep, 2010, 10(2):92-100.
[11] Farmer KL,Li C,Dobrowsky RT. Diabetic peripheral neuropathy:Should a chaperone accompany our therapeutic approach?[J]. Pharmacol Rev,2012,64(4):880-900.
[12] Murakami T,Iwanaga T,Ogawa Y,et al. Development of sensory neuropathy in streptozotocin-induced diabetic mice[J]. Brain Behav,2013,3(1):35-41.
[13] 刘瑶霞,陈树,周晋,等. 糖尿病患者周围神经病变早期筛查的临床意义及危险因素分析[J]. 中国糖尿病杂志,2016,24(6):536-539.
[14] Herman WH,Pop-Busuit. Use of the Michigan neuropathy screening instrument as a measure of distal symmetrical peripheral neu-ropathy in type 1 diabetes:Results from the diabetes control and complications trial/epidemiology of diabetes interventions and complications[J].Diabet Med, 2012,29:937-944.
[15] 杨丹,鲍海萍,黄山. 糖尿病周围神经病变患者的电生理检查结果及患病危险因素分析[J]. 中国糖尿病杂志,2016,24(6):540-542.
[16] 成玉泽,李剑波. 雪旺细胞在糖尿病周围神经病变发病机制中的作用[J]. 国际内科学杂志,2009,36(1):26-29.
[17] 路亚,韩方义,王修兵,等. 以周围神经病变为首发症状的糖尿病62例临床分析[J]. 安徽医学,2003,24(1):56.
[18] 沈玉莉,杨毅华. 2型糖尿病患者周围神经病变的危险因素分析[J]. 中国实用医刊,2012,39(11):60-62.
[19] Kou ZZ, Li CY, Tang J, et al. Down-regulation of insulin signaling is involved in painful diabetic neuropa- thy in type 2 diabetes[J]. Pain Physician,2013,16(2):E71-83.
[20] Balakumar M,Saravanan N,Prabhu D,et al. Benefits of early glycemic control by insulin on sensory neuropathy and cataract in diabetic rats[J]. Indian J Exp Biol, 2013, 51(1): 56-64.
(收稿日期:2017-03-14)
