Cyr61、MMP—3在痛风性肾病大鼠肾脏中的表达
2017-07-18张宁宁赵玉杰牛效清
张宁宁 赵玉杰 牛效清
[摘要] 目的 研究富含半胱氨酸蛋白61(cysteine-rich 61,Cyr61/CCN1)、基质金属蛋白酶-3(matrix metalloproteinases-3,MMP-3)在痛风性肾病大鼠肾脏组织的分布及表达,探讨Cyr61在肾间质损伤中的作用。 方法 20只雄性Wistar大鼠随机分为对照组和模型组。模型组大鼠给予含0.2%腺嘌呤和20%酵母浸粉的高嘌呤饲料喂饲,周期90 d。模型建立后行HE染色并用免疫组化法检测Cyr61、MMP-3在肾组织的表达情况。 结果 光镜下两组MMP-3表达部位一致,主要分布于肾皮质内的小管上皮细胞胞浆中且以基底膜侧表达为著,模型组阳性表达强度减弱(P<0.05);两组Cyr61均主要表达于近端小管上皮细胞胞浆内,模型组阳性表达增加(P<0.01)。 结论 在肾损伤末期Cyr61对MMP-3的诱导作用减弱,防护能力下降。
[关键词] 富含半胱氨酸蛋白61;基质金属蛋白酶-3;痛风性肾病;肾间质损伤
[中图分类号] R285.5 [文献标识码] A [文章编号] 1673-9701(2017)17-0033-03
[Abstract] Objective To investigate the distribution and expression of cysteine-rich 61 and matrix metalloproteinases-3 in renal tissue of rats with gouty nephropathy, and to explore the role of Cyr61 in renal interstitial injury. Methods Twenty male Wistar rats were randomly divided into two groups: the control group and the model group. Rats in the model group were fed with high purine diets containing 0.2% adenine and 20% yeast extract for a period of 90 days. After the model was established, HE staining was performed and the expression of Cyr61 and MMP-3 in renal tissue was detected by immunohistochemistry. Results The expressions of MMP-3 in the two groups were mainly distributed in the cytoplasm of tubular epithelial cells which in the renal cortex, and the expression of MMP-3 in the model group was decreased(P<0.05) .Two groups of Cyr61 were mainly expressed in the cytoplasm of proximal tubule epithelial cells,and the positive expression in model group was increased(P<0.01). Conclusion At the end of renal injury, the induction of MMP-3 by Cyr61 was weakened, and the protective ability decreased.
[Key words] Cyr61; MMP-3; Gouty nephropathy; Renal interstitial injury
痛风(gout)是尿酸鹽沉积性炎性疾病,以血清尿酸水平升高伴急慢性关节炎、间质性肾炎或肾结石为主要临床表现。基质金属蛋白酶-3(matrix metalloproteinases-3,MMP-3)在炎症反应中占有重要地位,可使炎症细胞聚集浸润,调节炎症反应[1],同时MMP-3还通过降解细胞外基质(extracellular matrix,ECM)参与肾脏纤维化的发生。富含半胱氨酸蛋白61(cysteine-rich 61,Cyr61/CCN1)是一种分泌型蛋白质,其表达水平及生物学功能具有组织特异性[2]。研究发现Cyr61与肾小球疾病、肾血管疾病、肾小管间质损伤和纤维化等密切相关,但其作用机制有待进一步研究[3]。本文尝试通过对痛风性肾病大鼠肾组织中MMP-3、Cyr61分布及表达变化的研究,探讨Cyr61在肾间质损伤中的作用。
1 材料与方法
1.1 动物模型的制备及分组
6~8周龄清洁级雄性Wistar大鼠20只,体重188~220 g,购于哈尔滨医科大学实验动物中心[SCXK(黑)2013-001],适应性喂养1周后随机等分为对照组和模型组。对照组给予普通饲料喂养,模型组给予含0.2%腺嘌呤和20%酵母浸粉的高嘌呤饲料喂饲,药物剂量每只大鼠酵母浸粉20 g/(kg·d),腺嘌呤200 mg/(kg·d),依据体重限量投放饲料。两组大鼠自由饮水,每周称重1次,造模周期为90 d。
1.2 主要试剂
腺嘌呤产自Sigma公司;酵母浸粉产自北京奥博星生物公司;MMP-3、Cyr61多克隆抗体及即用型SABC免疫组化试剂盒均产自武汉博士德生物公司。
1.3 病理学检测
1.3.1 苏木素-伊红(HE)染色 肾组织经固定、脱水、透明以及石蜡包埋后,制成3 μm厚组织切片,HE染色后光镜下观察组织结构变化。
1.3.2 免疫组织化学染色 将石蜡组织切片脱蜡、脱水,然后抗原修复、孵育抗体、DAB显色,最后在LEICA DM4000B显微镜下观察,每张切片随机选取10个视野拍摄图片,应用Image pro plus 6.0图像分析系统对图像进行分析,测量阳性区域的累积光密度值(IOD)。
1.4 统计学方法
采用SPSS 20.0软件进行统计分析。计量资料以中位数(M)、四分位数间距(QR)表示;对非正态分布或方差不齐的计量资料采用Mann-Whitney U检验,P<0.05为差异有统计学意义。
2 结果
2.1 组织病理观察
对照组肾单位形态规则,间质内无炎性细胞浸润。模型组肾组织结构紊乱,肾小球萎缩;近端小管上皮细胞水肿,管腔扩张,偶见颗粒管型及蛋白管型;髓袢和集合管内可见棕黄色的沉积物;间质纤维化,可见大量淋巴细胞、单核细胞及巨噬细胞浸润,见封三图5。
2.2 肾组织中MMP-3的表达部位及水平
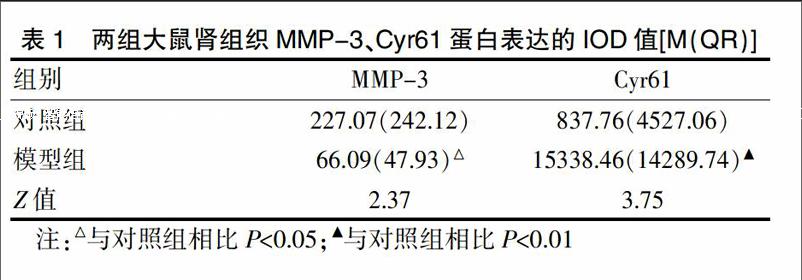
光镜下,对照组MMP-3主要分布于肾皮质内的小管上皮细胞胞浆中且以基底膜侧表达为著。模型组MMP-3的阳性部位与对照组一致,但表达强度减弱,与对照组间存在显著性差异(P<0.05),见表1、封三图6。
2.3 肾组织中Cyr61的表达部位及水平
光镜下,两组Cyr61均主要表达于近端小管上皮细胞胞浆内。由于Cyr61分泌后与硫酸乙酰肝素蛋白多糖结合,蛋白构象改变,抗原位点封闭,在ECM中不能利用免疫组化方法检测[4]。本研究未观察到Cyr61在小管间质表达,与以往研究一致[4,5]。模型组阳性表达增加,与对照组相比,差异具有统计学意义(P<0.01),见表1、封三图7。
3 讨论
MMP-3又称间质溶解素1(stromelysins-1),在肾脏主要由肾小管的上皮细胞以无活性的酶原形式分泌,只有被活化后才能降解基质蛋白[6]。激活后的MMP-3可降解几乎全部肾小球基底膜和ECM的组成成分[7],并能够激活其他MMPs家族成员,共同参与肾间质ECM的降解和转运。正常情况下MMP-3的表达量极少[7],而在炎症、胚胎发生、血管形成、肿瘤侵袭转移时其表达量上升。研究证实,在急性痛风性关节炎患者关节滑液中,MMP-3浓度高于非炎性关节疾病[8];在中、重度系膜增生性肾炎患者的肾小球中MMP3蛋白表达增强[9]。
紫外线、细胞因子和生长因子等可引起MMP-3发生转录水平的改变。白细胞介素1、神经生长因子、表皮生长因子、血小板源性生长因子(PDGF)等可诱导MMP-3表达,而转化生长因子-β(TGF-β)、糖皮质激素则抑制MMP-3的表达[7,9];此外,组织金属蛋白酶抑制剂-1(tissue inhibitor of metalloproteinase-1,TIMP-1)通过与MMP-3的催化区域结合形成复合物,抑制MMP-3的活性[3-9]。
近年来,ECM降解机制的研究日益受到人们的重视。MMPs及TIMPs是调节ECM动态平衡的最重要的酶系之一,其活性的变化及比例的失衡是最终导致肾脏纤维化发生的主要机制。Cyr61作为整合素的配体,是抗纤维化中重要的一个环节[10]。
Cyr61是由上皮细胞、成纤维细胞、软骨细胞、血管内皮和平滑肌细胞等多种间质细胞,在血清、PDGF、TGF-β等刺激下生成的即刻蛋白[5]。Cyr61作为一种信号分子具有多种功能,能够趋化细胞及促进细胞增殖、粘附[2];诱导MMP-1、MMP-3和TIMP1表达上调[11],引起ECM重构;调节多个基因的转录,在细胞免疫应答、炎症反应和肿瘤细胞恶性生物学行为等生理病理过程中发挥重要作用[12]。
本研究中我们通过喂饲大鼠含酵母及腺嘌呤饲料的方式来模拟人类痛风性肾病的发病机制,并依据临床急慢性肾病的判定时长设定造模周期,从而引发大鼠代谢异常相关的慢性间质性肾炎。从实验结果中我们发现,MMP-3在肾组织中的阳性表达明显减弱,同其他肾纤维化研究的结果一致[13,14]。然而Cyr61在肾组织中的阳性表达增加,與对照组相比差异有统计学意义(P<0.01)。由于活化的MMP-3能够降解ECM成分,故在肾纤维化进程中起保护性作用。PDGF可直接或间接通过刺激Cyr61的生成,促进MMP-3在肾脏的表达;作为致纤维化的细胞因子TGF-β一方面可以降低MMP-3的表达量,另一方面又能刺激Cyr61的产生。由此我们认为Cyr61作为机体抵抗纤维化的防御性蛋白,其表达增多是机体的一种代偿机制。
有研究称肾缺血损害后3~6 h Cyr61便可在近端肾小管直部诱导生成,并于6~9 h达峰后降低[15]。赵丽君等[13]的研究显示,在肾损伤早期MMP-3的表达量同Cyr61一样也呈现出先增高后逐渐降低的趋势。推测MMP-3的早期升高可能与Cyr61的诱导作用相关。然而在本次实验中我们发现MMP-3与Cyr61的表达水平是相悖的,这说明Cyr61在肾损伤的末期对于MMP-3的促生成作用是不足的。同时由于Cyr61对MMP3及其活性抑制剂TIMP1均具有上调表达的作用,且在肾损伤末期TIMP仍能大量表达[14],导致MMP-3的降解活性下降ECM积聚,进一步削弱了Cyr61的抗纤维化作用。
肾损伤早期Cyr61虽通过诱导MMP-3的生成发挥抗纤维化作用,但其代偿能力有限,在肾损伤末期诱导作用减弱,防护能力下降。ECM合成和降解失衡是肾间质纤维化发生与发展的重要机制之一。研究肾间质损伤中的信号转导,对认识疾病的本质,为疾病的治疗和基因靶向干预提供了依据。
[参考文献]
[1] Merkle M,Ribeiro A,K?觟ppel S,et al. TNFα enhances TLR3-dependent effects on MMP-9 expression in human mesangial cells[J]. Cell Biology International,2012,36(12):1155-1160.
[2] 李东,周新,郑方,等. Cyr61的研究进展[J]. 国际检验医学杂志,2005,26(7):424-426.
[3] 田寿福,王筱霞,汪年松. CCN1与肾脏疾病的研究进展[J]. 中国中西医结合肾病杂志,2011,12(9):831-833.
[4] Yang,Lau. Cyr61,product of a growth factor-inducible immediate early gene, is associated with the extracellular matrix and the cell surface[J]. Cell Growth & Differentiation the Molecular Biology Journal of the American Association for Cancer Research,1991,2(7):351-357.
[5] 徐岩. 缺血性急性肾损伤患者体液Cyr61定量检测及其机制研究[D]. 第二军医大学,2008.
[6] 闫训友,薛冲,刘志敏,等. 基质金属蛋白酶及其组织抑制剂研究进展[J]. 生物技术通讯,2004,15(3):302-305.
[7] 郭晓冲,李如波,梁红霞,等. 基质金属蛋白酶3研究進展及其法医学意义[J]. 中国法医学杂志,2008,23(3):184-186.
[8] Liu R,Lioté F,Rose DM,et al. Proline-rich tyrosine kinase 2 and Src kinase signaling transduce monosodium urate crystal-induced nitric oxide production and matrix metalloproteinase 3 expression in chondrocytes[J]. Arthritis & Rheumatism,2004,50(1):247.
[9] 黄志芳,朱妙珍,何娅妮,等. ET-1、MMP-3、TIMP-1在人肾小球中的表达及意义[J]. 第三军医大学学报,2003, 25(11):1009-1012.
[10] 张承彦. CCN家族在纤维化中的研究进展[J]. 基础医学与临床,2014,34(3):410-413.
[11] Chen CC,Chen N,Lau LF. The angiogenic factors Cyr61 and connective tissue growth factor induce adhesive signaling in primary human skin fibroblasts[J]. Journal of Biological Chemistry,2001,276(13):10443-10452.
[12] Chen CC,Lau LF. Functions and mechanisms of action of CCN matricellular proteins[J]. International Journal of Biochemistry & Cell Biology,2009,41(4):771.
[13] 赵丽君,崔建军,李秀花. MMP-3和TIMP-2在UUO大鼠肾间质的表达[J]. 中国中西医结合肾病杂志,2013, 14(3):212-214.
[14] 付平,冯梅,张翥,等. 苦参碱对肾小管间质MMP-3和TIMP-1的影响[J]. 中国中西医结合肾病杂志,2006,7(2):1-2.
[15] Muramatsu Y,Tsujie M,Kohda Y,et al. Early detection of cysteine rich protein 61(CYR61,CCN1)in urine following renal ischemic reperfusion injury[J]. Kidney International,2002,62(5):1601-1610.
(收稿日期:2017-04-16)
