替吉奥治疗卡培他滨耐药转移性乳腺癌的疗效分析
2017-07-18王少敏倪曙民
王少敏,叶 孟,倪曙民
·论著·
替吉奥治疗卡培他滨耐药转移性乳腺癌的疗效分析
王少敏*,叶 孟,倪曙民
目的 分析卡培他滨单药治疗耐药后的转移性乳腺癌患者接受替吉奥单药治疗的疗效及安全性。方法 回顾性分析2011年11月—2015年5月宁波大学医学院附属医院肿瘤内科治疗的22例转移性乳腺癌患者的临床资料。22例患者接受卡培他滨单药治疗,在卡培他滨耐药后接受替吉奥单药治疗,直至疾病进展、不可耐受的毒副作用或患者拒绝治疗。按照实体瘤疗效评价标准(RECIST)进行替吉奥临床疗效评价,观察进展时间(TTP)及总生存期(OS),记录疼痛评分及CA153水平,根据美国国家癌症研究所发布的常见不良反应事件评价标准(CTCAE v4.02)进行毒副作用评价。结果 22例卡培他滨耐药的转移性乳腺癌患者接受替吉奥治疗后5例部分缓解,12例疾病稳定,5例疾病进展,客观有效率(ORR)为22.7%(5/22),临床获益率(CBR)为77.3%(17/22);中位TTP为113 d(22~218 d),中位OS为20.2个月(3.8~38.2个月)。替吉奥治疗前有15例患者有疼痛表现,未经提高止痛药物剂量,治疗后10例患者疼痛减轻。开始替吉奥治疗时CA153水平与治疗过程中最低CA153水平比较,差异有统计学意义〔(174.8±67.4)U/ml与(102.8±69.7)U/ml,t=4.174,P=0.001〕。替吉奥治疗的毒副作用均可耐受,主要毒副作用有厌食〔59.1%(13/22)〕、恶心〔50.0%(11/22)〕、乏力〔45.5%(10/22)〕、中性粒细胞计数减少〔45.5%(10/22)〕、贫血〔40.9%(9/22)〕、腹泻〔36.4%(8/22)〕、手足综合征〔27.3%(6/22)〕、转氨酶升高〔22.7%(5/22)〕及呕吐〔18.2%(4/22)〕等。毒副作用多为Ⅰ~Ⅱ级,仅3例发生Ⅲ级毒副作用。结论 替吉奥单药对于卡培他滨单药耐药的转移性乳腺癌有一定的疗效,而且耐受性良好。因此,对于使用卡培他滨单药治疗后耐药的转移性乳腺癌可考虑选用替吉奥单药治疗。
乳腺肿瘤;替吉奥;卡培他滨;抗肿瘤联合化疗方案
王少敏,叶孟,倪曙民.替吉奥治疗卡培他滨耐药转移性乳腺癌的疗效分析[J].中国全科医学,2017,20(20):2469-2473.[www.chinagp.net]
WANG S M,YE M,NI S M.Therapeutic efficiency of tegafur,gimeracil and oteracil potassium for metastatic breast cancer resistant to capecitabine[J].Chinese General Practice,2017,20(20):2469-2473.
乳腺癌是女性最常见的肿瘤,随着生活方式的改变及人口老龄化,发病率逐年升高[1]。而相当一部分乳腺癌患者会出现远处转移,最常见的转移部位有骨、肺、肝及脑等。乳腺癌内科治疗手段包括化疗、内分泌治疗、靶向治疗等。由于乳腺癌对内科治疗手段比较敏感,使得转移性乳腺癌患者仍有较长的生存期,因此转移性乳腺癌的治疗是临床中一个值得探讨的问题。
卡培他滨为口服氟尿嘧啶类化疗药物,是转移性乳腺癌治疗中有效的化疗药物之一。卡培他滨单药治疗乳腺癌的客观有效率(ORR)约为20%[2]。卡培他滨联合其他细胞毒性药物或靶向药物在转移性乳腺癌的治疗中也取得了较好的疗效[3-8]。卡培他滨的主要毒副作用为手足综合征,但大多数患者症状较轻,其次消化道反应及骨髓毒性也较轻,因此对于晚期乳腺癌治疗应用卡培他滨是较好的选择[9]。替吉奥作为另一种口服的氟尿嘧啶类药物,同样具有毒副作用轻及耐受良好的优点,在多种实体肿瘤中获得较好的疗效,在乳腺癌中也有一定的疗效[10-14]。尽管两者均为口服氟尿嘧啶类化疗药物,但在药物成分及作用机制上有一定的区别。对于卡培他滨治疗耐药的转移性乳腺癌患者选择替吉奥治疗的疗效如何,经PubMed检索可见两篇文献报道[15-16],国内未检索到相关文献报道。基于此,本研究对22例转移性乳腺癌患者在卡培他滨单药治疗耐药后采用替吉奥单药治疗,取得了一定疗效,现报道如下,以期为转移性乳腺癌患者卡培他滨单药治疗耐药后的治疗提供借鉴。
1 对象与方法
1.1 研究对象 选取2011年11月—2015年5月宁波大学医学院附属医院肿瘤内科治疗的22例转移性乳腺癌患者。患者的临床分期均为Ⅳ期;均为女性;年龄47~76岁,中位年龄59岁;转移灶经骨ECT、MRI及CT检查进行确诊;转移病灶1~6个,中位转移病灶为2个;20例患者有骨转移,16例患者有内脏转移;一般状况根据美国东部肿瘤协作组(ECOG)评分,0分2例,1分16例,2分4例;激素受体阳性16例,阴性6例;绝经前2例,绝经后20例;既往使用蒽环类化疗药物16例,紫杉类化疗药物15例,吉西他滨11例;既往使用过曲妥珠单抗2例,未使用20例。纳入标准:(1)年龄≥18岁;(2)患者无认知功能障碍;(3)所有患者的乳腺癌原发灶手术切除,经病理证实为浸润性小叶癌或浸润性导管癌;(4)既往未接受口服氟尿嘧啶类药物治疗;(5)ECOG评分0~2分;(6)中性粒细胞计数≥1.5×109/L,血小板计数≥75×109/L,丙氨酸氨基转移酶及天冬氨酸氨基转移酶<2.5×参考范围上限(肝转移时<5.0×参考范围上限),胆红素<1.25×参考范围上限;(7)心、肺及肾功能良好,预期生存>3个月;(8)患者对治疗方案及潜在风险知情同意。排除标准:(1)ECOG评分≥3分;(2)脑转移。
1.2 治疗方法 所有患者接受卡培他滨片(上海罗氏制药有限公司生产)单药口服治疗,卡培他滨的初始治疗剂量为2 500 mg·(m2)-1·d-1,服药2周停用1周,可根据毒副作用调整治疗剂量,卡培他滨单药治疗后出现疾病进展(PD)定义为卡培他滨耐药。卡培他滨耐药后接受替吉奥胶囊(山东新时代药业有限公司生产)单药口服治疗,替吉奥的治疗剂量根据体表面积:<1.25 m2,40 mg,2次/d;1.25~1.50 m2,50 mg,2次/d;>1.50 m2,60 mg,2次/d。替吉奥的常规用法为服药4周停用2周,对于耐受能力差的患者服药2周停用1周,治疗过程中可根据毒副作用调整治疗剂量,120 mg/d调整为100 mg/d,100 mg/d调整为80 mg/d,80 mg/d调整为60 mg/d。替吉奥单药治疗终点至PD、不可耐受的毒副作用或患者拒绝治疗。
1.3 观察指标 (1)疗效评价:常规自服用替吉奥42 d后开始评估临床疗效。此后每3周复查肿瘤标志物并观察症状变化,若无明显进展每2~3个月行系统的影像学检查评估临床疗效,若有明显进展及时进行系统的影像学检查。临床疗效按照实体瘤疗效评价标准(RECIST)进行评价。完全缓解(CR):指所有病灶消失,持续4周以上;部分缓解(PR):所有可测量病灶最大直径总和缩小30%,持续4周以上;PD:所有可测量病灶最大直径总和增大20%,或出现新病灶;疾病稳定(SD):除CR、PR及PD之外。ORR为CR+PR的患者例数占总例数的百分比。临床获益率(CBR)为CR+PR+SD的患者例数占总例数的百分比。(2)进展时间(TTP)及总生存期(OS):TTP为自服用替吉奥日至首次证实为PD日或替吉奥停药日;OS为自服用替吉奥日至患者死亡日或随访截止。(3)疼痛评分:采用数字评分法,记录患者开始接受替吉奥治疗时的疼痛评分,并记录替吉奥治疗42 d后的疼痛评分。(4)CA153水平:CA153水平采用化学发光法检测,记录患者开始接受替吉奥治疗时的CA153水平,并记录替吉奥治疗过程中最低的CA153水平。(5)毒副作用:毒副作用评价根据美国国家癌症研究所发布的常见不良反应事件评价标准(CTCAE v4.02)进行评价。
1.4 随访 治疗结束后通过查阅患者定期复查记录及电话方式进行随访,随访至2015-11-20,22例患者资料均完整,20例死亡,2例存活,0例失访。

2 结果
2.1 疗效及生存分析 22例卡培他滨耐药的转移性乳腺癌患者接受替吉奥治疗后5例PR,12例SD,5例PD,ORR为22.7%(5/22),CBR为77.3%(17/22)。开始替吉奥治疗后,22例患者的中位TTP为113d(22~218d)(见图1),中位OS为20.2个月(3.8~38.2个月)(见图2)。
2.1.1 依据激素受体状态的疗效评价 16例激素受体阳性患者,4例PR,10例SD,2例PD,ORR为4/16,CBR为14/16;6例激素受体阴性患者,1例PR,2例SD,3例PD,ORR为1/6,CBR为3/6。
2.1.2 依据既往对卡培他滨治疗反应的疗效评价 22例患者在接受卡培他滨治疗时,7例PR,10例SD,5例PD。7例对卡培他滨PR的患者,耐药后接受替吉奥治疗后,4例PR,3例SD,ORR为4/7,CBR为7/7。10例对卡培他滨SD的患者,耐药后接受替吉奥治疗后,1例PR,6例SD,3例PD,ORR为1/10,CBR为7/10。5例对卡培他滨PD的患者,耐药后接受替吉奥治疗后,3例SD,2例PD,CBR为3/5。
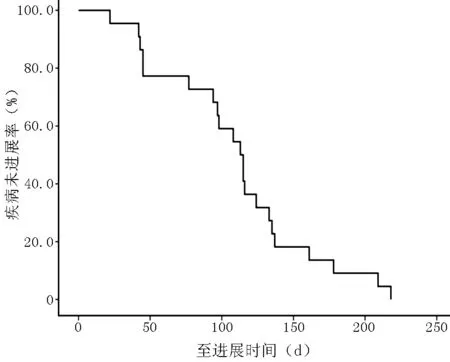
图1 替吉奥治疗卡培他滨耐药的转移性乳腺癌患者的TTP曲线
Figure1Kaplan-meiercurveofTTPfortegafur,gimeracilandoteracilpotassiummonotherapyinmetastaticbreastcancerpatientsresistingtocapecitabine
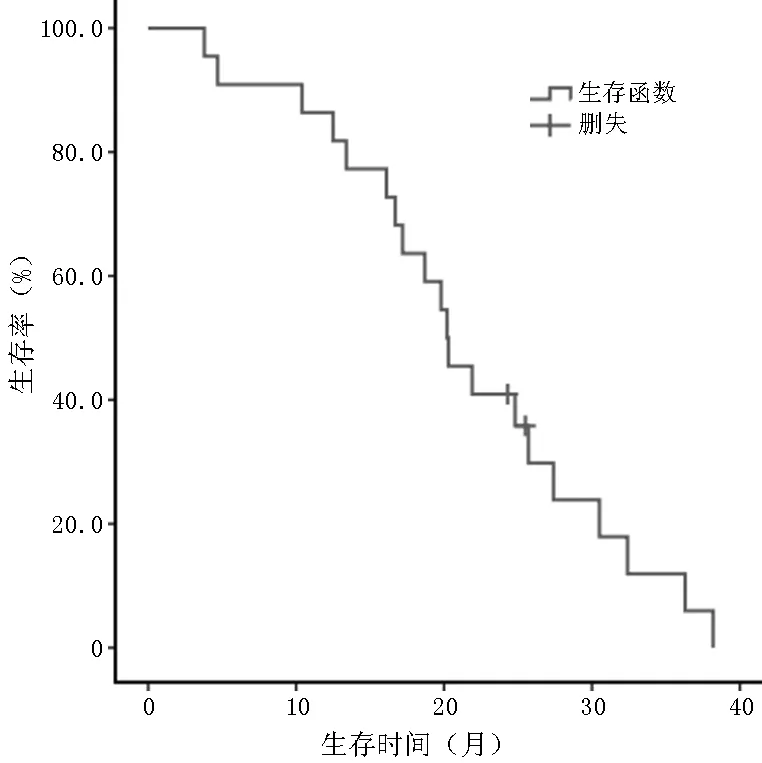
图2 替吉奥治疗卡培他滨耐药的转移性乳腺癌患者的OS曲线
Figure 2 Kaplan-meier curve of OS for tegafur,gimeracil and oteracil potassium monotherapy in metastatic breast cancer patients resisting to capecitabine
2.2 治疗前后疼痛评分及CA153水平比较 替吉奥治疗前15例患者有疼痛表现,未提高止痛药物剂量,治疗后10例患者疼痛减轻。开始替吉奥治疗时17例患者CA153水平升高,CA153水平为(174.8±67.4)U/ml,替吉奥治疗过程中最低CA153水平为(102.8±69.7)U/ml。治疗前后CA153水平比较,差异有统计学意义(t=4.174,P=0.001)。
2.3 毒副作用 替吉奥治疗的毒副作用均可耐受,无治疗相关性死亡。主要毒副作用有厌食(59.1%)、恶心(50.0%)、乏力(45.5%)、中性粒细胞计数减少(45.5%)、贫血(40.9%)、腹泻(36.4%)、手足综合征(27.3%)、转氨酶升高(22.7%)及呕吐(18.2%)。多数毒副作用均为Ⅰ~Ⅱ级,1例发生Ⅲ级手足综合征,经调整剂量及对症治疗后好转;1例发生Ⅲ级呕吐,1例发生Ⅲ级腹泻,经停药后好转(见表1)。
表1 替吉奥治疗的毒副作用发生率〔n(%)〕
Table 1 Incidence rates of side effects of tegafur,gimeracil and oteracil potassium
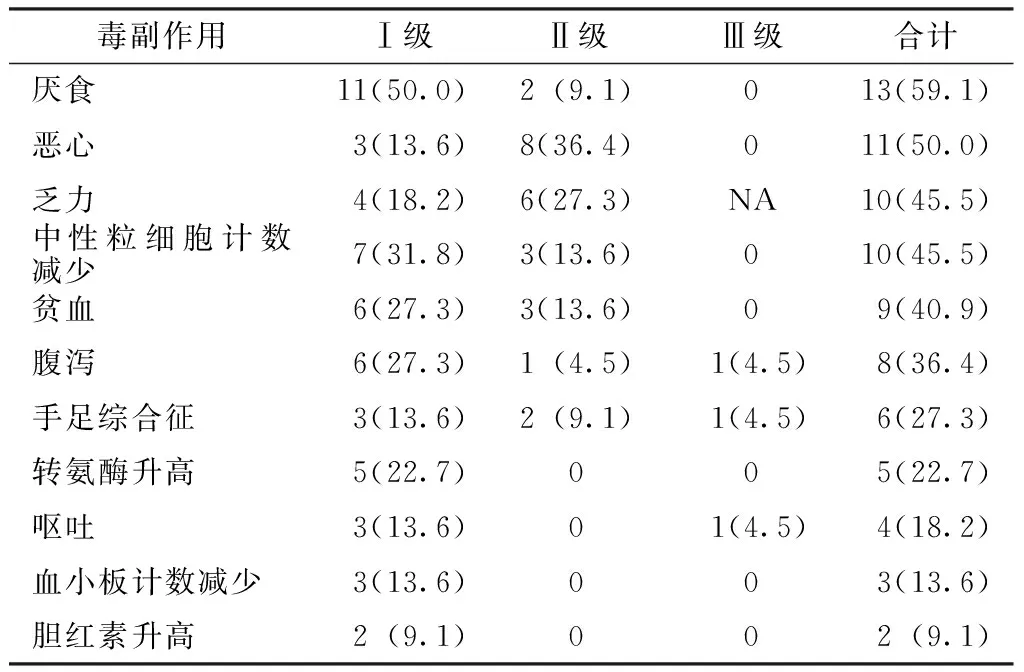
毒副作用Ⅰ级Ⅱ级Ⅲ级合计厌食11(50.0)2(9.1)013(59.1)恶心3(13.6)8(36.4)011(50.0)乏力4(18.2)6(27.3)NA10(45.5)中性粒细胞计数减少7(31.8)3(13.6)010(45.5)贫血6(27.3)3(13.6)09(40.9)腹泻6(27.3)1(4.5)1(4.5)8(36.4)手足综合征3(13.6)2(9.1)1(4.5)6(27.3)转氨酶升高5(22.7)005(22.7)呕吐3(13.6)01(4.5)4(18.2)血小板计数减少3(13.6)003(13.6)胆红素升高2(9.1)002(9.1)
注:NA=不适用
3 讨论
5-氟尿嘧啶(5-fluorouracil,5-Fu)自1957年问世以来,已被广泛应用于头颈、乳腺及胃肠等多个部位实体恶性肿瘤的治疗,并获得了较好的疗效[17]。此后又开发了多种口服氟尿嘧啶制剂,如替加氟、卡培他滨及替吉奥胶囊[18]。5-Fu在体内最终转变为5-氟-2-脱氧尿嘧啶核苷酸,进而影响细胞DNA的合成。卡培他滨为5-Fu的前体药物,易从胃肠道吸收,最终经胸苷磷酸化酶(dThdPase)水解为5-Fu。人体有许多组织表达dThdPase,一些人类肿瘤中dThdPase的表达高于周围正常组织,说明服用卡培他滨可获得更高的5-Fu组织浓度及更低的5-Fu血药浓度,因此卡培他滨相对于5-Fu高效低毒。而二氢嘧啶脱氢酶(dihydropyrimidine dehydrogenase,DPD)可将5-Fu分解为无活性的代谢产物,DPD在高表达或较高活性的情况下,可加速5-Fu的清除而导致5-Fu及氟尿嘧啶类口服制剂的耐药[19]。
替吉奥为口服氟尿嘧啶复方制剂,主要有3种成分:替加氟、吉美嘧啶及奥拉西坦。口服后替加氟在体内逐渐转化成5-Fu[20]。吉美嘧啶选择性可逆抑制存在于肝脏的DPD,减少5-Fu的分解代谢而维持体内5-Fu较高的血药浓度,克服了5-Fu t1/2短、代谢快的不足,从而增强抗肿瘤活性。奥拉西坦口服后主要分布于胃肠道,可选择性拮抗乳清酸磷酸核糖转移酶而阻止5-Fu磷酸化转变为5-Fu脱氧核苷酸,从而在不影响5-Fu抗肿瘤活性的同时减轻胃肠道的毒副作用。替吉奥中的DPD抑制剂吉美嘧啶可减少5-Fu的清除而提高其抗肿瘤作用,因此对于卡培他滨耐药的转移性乳腺癌患者,替吉奥应该能继续取得一定的疗效。国外可见两篇关于这方面的报道[15-16],但治疗效果报道不一,一篇报道认为可获得一定的疗效但很有限[15],另一篇报道则认为获得较好的治疗效果[16],两篇报道均认为耐受性良好。
本研究中22例患者经替吉奥治疗后尽管ORR仅为22.7%,但CBR可达77.3%,因此替吉奥单药治疗卡培他滨耐药的转移性乳腺癌可获得较高的SD。口服替吉奥胶囊后毒副作用有厌食、恶心、乏力、中性粒细胞计数减少、贫血、腹泻、手足综合征、转氨酶升高、呕吐、血小板计数减少及胆红素升高,多数为Ⅰ~Ⅱ级毒副作用,对患者生活质量几乎没有影响。且有10例患者治疗后疼痛减轻,使得生活质量得以改善。由于替吉奥CBR较高且耐受性良好,因此对卡培他滨耐药的转移性乳腺癌患者不失为一个较好的选择。进一步分析显示,激素受体阳性患者的CBR可达14/16,而激素受体阴性患者的CBR仅为3/6,这表明替吉奥可能对激素受体阴性患者的疗效较差。另外根据患者既往对卡培他滨的治疗反应分析了替吉奥的疗效,既往对卡培他滨疗效为PR、SD及PD的患者耐药后转为替吉奥治疗后CBR分别为7/7、7/10及3/5,可见既往能从卡培他滨获益的患者更容易从替吉奥的治疗中获益,但由于病例数较少,需要更多病例加以证实。22例患者接受替吉奥治疗后中位TTP为113 d,即在替吉奥治疗后获得了近4个月的无进展生存,替吉奥治疗后患者中位OS达20.2个月,可能延长转移性乳腺癌患者的生存期。本研究中替吉奥的疗效与YAMAMOTO等[16]的结果相近,且疗效优于ITO等[15]的研究结果,可能与ITO等[15]的研究中多数患者已接受多线既往化疗有关。本研究与以上两个研究的不同之处在于,前两个研究中的所有患者虽接受卡培他滨治疗,但不考虑既往是否采用卡培他滨单药或联合其他药物治疗,而本研究中所有患者为卡培他滨单药治疗后出现耐药的患者,因此更能说明卡培他滨耐药的转移性乳腺癌患者能否从替吉奥治疗中获益。本研究中12例患者疗效为SD且5例患者疗效为PD,说明替吉奥并非转移性乳腺癌患者在卡培他滨耐药后的最佳选择,但对于老年或一般状况不佳而不适合静脉化疗或无法选择其他治疗药物时是一个可供选择的较佳治疗方案。
综上所述,替吉奥对于卡培他滨耐药的转移性乳腺癌患者是一个可选的治疗方案,并且可获得一定的治疗效果。但由于本研究病例数相对较少,需要更多的病例对疗效进行进一步的验证,必要时需要多中心合作以了解其治疗效果。在多中心合作的支持下,可根据患者的分子生物学特征进一步分析以了解哪些转移性乳腺癌患者在卡培他滨耐药后仍能从替吉奥治疗中获得一定的疗效,以达到个体化治疗,避免不必要的治疗。
作者贡献:王少敏参与文章的构思设计、数据收集及整理、统计学分析、论文撰写和修改及结果分析;叶孟参与研究的实施及可行性分析;倪曙民参与数据收集及整理。
本文无利益冲突。
[1] FERLAY J,SOERJOMATARAM I,DIKSHIT R,et al.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136(5):E359-386.DOI:10.1002/ijc.29210.
[2] BLUM J L,JONES S E,BUZDAR A U,et al.Multicenter phase Ⅱ study of capecitabine in paclitaxel-refractory metastatic breast cancer[J].J Clin Oncol,1999,17(2):485-493.DOI:10.1200/JCO.1999.17.2.485.
[3] O′SHAUGHNESSY J,MILES D,VUKELJA S,et al.Superior survival with capecitabine plus docetaxel combination therapy in anthracycline-pretreated patients with advanced breast cancer:phase Ⅲ trial results[J].J Clin Oncol,2002,20(12):2812-2823.DOI:10.1200/JCO.2002.09.002.
[4] CHAN S,ROMIEU G,HUOBER J,et al.Phase Ⅲ study of gemcitabine plus docetaxel compared with capecitabine plus docetaxel for anthracycline-pretreated patients with metastatic breast cancer[J].J Clin Oncol,2009,27(11):1753-1760.DOI:10.1200/JCO.2007.15.8485.
[5] WARDLEY A M,PIVOT X,MORALES-VASQUEZ F,et al.Randomized phase Ⅱ trial of first-line trastuzumab plus docetaxel and capecitabine compared with trastuzumab plus docetaxel in HER2-positive metastatic breast cancer[J].J Clin Oncol,2010,28(6):976-983.DOI:10.1200/JCO.2008.21.6531.
[6] MAVROUDIS D,PAPAKOTOULAS P,ARDAVANIS A,et al.Randomized phase Ⅲ trial comparing docetaxel plus epirubicin versus docetaxel plus capecitabine as first-line treatment in women with advanced breast cancer[J].Ann Oncol,2010,21(1):48-54.DOI:10.1093/annonc/mdp498.
[7] STEMMLER H J,DIGIOIA D,FREIER W,et al.Randomised phase Ⅱ trial of gemcitabine plus vinorelbine vs gemcitabine plus cisplatin vs gemcitabine plus capecitabine in patients with pretreated metastatic breast cancer[J].Br J Cancer,2011,104(7):1071-1078.DOI:10.1038/bjc.2011.86.
[8] BACHELOT T,BAJARD A,RAY-COQUARD I,et al.Final results of ERASME-4:a randomized trial of first-line docetaxel plus either capecitabine or epirubicin for metastatic breast cancer[J].Oncology,2011,80(3/4):262-268.DOI:10.1159/000329066.
[9]张明帅,张国庆,欧江华,等.唑来磷酸联合卡培他滨治疗乳腺癌多发骨转移临床疗效研究[J].中国全科医学,2011,14(35):4103-4105.DOI:10.3969/j.issn.1007-9572.2011.35.035. ZHANG M S,ZHANG G Q,OU J H,et al.Clinical efficacy research on zoledronic acid combined with capecitabine in treating breast cancer with multiple bone metastases[J].Chinese General Practice,2011,14(35):4103-4105.DOI:10.3969/j.issn.1007-9572.2011.35.035.
[10] SATOH T,SAKATA Y.S-1 for the treatment of gastrointestinal cancer[J].Expert Opin Pharmacother,2012,13(13):1943-1959.DOI: 10.1517/14656566.2012.709234.
[11] MIYAMOTO Y,SAKAMOTO Y,YOSHIDA N,et al.Efficacy of S-1 in colorectal cancer[J].Expert Opin Pharmacother,2014,15(12):1761-1770.DOI:10.1517/14656566.2014.937706.
[12] KAWAHARA M.Efficacy of S-1 in non-small cell lung cancer[J].Expert Opin Pharmacother,2014,15(13):1927-1942.DOI:10.1517/14656566.2014.945424.
[13] SUDO K,NAKAMURA K,YAMAGUCHI T.S-1 in the treatment of pancreatic cancer[J].World J Gastroenterol,2014,20(41):15110-15118.DOI:10.3748/wjg.v20.i41.15110.
[14] TAKASHIMA T,MUKAI H,HARA F,et al.Taxanes versus S-1 as the first-line chemotherapy for metastatic breast cancer(SELECT BC):an open-label,non-inferiority,randomised phase 3 trial[J].Lancet Oncol,2016,17(1):90-98.DOI:10.1016/S1470-2045(15)00411-8.
[15] ITO Y,OSAKI Y,TOKUDOME N,et al.Efficacy of S-1 in heavily pretreated patients with metastatic breast cancer:cross-resistance to capecitabine[J].Breast Cancer,2009,16(2):126-131.DOI: 10.1007/s12282-008-0073-9.
[16] YAMAMOTO D,IWASE S,YOSHIDA H,et al.Efficacy of S-1 in patients with capecitabine-resistant breast cancer-Japan Breast Cancer Research Network(JBCRN)04-1 trial[J].Anticancer Res,2010,30(9):3827-3831.
[17] HEIDELBERGER C,CHAUDHURI N K,DANNEBERG P,et al.Fluorinated pyrimidines,a new class of tumour-inhibitory compounds[J].Nature,1957,179(4561):663-666.
[18] MALET-MARTINO M,MARTINO R.Clinical studies of three oral prodrugs of 5-fluorouracil(capecitabine,UFT,S-1):a review[J].Oncologist,2002,7(4):288-323.
[19] 韩勇,寿成超.影响5-Fu疗效的研究进展[J].中国肿瘤临床,2010,37(21):1255-1259.DOI:10.3969/j.issn.1000-8179.2010.21.014. HAN Y,SHOU C C.The mechanisms involved in 5-Fu efficacy[J].Chinese Journal of Clinical Oncology,2010,37(21):1255-1259.DOI:10.3969/j.issn.1000-8179.2010.21.014.
[20] MIURA K,SHIRASAKA T,YAMAUE H,et al.S-1 as a core anticancer fluoropyrimidine agent[J].Expert Opin Drug Deliv,2012,9(3):273-286.DOI:10.1517/17425247.2012.652945.
(本文编辑:张小龙)
Therapeutic Efficiency of Tegafur,Gimeracil and Oteracil Potassium for Metastatic Breast Cancer Resistant to Capecitabine
WANGShao-min*,YEMeng,NIShu-min
DepartmentofMedicalOncology,theAffiliatedHospitalofSchoolofMedicineofNingboUniversity,Ningbo315020,China
*Correspondingauthor:WANGShao-min,Associatechiefphysician;E-mail:wangshaomin2000@163.com
Objective The purpose of this study is to analyze retrospectively the therapeutic efficiency and safety of tegafur,gimeracil and oteracil potassium monotherapy in patients with metastatic breast cancer resistant to capecitabine monotherapy.Methods We retrospectively ananlyzed the clinical data of 22 cases of patients with metastatic breast cancer in the Department of Medical Oncology,the Affiliated Hospital of School of Medicine Ningbo University between November 2011 and May 2015.All patients accepted capecitabine monotherapy,then they all accepted tegafur,gimeracil and oteracil potassium monotherapy after resistant to capecitabine until tumor progression,intolerable side effects and toxicity or refusal of treatment.The therapeutic efficiency of tegafur,gimeracil and oteracil potassium was evaluated according to the Response Evaluation Criteria in Solid Tumors(RECIST),and then the time to progression and overall survival were observed.The pain score and CA153 value were also recorded.Side effects and toxicities were assessed according to the common terminology criteria for adverse events(CTCAE v4.02) issued by the National Cancer Institute.Results Five patients had partial remission,12 had stable disease,and 5 had disease progress in 22 patients with capecitabine-resistant metastatic breast cancer after tegafur,gimeracil and oteracil potassium treatment.Objective response rate was 22.7%(5/22),clinical benefit response was 77.3%(17/22).Median time to progression was 113 days(22-218 days),median overall survival was 20.2 months(3.8-38.2 momths).A total of 15 patients complained of pain before tegafur,gimeracil and oteracil potassium therapy.Pain relief happened in 10 cases without the increase of analgesic drugs dosage after therapy.Compared with the CA153 value on the beginning of tegafur,gimeracil and oteracil potassium therapy,the lowest CA153 value in the course of therapy decreased signifcantly〔(174.8±67.4)U/ml vs.(102.8±69.7)U/ml,t=4.174,P=0.001〕.The toxic side effects of tegafur,gimeracil and oteracil potassium were well tolerated,and major adverse reactions included anorexia〔59.1%(13/22)〕,nauseas〔50.0%(11/22)〕,fatigue〔45.5%(10/22)〕,neutropenia〔45.5%(10/22)〕,anemia〔40.9%(9/22)〕,diarrhea〔36.4%(8/22)〕,hand-foot syndrome〔27.3%(6/22)〕,transaminase elevation〔22.7%(5/22)〕 and vomiting〔18.2%(4/22)〕et al.Most adverse reactions were Grade Ⅰ-Ⅱ adverse events,Grade Ⅲ adverse events only occurred in 3 cases.Conclusion Tegafur,gimeracil and oteracil potassium monotherapy is effective and well-tolerated in patients with metastatic breast cancer resistant to capecitabine monotherapy.So tegafur,gimeracil and oteracil potassium monotherapy is a selective regime treatment for patients with metastatic breast cancer after they were resistant to capecitabine monotherapy.
Breast neoplasms;Tegafur,gimeracil and oteracil potassium;Capecitabine;Antineoplastic combined chemotherapy protocols
宁波大学校级科研项目(XYY15007)
R 737.9
A
10.3969/j.issn.1007-9572.2017.20.009
2016-10-15;
2017-04-28)
315020浙江省宁波市,宁波大学医学院附属医院肿瘤内科
*通信作者:王少敏,副主任医师;E-mail:wangshaomin2000@163.com
