自拟中药复方对带状疱疹后遗神经痛大鼠脊髓背角iNOS表达的影响
2017-07-18方玉甫耿庆娜周国秀王雪峰
王 丽 方玉甫 耿庆娜 周国秀 王雪峰
(河南省中医院皮肤科 河南中医药大学皮肤性病研究所,河南 郑州 450002)
自拟中药复方对带状疱疹后遗神经痛大鼠脊髓背角iNOS表达的影响
王 丽 方玉甫 耿庆娜1周国秀 王雪峰2
(河南省中医院皮肤科 河南中医药大学皮肤性病研究所,河南 郑州 450002)
目的 通过建立水痘带状疱疹病毒慢性感染的带状疱疹后神经痛大鼠模型,研究自拟中药复方对带状疱疹后神经痛模型大鼠脊髓背角iNOS表达的影响。方法 利用水痘带状疱疹病毒慢性感染大鼠,建立带状疱疹后神经痛动物模型。空白对照组(大鼠左趾璞注射同等剂量的生理盐水)、模型对照组、自拟方高剂量组、自拟方低剂量组。各组大鼠分别于给药前1 d、给药开始后第4、7、14天检测大鼠机械缩爪阈值、热刺激缩爪潜伏期;末次测量完成后,取各大鼠L4 ~ L6 脊髓组织进行RT-PCR、Western印迹和免疫组化。结果 分组后给药前1 d,模型组、自拟方高、低剂量组的MWT、PWL值明显低于对照组,而这三组间无显著性差异,说明造模成功。模型组MWT、PWL值第4、7、14天均比对照组明显降低;给药后第7、14天,自拟方高低剂量组MWT、PWL值与模型组相比均明显升高,高剂量组在第14天MWT、PWL值与模型组相比明显升高。模型组PWL值iNOS mRNA及蛋白表达水平与对照组相比明显升高;自拟方高低剂量组iNOS mRNA及蛋白表达水平与模型组相比均降低,高剂量组iNOS mRNA水平与模型组相比明显降低。结论 自拟中药方对带状疱疹后神经痛模型大鼠痛觉行为有改善作用,其机制可能与下调iNOS在脊髓背角的表达有关。
带状疱疹后神经痛;水痘带状疱疹病毒;脊髓背角;诱导型一氧化氮合酶
带状疱疹后遗神经痛(PHN)神经病理性疼痛的发生机制目前尚在研究中,目前主要认为带状疱疹由病毒引起,且该病毒具有嗜神经性,人受到水痘带状疱疹病毒感染(VZV)后,该病毒能一直潜伏在神经节内,当人体免疫力低下或免疫功能受到抑制时就会激活该病毒,从而引起一种特征性、区域性、剧烈疼痛性的皮疹〔1~4〕,是神经损伤后周边和中枢的敏感化带来的灼烧痛、锐痛和异常性疼痛。目前临床上尚缺乏行之有效的治疗方案,中药的整体调节与标本兼治的作用可减轻患者的痛苦。多项研究显示PHN的发生与脊髓背角诱导型一氧化氮合酶(iNOS)的过表达密切相关〔5,6〕,本方中细辛等的镇痛作用与其减少iNOS的表达有关〔7〕。本研究拟探讨自拟中药方对PHN模型大鼠脊髓背角iNOS表达的影响,探讨该方的作用机制。
1 材料与方法
1.1 实验动物 SPF 级成年SD 大鼠,雄性,购自河南省医药科学研究院〔SYXK(豫)2013~0008〕,体重 200~220 g,共48只。动物实验设施持续保持屏障环境标准,控制室温为18~26℃,温差在4℃以内;相对湿度40%~70%,昼夜各12 h;所有动物在整个饲养过程中自由饮食与活动,其余饲养条件均符合中华人民共和国国家标准GB14925-2010中的规定。
1.2 试剂与仪器 Trizol总RNA提取试剂:Invitrogen公司;组织RNA提取试剂盒:Omega公司;cDNA合成试剂盒:TaKaRa公司; PCR扩增试剂盒:Taq公司;BCA试剂盒、ECL化学发光试剂盒:Beyontime公司;iNOS 1抗:Abcam公司; BME-410A型热痛刺激仪:中国医学科学院生物医学工程研究所。
1.3 动物模型复制 按照文献〔8〕方法利用水痘带状疱疹病毒慢性感染大鼠,建立带状疱疹后神经痛动物模型。首先将CV-1细胞加入完全培养基(DMEM/F12)中制成细胞悬液,进行细胞计数后按5×104/cm2的浓度接种于培养瓶中,然后用VZV 感染CV-1细胞。约有80%的细胞被感染时(约2 d后),收集被感染细胞于PBS中制成病毒接种细胞悬液,最后浓度约为12×106个/100 μl的病毒接种液注入SD大鼠左趾璞,每只50 μl。VZV感染后3~4 d大鼠开始出现热痛敏阈值和机械痛敏阈值异常可判定为模型复制成功,选取成功的动物纳入分组。
1.4 动物分组与给药 除10只大鼠为空白对照组(大鼠左趾璞注射同等剂量的 生理盐水)外,余大鼠均进行造模,造模成功的大鼠中选取30只分为模型对照组、自拟方高剂量组、自拟方低剂量组,每组10只。带状疱疹后遗神经痛自拟中药方主要组成:黄芪20 g,丹参20 g,川芎12 g,元胡20 g,徐长卿20 g,川楝子15 g,细辛3 g,地龙10 g,等;以上方药按临床用量与动物体重关系换算为高剂量及低剂量,煎煮过滤药渣后,药液灌胃给药;空白对照组及模型对照组给予等量生理盐水。
1.5 指标检测 各组大鼠分别于给药前1 d、给药开始后第4、7、14天检测大鼠机械缩爪阈值、热刺激缩爪潜伏期,均在每天上午相同时间进行;末次测量完成后,取各大鼠L4~L6脊髓组织进行RT-PCR、Western印迹和免疫组化。
1.5.1 机械缩爪阈值(MWT) 测定 即50%缩爪阈值。各组大鼠在相应的时间以von Frey纤维(美国 Stoelting 公司)测定机械痛阈。采用up-and-down的方法测定大鼠50%缩爪阈值。由弱到强刺激每只大鼠足底,每个刺激强度重复10次,出现5次以上缩足反射的阳性反应时,即可完成50%缩爪阈值的测定。5 MWT按50%阈值(g)=10logXf + kä/10 000进行计算,公式中Xf是指最后刺激所用力度,k是指不同刺激方式的系数,ä是指各刺激力度的对数值值相邻间距的平均数,在本实验中ä=0.186。
1.5.2 热刺激缩爪潜伏期(PWL)测定 各组大鼠在相应的时间用BME-410A型热痛刺激仪测定PWL值。将大鼠置于底为3 mm厚玻璃板的有机玻璃箱中,大鼠适应15 min后,用热辐射刺激仪发出的5 mm光斑照射大鼠足底,从照射开始至大鼠出现抬腿回避时间记录为PWL,照射时间在30 s内,因此最长记为30 s。每只大鼠同样操作测量5次,每次间隔10 min,去掉最小值和最大值,余3次的平均值为每只大鼠的PWL值。
1.5.3 iNOS mRNA表达测定 大鼠麻醉后取L4~L6脊髓组织在洁净操作台上于匀浆器中加入液氮研磨后,加入Trizol进行裂解,采用RNA提取试剂盒分离提取总mRNA。总mRNA浓度测定符合要求后,采用cDNA合成试剂盒合成cDNA模板并进行逆转录-聚合酶链反应(RT-PCR)。测定iNOS mRNA的表达水平。RT-PCR 引物序列:iNOS:正义链:5′-CCCTTCCGAAGTTTCTGGCAGCAGC-3′,反义链:5′-GGGTGTCAGAGTCTTGTGCCTTTGG-3′。
1.5.4 iNOS蛋白表达测定 取 L4~L6脊髓组织于细胞裂解缓冲液中匀浆,分离提取总蛋白溶液。总蛋白浓度测定符合要求后,蛋白于SDS-PAGE胶上电泳分离转膜。5%脱脂牛奶封闭,4℃Ⅰ抗(1∶1 000)孵育过夜,PBS洗膜3次,Ⅱ抗(1∶5 000) 孵育1 h,PBS洗膜3次,ECL化学发光试剂盒显像。计算分析平均灰度值。
1.5.5 免疫组织化学观察 取 L4~L6脊髓组织切片PBS后漂洗3次,iNOS 一抗(1∶200,Calbiochem,USA) 孵育过夜,PBS洗3次;二抗(1∶400)孵育6 h,PBS洗3次。经脱水、透明后石蜡包埋制片,常规染色,在显微镜下观察所取组织的形态。
1.6 统计学分析 采用SPSS19.0软件,符合正态分布的进行成组设计方差分析,组内均数差异比较用t检验。
2 结 果
2.1 MWT测定结果 分组后给药前1 d,模型组、自拟方高、低剂量组的MWT值明显低于对照组,而这三组间无显著性差异,说明造模成功。模型组MWT值第4、7、14天均比对照组明显降低(P<0.05);给药后第7、14天,自拟方高低剂量组MWT值与模型组相比均明显升高(P<0.05,P<0.01),高剂量组在第14天MWT值与模型组相比明显升高(P<0.01)。见表1。
2.2 PWL测定结果 分组后给药前1 d,模型组、自拟方高、低剂量组的PWL值明显低于对照组,而这三组间无显著性差异,说明造模成功。模型组PWL值第4、7、14天均比对照组明显降低(P<0.05,P<0.01);给药后第7、14天,自拟方高低剂量组PWL值与模型组相比均升高(P<0.05,P<0.01),高剂量组在第14天PWL值与模型组相比明显升高(P<0.01)。见表2。
2.3 免疫组化结果 棕黄色颗粒沉淀为iNOS阳性表达,对照组棕黄色颗粒沉淀少见,可见对照组脊髓背角iNOS未见过度表达;模型组可见棕黄色颗粒沉淀较多密度较大,可见模型组脊髓背角iNOS过表达;而给予自拟方高、低剂量干预后,棕黄色颗粒沉淀减少,iNOS表达下降。见图1。
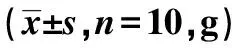
表1 各组大鼠给药前、后MWT值的变化
与模型组比较:1)P<0.05,2)P<0.01

表2 各组大鼠给药前、后PWL值的变化
与对照组比较:1)P<0.05,2)P<0.01;与模型组比较:3)P<0.05,4)P<0.01

图1 iNOS在各组大鼠脊髓背角中的表达(DAB,×400)
2.4 iNOS在各组大鼠脊髓背角中的表达 模型组iNOS mRNA及蛋白表达水平与对照组相比明显升高(P<0.05);自拟方高低剂量组iNOS mRNA及蛋白表达水平与模型组相比均降低(P<0.05,P<0.01),高剂量组iNOS mRNA表达水平与模型组相比明显降低(P<0.01)。见表3,图2、图3。
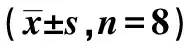
表3 自拟方对VZV大鼠脊髓背角iNOS mRNA及蛋白表达的影响
与模型组比较:1)P<0.05,2)P<0.01

图2 自拟方对VZV大鼠脊髓背角iNOS mRNA表达的影响

图3 自拟方对VZV大鼠脊髓背角iNOS 蛋白表达的影响
3 讨 论
带状疱疹常因延误治疗而带来严重的并发症,即使发现后给予及时的抗病毒治疗,PHN的发生率仍然较高。人体初次感染水痘-带状疱疹病毒,虽然通常发生在童年时期,但VZV 具有嗜神经性,容易沿着轴突逆行转运并静息、潜伏于感觉神经节。老年人容易发生免疫功能生理性减退或由于肿瘤、自身免疫性疾病、感染、器官移植排斥反应等使得免疫系统受抑制时,VZV可能被重新激活,大量复制后沿轴突转运到人体表层即皮肤,而产生疱疹,产生神经性急性疼痛。目前治疗急、慢性疼痛药物常用的有阿片肽类药物、辣椒素受体抑制剂、抗抑郁药、局麻药和类固醇类等,但对 PHN 的疗效不佳;对于大部分老年人患者,自身免疫功能降低,且常有心脑血管功能、呼吸系统功能、内分泌功能等异常性疾病合并发生,大剂量的上述药物可能带来更严重的药物副作用而给生命带来危害。合适的动物模型是研究PHN发生发展机制以及药物作用机制的重要桥梁。Guedon等〔9〕成功建立了 VZV 慢性感染的PHN动物模型。研究者将感染 VZV 的 CV-1 细胞经过皮下注射于大鼠左趾蹼,3~4 d后成功感染的大鼠会开始出现痛觉异常,2 w左右痛觉阈值达到最低值,该效应至少持续7~8 w,14 w左右可恢复到基线水平,这些表现与临床上患者 PHN 的发生、发展与消退过程十分相似。因此,该模型成为目前运用最多的并被大多数研究者认为是用于研究PHN 相对可靠的模型。本研究发现造模后,模型组的痛觉行为MWT、PWL值均明显降低,且在14 d差异更加显著。提示VZV感染后疼痛模型复制成功。
免疫力低下、周围神经纤维以及末梢发生炎症和变性,是目前认为PHN发病的主要原因,而脊髓等中枢神经系统与其发生也有密切关系〔10〕。有学者发现 PHN 病人的脊髓背角、前扣带回皮质等参与痛觉信息调控的中枢中,相关的核团或脑区呈现出过度代谢和激活状态〔11〕。脊髓背角可能起着至为关键的作用。研究发现其上的iNOS过表达可能参与PHN的发生与进程〔4〕。一氧化氮(NO) 作为重要的神经递质,参与中枢及外周不同程度的痛觉调制,在脊髓更显示出起着极其重要的作用〔12〕。外周神经损伤可见脊髓背角NOS 的过度表达;而给予全身或鞘内注射NOS 抑制剂则可对神经病理性痛起到良好的镇痛作用,有研究结果显示NOS三个亚型中只有 iNOS 参与了PHN 的形成和维持。在本研究中,模型组大鼠脊髓背角iNOS mRNA及蛋白均处于表达状态,显示出iNOS与VZV诱导的PHN模型密切相关。而给予自拟中药方干预后大鼠脊髓背角iNOS mRNA及蛋白表达水平均下降,而痛觉行为MWT、PWL值也升高,且以高剂量较为显著。自拟方以黄芪、丹参等调解免疫系统,以川芎、元胡、细辛、徐长卿、川楝子等缓解疼痛,川芎〔13〕、细辛〔7〕、元胡〔14〕等均有研究报道能通过下调神经或组织iNOS表达水平而起到镇痛作用,结合本研究结果,推测本研究中的中药复方临床用于治疗PHN的机制可能通过下调iNOS信号通路实现。
1 Forbes HJ,Thomas SL,Smeeth L,etal.A systematic review and meta-analysis of risk factors for postherpetic neuralgia〔J〕.Pain,2016;157(1):30-54.
2 Pickering G,Leplege A.Herpes zoster pain,postherpetic neuralgia,and quality of life in theelderly〔J〕.Pain Pract,2011;11(4):397-402.
3 Philip A,Thakur R.Post herpetic neuralgia〔J〕.J Palliative Med,2011;14(6):765-73.
4 Massengill J,SKittredge JL.Practical considerations in the pharmacological treatment of postherpetic neuralgia for the primary care provider〔J〕.J Pain Res,2014;7:125-32.
5 张丹龙,吴 楠,衡立君,等.大鼠脊髓 iNOS 的过表达参与形成带状疱疹后神经痛〔J〕.神经解剖学杂志,2014;30(3):285-90.
6 叶永贤,林 洪,沙 漠,等.神经病理性疼痛大鼠脊髓 NF-κB、NR2B 和 iNOS 的表达及意义〔J〕.中国病理生理杂志,2014;30(4):598-602.
7 梁学清,李丹丹.细辛药理作用研究进展〔J〕.河南科技大学学报,2011;29(4):319-20.
8 涂 涛,董蜀华.带状疱疹后遗神经痛大鼠脊髓背角组织MITOL 表达变化及意义〔J〕.山东医药,2015;55(23):24-5.
9 Guedon JM,Yee MB,Zhang M,etal.Neuronal changes induced by Varicella Zoster Virus in a rat model of postherpetic neuralgia〔J〕.Virology,2015;482(1):167-80.
10 Delaney A,Colvin LA,Fallon MT,etal.Postherpetic neuralgia:from preclinical models to the clinic〔J〕.Neurotherapeutics,2009;6:630-7.
11 Zhang Y,Liu J,Li L,etal.A study on small-world brain functional networks altered by postherpetic neuralgia〔J〕.Magn Reson Imaging,2014;32(4):359-65.
12 Schmidtko A,Tegeder I,Geisslinger G.No,no,no pain? The role of nitric oxide and cGMP in spinal pain processing 〔J〕.Trends Neurosci,2009;32:339-46.
13 王银龙,单铁英.芪归健脑颗粒抑制老年痴呆大鼠海马组织iNOS 表达及 NO 含量的影响〔J〕.中西医结合心脑血管病杂志,2016;14(13):1478-80.
14 张 倩,梁晓春,孙 青,等.筋脉通对糖尿病大鼠背根神经节氧化应激的影响〔J〕.协和医学杂志,2012;3(4):441-7.
〔2016-10-15修回〕
(编辑 徐 杰)
河南省教育厅科学技术研究重点项目资助计划(14A320056);河南省中医药科学研究专项课题(2013ZY04036)
王 丽(1982-),女,硕士,主治医师,主要从事中西医结合治疗皮肤病、性病方面研究。
R752.1+2
A
1005-9202(2017)13-3145-03;
10.3969/j.issn.1005-9202.2017.13.010
1 开封市第二人民医院皮肤科 2 河南省中医院康复科
