推拿对慢性神经根型颈椎病疼痛相关脑区的影响❋
2017-07-18左伟斌尚可欣谭中建
王 昊,左伟斌,张 慧,尚可欣,谭中建,陈 红,张 华
(北京中医药大学东直门医院, 北京 100070)
【针灸研究】
推拿对慢性神经根型颈椎病疼痛相关脑区的影响❋
王 昊,左伟斌,张 慧,尚可欣,谭中建,陈 红△,张 华△
(北京中医药大学东直门医院, 北京 100070)
目的: 探讨推拿对慢性神经根型颈椎病疼痛相关脑区关联性的影响。方法: 研究对象为10名神经根型颈椎病慢性疼痛患者与10名健康人,2组在治疗前采集静息态功能磁共振数据;患者组给予12周的推拿治疗,并在治疗前后进行颈椎病量表评估,治疗结束后再次采集静息态功能磁共振数据;提取患者组与对照组的疼痛感兴趣区域进行格兰杰因果分析。结果: 与对照组比较,患者组左侧丘脑与双侧岛叶、右侧丘脑与右侧岛叶之间存在明显的因果联系;与治疗前比较,患者组推拿治疗后中脑导水管周围灰质与左侧丘脑、右侧中央后回与前扣带回存在明显的因果联系。结论:推拿通过抑制伤害性信息在中脑导水管周围灰质中上行传导或通过激活中脑导水管周围灰质诱发上行镇痛通路,抑制丘脑对疼痛信息的传递以达到镇痛作用。
推拿;神经根型颈椎病;慢性疼痛;静息态功能磁共振;感兴趣区域
颈椎病是一种常见病、多发病,我国颈椎病的发病率为17.3%[1],30岁以下的青年患者约占总患者人数的11.1% 左右, 并呈增加趋势[2],其中神经根型颈椎病占颈椎病发病率的50%~70%[3]。“根性痛”是其常见症状,主要表现为神经根支配区域的疼痛,此外还可出现神经根支配区域的麻木及感觉缺失。慢性疼痛是指持续3~6个月以上的疼痛[4],能够引起脑功能紊乱,导致焦虑、抑郁、智能下降等精神疾患[5]。中医推拿治疗慢性疼痛性疾病疗效确切,但目前推拿镇痛的脑中枢机制尚不明确。本研究以推拿治疗慢性神经根型颈椎病疼痛为切入点,通过应用静息态磁共振成像技术探讨其镇痛的脑中枢机制。
1 对象与方法
1.1 研究对象
本课题研究时间为2013年7月至2014年1月,患者组为于北京中医药大学东直门医院推拿科就诊的患者10例,其中男性2例,女性8例,年龄44~56岁,平均年龄(50.8±5.4)岁,平均病程(7.3±5.1)年。对照组为从社区招募的10名健康志愿者,其中男性2名,女性8名,年龄42~55岁,平均年龄48岁。两组经爱丁堡利手量表测试均为右利手。患者组在治疗前先进行汉密尔顿17项抑郁量表(hamilton depressionrating scale,HAMD)评估,排除抑郁症后进行视觉模拟评分(visual analogue score,VAS)和田中靖久颈椎病症状量表评估。所有受试者一般资料经SPSS19.0统计,差异无统计学意义(P>0.05)。
1.2 诊断标准
参照第三届全国颈椎病专题座谈会对神经根型颈椎病的诊断标准[6],根据患者症状、体征和影像学结果进行诊断。
1.3 纳入标准
①颈项、肩背部疼痛、僵硬,上肢疼痛、麻木且范围与颈脊神经支配区域一致;②颈背部肌肉紧张,有局限性条索状或结节状阳性反应物。在病变的颈椎节段间隙、棘突上、棘突旁及其神经分布区可出现压痛、放射性痛、麻,均与病变节段相吻合;③颈部活动受限;④臂丛神经牵拉试验和或颈椎间孔挤压试验㈩;⑤患侧肌力可减弱,痛、触觉可减低;⑥腱反射可减弱或消失;⑦X线片:颈椎生理曲度变直或消失、椎间隙变窄、椎体增生、椎间孔狭窄、韧带钙化;⑧CT或MRI检查:椎体增生、颈椎椎管或神经根管狭窄、椎间盘突出或膨出、韧带肥厚、脊神经受压。①~④必备,⑦⑧有1项符合即可。
1.4 排除标准
患有心脑血管系统疾病者;有起搏器心脏支架等不能行核磁检查者;治疗前2周内服用止痛药者;汉密尔顿17项抑郁量表(hamilton depression rating scale,HAMD)评分>17分者。
1.5 脱落标准
不能配合治疗或不能按时接受治疗者;中途使用其他治疗或其他药物治疗且无法判断疗效者。
1.6 纳入标准
无颈椎病及慢性疼痛病史;无脑血管病、抑郁、焦虑、痴呆等神经精神疾病。
1.7 中医推拿方法
先在患者颈部、肩部与患侧上肢采用常规放松类手法,并按照患者疼痛部位的不同,根据经络辨证原则辨经选穴,后患者仰卧采用颈椎拔伸法。每次治疗时间35~40 min,隔日治疗1次,12次为1个疗程,在治疗前后进行颈椎病症状量表和VAS评分。
1.8 数据采集
以泡沫枕固定受试者头部以减少头动,使用耳塞降低噪音。嘱受试者闭眼、放松并保持清醒,尽量不进行任何思考。使用Siemens Vero 3.0 T MR扫描仪,3D-T1扫描参数:TR 1900 ms,TE 3.93 ms,矢状位采集矩阵240×240,层厚1.0 mm,扫描层数176 层,体素1.0×1.0×1.0 mm。静息态功能磁共振采用T2WI 梯度回波-平面回波成像(echo-planar imaging, EPI)序列,层厚3.5 mm,层间距0.7 mm,TR 2000 ms,TE 50 ms,扫描矩阵128×128,Fov 240×240,Flip angle90°,采集层数26层,共采集210帧图像。
1.9 数据处理
1.9.1 数据预处理 使用DPARSF软件[7]将原始文件转换为NIFTI格式,去除前10个时间点数据,以消除磁场不均匀的影响。进行层面时间校正、头动校正,所有受试者在3个平移方向位移<2 mm,3个旋转方向角度<2°。进行空间标准化及空间平滑,去除脑脊液、白质噪声及线性趋势,得到带宽为0.01~0.08 Hz时域带通滤波,提取感兴趣区(region of interest ROI)时间序列。
1.9.2 感兴趣区域的选择 在Neurosynth中,以pain作为关键词进行搜索,得出420篇文章的荟萃分析结果,将阈值设为z>6、簇值>50个体素,最终选取中脑导水管周围灰质(periaqueductal gray,PAG)、左侧岛叶(left insula,INS.R)、右侧岛叶(right insula,INS.R)、左侧丘脑(left thalamus,Thal.L)、右侧丘脑(right thalamus,Thal.R)、扣带回前部(anterior cingulum cortex)、右侧中央后回(right postcentral gyrus)7个脑区为感兴趣区域,感兴趣区域空间分布见及表1。
1.9.3 统计学方法 采用SPSS19.0软件对患者组颈椎病症状量表及VAS评分进行统计分析,符合正态分布的采用配对t检验,不符合正态分布的采用非参数检验,P<0.05为差异有统计学意义。Granger(格兰杰)因果分析采用rest软件GCA模块进行统计,对7个ROI两两之间因果关系进行计算,得出Granger因果关系系数,因为数据为非正态分布,故采用非参数检验。患者组与对照组采用Mann-Whitney U检验(MATLAB软件包中ranksum函数,相当两个样本t检验),患者组治疗后与治疗前采用Wilcoxon符号秩检验(MATLAB软件包中signrank函数,相当于配对检验),最后数据经BrainViewer软件处理,以图像形式呈现。
2 结果
2.1 临床疗效评估
表2显示,与治疗前比较患者治疗后的症状得分明显降低,表明经推拿治疗后症状改善。
2.2 Granger因果分析结果
图1显示,与对照组比较,患者组的左侧丘脑与双侧岛叶、右侧丘脑与右侧岛叶之间存在明显的因果联系(P<0.05)。
图2显示,与治疗前对比,患者组推拿治疗后中脑导水管周围灰质与左侧丘脑,右侧中央后回与前扣带回存在明显的因果联系,P<0.05。
3 讨论
推拿对多种慢性疼痛性疾病疗效显著,但其镇痛机制尚未完全明确。近年来,从外周水平、脊髓水平、脑中枢水平机制进行了大量研究工作,证实推拿对疼痛传导通路的多个环节均可产生影响,从而起到镇痛作用。
外周水平机制研究表明,推拿手法能够促使局部组织血液循环加快,改善组织缺血缺氧状态,加速新陈代谢,进而促进损伤组织修复;促进5-羟色胺、组胺等致痛物质的代谢与排泄,减轻致痛物质的持续刺激,降低周围神经末梢的痛觉敏感程度,使损伤组织的内环境达到稳态。此外,推拿手法能够对颈椎的解剖结构产生影响。关节运动类手法能够改善小关节紊乱,解除滑膜嵌顿,增大椎间孔与椎间隙空间, 减轻神经根的压迫状态,恢复颈椎的内外源平衡。脊髓水平机制研究认为,推拿通过调节“闸门控制系统”起到镇痛作用,推拿手法作用于局部会产生一种刺激信号,这种信号沿粗纤维传至脊髓后角兴奋一种胶质细胞。这种胶质细胞一旦激活,便会抑制后角T细胞传递痛觉信号,使得脊髓后角痛冲动传递的闸门关闭。脑中枢水平的研究多从动物实验获得,认为推拿通过刺激产生内源性阿片肽来发挥镇痛作用。内源性阿片肽是一种镇痛物质,在疼痛调节中发挥着重要作用。推拿作为一种良性刺激,其信息传导到脑部时,会刺激脑组织产生内源性阿片肽,通过作用于阿片受体以减轻疼痛。因内源性阿片肽分布广泛,种类较多,目前对脑中枢镇痛机制的认识仍处于初期阶段,且主要停留在对脑内某一局部、非动态的研究水平。
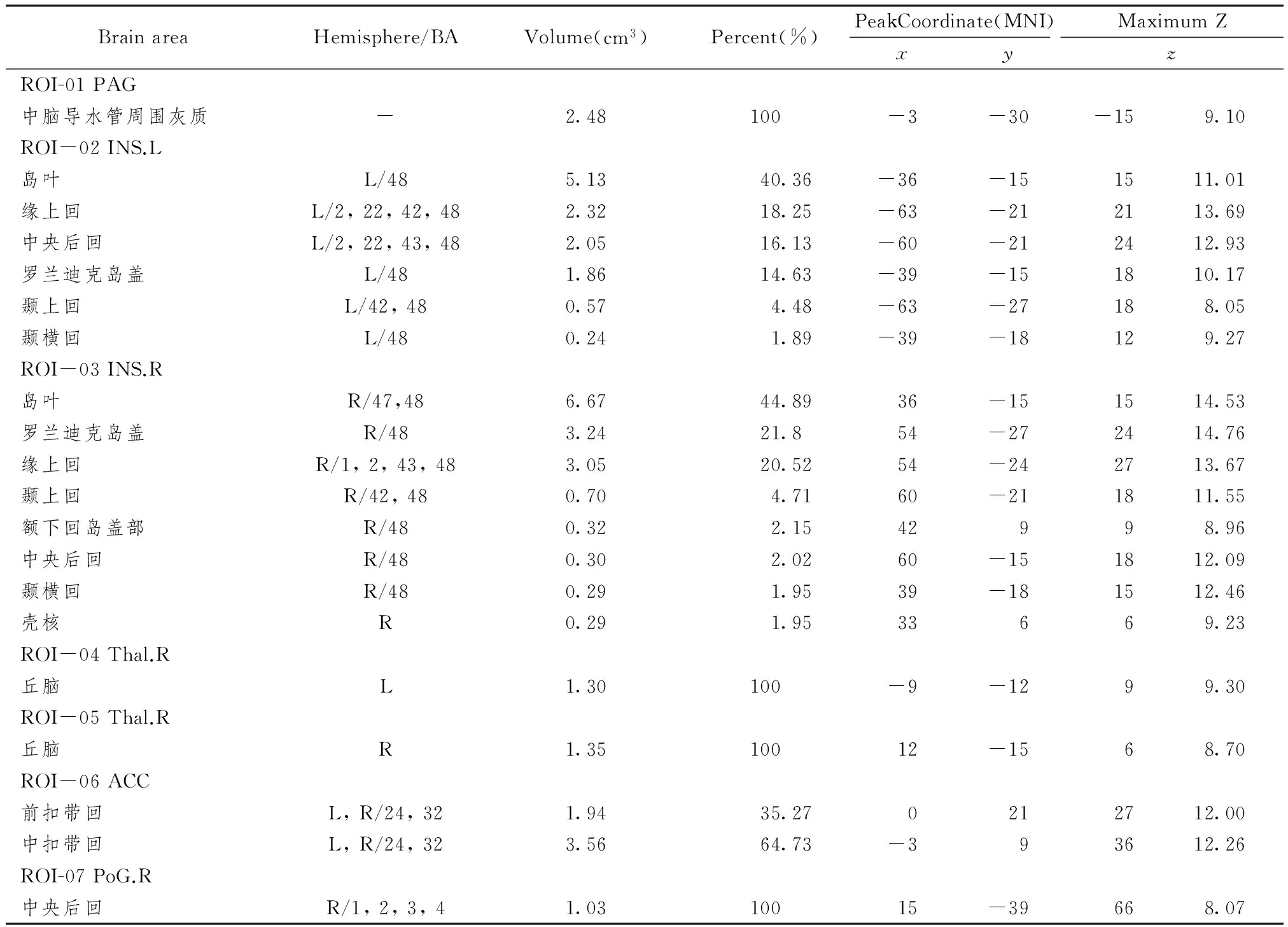
表1 感兴趣区域的空间分布

表2 患者组治疗前后颈椎病症状量表及VAS评分比较±s)
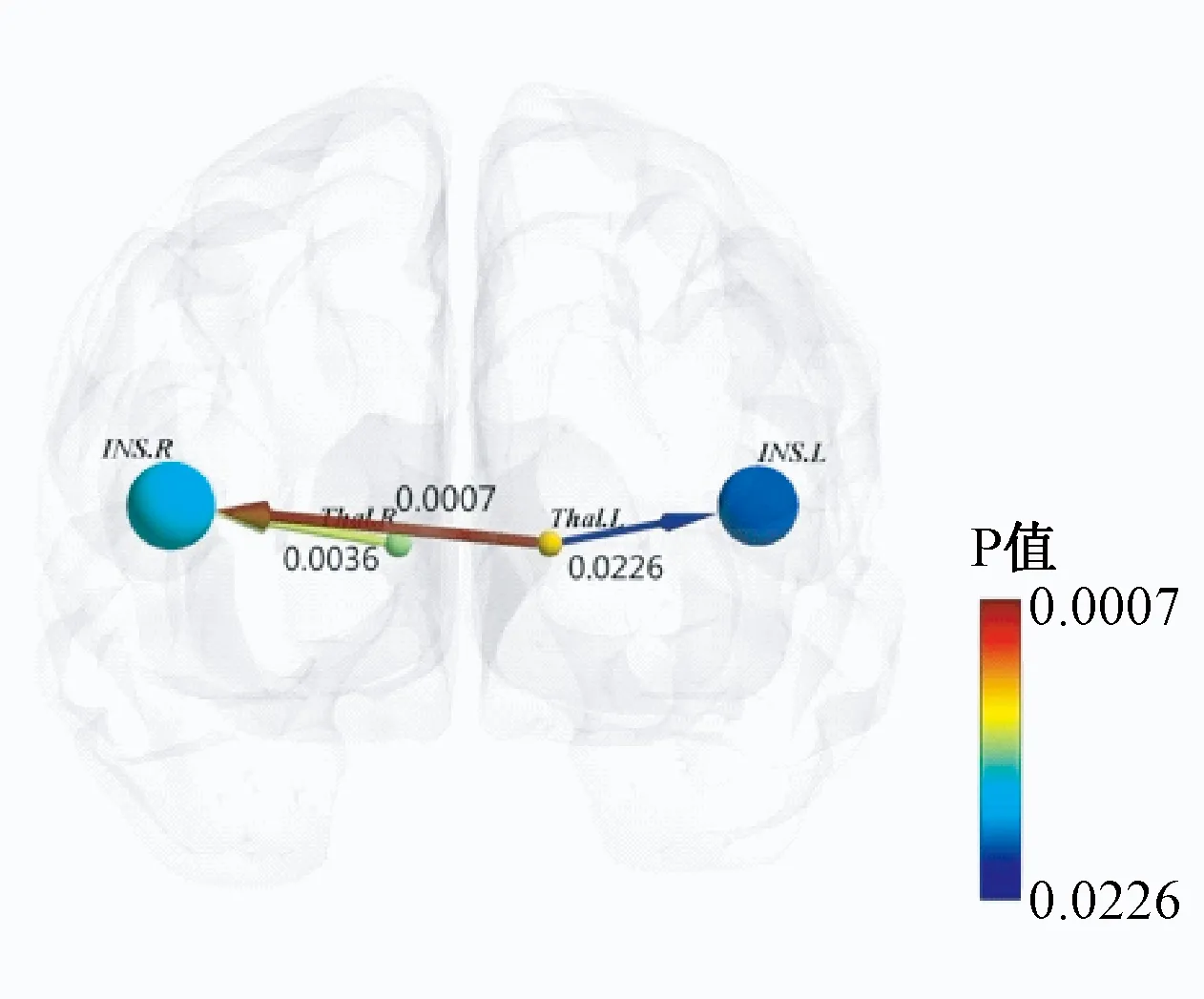
图1 患者组与对照组Granger因果分析
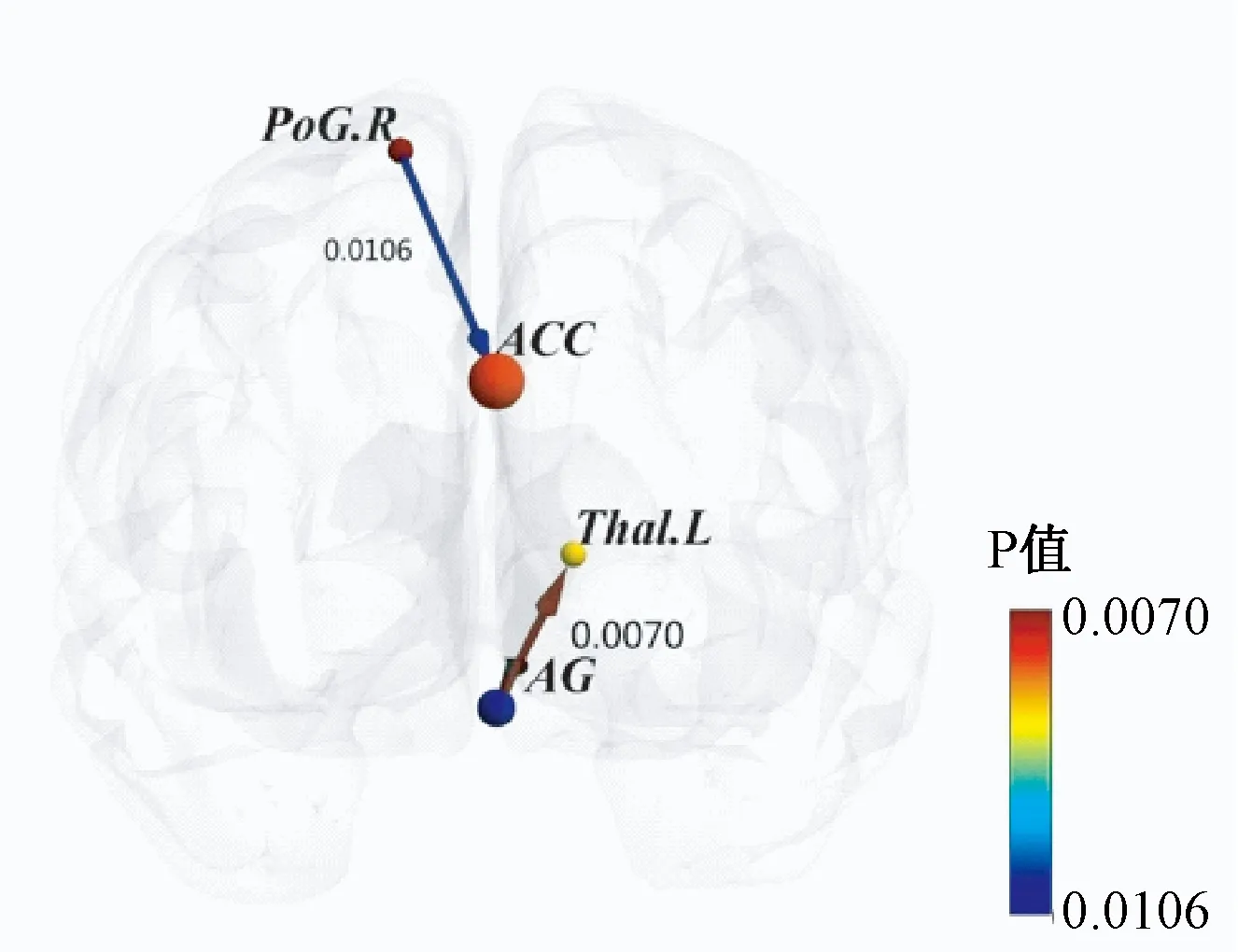
图2 患者组疗前与疗后Granger因果分析
脑是一个复杂的网络结构,疼痛是多个脑区共同协调,对内外刺激信息加工整合的结果,疼痛性疾病存在多个涉及痛觉调控的脑区功能受损。参与痛觉处理的脑区之间相互作用,共同参与痛觉的形成与调节,从而构成痛觉的脑内网络。推拿镇痛的脑中枢机制研究应着重于其对脑内疼痛相关脑区功能连通性的动态影响。Granger因果分析方法能够很好地描述特定脑功能区间的交互作用,并能反映交互脑区间信息流向和强度。
本研究结果显示,与正常组相比,患者组的左侧丘脑与左侧岛叶、右侧丘脑与右侧岛叶、左侧丘脑与右侧岛叶之间有较强的因果联系,表明神经根型颈椎病慢性疼痛对脑的影响包括感觉、认知、情感等多个方面。痛觉不仅仅是一种感觉,还是一种不愉快的情绪体验[8]。痛觉有3种组成成分,即感觉辨别、情绪动机和认知评估[9]。慢性疼痛可诱导疼痛中枢的显著激活, 并显著激活认知和情感脑区。痛觉的感觉和情绪成分分别由脑内两条平行上传的通路传递,外侧痛觉系统传导伤害性刺激的感觉信息[10],内侧痛觉系统传递伤害性刺激的情绪成分[11],这两个系统并非完全独立。伤害性刺激引起的情绪反应依赖于其感觉特性,其中最重要的是强度的影响,刺激强度越大,情绪反应就越强烈。长时间存在的伤害性感觉会产生强烈的厌恶情绪[12]。本研究所选择的左侧丘脑及右侧丘脑在内、外侧痛觉系统中均有所参与,中脑导水管周围灰质与右侧中央后回属于外侧痛觉系统,左侧岛叶、右侧岛叶及扣带回前部属于内侧痛觉系统。
丘脑是人体重要的感觉传导中转站,内侧痛觉系统及外侧痛觉系统均由其介导。在疼痛研究中,丘脑是经常被激活的脑区[13-14],而且丘脑的激活常常是双侧,是大脑对痛觉“普遍觉醒”的表现[15]。岛叶在痛觉调控网络中发挥重要作用[16],主要进行痛觉的情绪成分处理,参与疼痛的期望、逃避、不愉快的编码[17],也在某种程度上参与感觉信息的编码[12]。它与疼痛引起的负性情绪密切相关,涉及认知、移情处理等功能,在看到别人处于疼痛状态时,岛叶也会出现激活,表现出对他人疼痛的同情[18]。Wu等[19]发现,慢性疼痛引起岛叶功能发生显著变化,认为岛叶具有疼痛识别和信息的整合作用,对了解慢性疼痛对脑功能的整体影响发挥重要作用。本研究中,丘脑与岛叶之间的因果联系动态地展示出神经根型颈椎病慢性疼痛的形成过程。虽然Granger因果分析反映相关脑区间功能上的信息交互,但无法说明这种交互关系是直接还是间接的,其间可经过其他脑组织加工、处理、传输。本研究结果显示,左侧丘脑与右侧岛叶有因果联系,可能是左侧丘脑的信息经过其他脑组织传输的结果有关,具体有待进一步研究。
中脑导水管周围灰质(PAG)既是中枢痛觉通路的重要驿站,又是脑内重要的镇痛结构。PAG接受来自伤害性感受神经元的传入信息,将其投射至丘脑核团,是上行痛觉传导的重要部位[20]。PAG具有异觉会聚和异位会聚的作用。研究发现,伤害性信息和电针信息能会聚到同一个PAG单位上,这是中枢整合作用和针刺镇痛的神经基础[21]。本研究显示,推拿治疗后患者组的临床症状减轻,且中脑导水管周围灰质与左侧丘脑有较强的因果关系。笔者认为,推拿产生的刺激信息与外周伤害性信息亦可在PAG会聚,2种信息相遇后产生相互作用, 经PAG整合后,伤害性信息的上行传导被抑制, 从而达到镇痛效应。同时中脑导水管周围灰质又是产生内源性阿片肽的重要场所,内源性阿片肽是重要的镇痛物质。许丽[22]观察到,使用推拿轻手法时家兔PAG灌流液中β-EP含量升高。结合本研究结果,笔者推测推拿通过刺激中脑导水管周围灰质中镇痛物质产生,激活上行镇痛通路,抑制丘脑对疼痛信息的传递,从而产生镇痛作用。中央后回是重要的躯体感觉中枢,是产生痛觉感觉成分的场所。前扣带回主要参与疼痛情绪信息的编码[23-24],同时又是“奖赏系统”重要的组成部分。奖赏系统参与并恶化疼痛引起的情绪反应[25]。有研究[26]认为,推拿的脑中枢镇痛机制和愉悦作用相关,对5例腰椎间盘突出症患者的“委中”按揉后,发现下丘脑信号升高,左前扣带回信号降低,表明推拿对感觉传入中枢及情绪中枢产生影响,提示愉悦作用的产生可能与奖赏系统的激活有关。而本研究发现,推拿后右侧中央后回与前扣带回存在因果联系,感觉中枢对情绪中枢产生影响,符合脑的奖赏系统的运作方式,表明推拿能够作用于奖赏系统,从而调节情绪。
通过本次研究我们发现,慢性神经根型颈椎病患者疼痛相关脑区间的联系较正常人有明显改变。笔者认为,推拿镇痛的脑中枢机制一方面是推拿能够抑制PAG中伤害性信息的上行传导,另一方面是推拿通过刺激PAG以激活上行镇痛通路,抑制丘脑对疼痛信息的传递。本研究有些许不足之处,如本病例收集数量较少,故难以全面反映患者的真实情况,在年龄、性别等方面存在一定的偏倚;患者在填写量表的过程中,自身主观性较强,可能较实际情况存在一定的偏差;头颅扫描时患者心理可能出现波动,对脑区活动性存在一定的影响。但从总体来说,推拿手法能够改善患者的症状,减少症状积分,对患者疼痛相关脑区的关联性产生正面影响。
本研究观察推拿对疼痛相关脑区关联性的影响,在影像学上展示推拿镇痛的脑中枢机制,这在国内是首次尝试,希望能够为今后研究工作提供一定的参考价值。目前功能核磁研究正在由静息态向功能态方向发展,今后可以尝试在四肢进行推拿观察其镇痛脑中枢机制的即时效应。
[1] 施杞.要重视对颈椎病的研究[J].中国中医骨伤科杂志,1999,7(1):11.
[2] 裴仁和.青年人颈推病病因及临床特点探讨[J].中国中医骨伤科杂志, 2002,10(4):56-58.
[3] 吴在德, 吴肇汉. 外科学[M]. 6 版. 北京: 人民卫生出版社, 2004:880-885.
[4] DEBONO DJ, HOEKSEMA LJ, HOBBS RD. Caring for patients with chronic pain: Pearls and Pitfalls [J]. J Am Osteopath Assoc,2013,113(8):620-627.
[5] FINE PG. Long-term consequences of chronic pain: mounting evidence for pain as a neurological disease and parallels with other chronic disease states [J]. Pain Med, 2011, 12(7): 996-1004.[6] 李增春, 陈德玉, 吴德升,等. 第三届全国颈椎病专题座谈会纪要[J]. 中华外科杂志, 2008, 46(23):1796-1799.
[7] YAN C, ZANG Y. DPARSF: a MATLAB toolbox for “pipeline” data analysis of resting-state fMRI[J]. Frontiers in Systems Neuroscience, 2010, 4(13):13.
[8] 蒋鸿,邓寿建,李红霞.影响疼痛的心理因素及护理干预[J].现代医药卫生, 2011, 27(5):781-782.
[9] FRANKLAND P W, TEIXEIRA C M. A pain in the ACC[J]. Molecular Pain, 2005, 1(2):165-168.
[10] VOGT B A, SIKES R W. The medial pain system, cingulate cortex, and parallel processing of nociceptive information. Prog Brain Res[J]. Progress in Brain Research, 2000, 122:223-235.[11] SCHNITZLER A, PLONER M. Neurophysiology and functional neuroanatomy of pain perception.[J]. Journal of Clinical Neurophysiology, 2000, 17(6):592.
[12] 王锦琰,罗非,韩济生. 内、外侧痛觉系统——伤害性信息处理的并行通路[J]. 中国神经科学杂志,2003,6:416-419.
[13] CASEY K L, MINOSHIMA S, MORROW T J, et al. Comparison of human cerebral activation pattern during cutaneous warmth, heat pain, and deep cold pain[J]. Journal of Neurophysiology, 1996, 76(1):571-81.
[14] VOGT B A, DERBYSHIRE S, JONES A K. Pain processing in four regions of human cingulate cortex localized with co-registered PET and MR imaging.[J]. European Journal of Neuroscience, 1996, 8(7):1461-73.
[15] 张蔚婷, 罗非, 韩济生. 痛觉的脑功能成像研究进展[J]. 生理科学进展, 2001, 32(3):209-214.
[16] 张明,王渊,章士正,等. 同强度电刺激诱发岛叶激活的功能磁共振成像研究[J]. 西安交通大学学报:医学版, 2005, 26(6):550-553.
[17] LUTZ A, MCFARLIN D R, PERLMAN D M, et al. Altered anterior insula activation during anticipation and experience of painful stimuli in expert meditators[J]. Neuroimage, 2013, 64(64C):538-546.
[18] OGINO Y, NEMOTO H,INUI K,et al.Inner experience of pain: imagination of pain while viewing images showing painful events forms subjective pain representation in human brain.[J]. Cerebral Cortex, 2007, 17(5):1139-1146.
[19] WU G, TAGLIAZUCCHI E, CHIALVO D R, et al. Point-process deconvolution of fMRI reveals effective connectivity alterations in chronic pain patients[J]. Brain Topography, 2013.
[20] 贾志华, 于生元. 中脑导水管周围灰质参与疼痛发病机制的磁共振研究进展[J]. 中国疼痛医学杂志, 2016, 22(6):454-457.
[21] 张长城, 李希成. 中脑导水管周围灰质在针刺镇痛中的作用[J]. 生理科学进展, 1983(3).
[22] ZHANG M, WANG Y, LIU H, et al. Anterior cingulate cortex involving in pain modulation -an functional magnetic resonance imaging study[J]. National Medical Journal of China, 2006, 86(30).[23] 许丽.推拿镇痛时兔中央灰质区β—内啡肽及单胺类物质的释改变化[J]. 中国中医药科技,1997,2:65-66.
[24] 王锦琰, 罗非, 韩济生. 前扣带回在痛感知中的作用[J]. 中国疼痛医学杂志, 2004, 10(2):113-116.
[25] 张涵, 王晓东, 李辉. 奖赏和动机在疼痛及其缓解过程中的作用[J]. 神经解剖学杂志, 2016, 32(1):108-112.
[26] 李征宇, 孙兮文, 张效初,等. 推拿镇痛的脑功能核磁共振研究[J]. 国际中医中药杂志, 2007, 29(6):329-332.
Effects of Tuina on Pain-Related Brain Area of Chronic Cervical Spondylotic Radiculopathy
WANG Hao, ZUO Wei-bin, ZHANG Hui, SHANG Ke-xin, TAN Zhong-jian, CHEN Hong△, ZHANG Hua△
(DepartmentofTuina,DongzhimenHospital,BeijingUniversityofChineseMedicine,Beijing100700,China)
Objective:To explore Tuina on pain - related brain area of chronic cervical spondylotic radiculopathy. Methods:10 patients with chronic cervical spondylotic radicular pain and 10 healthy controls accept resting state functional magnetic resonance scan before Tuina therapy. The patients received 12 weeks Tuina therapy,and were accessed by cervical spondylosis scale before and after therapy. The patients again accepted resting state functional magnetic resonance scan after Tuina therapy,and cervical spondylosis scale were accessed to contrast the difference before and after the treatment. Region of Interest (ROI) connected with pain was extracted,and was processed by Granger causilty analysis.Results:There is casualty relationship among left thalam,left insula and right insula,and between right thalam and right insula. After the treatment,there is casualty relationship between periaqueductal gray matter and left thalam,right central posterior gyrus and anterior cingulate gyrus.Conclusion:Tuina can inhibit the transmission of pain information by inhibiting the ascending conduction of nociceptive information in PAG, or stimulating the activation of PAG pathway, so as to achieve the analgesic effect.
Tuina; cervical spondylotic radiculopathy; chronic pain; resting state fMRI; region of interest
北京中医药大学中青年教师资助项目(2013-JYBZZ-JS-047)
王 昊(1974-),男,北京人,住院医师,从事中医推拿治疗颈椎病的临床与研究。
△通讯作者:陈 红,Tel:13501251483,E-mail: bin8266@hotmail.com;张 华,Tel:13811216612;E-mail:nwkzhhsf@aliyun.com。
R681.5+5
B
1006-3250(2017)06-0854-04
2017-01-18
