硬质神经内镜辅助手术治疗慢性硬膜下血肿的临床疗效
2017-07-18朱卿王中勇张檀戴纯刚许亮孙超陈爱林兰青
朱卿,王中勇,张檀,戴纯刚,许亮,孙超,陈爱林,兰青
(苏州大学附属第二医院 神经外科,江苏 苏州 215004)
硬质神经内镜辅助手术治疗慢性硬膜下血肿的临床疗效
朱卿,王中勇,张檀,戴纯刚,许亮,孙超,陈爱林,兰青
(苏州大学附属第二医院 神经外科,江苏 苏州 215004)
目的 探讨硬质神经内镜辅助手术治疗慢性硬膜下血肿(CSDH)的临床疗效与操作技巧。方法 回顾性分析2009年8月-2015年12月采用血肿抽吸冲洗术治疗的161例CSDH患者的临床资料,其中74例采用硬质神经内镜辅助手术(内镜组),同期的另87例采用常规钻颅抽吸冲洗术治疗(常规组)。两组患者的年龄分布、头部创伤后病程、双侧血肿比率和血肿量等一般资料比较,差异均无统计学意义(P >0.05),具有可比性。记录两组的手术时间、操作相关并发症、术后即刻血肿完全清除率以及术后住院时间、血肿复发率的情况。结果 虽然内镜组的手术时间长于常规组,但操作相关并发症、术后即刻血肿完全清除率、术后住院时间及血肿复发率均低于常规组。内镜组的手术时间为(112.68±34.86)min,常规组为(74.11±28.23)min,差异有统计学意义(t =7.75,P =0.000)。内镜组的术后住院时间为(8.23±2.01)d,常规组为(10.79±5.02)d,差异有统计学意义(t =-4.12,P =0.000)。内镜组无手术相关并发症,常规组有1例出现脑内血肿及运动性失语。内镜组的术后即刻血肿清除率为98.65%(73/74),常规组为86.21%(75/87),差异有统计学意义(χ2=8.34,P =0.004)。内镜组的术后血肿复发率为1.35%(1/74),常规组为18.39%(16/87),差异有统计学意义(χ2=12.29,P =0.000)。两组患者出院后均进行门诊随访,随访时间6~38个月,平均30.06个月;17例在随访期间诊断为血肿复发,其中15例再次接受手术治疗后治愈,2例口服阿托伐他汀后治愈。结论 硬质神经内镜辅助手术治疗CSDH简单、安全、有效,优于传统的钻孔抽吸冲洗术。自制的头端可弯曲软头吸引器是进行此类手术的有效工具。
慢性硬膜下血肿;硬质神经内镜;手术治疗
慢性硬膜下血肿(chronic subdural hematoma,CSDH)通常以慢性颅内压增高为主要临床表现。血肿量较大、中线结构偏移明显者通常无自愈倾向,诊断明确后应尽早手术治疗[1]。钻颅抽吸冲洗术是公认的首选术式,虽然操作简单、创伤小,但操作过程无法全程在直视下进行,部分病例血肿清除不彻底、术后复发率较高,特别是对于有分隔者[2]。苏州大学附属第二医院神经外科2009年8月-2015年12月共对74例CSDH患者采用硬质神经内镜辅助手术,效果良好。现回顾这些患者的临床资料,并与同期采用常规钻颅抽吸冲洗术的87例患者进行比较,分析探讨该方法的优势,并进行相关器械改进,为临床应用提供依据。现报道如下:
1 资料与方法
1.1 一般资料
1.1.1 纳入标准 ①经头部CT或磁共振成像(magnetic resonance imaging,MRI)扫描确诊为CSDH者;②有明确头部创伤史者,病程>3周;无明确头部创伤史者均行头部MRI扫描,T1W及T2W序列均呈高信号(血肿慢性期)者;③Glasgow昏迷评分(Glasgow coma scale,GCS)≥8分;④血肿量≥30 ml,有足够空间容纳神经内镜进行操作者。
1.1.2 排除标准 ①有明确头部创伤史者,病程≤3周;②血肿在头部CT及MRI上呈急性或亚急性表现者;③GCS<8分或并发脑疝者;④血肿量<30 ml,或术中脑组织迅速复位而无法导入神经内镜进行操作者;⑤合并需手术处理的其他颅内病变;⑥由于各种原因无法手术或未手术者,或者首先接受阿托伐他汀治疗者。
1.1.3 分组 2009年8月-2015年12月,共161例患者符合标准纳入研究。其中74例采用硬质神经内镜辅助手术(内镜组),另87例采用常规钻颅抽吸冲洗术治疗(常规组)。内镜组:男62例,女12例;年龄43~95岁,平均70.47岁。有明确头部创伤史者56例(75.68%),病程1~5个月,平均(57.98±29.06)d。临床表现为头痛32例,肌力减退32例,头晕14例,行走不稳6例,反应迟钝3例,二便失禁2例,无症状5例。双侧血肿17例(22.97%),单侧血肿57例(左侧32例,右侧25例)。血肿量60~220 ml,平均(121.76±32.24)ml。常规组:男79例,女8例;年龄27~88岁,平均68.57岁。有明确头部创伤史者66例(75.86%),病程1~6个月,平均(61.50±32.19)d。临床表现为头痛39例,头晕24例,肌力减退18例,反应迟钝9例,行走不稳8例,无症状1例。双侧血肿21例(24.14%),单侧血肿66例(左侧34例,右侧32例)。血肿量60~210 ml,平均(119.14±37.85)ml。两组患者的年龄分布、头部创伤后病程、双侧血肿率和血肿量等一般资料比较,差异均无统计学意义(P >0.05),具有可比性。见表1。
1.2 手术方法
所有患者均在气管内插管全身麻醉下接受手术。
1.2.1 常规组 根据术前CT或MRI定位血肿最厚处做4.0 cm头皮直切口。在切口中心钻单个骨孔(直径1.5 cm);“十”形切开硬脑膜及血肿包膜,置入10#硅胶管抽吸干净液态血肿后,至少向前后左右4个方向以生理盐水反复冲洗至冲洗液基本澄清,向血肿腔内枕部留置10#硅胶管;常规缝合切口。
1.2.2 内镜组 头皮切口与常规组相同;电钻在切口边缘钻单个骨孔(直径0.5 cm),以铣刀铣下直径2.5 cm小骨瓣,磨除骨窗缘内板;“十”形切开硬脑膜及血管包膜,向血肿腔最低处置入10#硅胶管抽吸干净液态血肿后,导入30°Storze硬质神经内镜观察血肿腔内,用自制的头端可弯曲软头吸引器打开分隔并吸除残余血肿(图1);在神经内镜监视下以生理盐水冲洗干净血肿腔后,向血肿腔内枕部留置10#硅胶管;悬吊并缝合硬脑膜,颅骨瓣以2枚钛连接片及4枚钛螺丝复位,常规缝合切口。
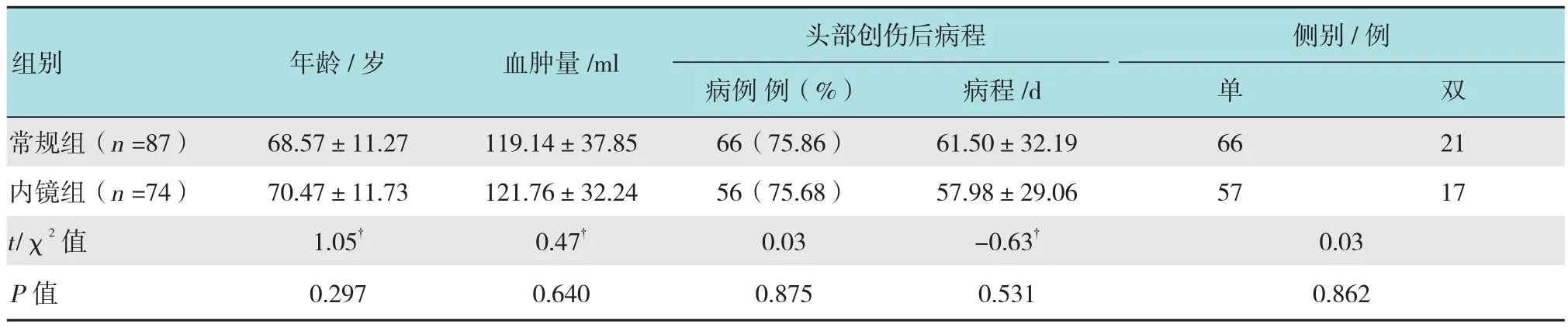
表1 两组一般资料比较Table 1 Comparison of general information between the two groups
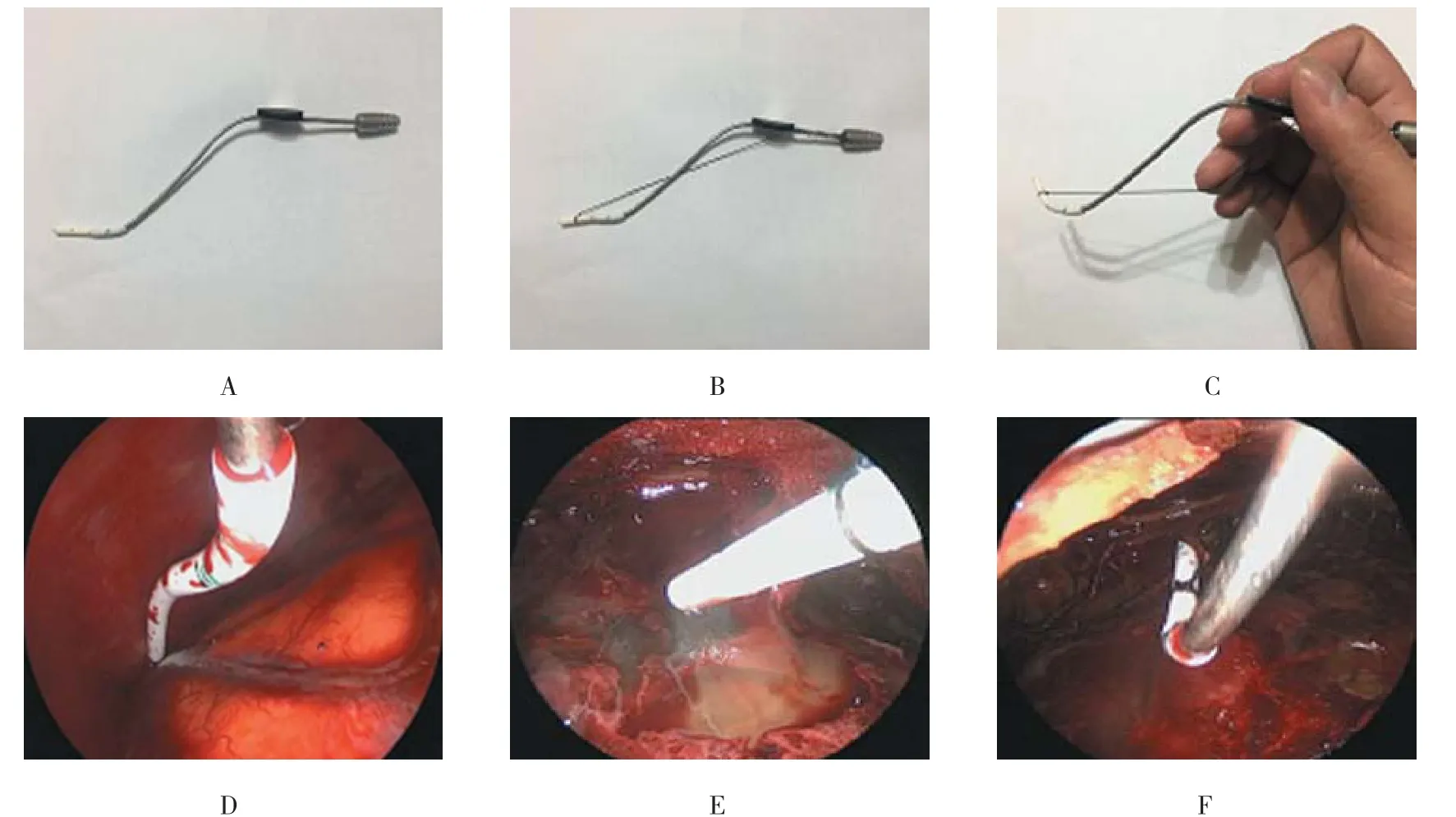
图1 吸引器的改进Fig.1 Improvement of suction
1.3 术后处理及疗效评价指标
两组患者手术后处理方法相同,均于术后2 h复查头部CT确认术后即刻是否完全清除血肿。术后第3天复查头部CT,无血肿残留及再出血、脑复张满意者拔除引流管;若有血肿残留、再出血或脑复张不满意者,留置引流管至术后5~7 d,复查头部CT后视情况拔除引流管。出院前、出院后1、3和6个月及1和3年门诊随访时常规复查头部CT。记录两组患者的手术时间、操作相关并发症、术后即刻血肿完全清除率以及术后住院时间、血肿复发率的情况。
1.4 统计学方法
所有数据采用SPSS 19.0软件包进行分析。计量资料以均数±标准差(±s)表示,组间数据的比较采用t检验;计数资料比较采用四格表χ2检验。检验水准α=0.05,以P <0.05为差异具有统计学意义。
2 结果
2.1 两组的手术结果比较
内镜组的手术时间为(112.68±34.86)min,比常规组的(74.11±28.23)min长,差异有统计学意义(t =7.75,P =0.000)。内镜组的术后住院时间为(8.23±2.01)d,比常规组的(10.79±5.02)d短,差异有统计学意义(t =-4.12,P =0.000)。内镜组无手术相关性并发症。内镜组的术后即刻血肿完全清除率为98.65%(73/74),常规组为86.21%(75/87),两组比较差异有统计学意义(χ2=8.34,P =0.004),见表2。常规组1例手术后出现骨孔下方邻近额叶脑内血肿(约10 ml)及不全性运动性失语,经保守治疗2周后血肿吸收、失语恢复;考虑原因为向血肿腔深部输送硅胶管时与脑表面摩擦引起挫伤所致。内镜组中1例未完全清除血肿者系因骨瓣偏额侧,血肿腔枕部角落因弧形的脑表面遮挡所致。
2.2 术后情况
所有患者出院后均进行门诊随访,随访时间6~38个月,平均30.06个月。内镜组1例术后复发(1.35%),常规组16例术后复发(18.39%),两组比较差异有统计学意义(χ2=12.29,P =0.000)。常规组的术后复发病例中有14例接受再次手术,硬质神经内镜观察发现血肿腔内均有分隔,在神经内镜监视下打开分隔清除分隔后方血凝块后,所有病例均得到治愈;另2例复发血肿量<30 ml者接受阿托伐他汀口服3个月后治愈。内镜组的1例术后复发病例系口服拜阿司匹林引起的凝血功能障碍所致,在纠正凝血功能障碍的同时再次手术,术中并未发现血肿腔内分隔,清除血肿后留置引流管10 d后治愈。硬质神经内镜辅助治疗CSDH典型病例见图2。
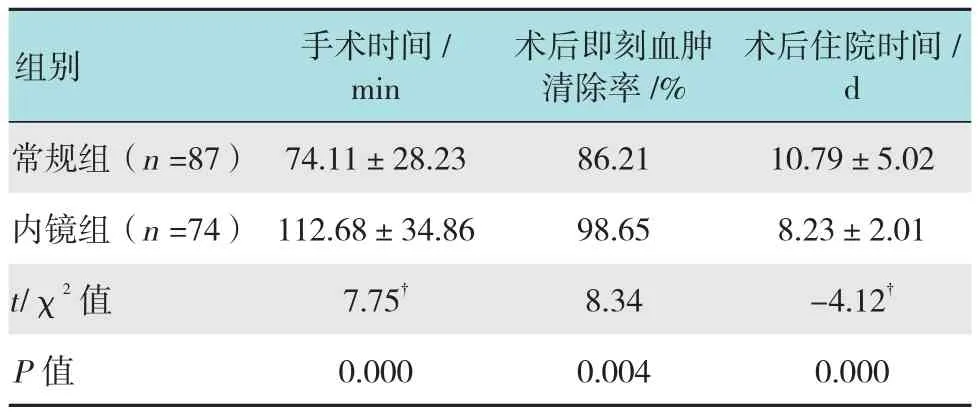
表2 两组的手术结果比较Table 2 Comparison of surgical outcome between the two groups
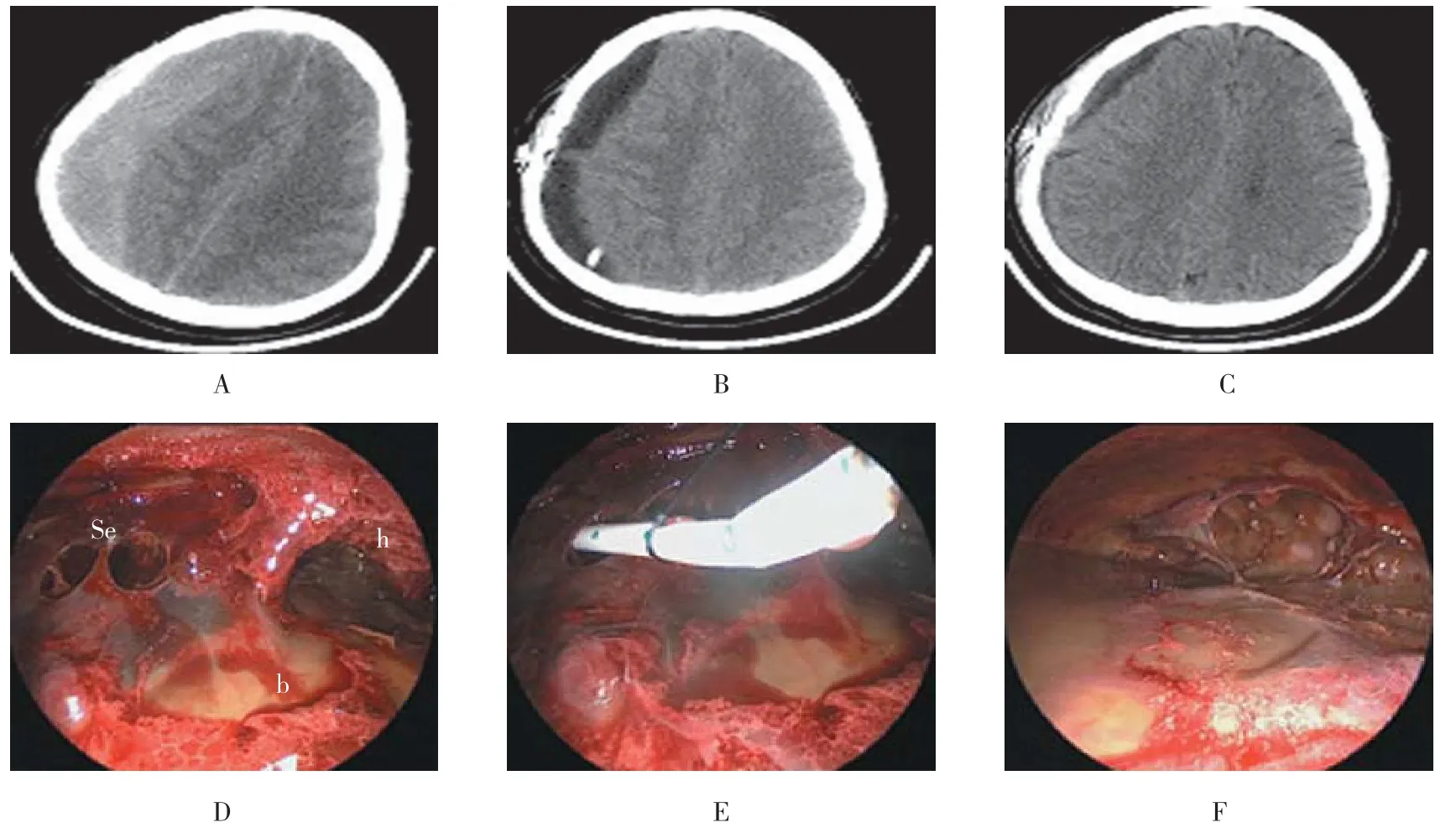
图2 硬质神经内镜辅助治疗CSDH典型病例Fig.2 A case of chronic subdural hematoma treated by rigid neuroendoscope
3 讨论
CSDH常见于中老年人,多数与头部创伤有关,但往往程度轻微而被忽视[3-4];本组病例中不能提供明确头部创伤史者达24.22%(39/161)。已有文献报道的新生毛细血管学说、血肿液纤溶亢进学说等都认为血肿包膜反复出血、局部凝血功能障碍导致血肿不断扩大[5];本组病例中也有1例手术后血肿复发者明确与服用拜阿司匹林引起的凝血功能异常有关,佐证了凝血功能异常是血肿进展与术后复发的危险因素之一,在治疗过程中应予以重视、纠正,特别是合并其他需进行抗凝、抗血小板治疗的疾病者[6-7]。
钻颅抽吸冲洗术仍是目前治疗CSDH的首选方式[8],其操作简单,甚至可在局部麻醉下进行,但术后血肿复发率较高[9];本研究常规组复发病例达18.39%。对这些复发病例进行再次手术时,内镜观察发现所有患者均有血肿腔分隔,通过打开分隔、清除其后方血肿并冲洗后均得到治愈;推测血肿腔分隔导致的血肿残留、脑复张受限是造成术后血肿复发的主要原因[10-11]。常规钻颅抽吸冲洗术,其置入硅胶管的过程在本质上是盲目的,在骨孔以外的区域完全凭手术者的手感;分隔的存在阻挡软性硅胶管对分隔后方血肿的清除与冲洗,并可能改变硅胶管行进方向,遗漏更大范围的血肿。因此,神经内镜的优势显而易见,不但可直视观察血肿腔,还为其深部精细操作提供了可能性[12-14]。本研究内镜组的手术中在导入神经内镜后均可见到不同程度的非液态血肿残留,主要附着于分隔后方、纤维束带周围、壁层包膜上;而采用常规方法的血肿残留概率很大。此外,血肿包膜渗血也被认为是造成术后血肿复发的原因之一,并常常造成术后复查CT发现血肿腔内有高密度新鲜出血[15-16]。本研究中内镜组观察到17例患者在清除血肿后血肿壁层包膜有活动性渗血,经双极电凝低功率烧灼止血后,均无新鲜血肿与复发;而这种情况在常规钻颅抽吸冲洗术中是无法发现、更无法处理的,有时甚至需要进行大骨瓣开颅处理[17]。因而,为了便于处理壁层包膜,选择头端向上弯曲的双极电凝更为方便。也有文献报道采用口服皮质激素、阿托伐他汀治疗CSDH并取得良好治疗效果,但其机制及适应证尚未明确[18];本研究仅对2例血肿量不大(<30 ml)的术后复发CSDH病例尝试采用阿托伐他汀口服,最终获得治愈,但对于血肿量较大者是否有效,尚待商榷。
在神经内镜的选择上,有学者主张采用软质镜进行手术,认为软质镜能更深入血肿腔观察其边缘[19]。虽然本研究的内镜组中也有1例因骨孔位置过于偏前导致血肿腔后部角落因弧形的脑表面遮挡造成血肿清除不彻底,似佐证了软质镜的优势;但软质镜需双手操作的复杂性也显而易见,进出血肿腔及调整位置时不如硬质镜便捷。通常CSDH范围越大,血肿也越厚,血肿腔也越大。因此,将骨孔位置置于血肿范围中央,采用硬质镜完全可以覆盖全部血肿腔;并且,硬质镜仅需单手持镜,另一手可持吸引器、双极电凝等,操作灵活、效率高。为了扩大硬质镜的操作自由度,笔者借鉴了本单位锁孔手术的经验[20],将小骨窗缘的颅骨内板磨除,不仅增加了内镜的操作角度,也便于手术器械的输送,并且使得处理硬脑膜外渗血更为方便。笔者在手术中更偏好选用30°硬质镜,兼顾到前方视野的同时,更有利于获得观察上方的视野,这也是为了便于对易于渗血的壁层包膜进行观察、止血的考虑。
吸引器是内镜下清除液态及非液态血肿的利器。但由于角度限制,常规的直头硬质吸引器无法进入血肿腔深部;而简单地将吸引器头端2.0 cm弯曲成45°,虽然便于进入血肿腔,但随后发现这种硬质吸引器在吸除壁层包膜附着的血肿时也容易损伤包膜造成新的出血。因此,为了在深部空间进行有效操作,需要解决3个问题:安全性、深度和角度。针对这3个问题,笔者在实际手术中也不断对吸引器进行改进:首先在上述成角吸引器头端套上2.0 cm的硅胶管(10#),使发挥吸引作用的头端变成软质材料,从而提高安全性。其次,套上更长的硅胶管(3.0 cm以上)可解决深度问题;软性硅胶管头端可被动地沿着壁层包膜内表面安全地进入血肿腔深部进行操作。针对角度问题,一般采用不同角度的成角吸引器进行解决,但手术中频繁更换较为繁琐,同时增加成本。笔者的改进方式是在硅胶管根部1.0 cm处缚扎一7#丝线,其尾端缚扎于吸引器调节口处,并将硅胶管头端预先向下10°放置;手术中通过按压、放松丝线,可使硅胶管头端上翘、下弯,达到主动改变吸引角度的目的,并且发现这种操作也能进行血肿腔分隔的处理。这种自制的头端可弯曲软头吸引器取材方便、制作简单、成本低廉。另一方面,与显微镜下操作不同,手术者在内镜下操作需以一手持镜,仅有一手可持其他器械。包膜渗血时需更换双极电凝,并且电凝产生的雾气也容易模糊内镜视野。虽然可采用气动臂固定内镜进行双手操作,但多加的一件器械也将限制骨孔中其他器械的操作灵活性。若能进一步改进在硅胶管头端安置U形金属回路外接单极电凝,制成一体化的吸引、电凝装置,则可有效地在吸引的同时进行止血。
[1] LEE K S. History of chronic subdural hematoma[J]. Korean J Neurotrauma, 2015, 11(2): 27-34.
[2] ILIESCU I A. Current diagnosis and treatment of chronic subdural hematomas[J]. J Med Life, 2015, 8(3): 278-284.
[3] LEE K S. Chronic subdural hematoma in the aged, trauma or degeneration[J]. J Korean Neurosurg, 2016, 59(1): 1-5.
[4] FARHAT NETO J, ARAUJO J L, FERRAZ V R, et al. Chronic subdural hematoma: epidemiological and prognostic analysis of 176 cases[J]. Rev Col Bras Cir, 2015, 42(5): 283-287.
[5] HAN S B, CHOI S W, SONG S H, et al. Prediction of chronic subdural hematoma in minor head trauma patients[J]. Korean J Neurotrauma, 2014, 10(2): 106-111.
[6] KAMENOVA M, LUTZ K, SCHAEDELIN S, et al. Does early resumption of low-dose aspirin after evacuation of chronic subdural hematoma with burr-hole drainage lead to higher recurrence rates[J]. Neurosurgery, 2016, 79(5): 715-721.
[7] OKANO A, OYA S, FUJISAWA N, et al. Analysis of risk factors for chronic subdural haematoma recurrence after burr hole surgery:optimal management of patients on antiplatelet therapy[J]. Br J Neurosurg, 2014, 28(2): 204-208.
[8] JANG K M, KWON J T, HWANG S N, et al. Comparison of the outcomes and recurrence with three surgical techniques for chronic subdural hematoma: single, double burr hole, and double burr hole drainage with irrigation[J]. Korean J Neurotrauma, 2015, 11(2):75-80.
[9] SONG D H, KIM Y S, CHUN H J, et al. The predicting factors for recurrence of chronic subdural hematoma treated with burr hole and drainage[J]. Korean J Neurotrauma, 2014, 10(2): 41-48.
[10] KIM J, MOON J, KIM T, et al. Risk factor analysis for the recurrence of chronic subdural hematoma: a review of 368 consecutive surgical cases[J]. Korean J Neurotrauma, 2015,11(2): 63-69.
[11] JUNG Y G, JUNG N Y, KIM E. Independent predictors for recurrence of chronic subdural hematoma[J]. J Korean Neurosurg Soc, 2015, 57(4): 266-270.
[12] KOLIAS A G, CHARI A, SANTARIUS T, et al. Chronic subdural haematoma: modern management and emerging therapies[J]. Nat Rev Neurol, 2014, 10(10): 570-578.
[13] BERHOUMA M, JACQUESSON T, JOUANNEAU E. The minimally invasive endoscopic management of septated chronic subdural hematomas: surgical technique[J]. Acta Neurochir(Wien), 2014, 156(12): 2359-2362.
[14] CODD P J, VENTEICHER A S, AGARWALLA P K, et al. Endoscopic burr hole evacuation of an acute subdural hematoma[J]. J Clin Neurosci, 2013, 20(12): 1751-1753.
[15] BOKKA S, TRIVEDI A. Histopathological study of the outer membrane of the dura mater in chronic subdural hematoma: its clinical and radiological correlation[J]. Asian J Neurosurg, 2016,11(1): 34-38.
[16] JACK A, O’KELLY C, MCDOUGALL C, et al. Predicting recurrence after chronic subdural haematoma drainage[J]. Can J Neurol Sci, 2015, 42(1): 34-39.
[17] LIU W, BAKKER N A, GROEN R J. Chronic subdural hematoma:a systematic review and meta-analysis of surgical procedures[J]. J Neurosurg, 2014, 121(3): 665-673.
[18] THOTAKURA A K, MARABATHINA N R. Nonsurgical treatment of chronic subdural hematoma with steroids[J]. World Neurosurg,2015, 84(6): 1968-1972.
[19] MÁJOVSKÝ M, MASOPUST V, NETUKA D, et al. Flexible endoscope-assisted evacuation of chronic subdural hematomas[J].Acta Neurochir (Wien), 2016, 158(10): 1987-1992.
[20] LAN Q, ZHU Q, LI G. Micorsurgical treatment of posterior cerebral circulation aneurysms via keyhole approaches[J]. World Neurosurg, 2015, 84(6): 1758-1764.
(曾文军 编辑)
Clinical eff cacy of surgery for chronic subdural hematoma assisted by rigid neuroendoscope
Qing Zhu, Zhong-yong Wang, Tan Zhang, Chun-gang Dai, Liang Xu, Chao Sun, Ai-lin Chen, Qing Lan
(Department of Neurosurgery, the Second Affi liated Hospital of Soochow University,Suzhou, Jiangsu 215004, China)
Objective To discuss the clinical effi cacy of surgery for chronic subdural hematoma assisted by rigid neuroendoscope and its surgical techniques. Methods Clinical data of 161 patients with chronic subdural hematoma from August 2009 to December 2015 was analyzed retrospectively. 74 of them experienced surgeries assisted by rigid neuroendoscope (endoscope group) and other 87 cases were operated without neuroendoscope(routine group) during the same period. Results Although there were signifi cant difference in operative duration between the two groups, complications, ratio of total removal of hematoma after surgery, postoperative inpatient duration and recurrent rate of hematoma were more advantageous in endoscope group. The operative duration of endoscope group with (112.68 ± 34.86) min was longer than that of routine group with (74.11 ± 28.23) min (t = 7.75,P = 0.000), while the postoperative inpatient duration of endoscope group with (8.23 ± 2.01) d was shorter than thatof another group with (10.79 ± 5.02) d (t = -4.12, P = 0.000). There were no surgical associated complications in endoscope group, but 1 patient in routine group experienced intracerebral hematoma of frontal lobe and associated aphemia. Total removal of hematoma was confi rmed in endoscope group with 98.65% (73/74), which was higher than that in routine group with 86.21% (75/78) (χ2= 8.34, P = 0.004). Hematoma recurrence was found in 16 cases of routine group (18.39%), but more superiority in endoscope group with 1.35% (χ2= 12.29, P = 0.000). Outpatient follow-up was carried out in all patients from 6 to 38 months with an average duration of 30.06 months. In 17 cases with recurrent hematoma during follow-up, 15 of them were cured by a second surgery, and another 2 patients were cured by atorvastatin. Conclusion As a simple, safe and effective technique, the application of rigid neuroendoscope during surgery for chronic subdural hematoma is more advantage than routine surgery. A self-made suction with adjustable soft curved tip is suitable for such procedure.
chronic subdural hematoma; rigid neuroendoscope; surgical therapy
R651.1
A
2016-11-20
10.3969/j.issn.1007-1989.2017.06.012
1007-1989(2017)06-0052-06
