食管胃交界部腺癌新辅助化疗疗效预测因子的临床研究
2017-07-18张志忠刘志强万云杰李守淼李保中
张志忠,张 伟,刘志强,万云杰,李守淼,李保中
(河南科技大学第一附属医院,河南 洛阳 471000)
食管胃交界部腺癌新辅助化疗疗效预测因子的临床研究
张志忠,张 伟,刘志强,万云杰,李守淼,李保中
(河南科技大学第一附属医院,河南 洛阳 471000)
目的 探讨P53、Ki-67、MRP在(AEGJ)组织中的表达情况及在SOX方案新辅助化疗疗效中的预测价值。方法 98例进展期AEGJ患者均行SOX方案新辅助化疗,并用免疫组化方法检测P53、Ki-67、多药耐药相关蛋白(MRP)的表达情况,分析各蛋白表达与化疗疗效的关系。结果 本组患者新辅助化疗有效率为48.0%。P53、Ki-67和MRP的阳性率分别为32.6%、59.2%和34.7%。P53和Ki-67的表达与化疗敏感性有关(P<0.05),但MRP的表达与化疗敏感性无关(P>0.05)。结论 P53低表达和Ki-67高表达是AEGJ患者SOX方案新辅助化疗敏感性的影响因素,两者表达情况可为AEGJ个体化新辅助化疗方案的选择提供有益的参考。
食管胃结合部肿瘤;新辅助化疗;预测因子;化疗敏感性
新辅助化疗对进展期食管胃交界部腺癌(adenocarcinoma of esophagogastric junction)(AEGJ)能提高手术切除率、减少术后复发转移、延长生存期,但仍有部分患者疗效差,通过早期筛选出对化疗应答不敏感的患者探寻可靠的化疗敏感性预测指标从而减少不必要的术前化疗,已成为较重要临床课题方向之一[1-5]。针对于此,我们回顾性检测了P53、Ki-67和多药耐药相关蛋白(multidrug resistance protein.MRP)在AEGJ化疗前活检标本中的表达状况,期望筛选出可能对SOX方案新辅助化疗较敏感的预测因子,从而研究化疗药物敏感性的差异,寻找可靠的化疗敏感性预测指标数据,为AEGJ的个体化治疗提供依据。
1 资料与方法
1.1 一般资料 收集2010年6月至2015年6月在安阳市肿瘤医院行新辅助化疗的98例进展期AEGJ患者临床资料,男65例,女33例;年龄38~70岁,中位年龄66.1岁;治疗前临床分期均为cT3~4Nl~3M0。其中术前病理类型(Lauren分型):共78例中、低分化腺癌(其中5例伴印戒细胞癌,8例伴黏液腺癌),高分化腺癌4例,黏液腺癌7例,印戒细胞癌5例,印戒细胞癌合并黏液腺癌4例。入组标准:1) 均为M0患者[5];2) 胃镜活检病理为腺癌;3) ECOG评分为0~2分,且无严重心、肺、肝、肾等脏器功能异常者;4) 腹部增强CT显示局部肿块侵犯胃壁全层(T3或T4)或有区域淋巴结肿大;5) 无其他恶性肿瘤病史及放化疗史者(原发);6)患者签署知情同意书。
1.2 治疗方案 对入选的患者实行SOX 3周方案的新辅助化疗:同时口服替吉奥胶囊40~60 mg,bid,第1~14天,休息1周后重复,为1周期,共2周期;奥沙利铂注射液130 mg·m-2,静脉滴注2~3 h,d1,化疗的同时予以西米替丁、地塞米松、格拉司琼、苯海拉明等辅助用药治疗。在化疗结束后3~5周进行术前疗效评价(ECOG生活质量评分及营养评分),若无肿瘤进展,则行标准食管胃交界部腺癌根治术(D2),术后给予常规辅助化疗。
1.3 检测方法
1.3.1 临床检查 患者在新辅助化疗前后分别进行64排增强CT检查、胃镜(或超声胃镜)进行疗效对比评价,手术患者术后行疗效评价和相关病理组织学检查。
1.3.2 免疫组化检查 新辅助化疗前对活检肿瘤组织行3种蛋白免疫组化检查。标本的处理及免疫组化染色按说明书进行操作:所有活检标本均用质量分数4%甲醛固定后行石蜡包埋,连续切片,厚度为4 μm。用多聚-L-赖氨酸涂覆玻片,常规HE染色,判别病理类型。采用柠檬酸缓冲液微波抗原法修复。实验试剂:鼠抗人P53、鼠抗人Ki-67、鼠抗人MRP、即用型单克隆抗体和检测试剂盒(KIT-9701)购于福州迈新生物技术开发公司。
S-P免疫组化染色方法简述如下:石蜡切片经二甲苯、梯度乙醇水化、柠檬酸缓冲液高温高压抗原修复后滴加过氧化酶阻断液室温10 min,pH=7.2磷酸盐缓冲液(PBS) 冲洗后滴非免疫性动物血清,室温10 min,然后滴加一抗(抗p53、抗Ki-67和抗MRP),4 ℃冰箱孵育过夜;PBS冲洗,滴加二抗,室温10 min;PBS冲洗后滴加链霉素亲和素-过氧化物酶溶液室温10 min,PBS冲洗,DAB显色,冲冼,苏木素复染,封片,显微镜观察。用PBS代替一抗作为阴性对照,用已知阳性切片作阳性对照。
P53、Ki-67蛋白均定位于细胞核,而MRP蛋白定位于细胞膜和细胞质。以细胞结构中存在粗细一致的棕黄色颗粒为阳性染色。P53、Ki-67、MRP阳性表达标准:阳性细胞数<50%表示低表达,计为阴性,而≥50%则表示高表达,计为阳性。以上结果由2名病理学专家阅片判断。
1.4 疗效判断 不良反应采用NCI-CTC 3.0不良反应分级标准判定[3]。新辅助化疗后原发病灶的疗效根据RECIST 1.0[2]标准评估,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。以CR+PR计算客观有效率。以新辅助化疗前后胃镜(或超声胃镜)、术后病理切片、64排增强CT等作为疗效判断的证据。
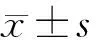
2 结果
2.1 病理特征 分化不良型(低分化腺癌、黏液腺癌、印戒细胞癌、未分化癌和单纯癌)43例,分化良好型(包括管状腺癌、乳头状腺癌、高中分化腺癌)55例。年龄≥65岁者37例,<65岁者61例。患者年龄、肿瘤分化程度与化疗效果均无关(P>0.05)。
2.2 治疗情况 全部98例入组患者均顺利完成新辅助化疗SOX 3周方案2周期。不良反应主要为恶心、呕吐、粒细胞减少、血小板减少、外周神经毒性等经对症治疗后缓解,并未出现Ⅲ度及以上不良反应,安全性良好。90例患者在新辅助化疗后4周行标准食管胃交界部腺癌根治术(D2),共8例患者获得PD,故未行手术治疗。术后并发症情况:7例出现并发症,其中4例患者出现吻合口瘘,3例患者出现吻合口出血,均经保守治疗后治愈。结合术后病理综合判断新辅助化疗疗效:6例CR(6.1%),41例PR(41.8%),43例SD(43.9%),8例PD(8.2%)。新辅助化疗总有效率为48.0%。
2.3 P53、MRP和Ki-67在AEGJ组织中的表达及其与化疗疗效的关系 3种蛋白的表达与年龄、分化程度无关(P>0.05)。P53、MRP和Ki-67阳性表达分别为32例(32.6%)、34例(34.7%)和58例(59.2%)。P53在有效组中阳性率明显低于无效组(P<0.05); Ki-67在有效组中阳性率明显高于无效组(P<0.05);MRP在有效组中阳性率高于无效组,但差异无统计学意义(P>0.05)。见表1。
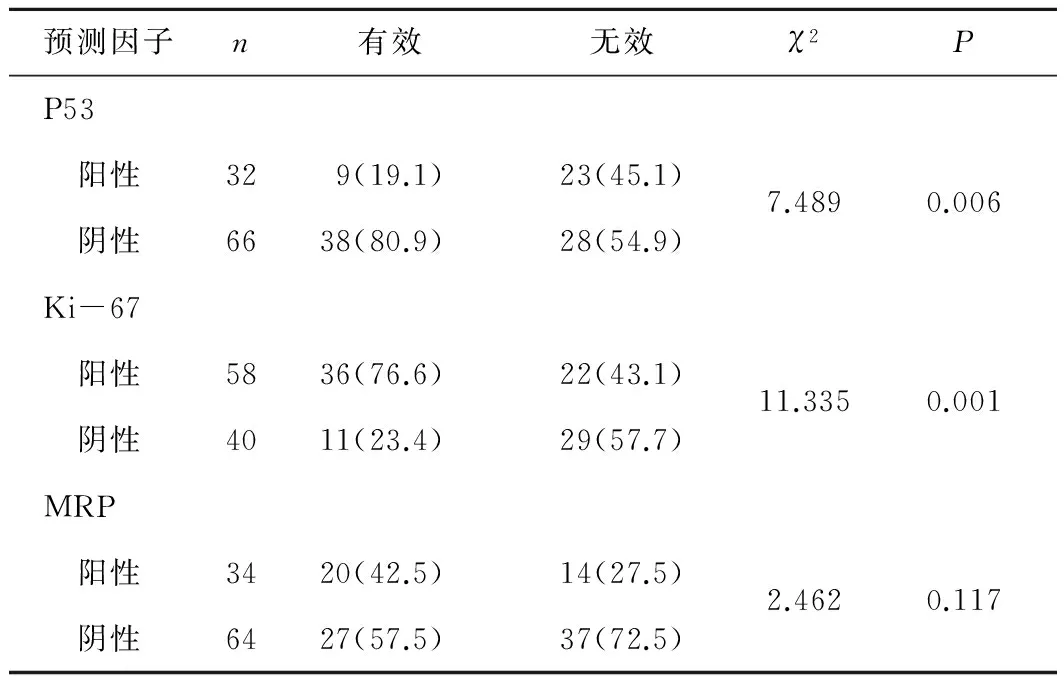
表1 P53、MRP和Ki-67在AEGJ组织中的表达及其与化疗疗效的关系 n(%)
3 讨论
降低消化道肿瘤患者生存率的主要原因之一是肿瘤细胞耐药。对于AEGJ的化疗敏感性如何评价和预测暂时未有定论。本研究参考胃癌的相关报道[5],应用SOX 3周方案对AEGJ进行新辅助化疗,有效率为48.0%,达到了提高R0切除率、降期、减少肿瘤负荷的目的。
本组结果显示,P53阳性者化疗有效率明显低于表达阴性者,与有关胃癌研究[6-7]结果相似,也再次验证了我们前期的研究结论[8]。原因可能为当P53基因发生突变时,对细胞凋亡的调控作用受阻,导致肿瘤细胞对化疗药物产生耐受性。Ki-67是一种细胞核抗原,仅在增殖细胞核中表达,与细胞的合成代谢有关,其表达水平能较全面客观反映肿瘤细胞的增殖状态,是较为理想的检测细胞增殖活性的抗体。本研究结果还显示:Ki-67的表达与化疗敏感性有关,Ki-67高表达患者对新辅助化疗敏感,疗效优于低表达患者,这与胃癌中的研究[9]结果一致。MRP是通过减少还原型谷胱甘肽的协同转运机制来降低细胞内的药物浓度[10]。研究[11]表明细胞表达MRP将明显增加肿瘤细胞对烷化类抗肿瘤药物的耐药性药物抵抗性。
本研究结果显示:P53和Ki-67的在新辅助化疗前的表达情况与化疗效果之间明显相关,P53低表达和Ki-67高表达是化疗敏感的有效预测因子;而MRP的表达与化疗效果之间无明显相关,这与在既往在胃癌[12]、食管胃交界部腺癌[13]新辅助化疗中的研究结果相一致,其表达尚不能在SOX方案的新辅助化疗中起到预测作用。
总之,P53和Ki-67的表达状况与新辅助化疗敏感性相关,可作为预测化疗疗效的因子,而MRP的表达状况则没有相似的效果。
[1] DAVIES AR, GOSSAGE JA, ZYLSTRA J, et al. Tumor stage after neoadjuvant chemotherapy determines survival after surgery for adenocarcinoma of the esophagus and esophagogastric junction[J]. J Clin Oncol, 2014,32(27):2983-2990.
[2] THERASSE P, ARBUCK SG, EISENHAUER EA, et a1.New guidelines to evaluate the response to treatment in solid tumors[J]. J Natl Cancer Inst, 2000,92(12):205-216.
[3] TROTTI A, COLEVAS AD, SETSER A, et al.CTCAE v3.0: development of a comprehensive grading system for the adverse effects of cancer treatment[J]. Semin Radiat Oncol, 2003,13(3):176-181.
[4] 赵晓龙,朱兆华,黄开红,等.胃癌患者临床预后及病理因素与瘦素表达的相关性研究[J]. 中华实验外科杂志,2004,21(5):524-526.
[5] 李涛,陈凛. SOX方案新辅助化疗应用于进展期胃癌的有效性和安全性研究[J].中华胃肠外科杂志, 2011,14(2):104-106.
[6] 曲建军,石毅然,郝风云,等.进展期胃癌新辅助化疗疗效预测因子的临床研究.中华胃肠外科杂志[J]. 2013,16(3):276-280.
[7] KAMOSHIDA S, SUZUKI M, SHIMOMURA R, et al. Immunostaining of thymidylate synthase and p53 for predicting chemoresistance to S-1/cisplatin in gastric cancer[J]. Br J Cancer, 2007, 96(2):277-283.
[8] 张志忠,刘志强,张伟,等. TopoⅡ、Ki-67、P53在胃食管结合部腺癌新辅助化疗疗效预测中的意义[J]. 中国现代医生, 2015,53(4):113-116.
[9] WU A, JIA Y, DONG B,et al.Apoptosis and KI 67 index correlate with preoperative chemotherapy efficacy and better predict the survival of gastric cancer patients with combined therapy[J].Cancer Chemother Pharmacol, 2014,73(5):885-893.
[10]TAKEBAYASHI Y, AKIYAMA S, NATSUGOE S,et al.The expression of multidrug resistance protein in human gastrointestinal tract carcinomas[J].Cancer,1998,82(4):661-666.
[11]SHIMANO K, SATAKE M, OKAYA A, et al. Hepatic oval cells have the side population phenotype defined by expression of ATP-binding cassette transporter ABCG2/BCRP1[J]. Am J Pathol, 2003,163(1):3-9.
[12]宋延强,李扬,林惠忠,等.胃癌新辅助化疗前后多药耐药基因的表达及其与化疗敏感性的关系[J].中华普通外科杂志,2009, 24(5):365-367.
[13]宋清荣. TopoⅡ、MRP和GST-π在食管胃交界部腺癌中的表达及与新辅助化疗疗效的关系[J]. 河南外科学杂志,2016,22(4):9-11.
河南省科技发展计划重点攻关项目(112102310121)
张志忠(1982-),男,主治医师,主要从事胃癌个体化治疗工作。E-mail:zhangzz003@163.com
李保中(1967-),男,主任医师,硕士生导师,主要从事胃肠道肿瘤规范化及个体化治疗工作。E-mail:libaozhong99@126.com
10.3969/j.issn.1673-5412.2017.03.021
R735.1;R730.53
B
1673-5412(2017)03-0243-03
2015-06-30)
