PLA—α—细辛脑纳米粒经鼻腔、静脉给药后药物动力学研究
2017-07-13陆瑾郭立玮付廷明朱国龙戴真南展
陆瑾+郭立玮+付廷明+朱国龙+戴真南+展冠军+陈丽丽
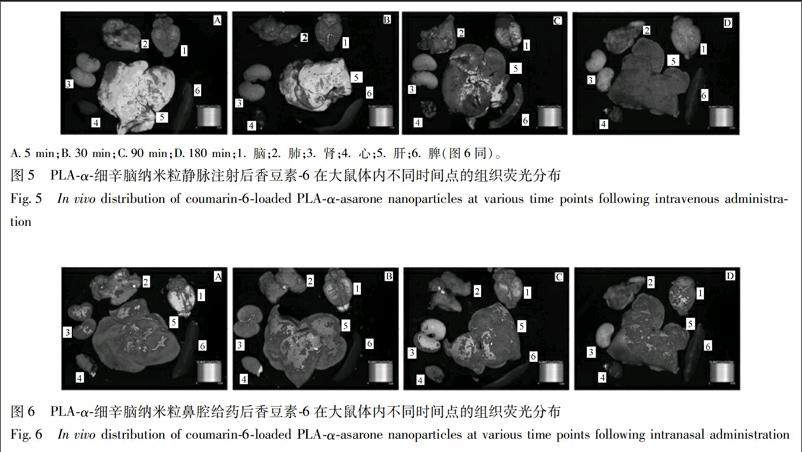
[摘要] 采用乳化溶剂挥发法制备聚乳酸(PLA)-α-细辛脑纳米粒,并与静脉注射给药比较,研究PLA-α-细辛脑纳米粒鼻腔给药后药物的体内分布及脑组织的靶向性。结果显示:鼻腔给药和静脉注射后的脑靶向系数分别为1.65与1.16,PLA-α-细辛脑纳米粒鼻腔给药后的绝对生物利用度为74.2%,脑靶向效率为142.24%,鼻-脑传递百分比为29.83%。荧光标记法显示,PLA-α-细辛脑荧光纳米粒经鼻腔给药后,香豆素-6在脑组织中的荧光强度最大,达到脑靶向给药的目的;PLA-α-细辛脑荧光纳米粒静脉注射给药后,香豆素-6在肝组织中的荧光强度远高于鼻腔给药,表明PLA-α-细辛脑纳米粒经鼻腔给药可降低药物导致的肝毒性。此外,PLA-α-细辛脑荧光纳米粒经鼻腔给药后,香豆素-6在肺组织中的荧光强度较弱,解决了气流粉碎法制备的α-细辛脑干粉经鼻腔给药到达肺部量较多的缺点。体内研究表明:与静脉注射相比,PLA-α-细辛脑纳米粒鼻腔给药后的脑靶向性优于静脉注射。
[关键词] PLA-α-细辛脑纳米粒; 鼻腔; 药物动力学; 脑靶向
[Abstract] PLA-α-asarone nanoparticles were prepared by using organic solvent evaporation method, and their in vivo distribution and brain targeting after intranasal administration were studied as compared with intravenous administration. The results showed that brain targeting coefficient of PLA-α-asarone nanoparticles after intranasal and intravenous administration was 1.65 and 1.16 respectively. The absolute bioavailability, brain-targeting efficiency and the percentage of nasal-brain delivery of PLA-α-asarone nanoparticles were 74.2%, 142.24 and 29.83%, respectively after intranasal administration. The results of fluorescence labeling showed that the fluorescent intensity of coumarin-6 in the brain tissue was the highest after intranasal administration of PLA-α-asarone fluorescent nanoparticles, achieving the purpose of brain-targeted drug delivery. The fluorescent intensity of coumarin-6 in liver tissue after intravenous administration of PLA-α-asarone nanoparticles was much higher than that after intranasal administration, indicating that intranasal administration of PLA-α-asarone nanoparticles could decrease drug-induced hepatotoxicity. In addition, the fluorescent intensity of coumarin-6 in lung tissue was weaker after intranasal administration, which solved the shortcomings of intranasal administration of α-asarone dry powder prepared by airflow pulverization method. In vivo studies indicated that PLA-α-asarone nanoparticles after intranasal administration had a stronger brain targeting as compared with intravenous administration.
[Key words] PLA-α-asarone nanoparticles; intranasal; pharmacokinetic; brain targeting
α-細辛脑是天南星科植物石菖蒲Acorus tatarinowii Schott的主要活性成分之一,研究报道:α-细辛脑通过作用于NO水平治疗阿尔茨海默病[1],通过抑制海马神经元的活性及γ-氨基丁酸(GABA)受体的表达[2]治疗癫痫,同时其可透过血脑屏障。因此,α-细辛脑具有治疗中枢性神经系统疾病的前景。目前,α-细辛脑主要有2种给药方式,以胶囊剂或片剂的形式给药,生物利用度分别仅有2.73%,5.56%[3];若采用静脉注射给药,由于α-细辛脑较高的脂溶性使其在制备过程中加入了吐温、丙二醇等助溶剂,而吐温、丙二醇等助溶剂又是导致细辛脑注射液过敏性休克等严重不良反应的重要原因之一[4-5]。
纳米粒作为胶态药物载体具有小粒子的特征,可以穿过生物膜屏障,有的甚至可避免网状内皮系统吞噬,在不增加药物向血液转运的情况下可促进药物由鼻至脑的直接转运,从而提高药物的脑内浓度[6-8]。本课题组将α-细辛脑通过乳化溶剂挥发法将其制备成PLA-α-细辛脑纳米粒,并对其进行了表征及鼻黏膜毒性的研究[9]。为评价药物在体内的靶向性,本研究采用与静脉注射对比的方式,进一步研究PLA-α-细辛脑纳米粒鼻腔给药后α-细辛脑在体内的分布情况。
1 材料
SM-1000D超声波细胞破碎仪(南京舜玛仪器设备有限公司);HJ-6A六联数显控温磁力搅拌器(江苏金运市金城国胜实验仪器厂);-70 ℃超低温冰箱(海尔);Allegra 64R高速冷冻离心机(美国贝克曼库尔特有限公司);I-6冷冻干燥机(Ehrisa公司);LibrorAEL-40SM 1/10万电子天平(岛津);微型移液器(Eppendor公司);MTN-2000W氮气浓缩仪(奥特赛恩斯仪器有限公司);KQ3200医用数控超声波清洗器(昆山市超声仪器有限公司);50 μL微量进样针(济南赛畅科学仪器有限公司);WH-90A型微型混合器(上海亚荣生化仪器厂);E6/10-8G型超细匀浆机(上海弗鲁克流体机械制造有限公司);ACQUITYTM UPLC超高效液相色谱系统,XevoTM TQ质谱系统(美国Waters公司); ACQUITYTM UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm,美国Waters公司);CRi Maestro IN-VIVO Imaging System小动物活体成像系统(美国)。
α-细辛脑对照品(中国食品药品检定研究院,批号100298-201203);吲哚美辛对照品(中国食品药品检定研究院,批号100258-200904);α-细辛脑原料药(湖北艺康源化工有限公司,批号130104,纯度>98%);聚乳酸(PLA,相对分子质量1万,批号14011105,山东医疗器械研究所);聚乙烯醇1788(polyvinyl alcohol,PVA1788,上海阿拉丁试剂有限公司);香豆素-6(coumarin-6,Sigma-Aldrich);甲醇(色谱纯,Merck),冰醋酸(美国ROE scientific INC.,HPLC),正丁醇(上海中试化工总公司,AR,20090423),水为重蒸水,丙酮、二氯甲烷为分析纯。
Sprague Dawley(SD)大鼠,体重200~250 g,雄性,SPF级(上海西普尔-必凯实验动物有限公司),许可证号SCXK(沪)2008-0016。大鼠饲养在SPF级的环境下,温度18~26 ℃,相对湿度40%~70%,12 h光照/黑暗交替,实验前自由饮水饮食。
2 方法
2.1 PLA-α-细辛脑纳米粒制备
精密称取一定量α-细辛脑原料药和PLA溶于10 mL的有机溶剂(二氯甲烷-丙酮=9∶1)中,配制成PLA质量浓度为14.76 g·L-1,α-细辛脑药物质量浓度为4.89 g·L-1的有机相,将有机相用注射器缓缓注入20 mL不断搅拌的浓度为1%的PVA水溶液中,滴毕,继续搅拌2 min后于超声波细胞破碎仪在600 W功率下超声4 min,磁力搅拌器搅拌6 h以上挥去有机溶剂后,5 000 r·min-1预离心5 min除去沉淀,离心液再以21 000 r·min-1离心45 min得纳米粒沉淀,该沉淀用重蒸水洗涤2次以除去PVA,适量水分散,冷冻干燥48 h得粉末状样品。临用前使用重蒸水配成10 g·L-1及50 mg·L-1的混悬液,分别供鼻腔给药及尾静脉注射。通过该方法制备得到的PLA-α-细辛脑纳米粒平均粒径为265.4 nm,PDI指数0.038,载药量12.40%,包封率55.86%。
2.2 PLA-α-细辛脑荧光纳米粒制备
参照2.1项下方法,在PLA-α-细辛脑荧光纳米粒制备过程中除有机相中加入0.1%的香豆素-6,其他步骤同2.1。
2.3 给药方式与剂量
2.3.1 PLA-α-细辛脑荧光纳米粒血药动力学研究 12只SD大鼠随机分成2组,每组6只,分别进行PLA-α-细辛脑纳米粒鼻腔给药及尾静脉注射。实验前禁食(不禁水)12 h。鼻腔给药方式如下:大鼠乙醚吸入麻醉后仰卧姿势放置,给药前将40 μL质量浓度为10 g·L-1PLA-α-细辛脑纳米粒混悬液吸入微量进样针,微量进样针前端套上塑料皮管对鼻腔进行保护,将微量进样针前端插入大鼠鼻腔,深度不超过8 mm,2个鼻孔分别给药20 μL,整个给药过程在麻醉后1 min内完成。静脉给药方式如下:大鼠乙醚吸入麻醉后装入静脉注射笼,静脉注射器吸入约0.8 mL质量浓度为50 mg·L-1的PLA-α-细辛脑纳米粒进行尾静脈注射,所有大鼠平均给药剂量约为1.6 mg·kg-1(该剂量是根据α-细辛脑纳米粒混悬液最大浓度以及大鼠鼻腔液体给药量而定),该给药剂量也与文献[10]基本一致。
2.3.2 PLA-α-细辛脑荧光纳米粒脑药动力学研究 48只SD大鼠随机分成2组,每组24只。给药方式与剂量同2.3.1,进行PLA-α-细辛脑纳米粒静脉注射与鼻腔给药后脑药动力学研究。
2.3.3 PLA-α-细辛脑荧光纳米粒的药代动力学研究 24只SD大鼠随机分成2组,每组12只。给药方式同2.3.1,根据香豆素-6在纳米粒中的含量,将荧光纳米粒配制成适当的浓度供大鼠鼻腔给药和尾静脉注射(香豆素-6的含量为10 μg)。
2.4 样品采集与处理
2.4.1 血药动力学研究样品采集与处理 鼻腔给药和尾静脉注射后分别于给药后1,3,5,10,15,30,45,60,90,120,180,240 min眼眶后静脉丛取血0.5 mL,置于肝素钠抗凝管中,3 500 r·min-1离心15 min,分离血浆,于-70 ℃冰箱冷冻保存待测。检测前,取出血浆至室温解冻后,精密吸取150 μL于干净离心管中,加入20 μL质量浓度为1 mg·L-1吲哚美辛[11]内标液后,再加入1 000 μL水饱和正丁醇,微型混合器涡旋3 min进行萃取,14 000 r·min-1离心10 min,取800 μL上清液至另一干净的离心管中,在40 ℃的水浴中用氮气浓缩仪吹干,残渣加入100 μL复溶液(0.1%甲酸水-甲醇6∶4),涡旋2 min后,14 000 r·min-1离心10 min,取上清液进样5 μL分析。
2.4.2 脑药动力学研究样品采集与处理 给药后每组分别于5,15,30,45,90,180 min处死4只大鼠,从头盖骨下取出全脑组织,所有样品于-70 ℃冷冻保存待测。检测前,取出样品,精密称取混匀后的脑组织0.3 g于0.5 mL离心管,加入900 μL蒸馏水,匀浆机匀浆后取匀浆液150 μL,加入20 μL质量浓度为1 mg·L-1吲哚美辛内标液,涡旋混匀后,加入1 000 μL水饱和正丁醇,涡旋震荡5 min,14 000 r·min-1离心10 min,吸取800 μL上清液氮气吹干。残渣加入100 μL复溶液(0.1%甲酸水-甲醇=6∶4),涡旋震荡5 min,14 000 r·min-1离心10 min后,取上清进样5 μL分析。
2.4.3 荧光标记法样品采集 给药后每组分别于5,30,90,180 min处死3只大鼠,取下心、肝、脾、肺、肾及脑组织,所有样品于-70 ℃冷冻保存待测。
2.5 检测方法
2.5.1 色谱条件及质谱条件 ACQUITYTM UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm);流动相0.1%甲酸水(A)-甲醇(B),0.5~1.0 min,90%A;1.0~2.0 min,90%~65%A;2.0~4.8 min,65%~35%A;4.8~5.0 min,35%~10%A;5.0~5.5 min,10%~90%A;5.5~6.0 min,90%A;流速0.3 mL·min-1;柱温35 ℃;进样量5 μL。质谱条件为:α-细辛脑母离子相对分子质量209.0,子离子相对分子质量181.0,锥电压34 V,碰撞能量16 V,保留时间4.0 min,离子模式ES+;吲哚美辛母离子相对分子质量360.0,子离子相对分子质量140.9,锥电压48 V,碰撞能量20 V,保留时间4.6 min,离子模式ES+。
2.5.2 荧光标记物的检测方法 取出-70 ℃冷冻保存的大鼠组织样品心、肝、脾、肺、肾及脑,将每只动物的组织样品放入小动物活体荧光成像仪中,对其进行荧光成像,以504 nm作为发射波长,确定示踪纳米粒在大鼠体内不同组织的分布情况。
2.6 数据分析
2.6.1 血药浓度数据处理 采用药动学计算程序DAS 2.2.1,计算α-细辛脑的药动学参数。实验数据以±s表示。鼻腔给药的绝对生物利用度见下。
2.6.2 脑组织浓度数据处理 采用药动学计算程序DAS 2.2.1,计算α-细辛脑的药动学参数。药物靶向指数[12](DTI),药物靶向效率[13](DTE),鼻脑直接传递百分比[14](DTP)计算公式见下。其中,Bi.n.为药物经鼻腔给药后的AUCbrain,Bx为药物经鼻腔给药后通过血液循环透过血脑屏障进入脑部的AUCbrain,Bi.v.为药物静脉注射后的AUCbrain,Pi.v.为药物静脉注射后的AUCplasma,Pi.n.为药物鼻腔给药后的AUCplasma,实验数据以±s表示。
3 结果
3.1 血药动力学研究
α-细辛脑在血浆中的含量测定方法学考察结果显示:该液质检测条件下,空白血浆中的内源性物质不干扰样品峰,α-细辛脑及吲哚美辛的峰分离良好,相互间无干扰,方法专属性好。其中,α-细辛脑与内标物吲哚美辛的保留时间分别为4.0,4.6 min,见图1。线性方程Y=0.029C-0.021 9,r=0.999 3(4.955~991 μg·L-1)。定量限和检测限分别为2.5,0.5 μg·L-1。日内相对标准偏差、日间相对标准偏差、溶液稳定性、回收率及基质效应考察均符合要求。
PLA-α-细辛脑纳米粒经鼻腔、静脉注射给药后,α-细辛脑在大鼠体内的药代动力学曲线见图2。2种给药方式均在第一时间达到了最大血药浓度,且鼻腔给药的血药浓度均小于静脉注射。PLA-α-细辛脑纳米粒鼻腔给药与静脉注射的Cmax分别为(216.2±45.2),(433.2±158.3) μg·L-1。
PLA-α-细辛脑纳米粒静脉注射的AUC0-t與AUC0-∞均大于鼻腔给药,且具有显著性差异。PLA-α-细辛脑纳米粒静脉注射后与鼻腔给药后的MRT0-t无显著性差异。PLA-α-细辛脑纳米粒鼻腔给药后的绝对生物利用度为74.2%,低于α-细辛脑干粉鼻腔给药的绝对生物利用度[15],见表2。
3.2 脑药动力学研究
α-细辛脑在脑组织中的含量测定方法学考察结果显示:该液质检测条件下,空白脑组织中的内源性物质不干扰样品峰,α-细辛脑及吲哚美辛的峰分离良好,相互间无干扰,方法专属性好,α-细辛脑与吲哚美辛的保留时间分别为4.0,4.6 min,见图3。线性方程Y=0.027 6C+0.340 9,r=0.997 4(4.955~991 ng·g-1)。定量限和检测限分别为2.5,0.5 ng·g-1。日内相对标准偏差、日间相对标准偏差、稳定性、回收率及基质效应考察均符合要求。
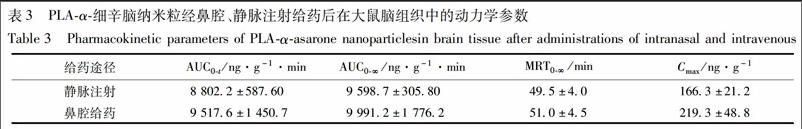
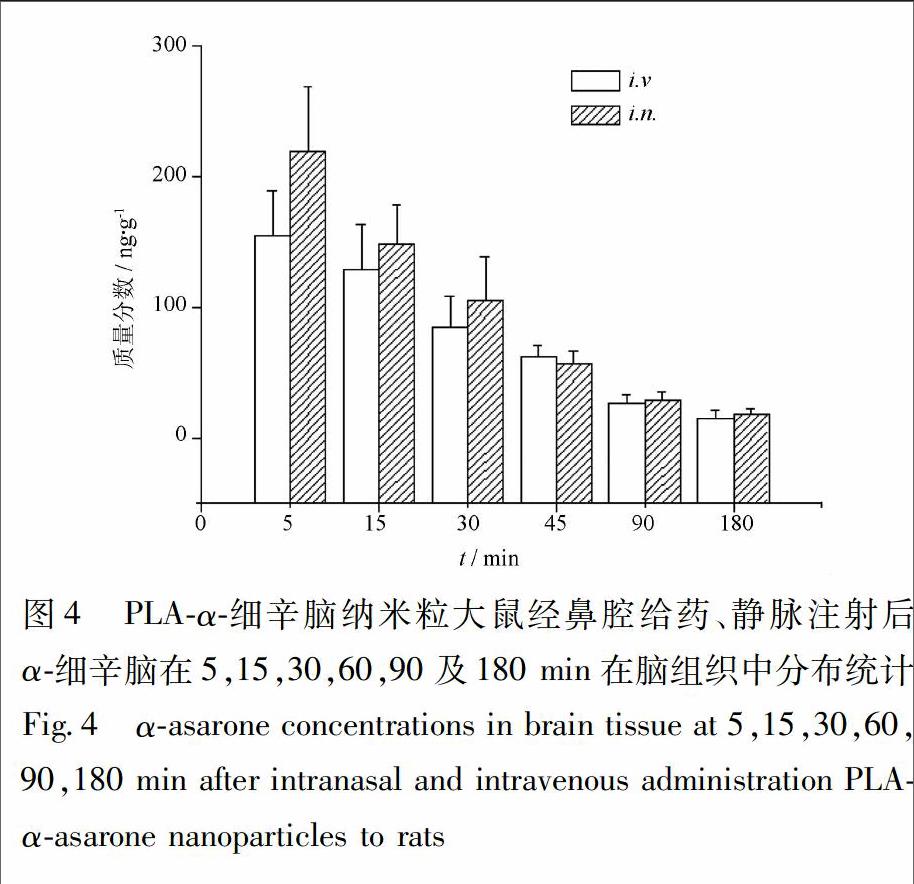
PLA-α-细辛脑纳米粒经鼻腔给药、静脉注射后α-细辛脑在5,15,30,60,90,180 min在脑组织中的分布见图4,PLA-α-细辛脑纳米粒鼻腔给药后α-细辛脑在脑组织中的浓度大于静脉注射后α-细辛脑在脑组织中的浓度,PLA-α-细辛脑纳米粒鼻腔给药后α-细辛脑在脑组织中的Cmax与静脉注射后的α-细辛脑在脑组织中的Cmax分别为(219.3±48.8),(166.3±21.2) ng·g-1。PLA-α-细辛脑纳米粒静脉注射后α-细辛脑在脑组织中的AUC0-t与AUC0-∞均小于鼻腔给药,但无显著性差异。此外,PLA-α-细辛脑纳米粒静脉注射后与鼻腔给药后α-细辛脑在脑组织中的MRT0-t均无显著性差异,见表3。
PLA-α-细辛脑纳米粒静脉注射与鼻腔给药后药物的脑靶向系数(AUCbrain/AUCplasma)分别为1.16和1.65,PLA-α-细辛脑纳米粒经鼻给药后的药物脑靶向效率(DTE)为142.24%,鼻-脑传递百分率(DTP)为29.83%。
3.3 荧光标记法研究
香豆素-6是一种脂溶性荧光染料,其检测灵敏度较高,常用于纳米粒递药系统的体内外示蹤和相关机制的研究[16-18]。根据文献报道,香豆素-6作为荧光探针不会影响载体本身的各项特性,可以较好的反应纳米粒的行为,且香豆素-6泄漏程度较低,一般情况下小于5%[19-21]。
PLA-α-细辛脑荧光纳米粒静脉注射后5 min时,其在肝组织中的荧光强度最大,其次为脑组织,而心、脾、肺、肾几乎无荧光。30 min时,与5 min相比,肝、脑组织中的荧光强度减弱,心、脾、肺、肾出现少量荧光,但肝组织中的荧光强度与其他组织相比,仍是最强的,90 min时,心、脾、肺中的荧光面积相对增大,强度仍较弱,180 min时,荧光强度在所有组织中都降低。PLA-α-细辛脑荧光纳米粒鼻腔给药后5 min时,其在脑组织中的荧光强度最大,其次为肝组织。与5 min相比,30 min时脑、肝组织中的荧光强度减弱,心、肺、肾荧光强度增加,但脾中几乎无荧光。90 min时,脑组织中的荧光强度与其他组织相比,仍是最强的,与30 min时相比,心和肾中的荧光面积相对减小,180 min时,组织中的荧光强度在4个时间点中最低,见图5,6。
此外,在5 min和30 min时,PLA-α-细辛脑荧光纳米粒静脉注射后香豆素-6在肝组织中的荧光强度明显强于PLA-α-细辛脑荧光纳米粒鼻腔给药后香豆素-6在肝组织中的荧光强度;而PLA-α-细辛脑荧光纳米粒静脉注射后香豆素-6在脑组织中的荧光强度明显弱于PLA-α-细辛脑荧光纳米粒鼻腔给药后香豆素-6在脑组织中的荧光强度。从某种程度上可以认为:纳米粒静脉注射后具有较强的肝靶向性,而鼻腔给药后脑靶向性更强。
4 讨论
本文采用与静脉注射对比的给药方式,研究了PLA-α-细辛脑纳米粒经鼻给药后α-细辛脑在体内的分布及脑靶向性,结果表明:PLA-α-细辛脑纳米粒鼻腔给药后的脑靶向性强于PLA-α-细辛脑纳米粒静脉注射后的脑靶向性。脑靶向系数分别为1.65,1.16。PLA-α-细辛脑纳米粒鼻腔给药后的绝对生物利用度为74.2%,与文献[22]相一致,表明不同的给药途径能改变药物的脑靶向性。PLA-α-细辛脑纳米粒经鼻腔给药后进入脑组织主要存在2种通路,即一部分药物通过呼吸部黏膜吸收进入血液循环后,透过血脑屏障而进入脑组织,另一部分药物通过嗅黏膜或嗅神经通路直接进入脑组织,后者避开了血脑屏障,这与文献[23-24]报道相一致。张龙开等[25]将β-细辛醚制备成微乳进行鼻腔给药用于治疗阿尔茨海默病,结果发现鼻腔给予含药微乳系统后脑靶向性良好,β-细辛醚微乳鼻腔给药后得到的AUCbrain/AUCplasma均高于静脉注射给药,这与本文的结果也相一致。药物经鼻腔给药后达药峰浓度的时间较短,可以起到速效的作用[26]。此外,目前还有将α-细辛脑制备成鼻用mPEG-PLA微粒[27]及纳米粒离子敏感型鼻用原位凝胶[28]的研究。
本课题组在之前的研究中采用气流粉碎的方式,将α-细辛脑粉末制备成α-细辛脑鼻用干粉吸入剂,通过鼻腔给药的方式可以较好的将药物导入脑部,但是由于该干粉的粒径范围较宽,有部分干粉通过吸入到达了肺部,且药物浓度与静脉注射到达肺部的量相当[15]。本文的研究结果可以发现:PLA-α-细辛脑纳米粒经鼻腔给药后,香豆素-6在肺组织中的荧光强度远远低于静脉注射后的荧光强度,解决了α-细辛脑鼻用干粉吸入剂到达肺部量较多的缺点。但是,哪些因素影响PLA-α-细辛脑纳米粒经过不同的通路到达脑组织还需进一步研究。
[参考文献]
[1] Limón I D,Mendieta L,Díaz A,et al. Neuroprotective effect of alpha-asarone on spatial memory and nitric oxide levels in rats injected with amyloid-beta(25-35)[J]. Neurosci Lett,2009,453(2):98.
[2] Huang C,Li W G,Zhang X B,et al. Alpha-asarone from Acorus gramineus,alleviates epilepsy by modulating A-type GABA receptors[J]. Neuropharmacology,2013,65C(5):1.
[3] 杨正鸿,吴闯. α-细辛脑在人体的生物利用度研究[J]. 中国医院药学杂志,1997,17(4):165.
[4] 武晓玉,张玉萌,栗晓东,等. 细辛脑制剂致过敏性休克文献分析[J]. 中国药物应用与监测,2011,8(6):364.
[5] 黄亮,陈力,韩璐,等. 细辛脑注射液118例不良反应文献分析[J]. 中南药学,2011,9(2):157.
[6] Betbeder D,Sperandio S,Latapie J P,et al. Biovector nanoparticles improve antinociceptive efficacy of nasal morphine[J]. Pharm Res,2000,17(6):743.
[7] Matthias V W,Nathalie W,Rémi R,et al. Development of siRNA-loaded chitosan nanoparticles targeting galectin-1 for the treatment of glioblastoma multiforme via intranasal administration[J]. J Control Release,2016,227:71.
[8] Eameema M,Raju D,Anjali J,et al. Intranasal delivery of nanoparticle encapsulated tarenflurbil:a potential brain targeting strategy for Alzheimer′s disease[J]. Eur J Pharm Sci,2016,92:224.
[9] 陆瑾,展冠军,郭立玮,等. PLA-α-细辛脑纳米粒的制备、表征及其对鼻黏膜的毒性[J]. 中国实验方剂学杂志, 2017,23(10):12.
[10] 陈伟,刘玉玲,贺玖明,等. 液相色谱-串联质谱法测定兔血浆中α-细辛脑的浓度[J]. 药物分析杂志,2006, 26(10):1364.
[11] 王媛媛,王淑君. α-细辛脑静脉注射乳剂在大鼠体内的药动学研究[J]. 中国药剂学杂志,2012,10(2):39.
[12] Wang F,Jiang X,Lu W. Profiles of methotrexate in blood and CSF following intranasal and intravenous administration to rats[J]. Int J Pharm,2003,263:1.
[13] Chow H S,Chen Z,Matsuura G T. Direct transport of cocaine from the nasal cavity to the brain following intranasal cocaine administration in rats[J]. J Pharm Sci,1999,88:754.
[14] 石森林,徐蓮英,吴瑾瑾,等. 灯盏花素不同给药途径脑内药物分布的比较[J]. 药学学报,2009,44 (5):515.
[15] Lu J,Fu T M,Qian Y Y,et al. Distribution of α-asarone in brain following three different routes of administration in rats[J]. Eur J Pharm Sci,2014,63:63.
[16] Panyam J,Labhasetwar V. Dynamics of endocytosis and exocytosis of poly (D, L-lactide-co-glycolide) nanoparticles in vascular smooth muscle cell[J]. Pharm Res,2003,20:212.
[17] Panyam J,Zhou W Z,Prabha S,et al. Rapid endo-lysosomal escape of poly (DL-lactide-co-glycolide) nanoparticles: implications for drug and gene delivery[J]. Faseb J,2002,16:1217.
[18] Grainger C I,Greenwell L L,Lockley D J. Culture of Calu-3 cells at the air interface provides a representative model of the airway epithelial barrier[J]. Pharm Res,2006,23:1482.
[19] Xia H,Gao X,Gu G,et al. Penetratin-functionalized PEG-PLA nanoparticles for brain drug delivery[J]. Int J Pharm,2012,436:840.
[20] 李晓芳,马艳结,张晓,等. 包载荧光探针香豆素-6的PLGA纳米粒的制备[J]. 中国现代应用药学,2011,28(8):740.
[21] 王俊腾,林东海,秦利芳,等. 单甲氧基聚乙二醇-聚乳酸羟基乙酸共聚物纳米粒在大鼠鼻黏膜的转运研究[J]. 药学学报,2013,48 (5):752.
[22] Dong Y,Feng S S. Poly(d,1-lactide-co-glycolide)/montmorillonite nanoparticles for oral delivery of anticancer drugs[J]. Biomaterials,2005,26:6068.
[23] Zhang Q,Jiang X,Jiang W,et al. Preparation of nimodipine-loaded microemulsion for intranasal delivery and evaluation on the targeting efficiency to the brain[J]. Int J Pharm,2004,275:85.
[24] 高科攀,蒋新国. 载药纳米粒的脑内递药系统[J]. 中国新药与临床杂志,2004,23(4):246.
[25] 张龙开,许日鑫,蒋梅,等. β-细辛醚微乳鼻腔给药脑内靶向性评价[J]. 中草药,2014,45(1):86.
[26] 黄秋艳,熊磊,孔淑君,等. 苍艾挥发油经鼻吸收的药代动力学及组织分布[J].中国实验方剂学杂志,2016,22(23):94.
[27] 鞠凤,潘林梅,郭立玮,等. 经鼻给药α-细辛脑mPEG-PLA微粒的制备与体外释放研究[J].中国中药杂志,2015,40(24):4847.
[28] 臧巧真,唐涛,龙凯花,等. α-细辛脑纳米粒离子敏感型鼻用原位凝胶的制备及体外释放行为[J].中国医院药学杂志,2015,35(23):2115.
[责任编辑 曹阳阳]
