桑椹多糖的结构表征及其对乙醇脱氢酶活性的影响研究
2017-07-13王杏邓青芳陈华国周欣
王杏+邓青芳+陈华国+周欣


[摘要] 该实验采用回流法提取桑椹多糖,经脱蛋白及DEAE-Cellulose 52分离纯化得到4种多糖组分(中性多糖MFP-1,微酸性多糖MFP-2,酸性多糖MFP-3和MFP-4)。通过化学法和仪器分析法对各多糖组分进行理化性质测定和结构表征,并研究其对乙醇脱氢酶(ADH)活性的影响。结果表明,MFP-1,MFP-2,MFP-3和MFP-4中的多糖量分别为75.3%,83.7%,79.1%,74.3%,其平均相对分子质量分别为112.2,128.8,199.5,181.9 kDa。MFP-1主要含有半乳糖、葡萄糖、阿拉伯糖、鼠李糖、甘露糖(26.8∶20.4∶8.7∶5∶1);MFP-2主要含有阿拉伯糖、半乳糖、鼠李糖、葡萄糖、半乳糖醛酸(34.2∶38.2∶8∶17.5∶15.1);MFP-3主要含有半乳糖醛酸、半乳糖、葡萄糖、鼠李糖、阿拉伯糖(28.3∶22.6∶20.9∶18.6∶12.5);MFP-4主要含有葡萄糖、半乳糖、鼠李糖、半乳糖醛酸、阿拉伯糖、葡萄糖醛酸(47.4∶34.9∶36.1∶33.1∶19.9∶4.1)。红外光谱分析结果表明,MFP-1,MFP-2,MFP-3和MFP-4中均有多糖的特征吸收峰,其中MFP-3和MFP-4是以β苷键为主的吡喃型多糖。活性结果表明,4种多糖对ADH均有激活作用,其ADH激活能力顺序为:联苯双酯>MFP-3>MFP-1>MFP-2>硫普罗宁>MFP-4,MFP-1,MFP-2和MFP-3对ADH的激活作用均大于阳性对照硫普罗宁,同时发现MFP-3对ADH的激活效果与阳性对照联苯双酯的激活效果相当,推测其与之连接的糖醛酸种类有关,这为桑椹多糖的“构-效”研究提供参考依据。
[关键词] 桑椹多糖; 理化性质; 结构表征; ADH活性
[Abstract] Mori Fructus polysaccharides (MFPs) have been used as a source of therapeutic agents. The most promising activities of these biopolymers are their immunomodulation and anti-cancer effects. It was reported that polysaccharides were a potential drug against liver injury, but the hepatoprotective effect of MFPs was ambiguous. In this study, the fractionation of crude polysaccharides on DEAE-Cellulose 52 gave four fractions (MFP-1, MFP-2, MFP-2 and MFP-4). The results showed that the contents of carbohydrates were 75.3%, 83.7%, 79.1%, 74.3%, and the molecular weight of them were 112.2, 128.8, 199.5, 181.9 kDa. Monosaccharide component analysis indicated that MFP-1 was composed of galactose, glucose, arabinose, rhamnose and mannose with the molarity rate of 26.8∶20.4∶8.74∶5∶1; MFP-2 contained arabinose, galactose, rhamnose, glucose and galacturonic acid with the molarity rate of 34.2∶38.2∶8∶17.5∶15.1; MFP-3 was composed of galacturonic acid, galactose, glucose, rhamnose and arabinose with the molarity rate of 28.3∶22.6∶20.9∶18.6∶15.1; MFP-4 contained glucose, galactose, rhamnose, galacturonic acid, arabinose and glucuronic acid with the molarity rate of 47.4∶34.9∶36.1∶33.1∶19.9∶4.1. IR analysis′s results indicated that MFP-3 and MFP-4 may be polysaccharides containing β-glycosides. The alcohol dehydrogenase (ADH) activity text showed that, all these four MFPs were found have a positive effect on the activity of ADH, with order: bifendate>MFP-3>MFP-1>MFP-2>tioprnin>MFP-4, and the MFP-3 had the highest activity and demonstrated outstanding hepatic protecting activity.
[Key words] Mori Fructus polysaccharides; physic-chemical characters; characterization; activity effect of ADH
據2015年版药典记载[1],桑椹具有滋阴补血、生津润燥的药效,用于肝肾阴虚、眩晕耳鸣、心悸失眠、须发早白、津伤口渴、内热消渴、肠燥便秘等。此外,还有少量文献报道[2]桑椹对酒精/四氯化碳所致的肝损伤有潜在的保护作用,国家已把桑椹列为药食同源的保健品行列。
桑椹多糖(Mori Fructus polysaccharides,MFPs)是从桑树果实中得到的具有抗氧化、降血糖、抗疲勞等[3-4]生物活性的一类高分子化合物。文献报道[5],桑椹多糖可提高妊娠小鼠的脾脏和胸腺指数、腹腔巨噬细胞的吞噬能力和速度,促进淋巴细胞转化和绵羊红细胞所致的小鼠抗体生成,增强小鼠迟发性过敏反应强度,改善妊娠小鼠免疫功能。
乙醇脱氢酶(alcohol dehydrogenase,ADH)是参与乙醇体内代谢的主要酶,可抑制人体对乙醇的吸收,加强乙醇在胃肠道的首过效应,从而减轻乙醇对人体消化系统、肝脏系统及神经系统的损害,起到有效的解酒护肝作用[6]。
由于多糖的相对分子质量大、黏度高、结构复杂等因素,不利于对其进行结构表征的研究和进一步“构-效”关系的探索。据文献报道[7],多糖是潜在的抗肝损伤药物制剂,但桑椹多糖的抗肝损伤作用尚不明确。因此,本研究从桑椹中分离纯化得到4种多糖,通过理化性质、单糖组成、红外光谱(FT-IR)分析等手段对其进行结构表征,并通过考察4种多糖对ADH活性的影响,探索桑椹多糖的解酒作用,为其在肝损伤方面的活性研究提供科学依据,也为桑椹多糖的“构-效”关系研究奠定基础。
1 材料
1.1 仪器
1/10万电子分析天平(XS105DU),梅特勒-托利多仪器(上海)有限公司;酶标仪(Max Plus 384),美国Moleaular Devices公司;红外光谱仪(TENSOR27),德国Bruker公司;高效液相色谱仪(Agilent 1260),安捷伦科技有限公司;冷冻干燥机(FD-80),北京博医康实验仪器有限公司。
1.2 试剂
二乙氨基乙基纤维素52(DEAE-Cellulose 52),Sigma公司;葡萄糖(glucose,Glc)、半乳糖(galactose,Gal)、甘露糖(mannose,Man)、木糖(xylose,Xyl)、鼠李糖(rhamnose,Rha)、半乳糖醛酸(galacturonic acid,GalUA)、葡萄糖醛酸(glucuronic acid,GlcUA)、阿拉伯糖(arabinose,Ara)对照品,均购于贵州迪大生物有限公司;氧化型辅酶 Ⅰ(nicotinamide adenine dinucleotide,NAD+),Roche公司;乙醇脱氢酶,Sigma公司;联苯双酯、硫普罗宁,中国食品药品检定研究院;考马斯亮蓝G-250,上海蓝季生物有限公司;1-苯基-3-甲基-吡唑啉酮(1-pheny-3-methyl-5-pyrazolone,PMP),天津市科密欧化学试剂有限公司;三氟乙酸(trifluoroacetic acid,TFA),天津市光复精细化工研究所;苯酚、浓硫酸、乙醇,均为国产分析纯。
2 方法与结果
2.1 方法
2.1.1 桑椹多糖的提取 取一定量的桑椹鲜果,匀浆,加水回流处理2次,每次2 h,滤过,合并滤液,减压浓缩,Sevag法[8]对浓缩液进行脱蛋白处理,取上层液,边振摇边缓慢加入适量的95%乙醇,使乙醇终体积分数达到80%,4 ℃冷藏24 h,离心(3 500 r·min-1,15 min),取沉淀复溶,再次醇沉,重复3次,真空冷冻干燥,即得桑椹粗多糖,于干燥罐保存,备用。
2.1.2 桑椹多糖的分离纯化 配制10 g·L-1的桑椹粗多糖溶液,离心(3 500 r·min-1,10 min),取上清液20 mL经DEAE-Cellulose 52纤维素离子交换树脂柱(3.2 cm×30 cm),依次用蒸馏水,0.1,0.3,0.5 mol·L-1NaCl溶液分段洗脱(流速为2.5 mL·min-1),每管收集10 mL,采用苯酚-硫酸法[9]对洗脱液跟踪测定,直至无多糖洗出为止,按组分洗脱峰合并获得不同组分,减压浓缩,透析,真空冷冻干燥,得各组分桑椹多糖。
2.1.3 桑椹多糖的理化性质 总糖含量的测定是以葡萄糖标准溶液为对照,采用苯酚-硫酸法测定总糖的含量。蛋白质含量的测定是以牛血清白蛋白标准溶液为对照,采用考马斯亮蓝法测定蛋白质的含量[10]。硫酸基含量的测定是以硫酸钾标准溶液为对照,采用氯化钡-明胶比浊法测定硫酸基的含量[11]。糖醛酸含量的测定是以葡萄糖醛酸标准溶液为对照,采用硫酸-咔唑法测定糖醛酸的含量[12]。
2.1.4 单糖组成分析 采用PMP柱前衍生化HPLC色谱[13]。样品的处理:称取15 mg各组分多糖样品,分别加入2 mol·L-1TFA溶液6 mL,封口,105 ℃水解10 h,水解液蒸发至干,再反复加入甲醇,蒸干,除去多余的TFA,加入少量水溶解,得完全酸水解溶液,备用。
取完全酸水解溶液和对照品(Rha,Glc,Man,Xyl,Gal,GlcUA,GalUA,Ara)各1 mL,依次加入1.2 mL PMP溶液和0.3 mol·L-1NaOH溶液1 mL,70 ℃水浴1 h,冷却至室温后加入0.3 mol·L-1HCl溶液1 mL中和NaOH溶液,加入二氯甲烷除去多余的PMP,离心(3 500 r·min-1,10 min),取上清液,经0.45 μm微孔滤膜滤过,得衍生化的样品和对照品溶液。
色谱条件,色谱柱为ZORBOX SB-C18(4.6 mm×250 mm,5 μm);流动相磷酸盐缓冲液pH 7.4(A)-乙腈(B);梯度洗脱(0~28 min,13%~19% B;28~38 min,19%~16% B;38~50 min,16%~25% B);柱温30 ℃;流速1 mL·min-1;进样量2 μL;检测波长250 nm。
2.1.5 红外分析 分别取1~2 mg干燥的各组分桑椹多糖,与100 mg干燥的KBr晶体混合,研细后压片,在400~4 000 cm-1进行红外扫描。
2.1.6 相对分子质量分析 将不同相对分子质量的葡聚糖对照品(Mw=70,130,175,300,256,580 kDa)配制成5 g·L-1溶液,由小分子到大分子依次进样,记录各对照品相应的保留时间,以保留时间为横坐标,以相对分子质量的对数为纵坐标绘制标准曲线。
色谱条件,色谱柱为Ultrahydrogel 250(7.8 mm×300 mm);流动相 0.1 mol·L-1NaNO3;柱温 40 ℃;流速 0.6 mL·min-1;进样量 20 μL;检测器为示差检测器;检测温度 55 ℃。将各组分桑椹多糖配制成5 g·L-1溶液,经0.45 μm微孔滤膜滤过,操作条件同上,然后根据MFP-1,MFP-2,MFP-3和MFP-4的保留时间计算其相对分子质量。
2.1.7 桑椹多糖各组分对ADH活性的影响 采用改良后的瓦勒-霍赫(Valle & Hoch)法[14]检测ADH活性,在测定板中依次加入100 μL焦磷酸钠缓冲液(pH 8.8),75 μL NAD+,35 μL乙醇,10 μL各组分桑椹多糖溶液和阳性对照溶液,混合后37 ℃加盖温育5 min。立即加入10 μL ADH,摇匀后立即测定340 nm处的吸光度(A340),每隔10 s读数1次,连续测定5 min,记录数据。以蒸馏水代替乙醇溶液调零点,以不加药物组为空白组,以硫普罗宁和联苯双酯为阳性对照。采用以下公式计算ADH活性和激活率。
2.2 结果与讨论
2.2.1 桑椹多糖分离纯化 桑椹多糖经DEAE-Cellulose 52分离得到4种多糖组分,分别为中性多糖MFP-1,微酸性多糖MFP-2,酸性多糖MFP-3和MFP-4,见图1。
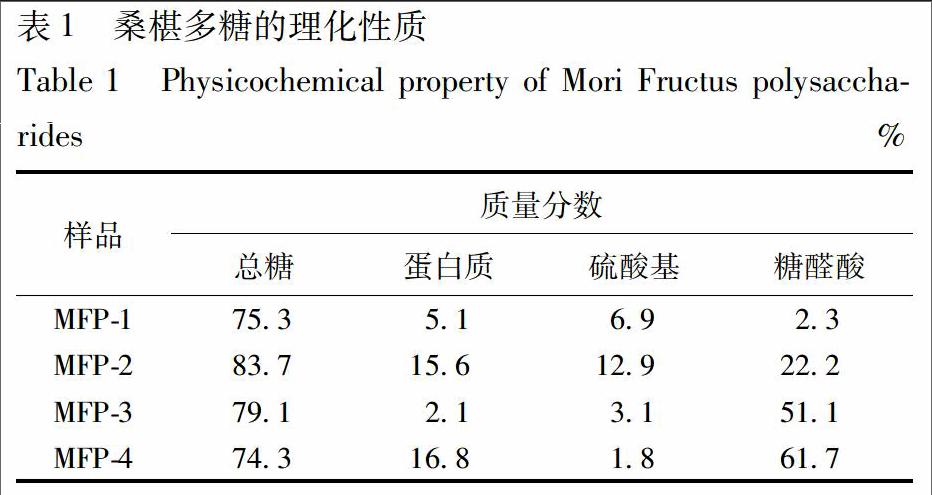
2.2.2 桑椹多糖理化性质 MFP-2的总糖含量最高,与上述洗脱曲线结果一致,见表1。各组分均存在一定量的蛋白质,推测这些组分可能是糖蛋白结合物。其中MFP-1含有少量的硫酸基和糖醛酸,表明MFP-1基本上为一些中性多糖。相反的,MFP-3和MFP-4中含有糖醛酸较多,表明这2种组分可能是一些果胶物质。
2.2.3 单糖组成分析 桑椹多糖各组分的单糖组成结果,见图2,MFP-1主要含有Gal,Glc,Ara,Rham,Man,其摩尔比为26.8∶20.4∶8.7∶5∶1;MFP-2主要含有Ara,Gal,Rham,Glc,GalUA,其摩尔比为34.2∶38.2∶8∶17.5∶15.1;MFP-3主要含有GalUA,Gal,Glc,Rham,Ara,其摩尔比为28.3∶22.6∶20.9∶18.6∶12.5;MFP-4主要含有Glc,Gal,Rham,GalUA,Ara,GlcUA,其摩尔比为47.4∶34.9∶36.1∶33.1∶19.9∶4.1。由结果可知,MFP-1中主要由5种中性单糖组成,这与上述结果MFP-1为中性多糖一致。值得注意的是,MFP-3和MFP-4除了含有半乳糖醛酸和半乳糖等单糖外,还含有一定比例的葡萄糖,这个结果与文献报道的果胶的理化性质(一般果胶物质含有很少比例的葡萄糖)有较大的差异[15]。
2.2.4 红外分析 MFP-1,MFP-2,MFP-3和MFP-4均出现了多糖特征吸收峰,4种多糖均在3 400 cm-1附近出现较强的宽吸收峰,应是糖类的O-H和蛋白质的N-H伸缩振动,说明多糖存在分子间或分子内氢键;在2 925,2 930,2 935,2 944 cm-1附近出现了弱吸收峰,是糖类不对称C-H伸缩振动;在1 615,1 636,1 635 cm-1处出现宽吸收峰是-COO-非对称伸缩振动,在1 415 cm-1附近出现吸收峰,应是-COO-对称伸缩振动;在1 300~1 000 cm-1处出现吸收峰是吡喃环的伸缩振动,因此,可以推测4种多糖是吡喃环结构[16],见图3。MFP-3和MFP-4多糖在897 cm-1处出现吸收峰,推测这2种多糖含有β-糖苷键[17]。
2.2.5 相对分子质量测定 根据标准多糖相对分子质量的计算公式lgMw =-0.41tR+6.77,其中tR为保留时间。在相同条件下测定MFP-1,MFP-2,MFP-3和MFP-4的相对分子质量,MFP-1,MFP-2,MFP-3和MFP-4的保留时间分别為11.512,11.366,10.902,11.000 min,将其代入标准回归方程,得各多糖的平均相对分子质量分别为112.2,128.8,199.5,181.9 kDa。
2.2.6 各组分桑椹多糖对ADH的激活作用 由实验结果可以得出,桑椹多糖分离的4种组分对ADH均有不同程度的激活作用。当ADH激活率为50%时,阳性对照(硫普罗宁,联苯双酯)及4种多糖(MFP-1,MFP-2,MFP-3,MFP-4)的质量浓度分别为16.7,9.3,14.1,16.6,10.3,18.6 mg·L-1,ADH激活能力顺序为联苯双酯>MFP-3>MFP-1>MFP-2>硫普罗宁>MFP-4,其中MFP-1,MFP-2和MFP-3对ADH激活作用均大于阳性对照硫普罗宁对ADH激活作用,并且MFP-3与阳性对照联苯双酯对ADH的激活作用相当,表明MFP-3具有很好的解酒护肝的应用前景。
3 讨论
桑椹多糖经提取、除蛋白及纯化,得到4组多糖(MFP-1,MFP-2,MFP-3和MFP-4),综合上述结果,MFP-1属于中性多糖,MFP-2属于微酸性多糖,含有总糖量最高,MFP-3属于酸性多糖,含有较多的糖醛酸,MFP-4属于酸性多糖,含有的糖醛酸最高,并且这些多糖在除去游离蛋白后仍然检测到含有少量蛋白质,说明这4种多糖可能是蛋白质的结合物。
柱前衍生化HPLC法,具有分离效果好、分析时间短、分析成本低和产物无立体结构等优点。本研究通过PMP柱前衍生化HPLC色谱、红外光谱及高效凝胶渗透色谱对桑椹多糖各组分的单糖组成、结构及分子量测定。初步推测4种多糖是含有吡喃环的多糖,MFP-3和MFP-4是含有β-糖苷键和糖醛酸的多糖。
人体摄入乙醇后,90%~98%的乙醇在肝脏代谢,乙醇代谢的途径之一是乙醇通过激活体内ADH,将乙醇转化为乙醛,从而降低体内酒精含量。ADH激活率可能与多糖中单糖组成、苷键类型、连接顺序、分枝情况、二级结构等有关。当ADH激活率为50%时,MFP-3的效果明显高于阳性对照硫普罗宁,且与阳性对照联苯双酯的效果相当。结合桑椹多糖的理化性质、单糖组成和结构不同的分析,ADH激活率可能与各组分多糖中所含的单糖种类和比例有关。MFP-3中半乳糖醛酸的量为27.5%,比MFP-2与MFP-4中含半乳糖醛酸分别高出15.3%和8.7%,这说明ADH激活率可能与其糖醛酸的种类和糖醛酸连接位点有关,本实验为研究多糖结构与ADH活性的关系奠定基础。
[参考文献]
[1] 中国药典. 一部[S]. 2015.
[2] 张兰兰,何承辉,古丽斯坦·阿吾提,等. 桑椹提取物对小鼠急性肝损伤保护作用[J]. 中国实验方剂学杂志,2016(15):149.
[3] 赵喜兰. 桑葚多糖提取、分离纯化及其降糖作用的研究[J]. 食品工业科技,2011,32(2):259.
[4] 王忠,历彦翔,骆新. 桑葚多糖抗疲劳作用及其机制[J]. 中国实验方剂学杂志,2012,18(17):234.
[5] 姚肖华. 桑葚多糖对妊娠小鼠免疫功能的影响[J]. 营养学报,2013,35(5):492.
[6] 陈绍红,钟赣生,李爱里,等. 枳椇子对酒后血中乙醇质量浓度和肝中乙醇脱氢酶活性的影响[J]. 中国中药杂志,2006,31(13):1094.
[7] 邓青芳,周欣,陈华国. 多糖抗肝损伤作用及其机制研究进展[J]. 中国中药杂志,2016,41(16):2958.
[8] Staub A M. Removal of proteins(sevag method)[J]. Method Carbohydr Chem,1965,5:6.
[9] Dubois M,Gilles K A,Hamilton J K,et al. Colorimetric method for determination of sugars and related substances[J]. Anal Chem,2002,28(3):350.
[10] Johnson J A,Lott H A. Standardization of the coomassie blue method for cerebrospinal fluid proteins[J]. Clin Chem,1978,24(1):1931.
[11] Bitter T,Muir H M. A modified uronic acid carbazole reaction[J]. Anal Biochem,1962,4(4):330.
[12] Therho T T,Hartiala K. Method for deteminnation of the sulfate content of glycosaminoglycans[J]. Anal Biochem,1971,41(2):471.
[13] 茅蕾蕾,陈颖,胡碧原,等. 银杏外种皮多糖的单糖组成分析[J]. 中国中药杂志,2014,39(2):262.
[14] Vallee B L,Hoch F L.Zinc, a component of yeast alcohol dehydrognnase[J]. Proc Natl Acad Sci USA,1955,41(6):327.
[15] Polle A Y,Ovodova R G,Shashkov A S,et al. Some structure features of pectic polysaccharide from tansy Tanacetumu vulgare L.[J]. Carbohydr Polym,2002,49(3):337.
[16] Chen W. Extraction,purification,and characterization of the polysaccharides from opuntia milpa alta[J]. Carbohydr Polym,2008,71(3):403.
[17] Xie J H,Xie M Y,Nie S P,et al. Isolation,chemical composition and antioxidant activities of a water-soluble polysaccharide from Cyclocarya paliurus (Batal.) Ⅱ jinskaja[J]. Food Chem,2010,119(4):1626.
[責任编辑 丁广治]
