4′—去甲基表鬼臼毒素的酶法糖基化
2017-07-13解可波陈日道张玉娇陈大伟戴均贵
解可波+陈日道+张玉娇+陈大伟+戴均贵

[摘要] 4′-去甲基表鬼臼毒素(4′-demethylepipodophyllotoxin,DMEP)的糖苷衍生物具有多种药理活性,但其化学合成面临位置及立体选择性和基团的保护与脱保护等诸多挑战。该研究从库拉索芦荟Aloe barbadensis中克隆得到1个新颖糖基转移酶(glycosyltransferase, GT)基因AbGT5,并成功进行了外源表达及蛋白纯化。重组AbGT5能够催化4′-去甲基表鬼臼毒素进行糖基化,获得的产物经MS,1H-NMR,13C-NMR,HSQC以及HMBC等波谱技术鉴定为4′-去甲基表鬼臼毒素-4′-O-β-D-葡萄糖苷。酶学性质研究发现AbGT5的最适反应温度为20 ℃,最适pH 9.0,且不依赖金属离子。在最适反应条件下,4′-去甲基表鬼臼毒素的转化率可达80%。该研究表明利用新颖糖基转移酶AbGT5可实现4′-去甲基表鬼臼毒素的高效酶法糖基化,为其糖基化提供新方法。
[关键词] 糖基转移酶; 酶法糖基化; 工具酶; 4′-去甲基表鬼臼毒素; 库拉索芦荟
[Abstract] The glycosides of 4′-demethylepipodophyllotoxin (DMEP) possess various pharmacological activities; however, the chemical synthesis of these glycosides faces challenges in regioselectivity, stereoselectivity, and the protection and de-protection of functional groups. In this work, a novel glycosyltransferase (GT) gene AbGT5 from Aloe barbadensis was successfully cloned, heterogeneously expressed and purified. Recombinant AbGT5 was able to catalyze the glycosylation of DMEP and the glycosylated product, which was separated from the preparative scale reaction, was characterized as DMEP 4′-O-β-D-glucoside via MS, 1H-NMR, 13C-NMR, HSQC and HMBC. According to the investigations of enzyme properties, AbGT5 show the highest activity around 20 ℃ in the buffer of pH 9.0, and it was independent of divalent metal ions. Under the optimum conditions, the conversion rate of DMEP can reach 80%. Above all, in this work the enzymatic glycosylation of DMEP was achieved with high efficiency by the novel GT AbGT5.
[Key words] glycosyltransferase; enzymatic glycosylation; tool enzyme; 4′-demethylepipodophyllotoxin; Aloe barbadensis
鬼臼毒素(podophyllotoxin)是来源于桃儿七属Sinopodophyllum、鬼臼属Dysosma及山荷叶属Diphylleia等小檗科植物的木脂素类活性天然产物,具有抗病毒、抗肿瘤等活性[1]。由于鬼臼毒素的毒副作用较大,不适于直接在临床上使用,因此,自20世纪50年代开始,医药领域的科研工作者等从鬼臼毒素出发,利用化学法进行结构修饰,获得了一系列毒副作用降低、水溶性及生物利用度等得到改善的衍生物[2]。其中4′-去甲基表鬼臼毒素(4′-demethylepipodophyllotoxin,DMEP)是由鬼臼毒素经化学半合成得到的,其糖苷类衍生物依托泊苷(etoposide,VP-16)和替尼泊苷(teniposide,VM-26)能够抑制微管蛋白的聚合作用、阻断细胞的有丝分裂和抑制DNA拓扑异构酶Ⅱ的活性,是目前临床治疗淋巴癌、白血病及小细胞肺癌等肿瘤疾病的主要药物[3-5]。另外,从植物中也分离得到了多种天然鬼臼毒素糖苷类衍生物,并具有良好的抗肿瘤药理活性[6-7],但这些糖苷类衍生物仍然存在水溶性差、抗癌谱窄、易产生耐藥性以及毒副作用大等问题,限制了其临床应用[8]。因此,为开发新型DMEP糖苷类药物,寻找更为有效且毒性小的抗肿瘤新药,药物化学家通过化学法对DMEP进行了大量并富有成效的糖基化修饰,但无一不涉及位置及立体选择性、基团的保护与脱保护等[9-10],大大限制了多样化DMEP糖苷类衍生物的研究与开发。
糖基转移酶(glycosyltransferases,GTs)是广泛存在于生物体中的一大类酶,能够催化NDP(nucleoside diphosphate,核苷二磷酸)活化的糖基转移到苷元受体上形成糖苷。糖基转移酶催化的糖基化反应具有高度的位置及立体选择性和反应条件温和等特点,为DMEP糖苷类衍生物的酶法合成提供了一种有效策略[11-17]。DMEP具有2个O-糖基化位点即4-OH和4′-OH,催化4-OH进行糖基化的糖基转移酶已有报道[18],而催化4′-OH进行糖基化修饰的酶尚未见报道。中药植物库拉索芦荟Aloe barbadensis中含有多种结构类型的糖苷类化合物[19],预示着新颖糖基转移酶的存在。因此,为寻找新颖糖基转移酶对DMEP的4′-OH进行糖基化修饰,本研究从库拉索芦荟中挖掘得到5个糖基转移酶基因(AbGT1~AbGT5)并进行了外源表达及酶活性筛选,其中AbGT5能够高效催化DMEP的4′-OH进行糖基化生成DMEP 4′-O-β-D-glucoside,为DMEP糖基化提供了新方法,现报道如下。
1 材料
1.1 植物 库拉索芦荟A. barbadensis由中央民族大学生命与环境科学学院杨林副教授鉴定。
1.2 菌株 实验使用Escherichia coli Trans1-T1克隆宿主与E. coli Transetta (DE3)表达宿主购自北京全式金生物技术有限公司。
1.3 仪器与试剂 Agilent 1200高效液相色谱仪购自美国安捷伦科技有限公司;LCQ Fleet离子阱质谱仪购自美国热电公司;核磁共振波谱仪型号为Mercury-400及VNS-600(Varian,USA);分析色谱柱为Shiseido capcellpak C18 MG III column (4.6 mm×250 mm,5 μm,Shiseido Co.,Ltd.,Japan);半制备色谱柱为YMC-pack ODS-A column(4.6 mm×250 mm,5 μm,YMC,Japan)。RNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒、质粒提取试剂盒购自江苏康为世纪生物科技有限公司;TransScript II First-Strand cDNA Synthesis SuperMix逆转录试剂盒购自北京全式金生物技术有限公司;E-fusion cloning kit购自淮安百慧生物科技有限公司;pET28a表达载体为Novagen公司产品;内切酶购自宝生物(大连)有限公司;镍柱亲和色谱填料(Ni SepharoseTM 6 Fast Flow)为美国GE公司产品;4′-去甲基表鬼臼毒素(1)购自大连美仑生物技术有限公司;尿苷二磷酸葡萄糖(uridine diphosphate glucose,UDP-Glc)购自Sigma-Aldrich公司。
2 方法
2.1 库拉索芦荟叶片RNA的提取及cDNA合成 取生长状态良好的库拉索芦荟的新鲜嫩叶进行液氮速冻,叶片组织充分研磨成粉后,按照植物总RNA提取试剂盒说明书提取RNA。用1%的琼脂糖凝胶电泳检测RNA的完整性,紫外-可见光光度计测定其浓度和纯度,其在260,280 nm处的吸光度,A260/A280均大于1.8小于2.1,说明提取的RNA无蛋白与DNA污染。将检测合格的RNA用于逆转录试剂盒合成cNDA,用作本研究后续糖基转移酶候选基因克隆的模板。
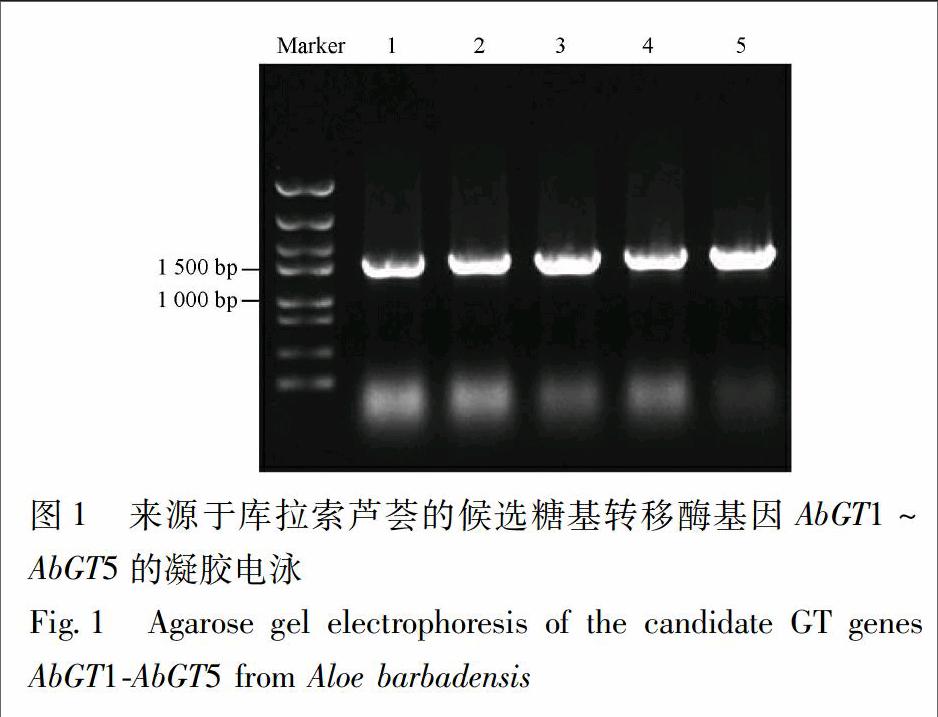
2.2 库拉索芦荟中糖基转移酶基因的克隆 根据库拉索芦荟转录组注释结果,选取具有完整ORF(open reading frame,开放阅读框)的候选糖基转移酶基因(AbGT1~AbGT5),设计带有pET28a插入位點两端各17~18 bp同源臂的PCR引物(表1)。以cDNA为模板扩增芦荟糖基转移酶基因全长,PCR产物经胶回收纯化后,用1%琼脂糖凝胶电泳检测,用于后续外源表达系统的构建。
2.3 糖基转移酶基因的外源表达与活性筛选 按照E-fusion cloning kit说明书,将候选糖基转移酶基因(AbGT1~AbGT5)插入表达载体pET28a构建重组质粒,且重组糖基转移酶带有His6标签,以利于后续蛋白纯化。将重组质粒pET28a-AbGTs导入克隆宿主Trans1-T1,挑取转化子进行菌落PCR验证,阳性转化子进一步测序验证。从测序正确的转化子中提取重组质粒导入表达宿主Transetta,构建AbGTs的外源表达系统。同时将空质粒pET28a导入Transetta用于对照实验。在37 ℃条件下,200 r·min-1摇床过夜培养含pET28a-AbGTs及pET28a空质粒的重组
Transetta菌株作为种子液。按照1%的接种量将种子液接种至100 mL的LB培养基中(含50 mg·L-1卡那霉素及34 mg·L-1氯霉素),培养至A600 nm=0.6,随后加入终浓度为0.5 mmol·L-1的IPTG(isopropyl β-D-thiogalactoside,异丙基硫代半乳糖),在16 ℃条件下继续诱导培养12 h。随后以8 000×g离心收集菌体,并用10 mL的Reaction Buffer(pH 7.4,50 mmol·L-1Tris-HCl,50 mmol·L-1NaCl,1 mmol·L-1PMSF)重悬菌体。将菌体重悬液在冰浴中超声破碎10 min(工作5 s,暂停5s,功率30 W),12 000×g离心30 min,上清液即为粗酶液,用于后续糖基化活性筛选实验。对照组粗酶液由含pET28a空质粒的Transetta重组菌制备。
糖基转移酶活性筛选反应体系为200 μL,包括197 μL粗酶液、1 μL 50 mmol·L-1的DMEP(1)以及2 μL 50 mmol·L-1的UDP-Glc。30 ℃水浴反应12 h后,加入400 μL冰甲醇,旋涡振荡,终止反应。15 000×g离心30 min后,取上清液进行HPLC-UV-MS分析,进行糖基化活性筛选。
2.4 糖基转移酶AbGT5的纯化及酶学性质研究 将诱导表达后的重组菌Transetta(pET28a-AbGT5)用Binding Buffer(pH 7.4,20 mmol·L-1Na2HPO3-NaH2PO3,0.5 mol·L-1NaCl,20 mmol·L-1咪唑)重悬,并超声破碎、离心制备粗酶液。将粗酶液上样于柱体积为5 mL的镍柱进行亲和层析纯化,分别用含不同浓度咪唑的Elution Buffer(pH 7.4,20 mmol·L-1Na2HPO3-NaH2PO3,0.5 mol·L-1NaCl,50,100,150,250,500 mmol·L-1咪唑)洗脱。随后分别将蛋白流份超滤脱盐,并进行SDS-PAGE(SDS-polyacrylamide gel electrophoresis,SDS-聚丙烯酰胺凝胶电泳)检测,以获得AbGT5纯酶。
为优化AbGT5催化DMEP糖基化的反应条件,分别考察了温度、缓冲液pH及二价金属离子等因素对酶催化活性的影响。酶促反应体系为200 μL,包含1 μL 50 mmol·L-1的DMEP(1),2 μL 50 mmol·L-1的UDP-Glc,20 μL 2 g·L-1的AbGT5纯酶,Reaction Buffer补齐至200 μL,分别在4,16,20,25,30,35,40,45,50 ℃水浴下反应30 min以考察温度对酶催化活性的影响。同样在20 ℃条件下,分别测定了以pH 4.0,5.0,6.0的柠檬酸钠-柠檬酸缓冲液、pH 6.0,7.0,8.0的磷酸氢二钠-磷酸二氢钠缓冲液、pH 8.0,9.0的Tris-HCl缓冲液以及pH 9.0,10.0,11.0的碳酸钠-碳酸氢钠缓冲液作为Reaction Buffer时,AbGT5的催化活性。随后在20 ℃及pH 9.0的Tris-HCl条件下,考察了不同二价金属阳离子(BaCl2,CaCl2,CoCl2,CuCl2,FeCl2,MgCl2,MnCl2,NiCl2,ZnCl2,终浓度为5 mmol·L-1)及金属离子络合剂(EDTA,终浓度为5 mmol·L-1)对酶活性的影响。以上酶促反应实验均进行3组平行以保证数据的准确性。
2.5 酶法糖基化产物的制备及结构鉴定 利用AbGT5酶法糖基化DMEP(1)制备DMEP 4′-O-β-D-glucoside(1a)的反应体系包含1 mmol·L-1的DMEP(1),2 mmol·L-1的UDP-Glc,5 mmol·L-1的MgCl2,1 mmol·L-1的AbGT5纯酶,终质量浓度分别为1,2,5,1 mg·L-1。酶促反应在pH 9.0的Tris-HCl缓冲液中进行,反应液总体积为20 mL。20 ℃水浴振荡反应24 h后,用40 mL的乙酸乙酯萃取5次,有机相减压蒸干后用1~2 mL甲醇溶解,利用反相半制备HPLC分离制备酶促反应产物。将分离获得的产物进行HR-ESI-MS,1H-NMR,13C-NMR,HSQC以及HMBC等谱学测定分析以对其结构进行鉴定。
3 结果与分析
3.1 库拉索芦荟糖基转移酶基因的克隆 通过对库拉索芦荟转录组序列的分析,发现5个功能注释为糖基转移酶的cDNA序列具有完整的ORF,分别命名为AbGT1~AbGT5。AbGT1长度为1 413 bp,编码470个氨基酸;AbGT2长度为1 401 bp,编码466个氨基酸;AbGT3长度为1 443 bp,编码480个氨基酸;AbGT4长度为1 431 bp,编码476个氨基酸;AbGT5长度为1 419 bp,编码472个氨基酸。以RNA逆转录的cDNA作为模板,AbGTs-F与AbGTs-R作为引物(表1),PCR扩增產物经电泳检测与预测ORF条带大小一致(图1)。
3.2 糖基转移酶基因的外源表达与活性筛选 基因AbGT1~AbGT5连接pET28a后进行测序验证,结果与转录组中的ORF序列信息一致,且候选糖基转移酶基因正确插入到pET28中。随后将验证正确的重组质粒导入到表达宿主Transetta,经菌落PCR验证,成功构建了候选糖基转移酶基因的外源表达体系。
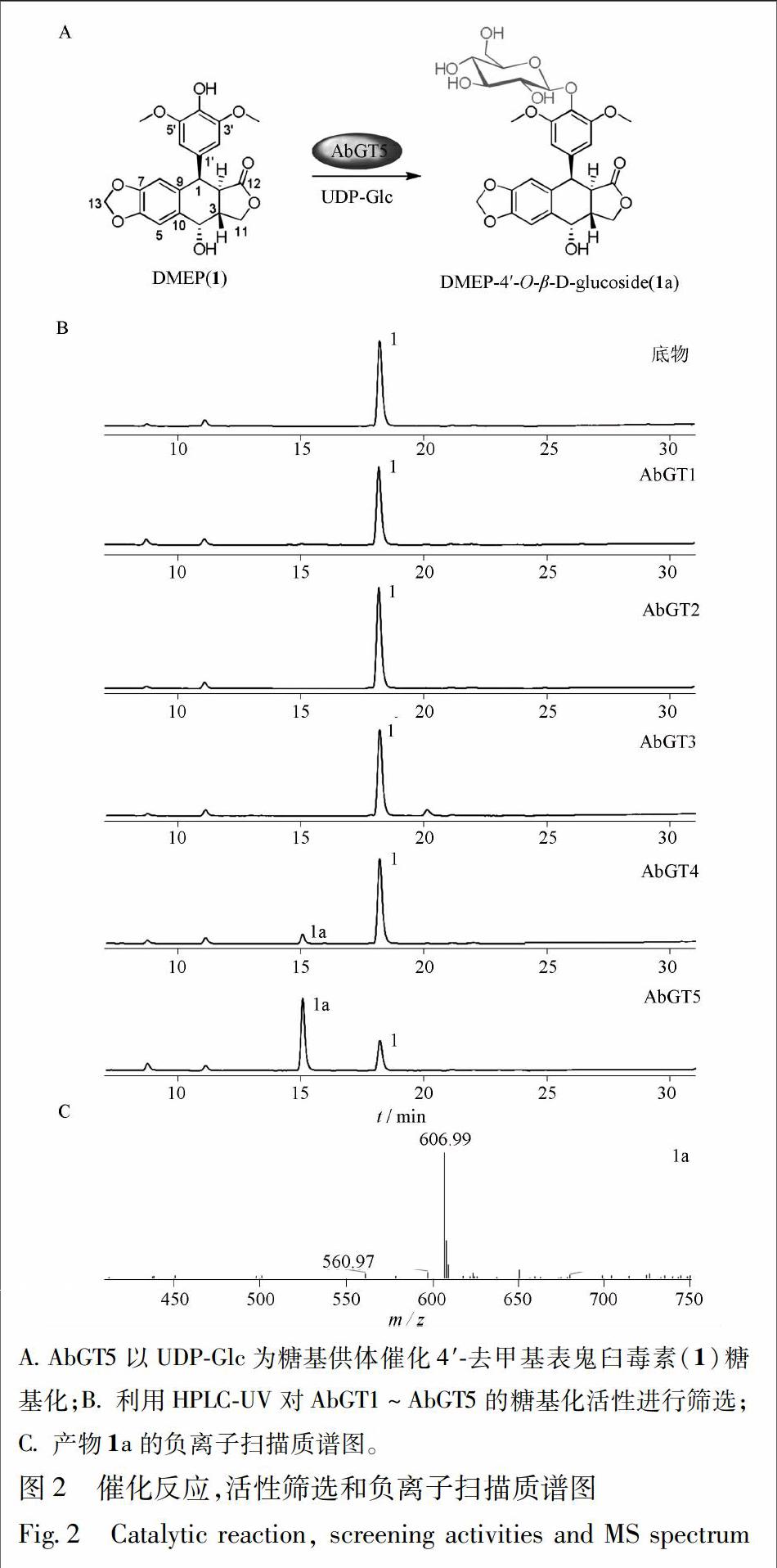
重组糖基转移酶经诱导表达后,利用HPLC-UV-MS进行糖基化反应活性初筛。对照组及AbGT1~AbGT3均未检测到糖基化产物的生成,而AbGT4与AbGT5在18.2 min出现1个产物峰,转化率分别为17%和70%(图2)。质谱检测显示该产物的相对分子质量为562,与底物DMEP(1)相比,相对分子质量增加162,推测产物峰为DMEP(1)的单糖基化产物。因此,选择具有高催化效率的AbGT5对其进行蛋白纯化以及后续DMEP(1)的酶法糖基化实验。
3.3 糖基转移酶AbGT5的纯化及酶学性质研究 经SDS-PAGE检测,AbGT5主要分布在咪唑浓度为150 mmol·L-1的洗脱液中,纯度达到90%以上(图3)。经超滤脱盐,获得7 mL纯酶,质量浓度为2 g·L-1。
通过在不同温度下测定AbGT5的催化活力,发现在4~20 ℃,AbGT5的活性随温度升高而逐渐升高;而在20~50 ℃,AbGT5的活性随温度升高而降低。因此,重组AbGT5催化DMEP(1)糖基化的最适温度在20 ℃附近(图4)。
通过在不同pH缓冲体系中测定酶的催化活力,发现在pH 5.0~9.0,AbGT5的催化活力随着pH的升高而逐渐升高;而在pH 9.0以后,酶活力迅速下降。因此,重组AbGT5的最适pH 9.0左右(图5)。
同时还考察了不同金属离子对重组AbGT5活性的影响。在含有金属离子络合剂EDTA时,AbGT5仍具有催化活力,说明AbGT5催化功能的发挥不依赖于金属离子。但Mg2+和Mn2+等能够提高AbGT5的催化活力,相反Cu2+能够极大的抑制酶的活性,Zn2+甚至能够使酶完全失去活性(图6)。
3.4 酶法糖基化产物的制备及结构鉴定 在20 ℃条件下及pH 9.0的Tris-HCl缓冲液(含5 mmol·L-1MgCl2)中,纯酶AbGT5酶法糖基化DMEP(1)的产物转化率可达80%。经HPLC反向半制备分离纯化获得8.9 mg产物,产物经HR-ESI-MS,1H-NMR,13C-NMR,HMBC及HSQC等手段鉴定结构为4′-demethylepipodophyllotoxin 4′-O-β-D-glucoside(1a)。质谱及核磁数据:HR-ESI-MS m/z 585.155 8 [M+Na]+,计算值 C27H30O13Na; 1H-NMR(methanol-d4,400 MHz) δ: 6.93(1H,s,H-5),6.48(1H,s,H-8),6.37(2H,s,H-2′,H-6′),5.95(2H,s,H-13),4.90(1H,overlapped,H-4),4.80(1H,d,J=7.2 Hz,Glc-H1),4.61(1H,d,J=5.2 Hz,H-1),4.35(2H,m,H-11),3.72(6H,s,H-3′,5′-OCH3),3.75~3.30(6H,m,Glc-H),3.34(1H,m,H-2),2.85(1H,m,H-3); 13C-NMR(methanol-d4,150 MHz) δ: 176.2(C-12),152.1(C-3′),152.1(C-5′),148.2(C-7),147.3(C-6),136.7(C-10),134.0(C-4′),132.6(C-1′),131.5(C-9),109.4(C-5),109.3(C-8),108.6(C-2′),108.6(C-6′),104.0(Glc-1),101.4(C-13),76.8(Glc-5),76.4(Glc-3),74.3(Glc-2),69.9(Glc-4),68.0(C-11),65.7(C-4),61.2(Glc-6),55.6(-OCH3),55.6(-OCH3),43.7(C-1),40.3 (C-2),38.8 (C-3)。
4 讨论
随着越来越多的糖基转移酶的发现,酶法糖基化越来越受到关注。相比化学法,酶法具有反应条件温和、位置及立体选择性强以及催化效率高效等特点。目前已发现的一些糖基转移酶具有很强的底物杂泛性,不仅能够识别多种结构不同的天然以及非天然产物,还能够将各种类型的糖基引入到这些苷元上,形成多样化的糖苷类产物[11-18],这为活性糖苷类化合物的合成提供了一种有效策略。本研究中从库拉索芦荟中挖掘到1个新颖糖基转移酶AbGT5(GenBank accession number KY662485),可作为工具酶以UDP-Glc为糖基供体高效催化DMEP的4′-OH进行糖基化反应,生成DMEP 4′-O-β-D-glucoside。AbGT5的发现为大量制备DMEP糖苷从而进行体内及体外药理活性的研究奠定了基础。不仅如此,未来对AbGT5受体底物谱的研究,可发掘该酶对于DMEP结构类似物的糖基化潜力;同时对糖基供体杂泛性的研究,尝试将不同结构类型的糖基引入DMEP的羟基,可酶法合成更加多样化的糖苷衍生物。这不仅能够增加鬼臼毒素类糖苷衍生物的结构多样性,更可为药物先导物的发现奠定基础。随着酶法糖基化研究的深入,糖基转移酶作为工具酶在鬼臼毒素类糖基衍生化的研究中将扮演越来越重要的角色。
[参考文献]
[1] Gordaliza M, García P A, Del Corral J M M, et al. Podophyllotoxin: distribution, sources, applications and new cytotoxic derivatives [J]. Toxicon, 2004, 44(4): 441.
[2] Yousefzadi M, Sharifi M, Behmanesh M, et al. Podophyllotoxin: current approaches to its biotechnological production and future challenges [J]. Eng Life Sci, 2010, 10(4): 281.
[3] Atta-Ur-Rahman, Iqbal Choudhary M A, Habibu-Ur-Rehman Kazmi M H. Antifungal aryltetralin lignans from leaves of Podophyllum hexandrum [J]. Phytochemistry, 1995, 40(2): 427.
[4] Iberti V, Donadio M, Giaccone G. Cisplatin and teniposide chemotherapy for advanced non-small cell lung cancer [J]. Eur J Cancer Clin Oncol, 1991, 27(9): 1104.
[5] Clark P I, Slevin M L. The clinical pharmacology of etoposide and teniposide [J]. Clin Pharmacokinet, 1987, 12(4): 223.
[6] Zilla M K, Nayak D, Amin H, et al. 4′-Demethyl-deoxypodophyllotoxin glucoside isolated from Podophyllum hexandrum exhibits potential anticancer activities by altering Chk-2 signaling pathway in MCF-7 breast cancer cells [J]. Chem Biol Interact, 2014, 224: 100.
[7] Liu Y, Zhao C, Li H, et al. Cytotoxicity and apoptosis induced by a new podophyllotoxin glucoside in human hepatoma(HepG2) cells [J]. Can J Physiol Pharmacol, 2010, 88(4): 472.
[8] 王莉莉, 周應军. 抗癌物质鬼臼毒素及其衍生物研究进展 [J]. 国外医药: 植物药分册, 2006, 21(1): 6.
[9] Abad A, Loópez-Perez J L, del Olmo E, et al. Synthesis and antimitotic and tubulin interaction profiles of novel pinacol derivatives of podophyllotoxins [J]. J Med Chem, 2012, 55(15): 6724.
[10] Zi C T, Yang D, Dong F W, et al. Synthesis and antitumor activity of novel per-butyrylated glycosides of podophyllotoxin and its derivatives [J]. Bioorg Med Chem, 2015, 23(7): 1437.
[11] Gantt R W, Goff R D, Williams G J, et al. Probing the aglycon promiscuity of an engineered glycosyltransferase [J]. Angew Chem Int Ed, 2008, 47(46): 8889.
[12] Xie K, Chen R, Li J, et al. Exploring the catalytic promiscuity of a new glycosyltransferase from Carthamus tinctorius [J]. Org Lett, 2014, 16(18): 4874.
[13] Sun L, Chen D, Chen R, et al. Exploring the aglycon promiscuity of a new glycosyltransferase from Pueraria lobata [J]. Tetrahedron Lett, 2016, 57(13): 1518.
[14] Chen D, Chen R, Wang R, et al. Probing the catalytic promiscuity of a regio- and stereospecific C-glycosyltransferase from Mangifera indica [J]. Angew Chem Int Ed, 2015, 54(43): 12678.
[15] Xie K, Dou X, Chen R, et al. Molecular characterization and phylogenetic analysis of two novel fungal phenolic UDP-Glycosyltransferases from Absidia coerulea and Rhizopus japonicus [J]. Appl Environ Microbiol, 2017, doi:10.1128/AEM.03103-16.
[16] Xie K, Chen R, Chen D, et al. Enzymatic N-glycosylation of diverse arylamine aglycones by a promiscuous glycosyltransferase from Carthamus tinctorius [J]. Adv Synth Catal, 2017, 359(4): 603.
[17] Feng J, Zhang P, Cui Y, et al. Regio- and stereospecific O-glycosylation of phenolic compounds catalyzed by a fungal glycosyltransferase from Mucor hiemalis [J]. Adv Synth Catal, 2017, doi:10.1002/adsc.201601317.
[18] Berim A, Ebel R, Schneider B, et al. UDP-glucose:(6-methoxy) podophyllotoxin 7-O-glucosyltransferase from suspension cultures of Linum nodiflorum [J]. Phytochemistry, 2008, 69(2): 374.
[19] Chen W, Van Wyk B E, Vermaak I, et al. Cape aloes—a review of the phytochemistry, pharmacology and commercialisation of Aloe ferox [J]. Phytochem Lett, 2012, 5(1): 1.
[責任编辑 丁广治]
