高原地区慢性阻塞性肺疾病患者血清C反应蛋白、内皮素1与脑钠肽的变化及其对肺动脉高压的影响
2017-07-10陈秋红
王 强,拜 钱,陈秋红
(青海省心脑血管病专科医院 a.呼吸科; b.功能科;c.检验中心, 青海 西宁 810012)
·论著·
高原地区慢性阻塞性肺疾病患者血清C反应蛋白、内皮素1与脑钠肽的变化及其对肺动脉高压的影响
王 强a,拜 钱b,陈秋红c
(青海省心脑血管病专科医院 a.呼吸科; b.功能科;c.检验中心, 青海 西宁 810012)
目的 探讨高原地区慢性阻塞性肺疾病(COPD)患者血清C反应蛋白(CRP),脑钠肽(BNP);内皮素-1(ET-1)的浓度,及与不同程度肺动脉高压(PH)的关系。方法 采用多普勒心脏超声对COPD患者118例测定肺动脉压,根据肺动脉压力将其分为3组,无肺动脉高压组(COPD-NPH),轻度PH 组(COPD-mPH),中重度PH 组(COPD-sPH),以酶联免疫吸附测定(ELISA)法测定CRP及ET-1,免疫荧光法测定BNP。结果 随着PH的增加,PO2明显降低,3组间差异有统计学意义(P<0.05)。COPD-sPH患者血红蛋白(HB)及血细胞比容(HCT)显著高于COPD-mPH患者及无PH患者(F=10.672,F=6.383,P均<0.05)。3组中CRP、BNP、ET-1差异有统计学意义(P均<0.01),肺动脉收缩压(sPAP)与血清CRP(r=0.354,P=0.000)及BNP(r=0.427,P=0.000);及ET-1(r=0.453,P=0.000)水平有显著性相关。结论 高原COPD患者低氧血症更严重,HB及HCT异常增加,血液学的高凝状态,促进了PH 的形成。血浆CRP水平随着肺动脉压的升高而增加,提示全身炎症可能参与了COPD继发肺动脉高压的形成;CRP,ET-1, BNP共同参与了COPD继发肺动脉高压发生和发展。
肺疾病,慢性阻塞性;高海拔;高血压, 肺性;C反应蛋白质;血管内皮生长因子类;利钠肽,脑
至2020 年慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)COPD将位居全球患者疾病死亡原因的第3位[1]。继发性肺动脉高压(PH)是COPD进展为肺源性心脏病(PHD)的关键环节,直接影响到COPD的预后,有报道,PH与COPD的病死率有密切关系[2]。 COPD 不仅表现为肺部局部炎症,还存在全身炎症反应,慢性缺氧、气道炎症等因素引起肺血管收缩、重塑,可导致PH甚至PHD的发生[3],严重影响患者生存质量及预后。有报道,高原地区由于其特殊的地域特征,COPD患病率低[4],也有报道高原地区COPD患者,进展为慢性PH的概率要显著高于平原地区[5-6]。目前COPD继发PH的形成机制尚不完全清楚,为了解高原地区COPD-PH患者中,炎性因子C反应蛋白(CRP),脑钠肽(BNP)及内皮素1(ET-1)在PH中的作用,我们观察了合并不同程度PH的COPD患者血清CRP、BNP及ET-1的变化,并与PH进行了相关分析,旨在探讨长期生活在高原低氧环境下COPD患者,炎性因子在PH的发生、发展过程中的变化;对COPD-PH患者早期诊断、及时预防PH,降低病死率提供依据。
1 资料与方法
1.1 病例选择 2014年3月至2015年12月我院收治并确诊的COPD患者,所有患者均符合《慢性阻塞性肺疾病诊治指南(2013年修订版)》诊断标准及中华医学会呼吸病学分会制定的COPD诊断及分期标准[1],剔除原发性PAH、COPD之外的其他呼吸系统疾病、冠心病、严重的心肝肾功能不全、出血及血栓栓塞性疾病、自身免疫性疾病、恶性肿瘤以及较为严重的内分泌疾病等。最终入组118例,其中男89例,女29例,年龄50~81岁,平均(65.92±10.61)岁。依据2015年欧洲心脏病学会肺动脉高压指南[7],以心脏彩色超声测算的肺动脉收缩压(sPAP)结果,将患者分为无肺动脉高压组(COPD-nPH)(肺动脉压收缩压sPAP<40 mmHg),男51例,女10例;轻度肺动脉高压组(COPD-mPH)(40 mmHg≤sPAP<55 mmHg),男23例,女10例;因重度肺动脉高压组例数较少,故将中重度列入COPD-sPH组,中、重度肺动脉高压组(COPD-sPH)(sPAP≥55 mmHg)男15例,女9例。
1.2 方法
1.2.1 肺动脉收缩压的测定 采用飞利浦彩色多普勒超声诊断仪,型号IE33。用三尖瓣返流法评估,sPAP=三尖瓣反流最大压差+右心房压力。PASP<40 mmHg为肺动脉压正常,40 mmHg≤4sPAP<55 mmHg 为轻度肺动脉高压,55 mmHg≤sPAP<70 mmHg为中度肺动脉高压,≥70 mmHg为重度肺动脉高压。
1.2.2 血液学指标测定 所有患者入院后2小时内,采集肘静脉血采集空腹静脉血4 ml,在30 分钟内离心(3 500 r/min,共10分钟)分离血清,置-80 ℃低温冰箱保存待测。BNP的测定用全自动免疫分析仪(AXSYM REF: 37000雅培公司,美国)及雅培配套BNP试剂盒(AXSYM BNP ABL004/RL REF:8G82-20),免疫荧光法按说明书进行操作。采用贝克曼AU5831科华原装试剂免疫比浊法检测CRP水平)。ET-1浓度测定用酶联免疫法(ELISA),试剂盒由南京建成生物工程公司提供,用酶标仪(BIO-PEK INSTRUMENT.INC.EIX-800),严格按检测试剂盒说明书操作,测定450 nm处的吸光值(OD),计算血浆中ET-1含量。
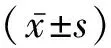
2 结 果
2.1 各组临床指标的比较 各组间年龄、体质指数差异无统计学意义,左心室舒张末内径、左心室射血分数(LVEF)差异亦无统计学意义。COPD-sPH患者HB及HCT显著高于COPD-mPH患者及COPD-nPH患者。右心房上下径及前后径,3组间比较差异有统计学意义;COPD-sPH组肺动脉收缩压明显高于COPD-nPH组和COPD-mPH组,见表1。
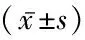
表1 各组间临床指标的比较
注:LVEF:左心室射血分数;Hb:血红蛋白;HCT:血细胞比容;sPAP:肺动脉收缩压。与COPD-nPH组比较,*P<0.05;与COPD-MPH组比较,#P<0.05
2.2 CRP、BNP比较 各组间CRP差异有统计学意义(P=0.000),COPD-mPH组及COPD-sPH组CRP高于COPD-nPH组,COPD-mPH组和COPD-sPH组比较差异无统计学意义。各组间BNP 、ET-1差异有统计学意义。COPD-nPH组患者的PO2显著高于有PH两组,COPD-mPH与COPD-sPH组之间差异无统计学意义。而COPD-sPH组的PaCO2则显著高于COPD-mPH组及COPD-nPH组,各组间SaO2%差异无统计学意义,见表2。
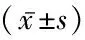
表2 各组间CRP、BNP及ET-1的比较
注:CRP:C反应蛋白;BNP:B型脑钠肽;ET-1:内皮素-1;PO2:氧分压;PaCO2:二氧化碳分压;SaO2:氧饱和度。与COPD-nPH组比较,*P<0.05
2.3 肺动脉压与CRP,BNP及ET-1的相关性分析 sPAP与血清CRP、ET-1及BNP水平有显著性相关(r=0.354,P=0.000;r=0.453,P=0.000;r=0.427,P=0.000),血浆BNP水平与ET-1呈正相关(r=0.325,P=0.000);CRP与 ET-1 呈显著正相关(r=0.243,P=0.006)。
3 讨 论
低氧对肺血管的直接作用,是最初的低氧性肺血管收缩(pulmonary vascular resistance,PVR),和随之而来的血管舒缩物质失衡,导致肺小动脉构型重建(structural modelin),形成低氧性肺动脉高压[8]。在平原地区,慢性COPD患者由于长期低氧血症刺激,促使红细胞生成素生成增加,引起继发性红细胞增多。由于地域特征,高原健康人本身就存在低氧继发性红细胞增多,红细胞的聚集性增加,血液黏稠度升高。所以,生活在高原地区患有COPD者,除疾病本身缺氧外还受环境低氧的影响,低氧血症更严重。我们的结果显示,COPD-sPH组的PO2明显低于COPD-nPH组; COPD-sPH组Hb及Hct明显高于COPD-nPH组和COPD-mPH组,COPD-mPH组和COPD-sPH组之间,差异亦有统计学意义(P<0.05)。COPD 患者长期缺氧导致的肺血管重构及低氧性肺血管收缩被认为是肺动脉高压的主要机制[3]。疾病自身及环境低氧的相互叠加不仅使低氧血症进一步增加,而且导致了继发性红细胞增多,但红细胞增多超过一定的界限值时,不但携氧能力不再增加,且引起血细胞比容增高,血浆量相对减少,使血液黏度增加。本研究结果显示,COPD-sPH组Hb达到了195 g/L,HCT超过了60%,使血液变得更“黏、稠”,血液学的高凝状态,使血流缓慢微血栓形成。所以,高原COPD患者低氧血症,血液高凝状态较平原COPD患者更严重,虽然COPD患病率低,一旦患病症状较重,这是高原COPD患者一突出的问题。
COPD是一种气道慢性炎症性疾病,随着COPD患者病情的进展,缺氧及多种炎性介质导致多种因素参与其发生、发展。有报道,慢性炎症和肺血管结构重塑有关[9-10]。CRP是一种肝脏合成的急性时相反应蛋白,被认为是系统炎症有效的标志物之一,CRP水平升高通常提示有炎症反应或者组织损伤的存在[11]。在本次研究中,随着PH的升高,COPD患者血浆CRP水平也逐渐增加,相关分析显示,CRP的水平与sPAP程度有明显的相关性(r=0.354,P=0.000)。说明COPD-sPH患者的气道和血管等的慢性炎症反应比COPD-mPH患者明显加重,炎症反应也是导致COPD-PH发生的重要因素,我们的结果进一步证实了CRP与COPD肺动脉高压有关。
ET-1是由肺内皮细胞合成和分泌的具有强烈收缩血管作用的多肽,在低氧性肺动脉高压过程中起重要作用[12]。对COPD-PH患者作用仍不清楚,有研究提示,内皮素-1与COPD继发的PH有关[13-14]。本研究显示ET-1浓度与PH有显著相关,COPD-sPH及COPD-mPH组高于COPD-nPH,说明ET-1在低氧环境下的COPD患者肺动脉高压的形成和发展中起了重要的作用。ET-1可通过上调白介素-6进而刺激肝脏产生更多的CRP,CRP通过降低NO的合成与生物活性,增加ET- 1的释放[15]。上述生物活性物质之间形成恶性循环,促进COPD继发性肺动脉高压的发生、发展。另外长期生活在低氧环境下,一氧化氮(NO)与ET-1这一对舒缩因子分泌平衡失调, ET-1水平持续升高[13],是促使COPD患者PH发生原因之一。
血浆BNP水平与平均肺动脉压力,肺微循环血管阻力及右心房压力,右心室功能相关[16]。我们观察了3组患者右心房内径的情况,随着PH程度的加重,右心负荷也在相应增大,COPD-PH组血浆BNP 水平高于COPD-nPH组,BNP水平与PH有相关性(r=0.427,P=0.000),相关分析显示,BNP与ET-1水平也有相关性(r=0.325,P=0.000),提示二者在COPD患者PH形成中有内在的相互关系。 ET可使血管平滑肌收缩,使PH程度增加,ET-1的升高可促进BNP的分泌[16]。而BNP通过利尿利钠,减轻右心室前负荷,还可以通过影响肺血管平滑肌细胞内的钙水平扩张肺动脉,调节肺动脉压,藉以缓解右心室压力,改善心肌肥厚和降低肺动脉压力,是机体的一种代偿性保护机制[16],二者在低氧环境中COPD-PH的发生发展中起到重要作用。BNP 水平除了受到肺动脉压增加的影响外,还受到细胞因子的影响。本次研究结果也显示,COPD 患者BNP水平与ET-1正相关,其详细机制应进一步探讨。随着病情的进展,3组间肺动脉压逐渐增加, ET -1和BNP水平虽然仍高于无肺动脉高压组,但在COPD-sPH组和COPD-mPH组之间差异无统计学意义,可能的机制为COPD-mPH时机体炎症反应较剧烈,ET-1、BNP等促炎因子及血管活性物质大量释放, COPD-sPH组由于病情进展到一定程度,机体炎症反应趋于平稳,肺小动脉重建减弱,使ET -1和BNP维持在相对稳定的水平有关。
综上所述,生活在高原地区的COPD者,除疾病本身缺氧外还受环境低氧的影响,低氧血症更严重,导致了患者继发性红细胞增多症,血液的“黏、稠”促进了PH 的形成。血浆CRP水平随着肺动脉压的升高而增加,提示COPD合并PH患者的炎症反应比COPD-nPH患者明显加重,炎症反应可能是导致PH发生的重要因素,CRP、ET-1、BNP共同参与了COPD继发PH发生和发展,其机制应进一步研究。
[1] 中华医学会呼吸病学分会慢性阻塞性肺疾病学组. 慢性阻塞性肺疾病诊治指南(2013 年修订版)[J]. 中华结核与呼吸杂志,2013,36(4):255 -264.
[2] Hurdman J, Condliffe R, Elliot CA, et al. Pulmonary hypertension in COPD:results from the ASPIRE registry [J].Eur Respir J, 2013,41(6): 1292-1301.
[3] Cottin V. Pulmonary hypertension in chronic respiratory diseases[J]. Presse Medicale, 2014, 43(9):945-956.
[4] 高芬,杜发茂,拉周,等.青海高原慢性阻塞性肺疾病所致慢性肺源性心脏病流行病学调查[J]. 国际呼吸杂志, 2011, 31(13): 989-992.
[5] 杨生岳.凋亡相关因子和肿瘤坏死因子-α介导的细胞凋亡及白介素-19、白介素-10在高原慢性肺心病发病中的作用[J]. 中华肺部疾病杂志:电子版, 2014. 7(3): 9-13.
[6] 杨生岳,戴胜归.高原地区慢性肺心病诊断与治疗中值得注意的几个特殊问题[J].中华肺部疾病杂志:电子版, 2014,7(3):243-246.
[7] Galiè N, Humbert M, Vachiery JL, et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension [J]. Eur Heart J,2015,46(6):1855-1856.
[8] 张凌云.肺动脉平滑肌细胞与低氧性肺血管重塑形成机制[J]. 中国动脉硬化杂志, 2013,21(2):177-181.
[9] 李雅敏.慢性阻塞性肺疾病并发肺动脉高压与炎症反应的相关性研究[J]. 心肺血管病杂志, 2013,32(2):174-178.
[10] Price LC, Wort SJ, Perros F, et al. Inflammation in pulmonary arterial hypertension[J]. Chest J, 2012, 141(1): 210-221.
[11] Adak MR. C-reactive protein: a novel inflammatory biomarker[J]. Res J Pharm Biol Chem Sci, 2014, 5(3):1413-1416.
[12] 王红,陆月明.慢性阻塞性肺疾病相关肺动脉高压发病机制及治疗进展[J]. 临床肺科杂志, 2015,20(11): 2101-2103.
[13] Mazurek JA, Jabuonski T, Zolty R. Endothelin-1 levels in COPD-induced pulmonary hypertension[J]. J Cardiac Fail, 2012, 18(8):S29.
[14] 孙伟, 黄永刚,许玺.慢性阻塞性肺疾病患者血管内皮素-1与降钙素基因相关肽检测临床价值的研究[J]. 中华临床医师杂志:电子版, 2014(13): 2394-2397.
[15] 郑黎晖.孤立性心房颤动患者血浆高敏C反应蛋白与大内皮素-1浓度变化及相互的关系[J]. 中国循环杂志, 2015,(3): 240-243.
[16] Oremus M, Mckelvie R, Donwauchope A, et al. A systematic review of BNP and NT-proBNP in the management of heart failure: overview and methods[J]. Heart Fail Rev, 2014, 19(4):413-419.
Serum C-reaction protein, endothelin-1 and brain natriuretic peptide in patients with chronic obstructive pulmonary disease in plateau region and pulmonary hypertension
Wang Qianga, Bai Qianb, Chen Qiuhongca.
DepartmentofRespiratoryMedicine;b.DepartmentofFunction;c:CenterLaboratory,Cardio-CerebrovascularDiseaseSpecializedHospitalofQinghaiProvince,Qinghai810012,ChinaCorrespondingauthor:WangQiang,Email: 33102515@qq.com
Objective To investigate the levels of plasma C-reactive protein(CRP),brain natriuretic peptide (BNP), endothelialin-1(ET-1) and pulmonary hypertension(PH) in the patients with chronic obstructive pulmonary disease(COPD) in the plateau region. Methods A total of 118 patients with COPD were included. Pulmonary artery pressure was measured by Doppler echocardiogram. CRP, BNP and ET-1 were tested by ELISA. All the patients were divided into three groups: COPD non-PH(COPD-nPH group),COPD with mild PH(COPD-mPH group), COPD with serious PH(COPD-sPH) group serious.Results As pulmonary artery pressure increased, PO2decreased, there were significantly differences among three groups (P<0.05). Hb and HCT in COPD-sPH group were significantly higher than those of COPD-mPH (F=10.672,P<0.05) and COPD-NPH group (F=6.383,P<0.05). There were also significant differences in the levels of CRP, BNP, and ET-1 among three groups(P<0.01). Pulmonary artery systolic pressure was positively associated with CRP (r=0.354,P=0.000), BNP (r=0.427,P=0.000), and ET-1 (r=0.453,P=0.000).Conclusion The patients with COPD in the plateau region have worse hypoxemia, greater abnormal Hb and HCT, and higher condensation state of blood, which promotes pulmonary arterial pressure. As the pulmonary artery pressure increases, the plasma CRP increases, suggesting systemic inflammation may be involved in the PH induced by COPD.
pulmonary disease, chronic obstructive; altitude; hypertension,pulmonary;C-reactive protein; vascular endothelial growth; factors;natriuretic peptide, brain
王强,Email: 33102515@qq.com
R563
A
1004-583X(2017)07-0583-04
10.3969/j.issn.1004-583X.2017.07.008
2017-02-22 编辑:武峪峰
