常规生化和血液学检验危急值复检策略*
2017-07-07王华新李云凤张淑华张海涛张吉奎徐福海高文育杨亚轩郑福和于水江
王华新,李云凤,张淑华,张海涛,张吉奎,徐福海,高文育,杨亚轩,郑福和,于水江
(黄骅开发区博爱医院,河北黄骅 061100)
·专题笔谈·
常规生化和血液学检验危急值复检策略*
王华新,李云凤,张淑华,张海涛,张吉奎,徐福海,高文育,杨亚轩,郑福和,于水江
(黄骅开发区博爱医院,河北黄骅 061100)
分析检验危急值差错来源,建议通过方法学评价、Delta检验和机器学习等加以识别和消除;借鉴国内外研究成果,常规生化和血液学检验危急值在分析测量范围或可报告范围内可直接报告,反之则需复检;若为不合格标本,条件允许下,应重新采集标本复检;若条件不允许,应复检原标本;在干扰因素无法消除时,应依据干扰实验结果评估干扰效应并加以说明。
危急值;分析前误差;分析误差;分析测量范围(AMR);复检
危急值(critical value)指若临床不及时干预,可能危及患者生命的实验室检测值。危急值报告的准确性和时效性直接关系到患者安全。复检包含对同一标本重复检测和重新采集标本后再测定两层含义。复检的目的是消除检测的系统误差,减少检测的随机误差,降低危急值假阳性率,避免给临床医生提供错误信息而造成不良后果。尽管如此,复检必然延误报告时间,甚至有可能贻误抢救和治疗时机以致于危及患者生命。1999年,美国医学研究所报告指出,美国每年近10万人死于医疗差错[1]。该报告一经发布便在全球引起轩然大波,医疗安全成为当时热门话题。美国病理学家学会(College of American Pathologists,CAP)、医疗机构认证联合委员会(Joint Commission on Accreditation of Healthcare Organizations,JACHO)均要求临床实验室建立规范化的危急值报告制度[2-3]。我国《临床检验危急值规范化管理京冀专家共识》[4]对危急值管理提出了系统化管理要求,将危急值复测(检)率作为一级质量指标来监控整个危急值报告过程的准确性和时效性,但对复检率指标的具体要求未提出明确要求。本文旨在探讨如何应对常规生化和血液学检验危急值复检问题,提出一些建议供同行讨论。
1 危急值差错避免与识别
1.1 危急值差错来源 Plebani等[5]和Carraro等[6]统计了1996年和2006年临床实验室差错变化情况:分析前、分析中和分析后差错所占比例分别为68.2%和61.0%、13.3%和15.0%、18.5%和23.1%,而总差错发生率由0.47%降低到0.30%。1996年分析前差错主要以患者姓名错误、患者信息不准确、医嘱丢失、申请检验项目不恰当、标本采集管错误、从输液处抽血、标本标识错误等为主。近年来,医院信息管理系统(hospital information management system,HIS)电子医嘱及电子扫描码等技术应用,患者信息、标本标识、医嘱差错率大幅下降,误差主要以标本污染、标本采集量不准确、空试管、采集标本容器错误、数据传送冲突、检测项目申请错误等为主。分析中差错未发生明显改变,主要体现在仪器故障和方法学错误,分析后差错主要表现为结果报告错误、周转时间长、与临床沟通少等。
1.2 危急值差错的识别与消除
1.2.1 制定标准化操作规程并定期评价方法学 分析前阶段是检验全过程的开始,直接影响检验结果准确性,也影响检验危急值的准确性。分析前差错的预防至关重要,需要加强护理人员管理,规范标本采集标准化操作规程并强化训练,促进部门间合作协调关系[7]。调查表明分析中差错发生率在不断减少[8],分析中误差主要表现在仪器故障、方法学特异性低、检测操作不当、样本量少等方面。规范仪器维护和保养标准化操作规程、熟练测试程序。依据美国临床和实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)文件,验证包括特异性、灵敏度、准确性、分析测量范围(analytical measurement range,AMR)、可报告范围(clinical reportable range,CRR)、干扰实验等,并将验证结果详尽说明。参加室内质控和室间质评活动,发现问题及时解决、纠正。
1.2.2 Delta检验法 Delta检验法即差值检查法,是检验分析前误差或分析后误差的敏感方法。Delta值是患者病情稳定下连续检测结果的差值,通过分析差值(delta difference)、差值百分数(delta percent change)、差值变化率(rate difference)、差值百分数变化率(rate percent change)等指标,若Delta值超过预期,有可能是患者病情发生急剧变化、标本错误或检测结果误差[9]。Park等[10]在常规Delta检验法基础上加以改进,用差值变化率/参考区间分布宽度(DD/RR)检验27项常规临床生化指标,结果显示该方法能更直观、准确地判定生物学变异,能很好地反映疾病变化,对误差的检出更加容易、准确。
1.2.3 机器学习 美国Massachusetts总医院的Baron博士开发出一种用于检测分析前误差的机器人。如将患者的血钾、钠、二氧化碳、阴离子间隙(AG)、血糖数据及临床信息的历史记录作为机器学习的训练数据(training data)进行机器学习(machine learning),当出现血糖危急值时,机器会通过决策树(decision tree)识别出“真伪”危急值[11]。
2 危急值复检策略
2.1 AMR内危急值复检策略 AMR是指患者样本未经稀释、浓缩或其他预处理直接检测所得到的可靠结果范围。验证AMR时,应参考《临床检验危急值规范化管理京冀专家共识》[4]中常规生化和血液学指标分层界限范围,见表1。AMR范围至少应超过危急值指标下限中位数和上限中位数,在此范围内才能得到可靠结果。检验指标在不同的医学决定水平具有不同的临床意义。同样,危急值界限反映了疾病的危重程度,需要采取不同的治疗措施。如:PLT有上限和下限,PLT低于下限时,极易发生出血性疾病,而高于上限时,血小板极易发生凝集,导致血小板性栓塞及出血倾向;PT(凝血酶原时间)仅有上限,PT缩短见于高凝状态或血栓性疾病,但其诊断意义不大, PT超过上限时,凝血机制遭到严重破坏,机体极易发生出血。
关于AMR范围内的检验危急值是否复检这一问题,多数学者和机构认为[12-15],在确认方法学评价结果符合要求的前提下,AMR范围内的危急值没有复检的必要性,复检毫无意义,复检非但不能提高检验结果的准确性反而会延误报告时间,甚至造成严重的不良事件(见表2)。
2.2 超出AMR的危急值复检策略 极端危急值极有可能超出AMR下限和/或AMR上限,见表1。极端高值超过AMR上限时,可稀释后复检,若在CRR范围内,则可向临床报告。如李云凤等[16]验证WBC、PLT、Hb的AMR分别为(0.024~96.82)×109/L、(9.7~970)×109/L、12.5~251 g/L,WBC和PLT的 CRR上限分别为4 841×109/L和48 500×109/L。如表1所示,除Hb外,WBC、PLT极端高值均未超出CRR上限。如极端高值超出AMR低限时,Deetz等[17]和Niu等[14]建议复检,若复检结果一致(delta≤10%),则可向临床报告;若复检结果不一致(delta>10%),则需复检3次,以减少随机误差,报告两次相近结果的平均值,并要求检验者与主管医生沟通,说明复检情况,要对报告结果解释说明。
表1 “临床检验危急值规范化管理京冀专家共识”中推荐常规生化和血液学分层界限范围
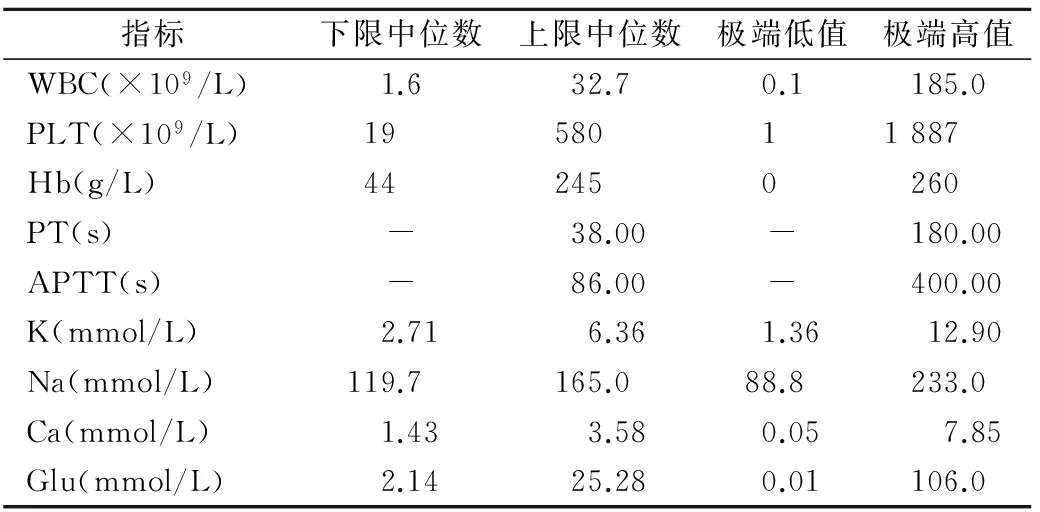
指标下限中位数上限中位数极端低值极端高值WBC(×109/L)1.632.70.1185.0PLT(×109/L)1958011887Hb(g/L)442450260PT(s)-38.00-180.00APTT(s)-86.00-400.00K(mmol/L)2.716.361.3612.90Na(mmol/L)119.7165.088.8233.0Ca(mmol/L)1.433.580.057.85Glu(mmol/L)2.1425.280.01106.0
注:该表汇总了成人和儿童危急值分层界限,下限中位数取两者最小值,上限中位数取两者最大值。Glu,血糖;PLT,血小板;WBC,白细胞;APTT,活化部分凝血活酶时间;Hb,血红蛋白;Ca,钙。
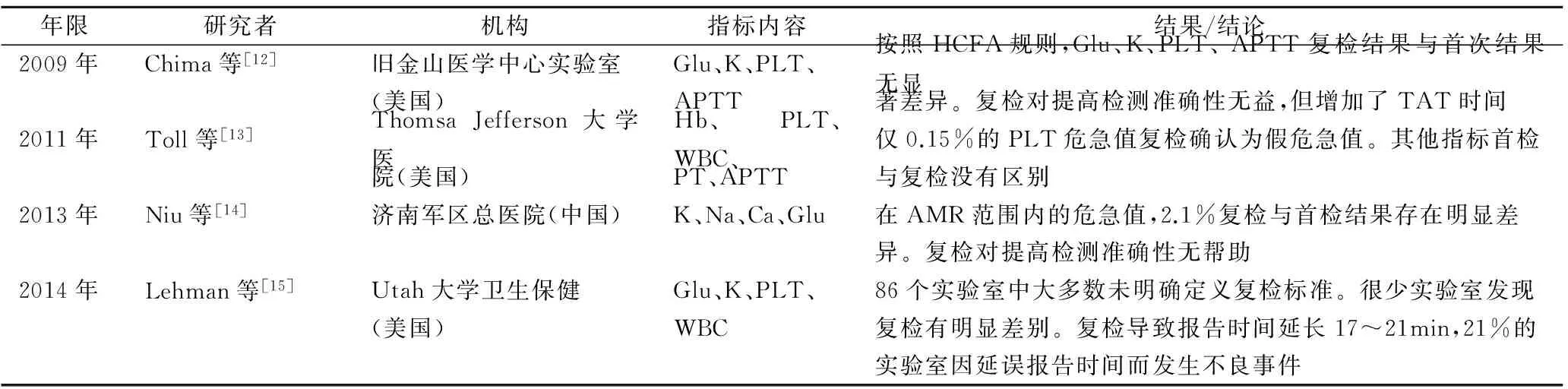
表2 检验危急值复检必要性调查结果
注: HCFA,美国医疗保险和医疗补助服务中心。
2.3 危急值干扰因素处理原则 脂血、溶血、黄疸是最常见干扰因素,但肉眼判断脂血、溶血和黄疸可信度较差,应用自动系统进行定量或半定量检查报告[18]。实验室应验证干扰实验。如标本发生溶血、脂血、黄疸时,在条件和时间允许下,可重新采集标本,若条件不允许而无法获取新标本时,则需要检验者将干扰实验的验证情况与主管医生沟通,对检测指标的依据干扰实验结果评估干扰效应,对检测结果的可靠性、准确性作出说明。
综上,检验危急值复检策略与流程,见图1。
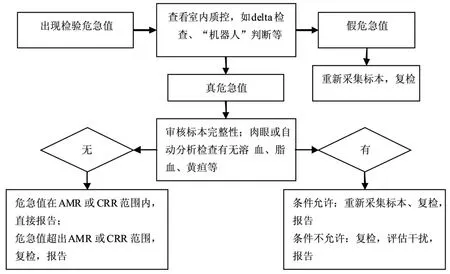
图1 危急值复检策略与流程
实验室应定期对检测系统评价方法学,只有符合要求时方可发出检测报告。检验人员需加强对异常结果的分析判断能力,同时还要增强与临床沟通能力[19],当出现检验危急值时,可通过查看室内质控、Delta检验或“机器人”等判断识别“真伪”危急值。假危急值应重新采集标本复检,反之,则需审核标本完整性、是否存在干扰因素。合格标本测定结果在AMR或CRR范围内则可直接报告,超出AMR或CRR范围时需复检;若为不合格标本,条件允许下,应重新采集标本复检;若条件不允许,应复检原标本,在干扰因素无法消除时,应依据干扰试验结果评估干扰效应并加以说明。
[1]IOM.To err is human[EB/OL].[2016-07-01].http://iom.edu.
[2]The Joint Commission. Accreditation program: laboratory, national patient safety goals (NPSG.02.03.01)[EB/OL]. (2010-07-12)[2016-07-01]. http://www.jointcommmission.org/Accessed.
[3]College of American Pathologists. Laboratory General Checklist[components GEN.41320, GEN.41330, and GEN.41340][EB/OL]. (2010-08-06)[2016-07-01]. www.cap.org.Accessed.
[4]北京市临床检验中心,北京市医学检验质量控制和改进中心,河北省临床检验中心,等.临床检验危急值规范化管理京冀专家共识[J].中华检验医学杂志,2016,39(3):158-165.
[5]Plebani M, Carraro P. Mistakes in a stat laboratory: types and frequency[J].Clin Chem, 1997,43(8): 1348-1351.
[6]Carraro P, Plebani M. Errors in a stat laboratory:types and frequencies 10 years later[J]. Clin Chem, 2007, 53(7): 1338-1342.
[7]Hammerling JA. A reviw of medical errors in laboratory diagnostics and where we are today[J]. Lab medicine, 2012, 43(2): 41-43.
[8]Agarwal R. Quality-improvement measures as effective ways of preventing laboratory errors[J]. Lab medicine, 2014, 45(2): e80-e88.
[9]Lacher DA,Connelty DP. Rate and delta checks compared for selected chemistry tests[J]. Clin Chem,1988, 34(10):1966-1970.
[10]Park SH,Kim SY,Lee W,etal. New decision criteria for selecting delta check methods based on the ratio of the delta difference to the witdth of the reference range can be generally applicable for each clinical chemistry test item[J]. Ann Lab Med, 2012, 32(5): 345-354.
[11]Baron JM, Mermel CH, Lewandrowski KB,etal. Detection of preanalytic laboratory testing errors using a statistically guided protocol[J]. Am J Clin Pathol, 2012, 138(3):406-413.
[12]Chima HS, Ramarajan V, Bhansali D. Is it necessary to repeat critical values in the laboratory? [J]. Lab medicine, 2009, 40(8): 453-457.
[13]Toll AD, Liu JM, Gulati G,etal. Does routine repeat testing of critical values offer any advantage over single testing? [J]. Arch Pathol Lab Med, 2011, 135(4): 440-444.
[14]Niu AJ, Yan XX, Wang L,etal. Utility and necessity of repeat testing of critical values in the clinical chemistry laboratory[J]. PLoS One, 2013, 8(11): e80663.
[15]Lehman CM, Howanitz PJ, Souers R,etal. Utility of repeat testing of critical values:a Q-probes analysis of 86 clinical laboratories[J]. Arch Pathol Lab Med, 2014,138(6):788-792.
[16]李云凤,张淑华,张海涛,等.应用CLSI 6-A文件评价血液学危急值项目线性范围[J].标记免疫分析与临床,2016,23(7):838-841.
[17]Deetz CO, Nolan DK, Scott MG. An examination of usefulness of repeat testing practices in a large hospital clinical chemistry laboratory[J]. Am J Pathol, 2012, 137: 20-25.
[18]Sumundic AM, Nikolac N, Ivankovic V,etal. Comparison of visual vs. automated detection of lipemic,icteric and hemolyzed specimens:can we rely on a human eye? [J].Clin Chem Lab Med, 2009, 47(11): 1361-1365.
[19]张葵.尿蛋白质定性与定量结果矛盾的解释及其引起的思考[J].临床检验杂志,2012,30(12):940-942.
(本文编辑:王海燕)
河北省卫计委指令性课题(1120140226)。
王华新,1967年生,男,主任技师,大学本科,主要从事临床实验室管理工作,E-mail:wanghuaxin004@163.com。
10.13602/j.cnki.jcls.2017.06.16
R446.1
A
2016-08-10)
