基因与环境交互作用对成人血脂水平影响的研究进展*
2017-07-07魏佳唐未名刘雁雁蒋理
魏佳,唐未名,刘雁雁,蒋理
(南京医科大学第一附属医院检验学部,南京 210029)
·综述·
基因与环境交互作用对成人血脂水平影响的研究进展*
魏佳,唐未名,刘雁雁,蒋理
(南京医科大学第一附属医院检验学部,南京 210029)
血脂异常(dyslipidemia)为动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)的独立危险因素。除生活方式等环境因素外,遗传也是决定血脂水平的重要因素。全基因组关联研究(genome wide association study,GWAS)报道的157个脂质代谢相关位点仅能解释约12%的血脂异常,高危环境因素可通过与基因交互作用致血脂水平改变。该文综述了血脂异常的遗传学研究进展,并探讨基因与环境交互作用对成人血脂水平的影响,为血脂异常的调控和治疗提供参考。
血脂异常;遗传危险评分;生活方式;单核苷酸多态性
血脂异常(dyslipidemia)指血清脂质代谢异常,包括总胆固醇(total cholesterol,TC)、三酰甘油(triglycerides,TG)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)水平升高及高密度脂蛋白胆固醇(high-density lipoprotein-cholesterol,HDL-C)水平降低。中国成人血脂水平快速增高并处于较高水平,以LDL-C或TC升高为特点的血脂异常是动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)的重要危险因素[1]。由于遗传背景和生活环境不同,个体血脂异常的危险程度也不同。本文通过阐述基因与环境交互作用对成人血脂水平的影响,为成人血脂调控和治疗提供参考。
1 血脂异常的遗传学研究
1.1 全基因组关联研究 家系研究表明,40%~60%血脂异常与遗传有关。1985年,Lehrman等[2]通过DNA测序首次发现LDLR基因突变可导致高胆固醇血症。2009年,唐新等[3]用连锁分析对家族性高三酰甘油血症的致病基因定位染色体。全基因组关联研究(genome wide association study,GWAS)和新一代高通量测序技术的应用为探索血脂异常的复杂性分子致病机制提供了更多线索。
2010年,Teslovich等[4]的GWAS报道了95个重要的脂质代谢相关位点,包括4个调脂治疗的靶基因:HMGCK(他汀类药物的靶基因),NPC1L1(依折麦布药物的靶基因),APOB(肝脏载脂蛋白ApoB 100合成抑制剂Mipormersen的靶基因),CETP(胆固醇酯转运蛋白抑制剂Anacetrapib、Dalcetrapib和Evacetrapib的靶基因)。2013年,一项基于5 000多个单核苷酸多态性(single nucleotide polymorphism,SNP)位点的基因芯片研究报道了62个脂质代谢相关新位点[5-6]。上述已知的157个位点(表1)不仅影响血脂水平,还能引起血糖、血压、体质指数(body mass index,BMI)等心血管疾病相关指标的改变。
但GWAS研究易产生假阳性和假阴性,且与疾病显著关联的SNP位点大多位于内含子、基因间区等非编码区域内,故阐明易感SNP位点的生物学功能有一定困难[7]。因此,将新一代基因组序列检测技术用于致病基因精确定位已成为后GWAS时代的主要研究内容之一。
1.2 脂质代谢相关基因 Strong等[8]通过GWAS分析发现,1号染色体短臂13区存在包括PSRC1、CELSR2、SORT1在内的大量基因与TC和LDL-C水平有关。Burkhardt等[9]通过小鼠模型研究发现,GWAS中的脂质相关基因与血浆TG水平、肝脂肪变性及冠状动脉疾病有关。如TRIB1在肝脏中过表达可抑制极低密度脂蛋白(very low density lipoprotein,VLDL)合成从而降低TG水平,发挥预防动脉粥样硬化的作用。当TRIB1基因缺失时,血浆TG和TC水平升高。
有GWAS发现[10],GALNT2基因变异与HDL-C和TG水平有关,其编码产物GalNAc转移酶在脂质代谢相关O-糖基化过程中起关键作用。小鼠实验研究表明,GALNT2在肝脏中的选择性表达能显著影响循环中HDL-C浓度[4]。
将血脂异常相关的危险等位基因总数乘以其效应量值得到的遗传危险评分(genetic risk score,GRS)可用于血脂异常的遗传易感性分级[11-13]。Amit等[14]利用GRS的五分位数对研究对象分组,发现GRS评分最高组新发血脂异常的相对危险度是最低组的1.91倍。
2 基因与环境的交互作用
研究指出,GWAS的157个脂质相关位点仅能解释约12%的脂质异常[4-6]。环境是导致血脂异常的另一个重要因素,主要包括高能量饮食、烟酒摄入、静态生活方式及运动等。相同遗传背景的人在高危环境中患血脂异常的风险可成倍增加,研究发现多数高危环境因素与基因交互作用实现了血脂水平的改变,且为一种叠加效应,见表2。
Cole等[15]报道,坚持健康的生活方式可降低约46%的血脂异常类疾病发病风险。个体间基因易感性的差异能导致个体对同一环境产生不同的应答。目前,研究人员通过GRS进行血脂异常的遗传危险性分级,而在每个遗传危险类别中,环境因素仍是影响最终血脂水平的重要因素。因此,研究基因与环境的交互作用对血脂水平的影响有助于更全面地阐明血脂异常的病因学机制。
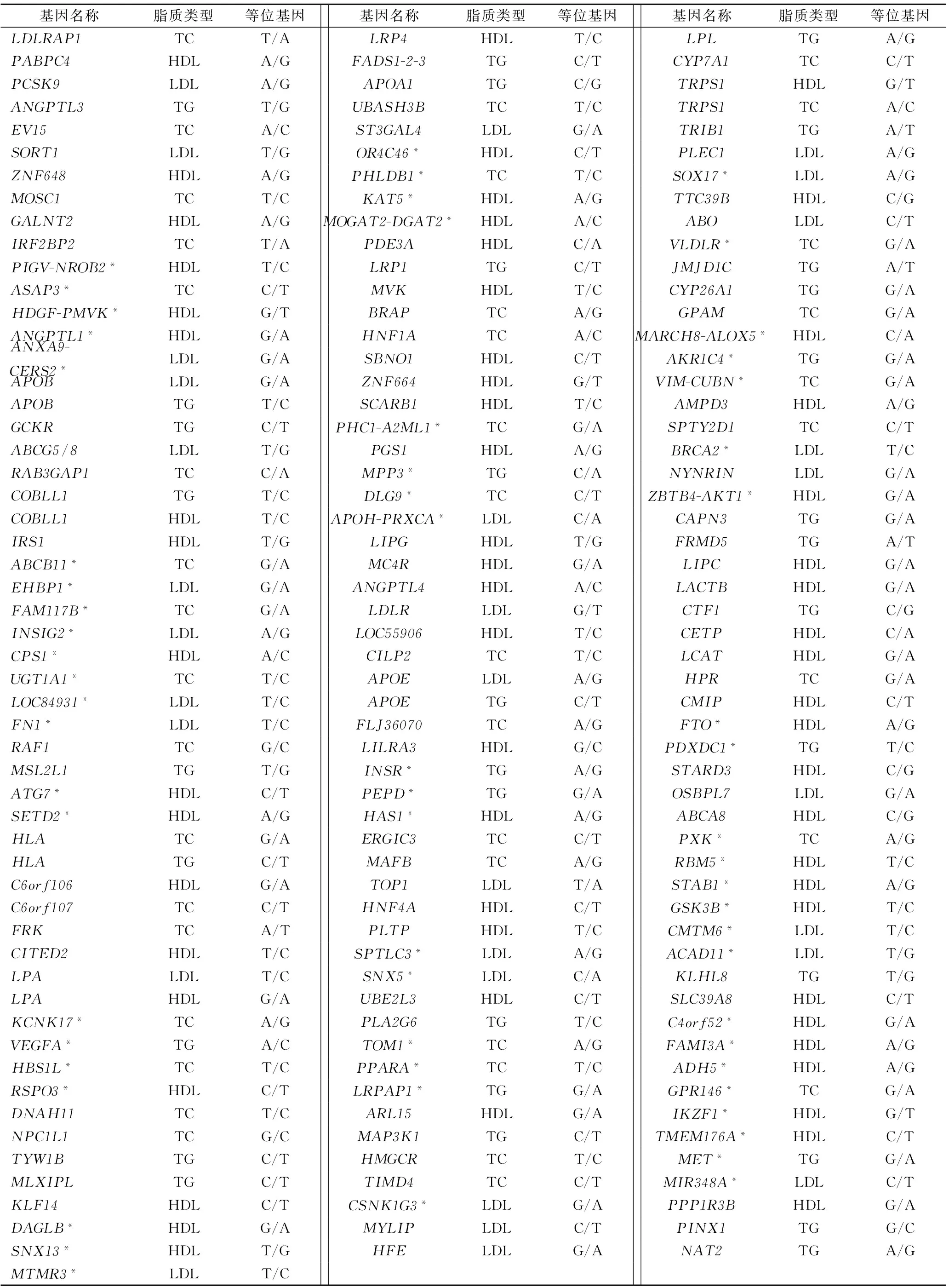
表1 157个脂质相关位点及其等位基因多态性[5-6]
注:*,2013年GWAS新发现的62个脂质相关位点。

表2 基因与环境交互作用对血脂水平影响的最新进展
注:ω-3 PUFA,ω-3多不饱和脂肪酸;ω-6 PUFA,ω-6多不饱和脂肪酸;Ω-3PUFA,Ω-3多不饱和脂肪酸;
2.1ALDH2基因与饮酒 乙醛脱氢酶-2(aldehyde dehydrogenase 2,ALDH2)是乙醇代谢通路的关键酶,在催化高毒性产物乙醛中起重要作用。位于其第12个外显子上rs671位点多态性,即鸟嘌呤(G)被腺嘌呤(A)所替换,第504位氨基酸由谷氨酸(Glu)突变为赖氨酸(Lys)(Glu504Lys)可显著影响其催化活性。研究表明,ALDH2 rs671为冠心病的遗传易感基因位点之一[16]。Tan等[17]对3 495例中国男性的GWAS结果分析TG水平关联性发现,饮酒与ALDH2(rs671位点)基因多态性的交互作用对TG水平具有双向影响。GG基因型者每日饮酒可致TG浓度平均升高20%,而AA/AG基因型者TG浓度可平均下降10%。
2.2FAD基因群与脂肪酸摄入 亚麻酸(linoleic acid,LA)和α-亚麻酸(ALA)经脂肪酸脱饱和酶(fatty acid desatuiases,FAD)代谢生成多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)。Lu等[18]发现,PUFA能够修饰一些脂质代谢相关基因,如FAD基因群,以致LDL-C、HDL-C、TG水平的改变,起到降脂作用。
一项纳入3 575例欧洲人群的研究[19]报道,PUFA的摄入可影响FADS1(rs174546)基因多态性。携带保护性C等位基因者若摄入较多的PUFA可导致HDL-C水平上升,而低PUFA饮食时,对HDL-C水平基本无影响(P=0.02)。马默尔饮食和肿瘤队列研究(Malmo diet and cancer cohort study,MDCS)发现,FADS1(rs174547)位点多态性和ω-3 PUFA摄入的交互作用可导致LDL-C水平的改变(P=0.01)。只有在ω-3 PUFA低水平摄入时保护性C-等位基因起降低LDL-C水平的作用[19],故TC基因型者高胆固醇血症的发病风险低于TT基因型者。
2.3ABCG5/G8基因与吸烟 ABCG5与ABCG8是依赖于ATP的跨膜转运蛋白ABC家族G亚家族的成员,其编码产物参与胆固醇吸收和胆汁排泄,抑制胆固醇聚积促进逆转运。ABCG5/G8突变可使人体对植物固醇等其他胆固醇吸收增加,引起谷固醇血症伴高胆固醇血症。
研究发现,ABCG5(rs6720173)和ABCG8(rs11887534、rs6709904、rs4148217)基因多态性与吸烟存在交互作用,可致血浆HDL-C水平改变[20]。研究发现,在吸烟人群中,ABCG5 rs6720173位点上基因型为CG/GG者血浆HDL-C浓度低于CC基因型者,ABCG8 rs4148217位点上基因型为CA/CC者HDL-C水平较低。而ABCG8(rs11887534、rs6709904)多态性在吸烟和非吸烟人群中对HDL-C水平的影响截然相反。吸烟人群中,rs11887534位点上基因型为CC/CG者HDL-C水平低于GG基因型者,而在非吸烟群体中结果相反。吸烟人群中,rs6709904位点上基因型为AG/GG者HDL-C水平较低,而在非吸烟群体中结果亦相反。有研究假设,吸烟可下调ABCG5/8基因表达水平,抑制胆固醇逆转运,最终导致HDL-C水平降低,但具体机制有待进一步研究。
2.4CDKN2A/B基因与能量摄入及运动 研究表明,CDKN2A/B基因与血脂异常、糖尿病、冠心病等心血管疾病的病程发展相关。Mehrane等[21]发现,CDKN2A/B基因rs10811661位点基因多态性与能量摄入及运动等环境因素具有相互叠加作用。青少年时期,人体脂肪组织中脂肪细胞的数量趋于恒定,且对胰岛素敏感性高[22],若其生成和凋亡的平衡打破,可致血清TG浓度明显改变[23]。研究表明,CDKN2A/B基因的表达可抑制前脂肪细胞转变为成熟的脂肪细胞[24]。Horswell等[25]发现,CDKN2A/B基因敲除小鼠的脂肪细胞增殖水平升高,表明该基因在脂肪细胞增殖中起关键作用,其突变可导致高甘油三酯血症的快速发展。
因TT基因型者血脂异常的发病风险高,故研究人员以低能量饮食和具有高频运动习惯的CC/CT基因型者作为对照组,分别研究rs10811661位点基因多态性与能量摄入和运动间的交互作用对血脂水平的影响。研究发现,在高能量饮食人群中,TT基因型者高胆固醇血症的发病率比对照人群高约2倍,CC/CT基因型者比对照人群高1.5倍[21]。研究指出,危险性TT基因型与血清胆固醇水平有关(P=0.008),而在对照人群中则无,上述叠加效应可能与CDKN2A/B基因INK4位点上反义非编码RNA(antisense noncoding RNA in the INK4 locus,ANRIL)的表观遗传学机制有关[19]。研究曾报道,包括脂肪、总能量摄入以及蛋白质和叶酸摄入在内的饮食等生活方式可通过表观遗传调节一定程度上改变基因表达水平[26]。
3 结语
目前,中国人群血脂水平日趋增高,ASCVD发病率明显增加。国内调查研究发现,90%以上的实验室均采用单一的血脂参考区间,忽略了血脂指南危险分层对个体化治疗的指导,难以满足临床治疗需求[27]。近年GWAS报道了157个脂质相关位点,通过新一代基因测序可根据危险基因数目及其效应值得出GRS进行个体化的遗传易感性分级。但上述位点变异仅能解释约12%的血脂异常,除遗传外环境因素与血脂密切相关,其可通过与基因交互作用导致血脂水平的明显改变。危险性基因型者在高危环境中,除HDL-C降低外其余血脂指标皆可出现增长甚至成倍上升,而携带保护性等位基因者血脂水平大多无变化。
但相关研究也面临着一系列挑战[28],主要为缺乏重复性研究、样本量小、测评环境因素的方法学的精确度有待提高以及如何评价其临床效果等。由于遗传易感性以及环境因素的差异,国外的研究结果不可直接应用于我国人群,但也为制定我国成人血脂异常的治疗策略提供了参考,例如计算GRS进行个体化的遗传危险性分级、通过伴随检测早期规避相应的高危环境因素等。
[1]中国成人血脂异常防治指南制订联合委员会.中国成人血脂异常防治指南(2016年修订版)[J].中华心血管病杂志,2016,44(10):833-853.
[2]Lehrman MA, Schneider WJ, Südhof TC,etal. Mutation in LDL receptor: Alu-Alu recombination deletes exons encoding transmembrane and cytoplasmic domains[J]. Science, 1985, 227(4683): 140-146.
[3]唐新,林婴,刘兵,等.家族性高甘油三酯血症家系的候选基因位点连锁分析[J].中华医学遗传学杂志,2009,26(5):499-503.
[4]Teslovich TM, Musunuru K, Smith AV,etal. Biological, clinical and population relevance of 95 loci for blood lipids[J]. Nature, 2010, 466(7307): 707-713.
[5]Asselbergs FW, Guo Y, van Iperen EP,etal. Large-scale gene-centric meta-analysis across 32 studies identifies multiple lipid loci[J]. Am J Hum Genet, 2012, 91(5):823-838.
[6]Willer CJ, Schmidt EM, Sengupta S,etal. Discovery and refinement of loci associated with lipid levels[J]. Nat Genet, 2013,45(11):1274-1283.
[7]宋庆峰,张红星,马亦龙,等.复杂疾病的遗传易感基因区域的精细定位[J].遗传,2014,36(1):2-10.
[8]Strong A, Ding Q, Edmondson AC,etal. Hepatic sortilin regulates both apolipoprotein B secretion and LDL catabolism[J]. Clin Invest, 2012, 122(8): 2807-2816.
[9]Burkhardt R, Toh SA, Lagor WR,etal. Trib1 is a lipid- and myocardial infarction-associated gene that regulates hepatic lipogenesis and VLDL production in mice[J].Clin Invest, 2010, 120(12): 4410-4414.
[10]Schjoldager KT, Vester-Christensen MB, Bennett EP,etal. O-glycosylation modulates proproteinconvertase activation of angiopoietin-like protein 3: possible role of polypeptide GalNAc-transferase-2 in regulation of concentrations of plasma lipids[J].Biol Chem, 2010, 285(47): 36293-36303.
[11]Ripatti S, Tikkanen E, Orho-Melander M,etal. A multilocus genetic risk score for coronary heart disease: case-control and prospective cohort analyses[J]. Lancet, 2010, 376(9750): 1393-1400.
[12]Ganna A, Magnusson PK, Pedersen NL,etal. Multilocus genetic risk scores for coronary heart disease prediction[J]. Arterioscler Thromb Vasc Biol, 2013, 33(9): 2267-2272.
[13]Tada H, Melander O, Louie JZ,etal. Risk prediction by genetic risk scores for coronary heart disease is independent of self-reported family history[J]. Eur Heart, 2016, 37(6): 561-567.
[14]Khera AV, Emdin CA, Drake I,etal. Genetic risk, adherence to a healthy lifestyle, and coronary disease[J]. N Engl J Med, 2016, 375(24): 2349-2358.
[15]Cole CB, Nikpay M, Lau P,etal. Adiposity significantly modifies genetic risk for dyslipidemia[J]. Lipid Res, 2014, 55(11): 2416-2422.
[16]潘畅,徐峰,袁秋环,等.乙醛脱氢酶2与心脑血管疾病研究进展[J].中华心血管病杂志,2016,44(2):175-178.
[17]Tan A, Sun J, Xia N,etal. A genome-wide association and gene-environment interaction study for serum triglycerides levels in a healthy Chinese male population[J]. Hum Mol Genet, 2012, 21(7): 1658-1664.
[18]Lu Y, Feskens EJ, Dollé ME,etal. Dietary n-3 and n-6 polyunsaturated fatty acid intake interacts with FADS1 genetic variation to affect total and HDL-cholesterol concentrations in the Doetinchem Cohort Study[J]. Clin Nutr, 2010, 92(1): 258-265.
[19]Congrains A, Kamide K, Ohishi M,etal. ANRIL: molecular mechanisms and implications in human health[J]. MolSci, 2013, 14(1): 1278-1292.
[20]Joseph PG, Pare G, Anand SS. Exploring gene-environment relationships in cardiovascular disease[J]. Cardiol, 2013, 29(1): 37-45.
[21]Mehramiz M, Ghasemi,F, Esmaily H,etal. Interaction between a variant of CDKN2A/B-gene with lifestyle factors in determining dyslipidemia and estimated cardiovascular risk: A step toward personalized nutrition[J]. Clin Nutri, 2016. [Epub ahead of print]
[22]Heinonen S, Saarinen L, Naukkarinen J,etal. Adipocyte morphology and implications for metabolic derangements in acquired obesity[J]. Obes, 2014, 38(11): 1423-1431.
[23]Burgio E, Lopomo A, Migliore L. Obesity and diabetes: from genetics to epigenetics[J]. MolBiol Rep, 2015, 42(4): 799-818.
[24]Park BO, Ahrends R, Teruel MN. Consecutive positive feedback loops create a bistable switch that controls preadipocyte-to-adipocyte conversion[J]. Cell Rep, 2012, 2(4): 976-990.
[25]Horswell SD, Fryer LG, Hutchison CE,etal. CDKN2B expression in adipose tissue of familial combined hyperlipidaemia patients[J].Lipid Res, 2013, 54(12): 3491-3505.
[26]Milagro FI, Mansego ML, De Miguel C,etal. Dietary factors, epigenetic modifications and obesity outcomes: progresses and perspectives[J]. Mol Aspects Med, 2013, 34(4):782-812.
[27]王薇,钟堃,何法霖,等.我国血脂7项检测指标参考区间来源调查[J].临床检验杂志,2016,34(1):70-72.
[28]Keller MC. Gene×environment interaction studies have not properly controlled for potential confounders: the problem and the (simple) solution[J]. Biol Psychiatry, 2014, 75(1): 18-24.
(本文编辑:王海燕)
苏州市科技发展应用基础研究(SYSD2014048)。
魏佳,1994年生,女,本科在读。
蒋理,主任技师,E-mail:joy232295@163.com。
10.13602/j.cnki.jcls.2017.06.15
R446.1
A
2017-02-24)
