耐力运动训练上调小鼠脑组织IL-15介导衰老伴随的凋亡相关途径的神经保护作用
2017-07-07薛晶晶
薛晶晶,胥 振,姜 宁,张 勇
●成果报告 OriginalArticles
耐力运动训练上调小鼠脑组织IL-15介导衰老伴随的凋亡相关途径的神经保护作用
薛晶晶1,2,3,胥 振2,3,姜 宁2,3,张 勇2,3
目的:观察耐力运动训练对不同年龄小鼠脑组织IL-15含量及凋亡的影响,探讨耐力运动诱导的IL-15与衰老脑组织细胞中凋亡发生的关系,进而探讨IL-15可能发挥的神经保护作用。方法:60只C57BL/6雄性小鼠按月龄分为2月龄青年对照组(YC,n=15),2月龄青年耐力运动训练组(YE,n=15),12月龄老年对照组(OC,n=15)和12月龄老年耐力运动训练组(OE,n=15)。耐力运动训练组进行12m/min,30min/d,每周5天,为期8周的跑台运动训练。训练完毕采用ELISA法测量脑组织、骨骼肌组织和血清中IL-15含量的变化;RT-PCR法测量脑组织IL-15 mRNA、凋亡相关蛋白BAX、p53、BCL-2和BCL-XLmRNA的表达情况;TUNEL法检测脑组织细胞凋亡发生情况。结果:(1)OC组脑组织、骨骼肌组织和血清IL-15含量较YC组均呈显著上升;YE和OE组脑组织、骨骼肌组织和血清IL-15含量分别较YC和OC组均呈显著性增加;(2)OC组脑细胞促凋亡蛋白BAX mRNA、p53mRNA表达,抑凋亡蛋白BCL-2mRNA、BCL-XLmRNA表达和凋亡指数较YC组均呈显著性增高,OE组促凋亡蛋白BAXmRNA、p53mRNA的表达和凋亡细胞指数均较OC组降低,抑凋亡蛋白BCL-2mRNA、BCL-XLmRNA表达较OC组增高;(3)OC组脑组织IL-15mRNA较YC组呈显著上升;OE组脑组织IL-15mRNA较OC组未呈显著性改变。结论:8周耐力运动训练可诱导脑组织IL-15含量的升高,耐力运动训练诱导的衰老小鼠脑组织IL-15升高可能介导了衰老伴随的神经细胞凋亡相关过程发挥一定神经保护作用。
IL-15;耐力运动训练;脑;增龄;凋亡
在神经退行性变和老龄化过程中,凋亡发生程度与神经元的丢失呈密切正相关,即当凋亡发生程度较高时,神经元丢失现象较严重,且不同神经退行性变中均存在较高程度的脑细胞凋亡[1]。
有研究表明,白介素-15(IL-15)在脑中可调节星形细胞,小神经胶质细胞的功能,可以在神经性疾病早期阶段调节T细胞和巨噬细胞的激活来调节相关免疫反应[2-4]。它还具有抗凋亡和神经保护作用,其参与阻止了TNF-α介导的凋亡的发生与发展,IL-15受体α(IL-15Rα)可通过招募TRAF2抑制TNFR介导的凋亡[5-6],此外,它还可抑制脑内一氧化氮的产生[7]。以上研究提示,IL-15可能通过调控凋亡相关的生物学功能影响神经系统。运动对脑具有神经保护作用,它使脑血流量增加,促进神经的发生,调控脑内神经营养因子的表达以及增强神经突触可塑性等[8-10]。还有研究表明,运动训练可以有效地抑制脑细胞凋亡的发生[11]。然而,运动训练对于脑组织IL-15的影响鲜有报道。虽然IL-15可以在中枢神经系统中发挥一定作用,但是,运动能否通过上调脑组织IL-15发挥何种神经保护作用尚不清楚。因此,本研究通过耐力运动训练干预不同年龄小鼠,观察耐力运动训练对衰老脑组织IL-15含量及其细胞凋亡的影响,试探讨耐力运动训练诱导的IL-15在衰老脑组织细胞凋亡中的作用及其可能机制。
1 实验对象及方法
1.1 实验对象
雄性C57BL/6小鼠60只,购置于北京华阜康生物科技股份有限公司,许可证号SCXK(京)2009-0007,SPF级。实验动物按月龄分为4组:2月龄青年对照组(YC,n=15),2月龄青年耐力运动训练组(YE,n=15),12月龄老年对照组(OC,n=15),12月龄老年耐力运动训练组(OE,n=15)。12月龄老年小鼠为2月龄小鼠自然饲养至12月龄,且当2月龄小鼠将达到12月龄时再次购买2月龄青年对照小鼠。所有动物分笼饲养,自然光照,自然饮水进食,环境温度20~25℃。YC和OC组分别饲养8周,YE和OE组分别进行为期8周的耐力运动训练。
1.2 动物运动训练模型
跑台训练模型:首先进行2天适应性跑台训练,使动物熟悉跑台环境和训练过程,跑台训练强度5m/m in,时长10m in;正式训练时每天上午进行中高等强度跑台训练,强度12m/m in,时长30m in/d,每周5天,连续8周。
1.3 动物处死及取材
运动训练组末次运动结束24小时后进行取材,分别取小鼠血液、骨骼肌组织和脑组织。首先,采用摘眼球法取血,离心20 m in(3 000 r/m in),保持温度0~4℃,仔细收集上清;断脊髓法将小鼠处死,取小鼠腓肠肌,称取100mg,加入PBS手工匀浆,离心20m in(3 000 r/m in),保持温度0~4℃,仔细收集上清;最后,开颅取全脑组织,参照小鼠大脑立体定位图谱分离出双侧中脑部位并称取重量,平均分为两部分。一部分加入PBS手工匀浆,离心20m in(3 000 r/m in),保持温度0~4℃,仔细收集上清,分装后待进行ELISA检测。另一部分置于已标好号的EP管之中,于液氮中冷冻,待冷冻完全后,-80°冰箱保存,用于RT-PCR表达测定。
石蜡切片样本制作:取小鼠用4%多聚甲醛0.1mmoL磷酸缓冲液(pH7.4)灌注固定。提取的脑组织保存在4%多聚甲醛0.1 mmoL磷酸缓冲液中4℃冰箱过夜,第2天转移至30%蔗糖脱水,之后进行常规脱水、透明、石蜡包埋,用于TUNEL细胞凋亡检测。
1.4 ELISA
采用小鼠IL-15定量酶联检测试剂盒(ELISA Kit forMouse IL-15),严格按照说明书方法于酶标仪上测定各组小鼠脑组织、骨骼肌组织及血清中IL-15的含量。根据标准IL-15浓度曲线,计算出检测样品中IL-15的含量(pg/m L)。
1.5 RT-PCR
取脑组织,加入trizol匀浆提取RNA。采用逆转录试剂盒(TAKARA.Co)进行逆转录反应。按照TAKARA试剂盒进行RT-PCR反应,RT-PCR反应使用ABIStep One Real-time PCR System(ABICo,USA)进行。以GAPDH为内参,目的基因的相对表达量Fold Change=2-Δ(ΔCttarget-ΔCtcontrol)。
根据RT-PCR试剂盒说明,进行如下操作:加入10μL SYBRGreen PCRMasterM ix,2μL cDNA,上下游引物各0.4μL,0.4μLROX Reference Dye,补充ddH2O至20μL。按照RT-PCR扩增循环参数进行反应:预变性95℃,30 s;PCR反应95℃,5 s;60℃,30~34 s,40个循环;分解阶段95℃,15 s;60℃,1m in(各基因引物序列见表1)。

表1 各基因引物序列Table1 Primer Sequence ofGene
1.6 TUNEL法检测脑组织细胞凋亡情况
采用DNA断裂的原位末端标记法(TUNEL法)对各组小鼠脑组织(中脑纹状体部位)的凋亡细胞进行检测。石蜡切片进行脱蜡后,PBS洗涤2次,样品上加50μL TUNEL检测液,37℃避光孵育60m in,PBS洗涤3次,用抗荧光淬灭封片液封片后采用类流式细胞仪Histo quest可见光分析系统在20倍物镜下观察统计TUNEL阳性细胞数目(绿色荧光细胞)与总细胞数目,TUNEL指数=阳性细胞数目/细胞总数目。
1.7 数据统计与分析
所有试验结果采取平均值±标准差(M±SD)表示,采用SPSS17.0统计软件进行数据分析,显著性差异检验采用双因素方差分析,P<0.05表示具有统计学意义。
2 实验结果
2.1 脑组织、骨骼肌组织、血清IL-15含量变化
2.1.1 脑组织IL-15含量变化 与YC组相比,YE组脑组织IL-15含量显著性增加(P<0.01);与YC组相比,OC组脑组织IL-15含量显著性增加(P<0.01),与OC组相比,OE组脑组织IL-15含量显著性增加(P<0.01)(见图1)。

图1 脑组织IL-15含量变化Figure1 IL-15 Contentof Brain Tissue注:**表示P<0.01(下同)。
2.1.2 骨骼肌组织IL-15含量变化 与YC组相比,YE组骨骼肌组织IL-15含量显著性增加(P<0.01);与YC组相比,OC组骨骼肌组织IL-15含量显著性增加(P<0.01);与OC组相比,OE组骨骼肌组织IL-15含量显著性增加(P<0.01)(见图2)。

图2 骨骼肌组织IL-15含量变化Figure2 IL-15 ContentofMuscle Tissue
2.1.3 血清IL-15含量变化 与YC组相比,YE组血清IL-15含量显著性增加(P<0.01);与YC组相比,OC组血清IL-15含量显著性增加(P<0.01);与OC组相比,OE组血清IL-15含量显著性增加(P<0.01)(见图3)。
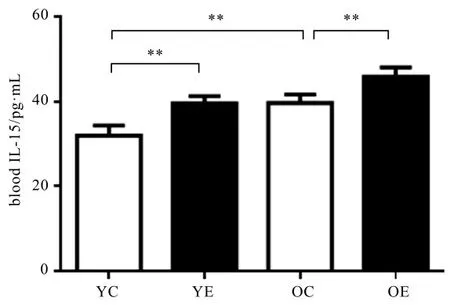
图3 血清IL-15含量变化Figure3 IL-15 Contentof Serum
2.2 脑组织IL-15m RNA表达
与YC组相比,YE组脑组织IL-15mRNA表达显著性增加(P<0.05);与YC组相比,OC组脑组织IL-15mRNA表达显著性增加(P<0.01);与OC组相比,OE组脑组织IL-15mRNA表达未呈显著性改变(P>0.05)(见图4)。

图4 脑组织IL-15 m RNA表达Figure4 IL-15m RNA Exp ression o f Brain Tissue
2.3 脑组织凋亡相关蛋白m RNA表达
2.3.1 促凋亡蛋白BAX mRNA表达 与YC组相比,YE组BAXmRNA表达未呈显著性变化(P>0.05);与YC组相比,OC组BAX mRNA显著性增加(P<0.01);与OC组相比,OE组BAXmRNA表达显著性降低(P<0.05)(见图5)。

图5 各组小鼠促凋亡相关蛋白BAXmRNA表达Figure5 m RNA Exp ression o f Pro-apoptosis Protein BAX
2.3.2 促凋亡蛋白p53mRNA表达 与YC组相比,YE组p53 mRNA表达显著性增加(P<0.05);与YC组相比,OC组p53 mRNA表达显著性增加(P<0.01);与OC组相比,OE组p53 mRNA表达显著性降低(P<0.05)(见图6)。

图6 各组小鼠促凋亡相关蛋白p53m RNA表达Figure6 mRNA Expression of Pro-apop tosis Protein p53
2.3.3 抑凋亡蛋白BCL-2mRNA表达 与YC组相比,YE组BCL-2mRNA表达显著性增加(P<0.01);与YC组相比,OC组BCL-2mRNA表达显著性增加(P<0.01);与OC组相比,OE组BCL-2mRNA表达显著性增加(P<0.01)(见图7)。

图7 各组小鼠抑凋亡相关蛋白BCL-2 mRNA表达Figure7 m RNA Exp ression o f Anti-apop tosis Protein BCL-2
2.3.4 抑凋亡蛋白BCL-XLmRNA表达 与YC组相比,YE组BCL-XLmRNA表达未呈显著性变化(P>0.05);与YC组相比,OC组BCL-XLmRNA表达显著性增加(P<0.01);与OC组相比,OE组BCL-XLmRNA表达显著性增加(P<0.01)(见图8)。

图8 各组小鼠抑凋亡相关蛋白BCL-XLmRNA表达Figure8 m RNA Exp ression o f Anti-apop tosis Protein BCL-XL
2.4 脑组织细胞凋亡指数
与YC组相比,YE组凋亡细胞指数未呈显著性变化(P>0.05);与YC组相比,OC组凋亡细胞指数显著性升高(P<0.01);与OC组相比,OE组凋亡细胞指数显著性降低(P<0.01)(见图9、图10)。

图9 脑组织细胞凋亡Figure9 the Apoptosis of Brain Cell

图10 各组脑组织细胞凋亡指数Figure10 the Apop tosis Index of Brain Ce ll
3 讨论
3.1 耐力运动训练对小鼠脑组织、骨骼肌组织和血清IL-15含量的影响
本研究中无论是2月龄青年小鼠还是12月龄老年小鼠,选取12m/m in的中高等强度进行训练,尽管摄氧量可能由于年龄因素导致具有一定差异性,但据FERNANDO等[12]根据不同年龄小鼠在不同强度跑台训练下摄氧量的变化研究发现,跑台训练强度和摄氧量之间存在线性相关,根据其线性相关公式可知,本研究中的训练强度和模式属于有氧耐力训练。本研究发现,8周耐力运动训练后,青年与老年小鼠脑组织IL-15含量均呈显著提高。但RT-PCR结果显示耐力训练仅上调了青年小鼠脑组织IL-15mRNA表达,而对老年小鼠脑组织IL-15mRNA表达无明显干预效果。JUSTIN等[13]发现,小鼠经过16m/m in持续1 h的10°上坡急性跑后发现,缺乏β1和β2亚单位的AMPK DMKO小鼠骨骼肌IL-15及IL-15mRNA较野生小鼠均有显著降低;他们后续研究报道,野生型小鼠30min上坡跑后3 h,骨骼肌IL-15 mRNA表达较运动前显著增加,而AMPK DMKO小鼠则无明显变化。他们的系列研究提示运动调控IL-15及IL-15mRNA的表达可能与AMPK通路有关。研究表明,规律运动可上调小鼠脑组织AMPK蛋白表达及其磷酸化水平[13]。因此,根据以上相关研究我们推测本研究中耐力运动上调青年小鼠脑组织IL-15 mRNA表达可能与AMPK通路相关。此外,研究发现衰老可导致脑组织AMPK信号通路活化反应水平较弱,导致其不能有效的应对内外环境(如年龄和运动应激)的改变[13]。我们推测,本研究中运动未改变衰老脑组织IL-15mRNA表达可能由于衰老脑组织AMPK基础活化水平较低,或因本研究采用的运动强度或训练时程不足,或是耐力运动训练未能引起衰老脑组织本体表达IL-15。
近年来,研究者逐渐认识到骨骼肌不仅是收缩器官,还可通过释放一系列肌肉因子(myokines)调控肌外组织功能。IL-15是一种重要的myokines,目前研究证明其从骨骼肌释放并参与调控机体脂肪代谢[14]。有研究报道,小鼠在经过数周跑台运动后,骨骼肌IL-15含量和IL-15mRNA水平呈显著增多[15-16]。ANDERS等[17]经过人体试验也同样证实12周自行车运动后,试验对象骨骼肌IL-15水平增加40%,然而3 h急性运动后并没有发现骨骼肌IL-15发生显著性变化,他们推测这可能验证了动物实验中长时间规律运动对IL-15的诱导刺激作用。本研究中,无论是青年还是衰老小鼠,8周耐力训练显著提高了骨骼肌、血清和脑组织IL-15含量。系列研究表明,IL-15被证明可以通过血脑屏障进入脑组织[18-20]。因而我们推测,耐力运动上调脑组织IL-15含量可能是运动上调了骨骼肌IL-15含量,IL-15流通入血进入脑组织导致的。因此表现为骨骼肌组织、血清和脑组织IL-15均有升高,这也解释了运动提高衰老脑组织IL-15含量却未上调IL-15mRNA表达的结果。当然,这也可能是耐力运动训练诱导其他组织IL-15含量升高通过血液循环流通入脑导致的,因此,本研究中耐力运动上调脑组织IL-15含量可能是运动上调了骨骼肌IL-15含量的推论需要同位素标记等实验加以验证。
3.2 耐力运动训练诱导的IL-15与衰老伴随的小鼠脑组织凋亡的关系
本研究发现,较青年小鼠脑组织凋亡相比,衰老小鼠脑组织凋亡发生呈显著提高,且脑组织、骨骼肌组织和血清IL-15含量也同时表现出显著升高。研究表明,凋亡在调节细胞生长、修复和死亡过程中发挥了重要作用,而当凋亡发生过多时会导致功能的失常或疾病的发生[21]。本研究中的衰老小鼠脑组织凋亡发生较青年小鼠凋亡发生明显增多,可见,衰老发生中伴随凋亡发生的增多。
INOUE等[22]研究发现,在老龄化和病态机体内,IL-15可以抑制凋亡的发生,降低免疫低下的发生率,增强细胞的生存能力等。EM IDIO等[23]研究表明,小鼠在导致骨骼肌萎缩症的老龄化状态和肌肉悬挂时,IL-15出现了显著升高,认为IL-15很可能是在压力应激条件下,诸如老龄化或者疾病等状态下才发挥其生物学功能。本研究推测衰老小鼠脑组织、骨骼肌组织和血清IL-15均表现一定程度的升高可能是由于抑制凋亡,增强细胞活性的代偿性反应所致。8周的耐力运动训练干预后,衰老小鼠脑组织促凋亡基因BAX和p53的表达显著下降,抑凋亡基因BCL-2和BCL-XL表达显著增加,脑组织细胞凋亡指数降低。这提示,耐力运动训练可抑制衰老脑组织细胞凋亡的发生。LEE等[24]人发现,运动训练可抑制小鼠脑组织的凋亡的发生,其中促凋亡蛋白BAX、Caspase3、Caspase 7和Caspase 9蛋白表达显著降低,抑凋亡蛋白BCL-2、HSP27和HSP110等蛋白表达显著上升,运动训练组较安静组脑组织凋亡细胞数目显著减少。ABOUTALEB等[25]研究表明,大鼠在脑局部缺血症前经过4周跑台预运动训练可以通过调节BAX和BCL-2蛋白比例以及抑制caspase3的活性抑制脑组织海马C3A区细胞凋亡的发生。我们的研究与以上研究结果是相似的,此外,我们还发现8周的耐力运动训练干预后,衰老小鼠脑组织细胞凋亡发生降低的同时,脑组织IL-15含量显著提高,这提示,耐力运动训练上调的IL-15可能参与了耐力运动训练抑制凋亡的相关过程。QUINN等[26]研究报道,IL-15过表达小鼠骨骼肌PPAR,SIRT1,PGC-1α,和PGC-1β表达显著升高,其中SIRT1可通过p53,Foxo,PGC-1α等调控细胞的生长、分化、自噬和凋亡等功能。其中,IL-15可诱导PGC-1α的表达,PGC-1α的表达可提高线粒体质量,抑制线粒体氧化应激的发生,从而抑制线粒体凋亡通路[27],这是IL-15抑制凋亡的可能机制之一。也有研究发现,IL-15的抗凋亡作用很可能是通过TNF-α通路进行调节的。IL-15可以下调TNFR-1,从而抑制caspase系列蛋白(caspase3,caspase9)的表达而抑制凋亡的发生[28]。另外,有研究证实p53为调控自噬和凋亡的共同信号分子,p53适当激活诱导自噬的发生,而p53过量表达时可激活诱导凋亡[29]。研究表明,运动可通过上调脑组织细胞自噬[30],清除损伤细胞器,从而实现神经保护效应[31]。综合本研究中结果和相关研究提示,耐力运动训练诱导的IL-15可能通过抑制p53过度活化,诱导细胞凋亡向细胞自噬转换,从而表现为促凋亡基因BAX表达的减少,抑凋亡基因BCL-2和BCL-XL表达的增加,凋亡指数的减少,进而发挥其神经保护作用。后期研究中我们将进一步监测SIRT1,PGC-1α等系列因子的变化以探讨运动诱导的IL-15对凋亡影响的机制及细胞自噬在此模型中的生物效应。
4 结论
(1)耐力运动训练可提高脑组织IL-15含量,其来源可能是骨骼肌源性的,此推论仍需进一步验证。
(2)耐力运动训练提高的脑组织IL-15可能通过调节衰老小鼠脑组织细胞凋亡发生相关过程,即抑制促凋亡基因BAX和p53的表达,促进抑凋亡基因BCL-2和BCL-XL的表达,减少脑组织细胞凋亡指数,进而发挥神经保护作用。
[1]MARTINDD,LONGERGAN PE,BOLAND B,etal.Apoptotic Chang⁃es in the aged brain are triggered by Interleukin-1-induced Activation of p38 and reversed by treatment with Eicosapentaenoic Acid[J].The journalofbiological chemistry,2002,277(37):239-246.
[2]LEE Y B,SATOH J,WALKER D G,et al.Interleukin-15 gene expres⁃sion in human astrocytes andmicroglia in culture[J].Neuroreport,1996,7(5):1062-1065.
[3]HANISCH U K,LYONSSA,PRINZM,etal.Mouse brainmicroglia ex⁃press interleukin-15 and itsmultimeric receptor complex functionally coupled to Janus kinase activity[J].Journal of Biological Chemistry,1997,272(46):53-60.
[4]SATOH J,KUROHARA K,YUKITAKE M,et al.Interleukin-15,a T-cell growth factor,isexpressed in human neural cell lines and tissues[J]. Journalof the Neurological Sciences,1998,155(2):7.
[5]HIROMATSU T,YAJIMA T,MATSUGUCHIT,etal.Overexpression of interleukin-15 protects against Escherichia coli-induced shock accom⁃panied by inhibition of tumor necrosis factor-alpha-induced apoptosis [J].Journalof InfectiousDiseases,2003,187(9):1442-1445.
[6]BULFONE PS,BULANOVA E,POHL T,etal.Death deflected:IL-15 inhibits TNF-alpha-mediated apoptosis in fibroblasts by TRAF2 re⁃cruitment to the IL-15Ralpha chain[J].FASEB Journal,1999,13(12):1575-1585.
[7]BUDAGIAN V,BULANOVA E,PAUSR,et al.IL-15/IL-15 receptor biology:a guided tour through an expanding universe[J].Cytokine and Growth Factor Reviews,2006,17(4):259-280.
[8]PEREIRA AC,HUDDLESTONDE,BRICKMANA L,etal.An in vivo correlate of exercise-induced neurogenesis in the adult dentate gyrus[J]. Proceedingsof the National Academy of Sciences of the United States of America,2007,14(13):5638-5643.
[9]MAKIPM,RESNICK SM.Effectsofestrogen on patternsofbrain activ⁃ity at restand during cognitive activity:a review ofneuroimaging studies [J].Neuroimage,2001,14(4):789-801.
[10]LECKIE R L,OBERLIN L E,VOSSMW,et al.BDNFmediates im⁃provements in executive function following a 1-year exercise interven⁃tion[J].Frontiers in human neuroscience,2014,8(2):985.
[11]TENDIE A,CUNSOLOR,BELLIA D,etal.Drug target identification for neuronal apoptosis through a genomescale screening[J].Currentme⁃dicinal chemistry,2010,17(26):2906-2920.
[12]FERNANDO P,BONEN A,HOFFMAN G L.Predicting submaximal oxygen consumption during treadmill running in mice[J].Can JPhysiol Pharmacol,1993,71,854-857.
[13]JUSTIN D C,MACNEIL L G,JAMESS L,et al.Exercise-stimulated interleukin-15 is controlled by AMPK and regulates skinmetabolism and aging[J].Aging Cell,2015,14(4):625-634.
[14]DAVIDEG,PRAAGH V.Exercise-mimetic AICAR transiently bene⁃fitsbrain function[J].Oncotarget,2015,6(21):18293-18312.
[15]REZNICK R M,ZONG H,LIJ,et al.Aging-associated reductions in AMP-activated protein kinase activity andmitochondrialbiogenesis[J]. CellMetabolism,2007,5(2):151-156.
[16]YANG H,CHANG J,CHENW,et al.Treadmill exercise promotes in⁃terleukin 15 expression in skeletalmuscle and interleukin 15 receptor alpha expression in adipose tissue of high-fat diet rats[J].Endocrine,2013,43(3):579-85.
[17]BOSTROM P,WU J,JEDRYCHOWSKIM P,etal.A PGC1-alpha-de⁃pendentmyokine that drives brown-fat-like development ofwhite fat and thermogenesis[J].Nature,2012,481(7382):463-8.
[18]RINNOV A,YFANTIC,NIELSENS,etal.Endurance trainingenhanc⁃es skeletal muscle interleukin-15 in human male subjects[J].Endo⁃crine,2014,45(2):271-8.
[19]PANW H,HSUCHOUH,YUC,etal.Permeation ofblood-borne IL-15 across the blood–brain barrier and the effect of LPS[J].Journal of Neurochemistry,2008,106(1):313-319.
[20]PANW H,WU X J,HE Y,etal.Brain interleukin-15 in neuroinflam⁃mation and behavior[J].Neuroscience and Biobehavioral Reviews,2013,37(2):184-192.
[21]ZHANG Y,HENMAN B.Ageing and apoptosis[J].Mechanisms ofAge⁃ingand Development,2002,123(4):245-260.
[22]INOUE S,UNSINGER J,DAVISCG,et al.IL-15 prevents apoptosis,reverses innate and adaptive immune dysfunction,and improves surviv⁃al in sepsis[J].JImmunol,2010,184:1401-1409.
[23]PISTLLIE E,SIU PM.,ALWAY SE,et al.Interleukin-15 responses toagingand unloading-induced skeletalmuscle atrophy[J].Am JPhysi⁃olCell Physiol,2007,292:1298-1304.
[24]LEE J,CHOB JY,OHC SD,et al.Maternal exercise reduces hyper⁃thermia-induced apoptosis in developingmouse brain[J].International JournalofHyperthermia,2011,27(5):445-52.
[25]ABOUTALEB N,SHAMSAEIN,KHAKSARIM,et al.Pre-ischemic exercise reduces apoptosis in hippocampal CA3 cells after cerebral ischemia bymodulation of the Bax/Bcl-2 proteins ratio and prevention of caspase-3 activation[J].JPhysiol Sci,2015,65(5):435-43.
[26]QUINN L S,ANDERSON BG,CONNER JD,etal.IL-15 overexpres⁃sion promotes endurance,oxidative energy metabolism,and muscle PPAR delta,SIRT1,PGC-1alpha,and PGC-1beta expression in male mice[J].Endocrinology,2013,154(1):232-45.
[27]QUINN LS,BARBARAG,ANDERSONBG,JENNIFERD,etal.Cir⁃culating irisin levels and muscle FNDC5 mRNA expression are inde⁃pendentof IL-15 levels inmice[J].Endocrine,2015,50(5):368-377.
[28]MARZETTIE,CARTERCS,STEPHANIEE,etal.Changes in IL-15 expression and death-receptor apoptotic signaling in ratgastrocnemius muscle with aging and life-long calorie restriction[J].Mechanisms of Ageingand Development,2009,130(4):272-280.
[29]ZHANG X D,WANG Y,WANGW,et al.p53 mediatesmitochondria dysfunction-triggered autophagy activation and cell death in rat stria⁃tum[J].Autophagy,2009,5(3):339-350.
[30]HE CC,SUMPTER R,LEVINE B.Exercise induces autophagy in pe⁃ripheral tissues and in the brain[J].Autophagy,2012,8(10):1548-1551.
[31]MARQUES A E,SANTOS,BALC M M,et al.Physical exercise im⁃proves brain cortex and cerebrum mitochondria bioenergetics and al⁃ters apoptotic,dynamic and auto(mito)phagy markers[J].Neurosci⁃ence,2015,301(30):480-495.
Neuroprotective Role of Endurance Exercise-induced Brain IL-15 M ediated Apop tosis Relative Pathway in Aged M ice
XUE Jingjing1,2,3,XU Zhen2,3,JIANGNing2,3,ZHANGYong2,3
(1.School of Sport Science,Beijing Sport University,Beijing 100084,China;2.Tianjin Key Laboratory of Exercise Physiology and Sports Medicine,Tianjin University of Sport,Tianjin 300381,China;3.Dept.of Health&Exercise Science,Tianjin University of Sport,Tianjin 300381,China)
Purpose:The aim of present study is to observe the effect of endurance exercise training on the content of brain IL-15 and apoptosis,and investi⁃gate the relationship between brain IL-15 and apoptosis,discuss the neuroprotective role of IL-15 induced by endurance exercise in aged brain.Methods:60 male C57BL/6micewere divided into 4 groups,2month Young Controlgroup(YC,n=15),2month Young Enduranceexercise traininggroup(YE,n=15),12 month Old Control group(OC,n=15),12month Old Endurance exercise training group(OE,n=15).Endurance exercise group performed treadmill training for 8weeks,5days/week,30minutes/day,atapproximately 12M/m.After exercise training,IL-15 content changesof brain tissue,muscle tissue and blood were measured by using ELISA Kit for Mouse IL-15;IL-15mRNA、BAXmRNA、p53mRNA、BCL-2mRNA and BCL-XLmRNA expression in brain weremea⁃sured by RT-PCR;Brain cell apoptosiswere detected by TUNELmethod.Results:1.Compared with YC,contentofbrain tissue、muscle tissue and blood IL-15 increased significantly in YE and OC;Compared with OC,content of brain tissue、muscle tissue and blood IL-15 of OE increased significantly.2.Com⁃pared with YC,BAX、p53、BCL-2 and BCL-XLmRNA expression and the TUNEL index were increased significantly in OC;Compared with OC,BAX and p53mRNA expression and the TUNEL indexwere decreased significantly in OE,BCL-2 and BCL-XLmRNA expressionwere increased significantly in OE.3. Compared with YC,IL-15mRNA expression were increased significantly in OC,Compared with OC,IL-15mRNA expression did not changed significantly in OE.Conclusions:The endurance exercise for 8 weeks upregulated the contentof IL-15 in brain;Exercise-enriched IL-15may take part in the aged-relative apoptosisprocess toexertneuroprotectiveeffects.
IL-15;enduranceexercise training;brain;aging
G 804.2
:A
:1005-0000(2017)01-016-06
10.13297/j.cnki.issn1005-0000.2017.01.003
2016-11-20;
2017-01-10;录用日期:2017-01-11
国家自然科学基金项目(项目编号:31370014);天津市科技创新体系创新平台计划专项(项目编号:10SYSYJC28400)
薛晶晶(1988-),女,河北唐山人,在读博士研究生,研究方向为运动生理学。
1.北京体育大学运动人体科学学院,北京100084;2.天津体育学院天津市运动生理与运动医学重点实验室,天津300381;3.天津体育学院健康与运动科学系,天津300381。
