环糊精及其衍生物在药学应用中的安全性综述
2017-07-06严忠海张加慧扬子江药业集团南京海陵药业有限公司江苏南京0049美国哥伦比亚大学医学院美国纽约00修正生物医药杭州研究院有限公司浙江杭州005
卓 敏,严忠海,张加慧(扬子江药业集团南京海陵药业有限公司,江苏 南京 0049;美国哥伦比亚大学医学院,美国 纽约 00;修正生物医药(杭州)研究院有限公司,浙江 杭州 005)
环糊精及其衍生物在药学应用中的安全性综述
卓 敏1,严忠海2,张加慧3(1扬子江药业集团南京海陵药业有限公司,江苏 南京 210049;2美国哥伦比亚大学医学院,美国 纽约 10032;3修正生物医药(杭州)研究院有限公司,浙江 杭州 310053)
环糊精(CD)是由6~8个D⁃吡喃葡萄糖单元通过α⁃1,4⁃糖苷键聚合而成的环状低聚糖化物.改性环糊精具有低毒、易修饰等优良性质,并可通过与药物分子形成包合物而提高药物的溶解性、稳定性、安全性和生物利用度等.改性环糊精不仅能够以其本身或修饰CD的形式充当载体,还可通过聚轮烷、阳离子聚合物或纳米粒等形式构建有效的药物载体.作为一种新型的药物赋形剂,改性环糊精广泛应用于口服、静脉注射和皮下给药等多种药物剂型,因此,其在人体内代谢及生物安全性等方面仍需要进一步研究.本文综述了改性环糊精类药物的结构特点、应用领域、吸收代谢以及毒理学性质的研究进展,并对市场上具有代表性的两种CD药物的安全性进行了初步归纳分析,提出了改性环糊精类物质研究的重点与发展方向.
改性环糊精;水溶性;药物剂型;给药途径;生物安全性;药学应用
0 引言
环糊精(cyclodextrin,CD)为环状寡聚糖,是一类由6~8个D⁃吡喃葡萄糖单元通过α⁃1,4⁃糖苷键连接的D⁃(+)⁃吡喃葡萄糖单元组成的大环化合物(图1a).根据环上吡喃葡萄糖分子数的差异,可将CD分为α、β、γ(分别含6、7、8个葡萄糖单体)等种类以及这些种类的多种衍生物,如羟丙基⁃β⁃CD(hydroxypropyl⁃β⁃cy⁃clodextrin)和磺丁基⁃β⁃环瑚精(sulfobutylether⁃β⁃cyclo⁃dextrin)等.这种环状低聚糖的空间结构导致葡萄糖单体的羟基裸露,具有适当大小可嵌进CD的中间腔中以非共价键方式形成包合物,增加了一些疏水性分子的溶解度[1-2].CD分子内部为一个呈“V”字型的疏水性空穴,表现出独特的分子识别能力[3-4].这种特殊的分子结构使其具有空腔表面具疏水性但外部具亲水性的特殊性能.此外,CD的包合作用是可逆的,这有利于客体分子从CD中释放.因此,可以利用CD对大小合适的客体分子和聚合物等进行包结形成复合物,从而提高被包合物对光、热的稳定性,降低挥发和升华(图1b).由于CD具有以上特点,所以它被用于许多药物的缓释,作为一种新型的药物赋形剂被广泛应用.
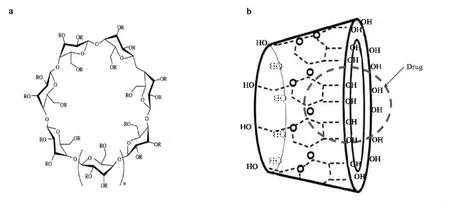
图1 环瑚精分子结构和包含原理
高分子材料是药物制剂重要的物质基础,制剂的性质和质量取决于所选用高分子材料及其与药物相互间的作用.新型药物制剂或给药系统的设计和研究取决于新型药用高分子材料的开发.CD可用来制备药物分子的包合物,从而增大药物的溶解度,并提高药物的化学和物理稳定性.近年来,CD及其衍生物应用于口服、静脉注射和皮下给药等多种药物剂型,故CD及其衍生物在人体内代谢及生物安全性等方面日益引起重视.本研究对改性环糊精的结构特点、包合性能、药物代谢、毒理学性质等方面的研究进展进行综述,并对市场上具有代表性的CD衍生药物的安全性进行了归纳分析,提出了CD类物质的研究重点,为CD类物质的开发利用提供理论依据.
1 天然CD的生物学毒性和药学作用
天然CD主要可分为α、β、γ三大类,分别含6、7、8个葡萄糖单体,疏水内腔由大到小依次分别是γ⁃CD、β⁃CD和α⁃CD,疏水内腔越大则可以与更多的药物分子形成有效的主客体结构;尽管β⁃CD的溶解性最差,但由于其价格低廉,目前β⁃CD仍是口服给药途径中使用最为广泛的一种天然CD辅料,常用于口服片剂的湿法制粒和干法制粒中.CD可特异性地被人体结肠中的糖苷酶降解,而在胃和小肠中缺乏此类酶.有研究表明,未修饰的天然CD,尤其是α⁃CD、β⁃CD,注射给药时肾毒性较大,因此大部分用于口服和外用制剂,非肠道给药较少使用.当前只有以α⁃CD为稳定剂的药物制剂PGE1⁃α⁃CD被批准用于海绵体内注射,可能是由于α⁃CD使用量较小不会导致严重的毒副作用[4-5].γ⁃CD的溶解度高于α⁃CD和β⁃CD,其肾毒性相对较轻,但γ⁃CD稳定性又相对较差[4].注射未经修饰的CD常常引起红细胞溶血、脂膜结构破坏等,推测可能是由于疏水性较强的CD会与细胞的膜类结构发生相互作用,萃取了其结构中的胆固醇、磷脂等成分[5].加上天然CD普遍水溶性低,代谢慢,且常以不溶性胆固醇复合物形式蓄积在脏器.这可能为注射给药导致肾毒性产生的主要原因,但具体机理尚未见相关报道.口服途径给药的天然CD的毒性十分轻微,主要原因在于其结构体积大且疏水性强,肠道系统难以对其进行吸收[6];而且 α⁃CD、β⁃CD难以被唾液淀粉酶、胰淀粉酶水解,对胃酸稳定,仅在结肠部位可以被内部的细菌进行一定的降解,最终90%以上的CD以原形代谢排出[7].
国内外学者对CD在药物增溶,提高药物稳定性和改善药物生物利用度方面已开展了大量研究,并形成相对成熟的评价体系[6-8].脂溶性的药物分子可以结合到CD的疏水性腔穴中形成主客体包合物,这种包合物可以有效改善药物分子的理化性质,如增加药物的水溶性和稳定性,提高药物生物利用度,从而在一定程度上降低药物的给药剂量,减少药物的毒副作用,并可抑制药物在体内形成结晶体,降低组织毒性[9],同时还可阻隔药物分子与血管壁上皮细胞直接接触,减轻药物对血管的损伤[10].通过与药物形成包合物,CD也有助于掩盖药物本体的气味,抑制药物挥发等[11].利用CD作为药用辅料来改善药物的理化性质得到了越来越多药剂学和生物医用领域研究人员的重视.如CD与甾体皮质激素类等亲脂性药物能够形成的水溶性复合物,降低了滴眼剂的局部刺激,有助于药物的眼部吸收.
2 改性环糊精的药剂学应用
鉴于天然CD具有水溶性低、代谢慢,不利于使用,且常以不溶性胆固醇复合物形式蓄积在脏器产生毒性等局限性.在实际的药物设计和生产中,均对CD的结构进行改造,从而改善了其理化和生物学性质.如对CD的某些性质进行改善,将甲基、乙基、羟丙基、葡糖基等基团引入CD分子,破坏CD分子内的氢键,通过对结构中游离羟基的烷基化、羟烷基化或酯化,可合成水溶性好、无定形、物理稳定性高、生理毒性低的CD衍生物,提高了其应用性能和应用范围.目前常用的环糊精的衍生物有羟丙基 CD(hydroxypropyl⁃β⁃cyclodextrin,HP⁃β⁃CD)、随机甲基CD(randomly methylated β⁃cyclodextrin,RM⁃β⁃CD)和磺丁基醚⁃β⁃CD(sulfobutyl ether⁃β⁃cyclodextrin,SBE⁃β⁃CD)[8].例如,为克服天然CD空腔尺寸小,可溶性低所导致的肾脏毒性,目前已经研发了改性环糊精,其原理是以葡萄糖单体中的 C2⁃OH和 C3⁃OH为修饰位点,进行了改性,提高基底对疏水性物质的吸附能力.改性后的分子量和溶解度均增加[1,5](表1).
目前,以改性CD作为辅料上市的国外制剂已达10余种(表2),且数量不断增加.在注射剂方面,由于改性后的HP⁃β⁃CD和SBE⁃β⁃CD等的卓越性能,已有多种注射剂、输液剂被批准进入临床[11].新的剂型在一定程度上降低了药物的毒副作用,提高了药物的溶解性、溶出率及生物利用度.目前,CD及各种衍生物已应用于全球30多个药物产品.在美国,也已有数种口服溶液和针剂产品在市场销售.例如,羟丙基⁃β⁃CD应用于Sporanox/(含药物伊曲康唑Itraconazole,口服溶液和静脉注射剂),而β⁃CD磺丁基则应用于盐酸齐拉西酮胶囊Geodon®(含药物Ziprasidone mesylate,肌肉注射剂)、伏立康唑片Vfend(含药物Voricanazole,静脉注射剂)和阿立哌唑Abilify®(含药物阿立哌唑Arip⁃iprazole,静脉注射剂).但是,在美国尚未见含CD的常用固体制剂如片剂和胶囊剂问世[12-13].表2中列举了现在市场上出现的一些CD药物产品及相应的给药途径.

表1 天然CD以及CD衍生物的理化特征
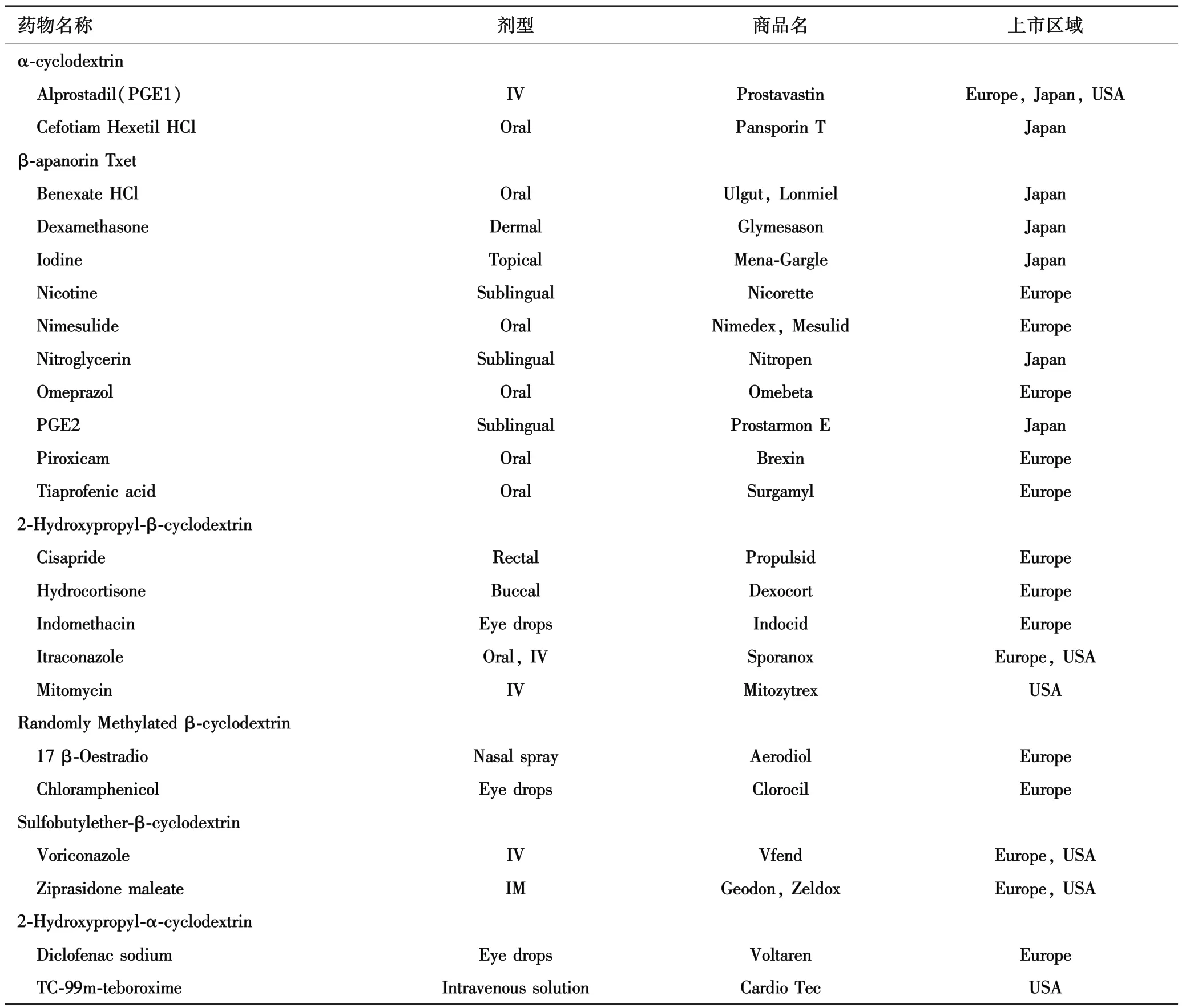
表2 目前国外CD修饰类药品
3 改性环糊精的安全性评价
药物⁃CD形成的包合物由于可以提高药物的吸收和生物利用度,故在一定程度上可降低药物的给药剂量,进而减少药物的毒副作用.采用改性环糊精,可以在药物分子周围构建一层保护隔离层,以阻隔不稳定的药物分子受到周围敏感环境的影响,防止药物水解、氧化、酶解、异构重排等.目前药剂学应用较多的改性环糊精主要有HP⁃β⁃CD,RM⁃β⁃CD和SBE⁃β⁃CD等[14-15],它们的理化性质及生物安全性见表 3[15-17].

表3 HP⁃β⁃CD,RM⁃β⁃CD和SBE⁃β⁃CD的理化性质比较
3.1 HP⁃β⁃CD安全性 HP⁃β⁃CD是最为常见的水溶性CD衍生物,是目前开发使用的CD衍生物中对药物增溶和提高稳定性效果最好的改性环糊精.现已经研究证实天然β⁃CD不可非肠道给药,是因为其具有较强的肾毒性.但改性后的HP⁃β⁃CD在水中的溶解度提高到50%以上,HP⁃β⁃CD的毒性大大降低,可用于非肠道给药途径;且经修饰后的HP⁃β⁃CD可阻止药物被胃酸和α⁃淀粉酶水解,口服后不蓄积,基本上能以完整的形态全部随尿排泄出人体[18].
虽然HP⁃β⁃CD为目前CD衍生物中毒副作用最小的药用辅料,但对它的临床使用安全性了解并不深入.目前 FDA仅批准了 Itraconazole注射液以及Levonorgestrel长效皮下植入剂(Jadelle Implants)使用HP⁃β⁃CD.国内仅石家庄制药集团有限公司有相关的静脉注射剂上市[19-20].静脉注射HP⁃β⁃CD出现的不良反应主要表现为轻度的肾毒性,溶血,并可能具有未知的致畸和致癌风险.其肾毒性主要与该辅料的纯度相关,究其原因可能为杂质引发肾小管远端空泡样病变,在表皮细胞内出现巨大的溶酶体和针状结晶,后者被认为是CD与胆固醇或脂蛋白聚合体[21].严重患者体内可观察到线粒体肿胀变形、高尔基体和滑面内质网基底部的细胞出现细胞间紧密连接不可逆的断裂,导致肾功能衰退甚至丧失.HP⁃β⁃CD的另外个不良反应就是溶血性.已有研究[22]表明,在静脉注射途径下,当其在血液中浓度达到0.02 mol/L时会出现轻微的溶血现象,在0.04 mol/L时出现明显的溶血.
总之,现有的非临床药理毒理研究及文献资料已经证明了环瑚精作为辅料的安全性,但对不同的药物进行修饰包装,药物主体的适应证、用法用量、治疗时间和疗程周期的差异需要进一步分析.目前除了伊曲康唑注射液获批上市临床使用外,其他以HP⁃β⁃CD作为药用辅料的注射剂的药学应用尚在临床研究阶段,目前的资料尚不足以证明其在临床使用过程中的安全性.
3.2 SBE⁃β⁃CD安全性初步分析 SBE⁃β⁃CD是由1,4⁃丁烷磺内酯(1,4⁃BS)在碱性条件下与β⁃CD的2,3,6位碳上的羟基发生取代反应而得到的阴离子型高水溶性CD衍生物.SBE⁃β⁃CD对于含氮类药物具有特殊的亲和力和包合性,与药物分子包合形成非共价复合物后能显著提高药物的稳定性、水溶性和安全性,可控制药物递释速率、缓解溶血、并降低肾毒性等[13,23].β⁃CD是SBE⁃β⁃CD的合成原料之一,控制其含量对于提高SBE⁃β⁃CD的质量有重要意义.
研究表明,麻醉狗给予SBE⁃β⁃CD 250 mg/kg iv给药,并不影响麻醉狗的心率和动脉血压.此外SBE⁃β⁃CD并不影响小鼠的呼吸、尿pH值或尿流率.大鼠静脉给予SBE⁃β⁃CD 500 mg/kg注射后,大鼠尿液中则发现钠和钾和氯水平大幅提高[12].在SBE⁃β⁃CD实验中,对大鼠和兔子模型进行了生育力、母体毒性、胎儿毒性和围产期研究,结果发现SBE⁃β⁃CD对生育力没有影响.SBE⁃β⁃CD 3000 mg/kg产生最小母体毒性和轻微围产期毒性.SBE⁃β⁃CD对F0,F1和F2代没有其他不利影响,并非动物致畸原.SBE⁃β⁃CD在体外细菌和体内的哺乳动物细胞评价中没有显示诱变活性或裂殖体活性[12].对小鼠和大鼠给予高达2000 mg/kg的单次静脉注射剂量未产生不良反应,SBE⁃β⁃CD重复静脉注射给药导致肾组织病理学的剂量依赖性变化见表4.SBE⁃β⁃CD 160 mg/kg给药后,在1~6个月的动物中出现肾小管的空泡,且发生率与给药剂量相关.给予320 mg/kg的日剂量停止治疗1个月后,在几只大鼠中可观察到较小的肾小管空泡形成,但是这种变化在程度和严重性方面很大程度上是可逆的.剂量超过160 mg/kg时,肺泡细胞病灶在1~6个月研究期存在剂量相关的发生率;在320 mg/kg的剂量停止1个月后发生可逆.在6个月的研究中,SBE⁃β⁃CD引发肾盂和膀胱的轻微上皮细胞空泡形成,但肾细胞空泡化不影响肾功能.药理学实验的剂量结果见表4.Lilly等[28]研究了伏立康唑注射液、卡泊芬净注射液和氟康唑注射液治疗真菌感染患者,探讨SEB⁃β⁃CD对患者急性肾损伤的影响.结果表明,肾功能受损的真菌感染患者临床治疗中,急性肾损伤(acute kidney injury,AKI)与SBE⁃β⁃CD的抗真菌剂使用无关[24].

表4 重复剂量实验条件下SBE⁃β⁃CD的安全性研究
CD类药物注射给药时的溶解性,溶血可能以及体内滞留时间等在药物设计时需要进一步考虑,目前对各种类型的CD及其衍生物引起的溶血做了研究,发现了溶血反应强弱顺序为:RM⁃β⁃CD>β⁃CD>HP⁃β⁃CD>α⁃CD>γ⁃CD>HP⁃γ⁃CD>SBE⁃β⁃CD[22,25-26].动物实验也证实β⁃CD、γ⁃CD修饰基团由于水溶性较低,有一定的肾脏毒性等,其修饰物大多不能直接用于注射给药,同时溶血反应较强的 RM⁃β⁃CD也不能用于静脉注射.其它类型的 α⁃CD,γ⁃CD,HP⁃γ⁃CD和SBE⁃β⁃CD则已被成功改造为CD类型的注射给药剂型,可用于静脉注射[27].注射给药后 HP⁃β⁃CD和SBE⁃β⁃CD在体内有较短的半衰期,大部分会随尿液完整的排出体外[25].对于肾功能正常的人来说,HP⁃β⁃CD和SBE⁃β⁃CD类型的药物,约99%的CD在12 h即会被完全排出[26-27].
HP⁃β⁃CD和SBE⁃β⁃CD是目前FDA批准仅有的2种可注射型 CD辅料.HP⁃β⁃CD安全性高,水溶性强,但对于药物的包合能力弱,且羟丙基的取代度越高,包合能力越弱,故对于此种材料,可认为是一种在“有效性”与“安全性”之间的权宜之策.SBE⁃β⁃CD则不同,其结构中具有羧基,故与药物间的相互作用既可通过疏水作用,亦可借助药物与材料间的静电相互作用,且本身由于带电,水溶性大幅度提高,故在适宜pH条件下(需调节药物分子带正电),采用SBE⁃β⁃CD包合难溶性药物可同时提高有效性和安全性[7,28].
4 展望
提高水难溶性以及脂溶性药物的生物利用度一直是制药界面临的一个主要问题,也是药物输送体系领域的研究热点.由于药物的水溶性差还会引发药效显现滞后、毒副作用增加(因为药物剂量加大)、研发成本提高(传统的制剂和生产方法不能发挥作用)等问题,直接导致产品被推迟上市甚至整个上市计划的被迫取消.改性环糊精具有低毒、易修饰等优良性质,并可通过与药物分子形成包合物而提高药物的溶解性、稳定性、安全性和生物利用度等,因而具有成为优秀药物载体的潜力.CD不仅能够以其本身或修饰CD的形式充当载体,还可通过聚轮烷、阳离子聚合物或纳米粒等形式构建有效的药物载体.CD及其衍生物具有独特的优良性能,可以提高药物溶解性、稳定性,改善其生物利用度、降低毒副作用,在数十种上市制剂中已有应用.用适当的化学方法将配体分子如叶酸、单糖或寡糖、透明质酸、转铁蛋白等键接在基于CD的载体上,可形成具有靶向性质的药物载体,进而与药物分子一起构筑靶向药物传递系统.但同时,改性的环糊精也具有一定的肾毒性,且由于CD基团外周亲水,难以穿透脂溶性膜.而内腔为疏水性,对于亲水能力强的药物,改性环糊精对药物的包封率随药物亲水性的升高而降低,其载药量及释放仍受到药物自身影响等.改性环糊精存在的这些问题限制了其进一步应用,尤其在注射剂领域,改性环糊精类辅料的安全性仍然需要密切关注.故对于此类材料的修饰改性、共混复合以提高水溶性、降低毒性仍为研究的重点.由于CD所具有的自身优势,可替代毒性较大的有机溶剂和表面活性剂,有着广泛的应用前景.近年来对天然CD进行改型的科研工作在国外得到了重视,并已取得了突破性的进展.国内外对HP⁃β⁃CD和SBE⁃β⁃CD两种新型辅料的需求大幅增加.这两种辅料对多种难溶性药物都有较好的增溶作用,但是该工作在我国仍处于刚刚起步阶段.一方面,基于CD的有效性更强且安全性更高的药物载体以及递释系统还待进一步开发;另一方面,多数CD靶向给药系统的安全性如毒性、生物相容性和生物可降解性等的评价仅仅是通过体外实验进行的,仍需要实施更多的体内实验来对其安全性能作进一步的研究.建议药物设计研究者们在今后的工作中加强重视,揭示其可能存在的缺陷,以便寻找更好的改良方法,提高临床应用安全性,以期取得具有自主知识产权的、品质优良,临床上安全使用的改性环糊精材料.
[1]Loftsson T,Brewster ME.Pharmaceutical applications of cyclodex⁃trins:basic science and product development[J].J Pharm Pharma⁃col,2010,62(11):1607-1621.
[2]Matilainen L,Larsen KL,Wimmer R,et al.The effect of cyclodex⁃trins on chemical and physical stability of glucagon and characteriza⁃tion of glucagon/gamma⁃CD inclusion complexes[J].J Pharm Sci,2008,97(7):2720-2729.
[3]Wang L,Yan J,Li Y,et al.The influence of hydroxypropyl⁃β⁃cyclo⁃dextrin on the solubility,dissolution,cytotoxicity,and binding of riluzole with human serum albumin[J].J Pharm Biomed Anal,2016,117:453-463.
[4]Devasari N,Dora CP,Singh C,et al.Inclusion complex of erlotinib with sulfobutyl ether⁃β⁃cyclodextrin:Preparation,characterization,in silico,in vitro and in vivo evaluation[J].Carbohydr Polym,2015,134:547-556.
[5]Gidwani B,Vyas A.A comprehensive review on cyclodextrin⁃based carri⁃ers for delivery of chemotherapeutic cytotoxic anticancer drugs[J].Biomed Res Int,2015,2015:198268.
[6]Yokoo M,Kubota Y,Motoyama K,et al.2⁃Hydroxypropyl⁃β⁃Cyclo⁃dextrin acts as a novel anticancer agent[J].PLoS One,2015,10(11):e0141946.
[7]钱 康,孙海锋,慈天元,等.环糊精在上市医药产品中的应用研究进展[J].药学进展,2016,40(7):483-489.
[8]赵中喜,王中利,张 煚,等.环糊精的药学应用[J].现代生物医学进展,2016,16(19):3788-3792.
[9]Tiwari G,Tiwari R,Rai AK.Cyclodextrins in delivery systems:applications[J].J Pharm Bioallied Sci,2010,2(2):72-79.
[10]Maragos S,Archontaki H,Macheras P,et al.Effect of cyclodextrin complexation on the aqueous solubility and solubility/dose ratio of praziquantel[J].AAPS PharmSciTech,2009,10(4):1444-1451.
[11]Arima H,Higashi T,Motoyama K.Improvement of the bitter taste of⁃drugs by complexation with cyclodextrins:applications,evaluations and mechanisms[J].Ther Deliv,2012,3(5):633-644.
[12]Luke DR,Tomaszewski K,Damle B,et al.Review of the basic and clin⁃ical pharmacology of sulfobutylether⁃beta⁃cyclodextrin(SBECD)[J].J PharmSci,2010,99(8):3291-3301.
[13]Kiser TH,Fish DN,Aquilante CL,et al.Evaluation of sulfobutyle⁃ther⁃β⁃cyclodextrin(SBECD)accumulation and voriconazole phar⁃macokinetics in critically ill patients undergoing continuous renal re⁃placement therapy[J].Crit Care,2015,19:32.
[14]Turner RB,Martello JL,Malhotra A.Worsening renal function in pa⁃tients with baseline renal impairment treated with intravenous voricon⁃azole:A systematic review[J].Int J Antimicrob Agents,2015,46(4):362-366.
[15]Chadha R,Gupta S,Shukla G,et al.Interaction of artesunate with β⁃cyclodextrin:characterization,thermodynamic parameters,molec⁃ular modeling,effect of PEG on complexation and antimalarial activi⁃ty[J].Results Pharma Sci,2011,1(1):38-48.
[16]Rachwalski EJ,Wieczorkiewicz JT,Scheetz MH.Posaconazole:an o⁃ral triazole with an extended spectrum of activity[J].Ann Pharmaco⁃ther,2008,42(10):1429-1438.
[17]McKeage K.Posaconazole:a review of the gastro⁃resistant tablet and intravenous solution in invasive fungal infections[J].Drugs,2015,75(4):397-406.
[18]Gould S,Scott RC.2⁃Hydroxypropyl⁃beta⁃cyclodextrin(HP⁃beta⁃CD):a toxicology review[J].Food Chem Toxicol,2005,43(10):1451-1459.
[19]Zhang H,Huang X,Zhang Y,et al.Efficacy,safety and mechanism of HP⁃β⁃CD⁃PEI polymers as absorption enhancers on the intestinal absorption of poorly absorbable drugs in rats[J].Drug Dev Ind Pharm,2016,43(3):474-482.
[20]Michel D,Mohammed⁃Saeid W,Getson H,et al.Evaluation of β⁃cy⁃clodextrin⁃modified gemini surfactant⁃based delivery systems in mela⁃noma models[J].Int J Nanomedicine,2016,11:6703-6712.
[21]Hanumegowda UM.Potential impact of Cyclodextrin⁃containing formu⁃lations in toxicity evaluation of novel compounds in early drug discov⁃ery[J].J Pharmaceu Pharmacol,2014,2(1):5.
[22]Comoglu T,Unal B.Preparation and evaluation of an orally fast disin⁃tegrating tablet formulation containing a hydrophobic drug[J].Pharm Dev Technol,2013,20(1):60-64.
[23]Samprasit W,Akkaramongkolporn P,Ngawhirunpat T,et al.Formu⁃lation and evaluation of meloxicam oral disintegrating tablet with dis⁃solution enhanced by combination of cyclodextrin and Ion exchange resins[J].Drug Dev Ind Pharm,2015,41(6):1006-1016.
[24]Stojanov M,Nielsen HM,Larsen KL.Cyclodextrins:efficient biocom⁃patible solubilizing excipients for bromhexine liquid and semi⁃solid drug delivery systems[J].Int J Pharm,2012,422(1-2):349-355.
[25]Lina BA,Bär A.Subchronic oral toxicity studies with acyclodextrin in rats[J].Regul Toxicol Pharmacol,2004,39(1):14-26.
[26]Cristin D,Davidson,Yonatan I,et al.Efficacy and ototoxicity of dif⁃ferent cyclodextrins in Niemann⁃Pick C disease[J].Ann Clin Transl Neuro,2016,3(5):366-380.
[27]Zhang J,Ma PX.Cyclodextrin⁃based supramolecular systems for drug delivery:recent progress and future perspective[J].Adv Drug Deliv Rev,2013,65(9):1215-1233.
[28]Lilly CM,Welch VL,Mayer T,et al.Evaluation of intravenous vori⁃conazole in patients with compromised renal function[J].BMC Infect Dis,2013,13:14.
Review of safety assessment for cyclodextrin and its derivatives in drug administration
ZHUO Min1,YAN Zhong⁃Hai2,ZHANG Jia⁃Hui31Nanjing Hailing Pharmaceutical Co.,Ltd,Yangtze River Phar⁃maceuticals Group,Nanjing 210049,China;2Department of Medicine, Columbia University, New York 10032, USA;3Xiuzheng Bio⁃pharmaceutical(Hangzhou) Research Institute Co.,Ltd,Hangzhou 310053,China
Cyclodextrins(CDs)are polysaccharide of six to eight glucose units that are covalently attached end to end via α⁃1,4 linkages.The modified CDs present the characteristics of low toxicity and high flexibility of structure modification,and they also can enhance the aqueous solubility,chemical stability,safety and bio⁃availability of drugs in virtue of their peculiar ability to form CD/drug inclusion complexes.Not only native and chemically modified CDs were employed as drug carriers,but also sorts of CD⁃based more sophisticated carrier systems such as polyrotaxanes,polyp⁃seudorotaxanes,polycations and nanoparticles emerged recently.In the pharmaceutical industry,modified CDs have mainly been used as complexing agents via oral,intravenous and hypodermic injection administration.However,their large⁃scale commercial u⁃tilization was prevented mainly due to the concerns regarding their safety.In this review,the structure of natural CDs,applications of modified CDs in drug delivery systems,characteristics features of dif⁃ferent types of inclusion complexation,safety,absorption and metab⁃olism,and comparative toxicology of modified CDs,as well as future prospects of research and development of modified CDs are summa⁃rized.
cyclodextrin derivatives;water solubility;dosage form;route of administration;biosafety;drug administration
2095⁃6894(2017)06⁃77⁃06
R917
A
2017-03-20;接受日期:2017-04-10
卓 敏.硕士,工程师.研究方向:天然产物化学.E⁃mail:zmina78@126.com
张加慧.硕士,高级工程师.研究方向:长效药物制剂开发与评价.E⁃mail:zhangjiahui@xiuzhengbmri.com
