MicroRNA⁃31在胶质瘤中的表达及功能研究
2017-07-06侯文仲毛振敏曾敏敏关北漩廖国民陈向林
侯文仲,毛振敏,曾敏敏,关北漩,廖国民,陈向林
[广州医科大学第六附属医院(清远市人民医院)神经外科,广东 清远 511518]
MicroRNA⁃31在胶质瘤中的表达及功能研究
侯文仲,毛振敏,曾敏敏,关北漩,廖国民,陈向林
[广州医科大学第六附属医院(清远市人民医院)神经外科,广东 清远 511518]
目的:探讨MicroRNA⁃31在胶质瘤中的作用.方法:利用realtime⁃PCR检测不同来源的胶质瘤组织和胶质瘤细胞中microRNA⁃31(miR⁃31)的表达,分析miR⁃31表达与胶质瘤级别的关系;MTT检测 miR⁃31对胶质瘤细胞增殖的影响.结果:miR⁃31在胶质瘤组织和细胞中都是低表达的,且在胶质瘤组织中其表达水平随着胶质瘤级别的升高而降低.在U87和U251中,miR⁃31均能抑制胶质瘤细胞的增殖,而同时加入antisense RNA抑制miR⁃31作用后细胞增殖即恢复.结论:MiR⁃31能够抑制胶质瘤细胞的增殖,可能成为未来胶质瘤治疗的新靶点.
MicroRNA⁃31;胶质瘤;恶性;增殖;治疗靶点
0 引言
脑胶质瘤是中枢神经系统最常见、预后较差的原发性恶性肿瘤.由于神经胶质瘤呈侵润性生长,与脑组织无明显分界,难以做到全部切除,仅通过传统手术无法有效治愈,多主张联合治疗,配以化疗和放疗延缓复发和延长生存期[1-4].由于现有的肿瘤药物和放疗多针对生长期细胞,对静止状态的神经胶质瘤干细胞没有明显的杀伤效果,导致侵润性极强的神经胶质瘤具有高复发、低治愈的特点,是细胞生物学和神经生物学面临的一大难题,因此寻找新的胶质瘤治疗靶标是胶质瘤临床治疗的迫切需要[5-6].
MicroRNA(miRNA)是一类含量丰富的非蛋白编码(non⁃protein⁃coding)小RNA,可作为负性基因调节器调节多种生物进程[7-8].生物信息数据显示,每个miRNA能影响数百种基因的表达,miRNA可能对每一条遗传通路都有影响[9].研究发现MicroRNA⁃31(miR⁃31)在多种肿瘤中表达异常,如口腔癌、乳腺癌等,其在不同肿瘤中的功能也有所不同.有研究发现miR⁃31作用可能与其内源表达相关,如在乳腺癌中的miR⁃31的异常表达与乳腺癌细胞的恶性转移相关.在作用机制方面,有部分研究提示miR⁃31可能参与调控细胞周期、表观遗传学修饰等.虽然关于miR⁃31在肿瘤中的功能有很多研究,但是其在胶质瘤中的表达和作用机制尚不明确.本研究分析了miR⁃31在胶质瘤细胞中的表达情况,发现miR⁃31在胶质瘤细胞的表达低于正常脑细胞.功能实验发现miR⁃31抑制了胶质瘤的生长,其作用的分子机制仍在继续研究中.
1 材料和方法
1.1 组织标本和细胞培养 收集广州医科大学第六附属医院2010~2015年间胶质瘤手术切除胶质瘤标本.纳入标准:诊断经病理学检查证实;手术患者术前未行化疗或放疗.所有标本获取均经过伦理委员会审核批准.人神经胶质瘤细胞系 U251MG和U87MG 2012年购自中国科学院细胞细胞库,正常胶质细胞系A172、T98和HEB购自北京创联生物科技公司(中国,北京).细胞系真实性均经过短串联重复序列验证.所有细胞均用高糖DMEM(Invitrogen公司,美国),添加 10%的胎牛血清(GIBCO公司,美国)、100 U/mL的青霉素(NCPC公司,中国)和100 μg/mL的链霉素(NCPC公司,中国),培养环境为含5%CO2的37°C细胞培养箱.
1.2 转染 MicroRNA⁃31 mimics(sense:5'⁃CGGCAA GAUGUGGCAUAGC⁃3',antisense:5'⁃TGCUTUGCCA GAUGUUGCC⁃3')由 Invitrogen(上海)合成,阴性对照RNA duplexes购自Ambion(USA).细胞按2×105铺板于6孔细胞培养板中,待生长至密度为70%时转染细胞,转染试剂为Lipofeatmin2000,均按说明书操作.
1.3 qRT⁃PCR 通过实时荧光定量 PCR(qRT⁃PCR)检测miR⁃31在神经胶质瘤细胞、神经胶质瘤组织和创伤性脑损伤组织中的表达水平.按照试剂盒操作规程使用Trizol(Invitrogen公司,美国)从冻存的组织样品和细胞中抽提总RNA.RNA用不含RNase的DNase处理(罗氏公司,瑞士).然后使用BcaBe⁃stRNA PCR试剂盒(TAKAR公司,中国)来合成cDNA.所有引物都由上海生工生物科技有限公司合成,荧光定量PCR使用SYBR底物,使用iQ5实时PCR检测系统(Bio⁃Rad公司)检测信号.引物序列为:5'⁃GGAGAGGAGGCAAGATGCTG⁃3',5'⁃GGAAA GATGGCAATATGTTG⁃3'.
1.4 MTT实验 将1×104个细胞重悬在200 μL培养基中种到96孔板中.处理后,培养基换成200 μL含0.5 mg/mL MTT的DMEM/FBS,37°C孵育4 h.弃掉上清,细胞用200 μL DMSO 37°C裂解10 min.测量490 nm处的OD值(SpectraMax公司,美国).
1.5 统计学处理 采用SPSS17.0统计学软件通过单边非配对t检验对独立样本进行分析.所有统计结果的定量分析均采用标准误(±SEM),并在图中标注,P<0.05表示差异具有统计学意义.
2 结果
2.1 MiR⁃31在胶质瘤组织中低表达 研究miR⁃31在胶质瘤中的功能,首先要检测miR⁃31在胶质瘤中的表达水平,本研究收集了40例胶质瘤标本和各肿瘤组织对应的正常组织或癌旁组织.qRT⁃PCR检测肝癌组织中miR⁃31的表达发现,miR⁃31在胶质瘤组织中的表达明显低于在正常组织和癌旁组织中的表达(图1).

图1 MiR⁃31在胶质瘤组织中的表达
2.2 MiR⁃31表达水平与胶质瘤恶性的关系 为了分析miR⁃31与胶质瘤恶性之间的关系,本研究进一步对不同级别胶质瘤组织中miR⁃31的表达进行了检测.结果显示,与一级胶质瘤组织相比,miR⁃31在二级和三级胶质瘤组织中的表达量显著降低(图2).
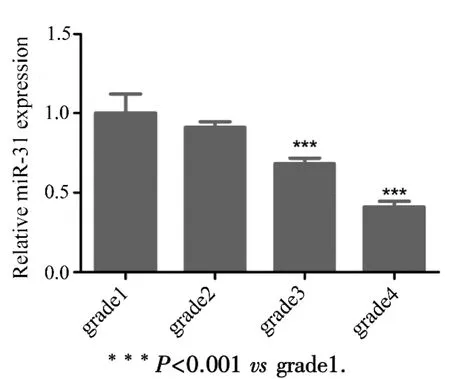
图2 MiR⁃31表达随胶质瘤级别升高而降低
2.3 MiR⁃31在胶质瘤细胞中低表达 前期结果表明,miR⁃31在胶质瘤组织中低表达.为了进一步明确miR⁃31在胶质瘤中的表达情况,本研究检测了几种胶质瘤细胞中miR⁃31的表达水平(图3).结果显示,与HEB细胞相比,miR⁃31在胶质瘤细胞系 U87、U251、T98和A172中的表达水平均显著降低.说明miR⁃31在胶质瘤组织和细胞中都是低表达的.
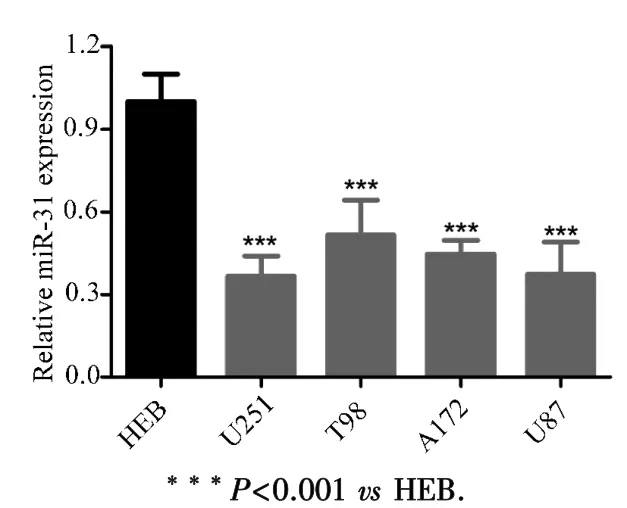
图3 MiR⁃31在胶质瘤细胞中的表达水平
2.4 MiR⁃31对胶质瘤细胞增殖的影响 根据前期结果,miR⁃31在胶质瘤组织和细胞中低表达,因此推测miR⁃31在胶质瘤中应该起抑癌基因的作用.因此本研究在U87和U251检测了miR⁃31对胶质瘤细胞增殖的影响(图4、5).结果发现,miR⁃31对U87和U251增殖起明显的抑制作用,而在miR⁃31过表达的同时加入antisense miR⁃31抵消miR⁃31的作用后,细胞的增殖得到明显恢复,这些结果充分说明miR⁃31能够抑制胶质瘤细胞的增殖.

图4 MiR⁃31对U87细胞增殖的影响
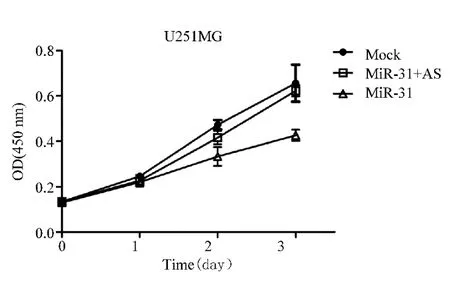
图5 MiR⁃31对U251细胞增殖的影响
3 讨论
神经胶质瘤是大脑最常见的原发性恶性肿瘤.尽管治疗技术不断进步,包括手术、放射治疗、光动力治疗、化疗等,但是恶性神经胶质瘤的预后依旧很差,其高发病率和高死亡率促使人们不断寻找新的治疗策略.MicroRNA是一种内源性非编码RNA,MicroRNA可以通过靶向目标基因的3'UTR区在转录后水平抑制基因的表达[7].多种人体癌症被证明与miRNA的突变或错误表达有关.如卵巢癌[8]、肺癌[9-10]、肝癌[11],结肠癌[12-13]和 GBM[14]等.MicroRNA的下调已经成为一个新的恶性肿瘤的特征,所以一些特定的microRNA可以成为肿瘤诊断和预后的生物标志物[15-19].
MiR⁃31定位于染色体 9q21.3,该位置存在CDKN2等很多肿瘤抑制基因[20].报道[21]称 miR⁃31在肺癌中可通过与LATS、PPP2R2A抑癌基因相互作用影响细胞增殖,在头颈肿瘤中也有类似发现.而在肠癌中,miR⁃31通过激活RAS信号通路抑制RASA1转运,进而导致肿瘤生长和恶性.与此同时,在某些肿瘤中,miR⁃31又可发挥抑癌作用,如miR⁃31可以抑制乳腺癌增殖和恶性转移.值得注意的是,miR⁃31在胶质瘤中的功能尚未见报道.本研究根据上述前期研究结果分析了miR⁃31在胶质瘤组织和细胞中的表达及对胶质瘤细胞增殖的影响.结果发现,miR⁃31在胶质瘤组织和细胞中都是低表达的,且表达水平随着胶质瘤级别的升高而降低.在U87和 U251中,miR⁃31均抑制细胞生长,而同时加入 antisense RNA抑制miR⁃31作用后细胞增殖即恢复.这些结果说明miR⁃31在胶质瘤内属于抑癌因子.
综上所述,本研究发现miR⁃31在胶质瘤中低表达,并且能够抑制胶质瘤细胞的增殖.miR⁃31在胶质瘤中的表达和作用的研究将有助于揭示胶质瘤发生发展的机制,使miR⁃31成为胶质瘤发生发展生理过程的指标,为未来胶质瘤的治疗提供新靶点.
[1]Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893-2917.
[2]Furnari FB,Fenton T,Bachoo RM,et al.Malignant astrocytic glio⁃ma:genetics,biology,and paths to treatment[J].Genes Dev,2007,21(21):2683-2710.
[3]Reitman ZJ,Yan H.Isocitrate dehydrogenase 1 and 2 mutations in cancer:alterations at a crossroads of cellular metabolism[J].J Natl Cancer Inst,2010,102(13):932-941.
[4]Wolffe AP,Matzke MA.Epigenetics:regulation through repression[J].Science,1999,286(5439):481-486.
[5]Park K,Lee S,Kang E,et al.New generation of multifunctional nanoparticles for cancer imaging andtherapy[J].Adv Funct Mater,2009,19(10):1553-1566.
[6]Schroeder A,Heller DA,Winslow MM,et al.Treating metastatic cancer with nanotechnology[J].Nat Rev Cancer,2011,12(1):39-50.
[7]Ambros V.microRNAs:tiny regulators with great potential[J].Cell,2001,107(7):823-826.
[8]Nam EJ,Yoon H,Kim SW,et al.MicroRNA expression profiles in serous ovarian carcinoma[J].Clin Cancer Res,2008,14(9):2690-2695.
[9]Zhu D,Chen H,Yang X,et al.Decreased microRNA⁃224 and its clinical significance in non⁃small cell lung cancer patients[J].Diagn Pathol,2014,9:198.
[10]Yang Y,Meng H,Peng Q,et al.Downregulation of microRNA⁃21 expression restrains non⁃small cell lung cancer cell proliferation and migration through upregulation of programmed cell death 4[J].Cancer Gene Ther,2015,22(1):23-29.
[11]Yang N,Ekanem NR,Sakyi CA,et al.Hepatocellular carcinoma and microRNA:new perspectives on therapeutics and diagnostics[J].Adv Drug Deliv Rev,2015,81:62-74.
[12]Chen P,Wang BL,Pan BS,et al.MiR⁃1297 regulates the growth,migration and invasion of colorectal cancer cells by targeting cyclo⁃ox⁃ygenase⁃2[J].Asian Pac J Cancer Prev,2014,15(21):9185-9190.
[13]Zhou MK,Liu XJ,Zhao ZG,et al.MicroRNA⁃100 functions as a tumor suppressor by inhibiting Lgr5 expression in colon cancer cells[J].Mol Med Rep,2015,11(4):2947-2952.
[14] Turner JD,Williamson R,Almefty KK,et al.The many roles of microRNAs in brain tumor biology[J].Neurosurg Focus,2010,28(1):E3.
[15]Yu SL,Chen HY,Chang GC,et al.MicroRNA signature predicts survival and relapse in lung cancer[J].Cancer Cell,2008,13(1):48-57.
[16]Shenouda SK,Alahari SK.MicroRNA function in cancer:oncogene or a tumor suppressor[J].Cancer Metastasis Rev,2009,28(3-4):369-378.
[17]Cho WC.MicroRNAs:potential biomarkers for cancer diagnosis,prognosis and targets for therapy[J].Int J Biochem Cell Biol,2010,42(8):1273-1281.
[18]Tu Y,Liu N.Systematic review of microRNAs and its therapeutic po⁃tential in glioma[J].Cancer Transl Med,2015,1(2):50-66.
[19]Tu Y,Zhang P,Pang X.Thioredoxin⁃interacting protein as a common regulation target for multiple drugs in clinical therapy/application[J].Cancer Transl Med,2015,1(1):26-30.
[20]Ivanov SV,Goparaju CM,Lopez P,et al.Pro⁃tumorigenic effects of miR⁃31 loss in mesothelioma[J].J Biol Chem,2010,285(30):22809-22817.
[21]Sun D,Yu F,Ma Y,et al.MicroRNA⁃31 activates the RAS pathway and functions as an oncogenic MicroRNA in human colorectal cancer by repressing RAS p21 GTPase activating protein 1(RASA1)[J].J Biol Chem,2013,288(13):9508-9518.
Study on the expression and function of microRNA⁃31 in glioma
HOU Wen⁃Zhong,MAO Zhen⁃Min,ZENG Min⁃Min,GUAN Bei⁃Xuan,LIAO Guo⁃Min,CHEN Xiang⁃Lin Department of Neurosurgery,The Sixth Affiliated Hospital of Guangzhou Medical University,Qingyuan City People's Hospital,Qingyuan 511516,China
AIM:To study the role of microRNA⁃31 in glioma.METHODS:The expression of miR⁃31 from different glioma tissues and glioma cells were detected by realtime⁃PCR,and the relationship between expression of miR⁃31 and the level of the gli⁃oma was analyzed.The effect on miR⁃31 for proliferation of glioma cells was detected by MTT.RESULTS:The expression of miR⁃31 in glioma tissues and cell lines were lower than normal tissues and cell lines.The higher the lever of glioma,the lower the expression of miR⁃31.In U87 and U251,miR⁃31 could inhibit the cell proliferation,while cell proliferation was recovered by inhibi⁃ting the expression ofmiR⁃31 added the antisense RNA.CONCLUSION:MiR⁃31 can inhibit the proliferation of glioma cells,and miR⁃31 may be a new target in the treatment of glioma in the future.
MicroRNA⁃31;glioma;malignant;preliferation;therapy target
2095⁃6894(2017)06⁃26⁃03
R739.41
A
2017-05-13;接受日期:2017-05-17
清远市科技计划项目(2016B025)
侯文仲.博士.E⁃mail:harzard@sina.com
