魔芋葡甘聚糖抗醉解酒作用机理研究
2017-07-05郑连姬
郑连姬
邓利玲1
罗嘉妮1
张 帅1
邓 利1
钟 耕1,3
(1. 西南大学食品科学学院,重庆 400716;2. 重庆食品工业研究所,重庆 400042;3. 重庆市特色食品工程技术研究中心,重庆 400715)
魔芋葡甘聚糖抗醉解酒作用机理研究
郑连姬1,2
邓利玲1
罗嘉妮1
张 帅1
邓 利1
钟 耕1,3
(1. 西南大学食品科学学院,重庆 400716;2. 重庆食品工业研究所,重庆 400042;3. 重庆市特色食品工程技术研究中心,重庆 400715)
以不同剂量的魔芋葡甘露聚糖(Konjac Glucomannan,KGM)灌胃昆明种小鼠,采用56%vol红星二锅头灌胃方法进行造模,研究KGM对小鼠的抗醉解酒作用及机理。结果表明:中(240 mg/kg)、高(400 mg/kg)剂量组可有效延长醉酒潜伏期,显著缩短醉酒小鼠的睡眠时间和醒酒时间,且高、中剂量组的血清乙醇浓度显著低于模型组小鼠,高剂量组小鼠肝组织匀浆中乙醇脱氢酶(Alcohol dehydrogenase,ADH)、乙醛脱氢酶(Acetaldehyde dehydrogenase,ALDH)和细胞色素P450(Cytochrome P450,P450)含量均显著升高;中、高剂量组小鼠胃黏膜组织和血清中丙二醛(Methane dicarboxylic aldehyde,MDA)含量显著降低,过氧化物歧化酶(Superoxide Dismutase,SOD)活力、一氧化氮(Nitric Monoxide,NO)含量、前列腺素 E2(Prostaglandin E,PGE2)含量显著升高。其解酒机理: ①可能是其抑制酒精的吸收,降低血清中乙醇浓度;② 小鼠胃黏膜和血清中MDA含量的降低,SOD活力、NO 和 PGE 的升高减轻了酒精对胃黏膜的损伤,并提高了肝脏中ADH、ALDH、P450含量,通过乙醇脱氢酶和乙醇氧化酶系统加速酒精代谢,发挥其防醉解酒作用。
魔芋葡甘露聚糖;抗醉解酒;作用机理;动物试验
适量饮酒具有促进血液循环、疏通经脉、助气健胃、散湿止痛等功效。但随着经济的不断发展和人际交往的增加,嗜酒人群所占比例上升,酒精所引发的疾病和问题也日益严重,急性酒精中毒己经成为节假日发病率最高的疾病之一[1]。开发安全、高效的抗醉解酒制品,并对其作用效果和作用机理进行探索,更好地服务消费者,极为必要。
目前中国关于解酒药物的研究主要集中在传统中药的复方及初提物方面,如复方葛根合剂[2]、葛花[3]、枳椇子水提物[4]、茶及提取物[5-6]、橄榄解酒饮[7]等。而对于一种普通食品原料——KGM,其研究报道主要集中在作为增稠剂、保水剂、胶凝剂、成膜剂、改善食品品质、模拟天然食品、改性等方面[8],在解酒功效研究方面还比较少。梁娜等[9]对KGM防醉解酒作用进行了评价。本试验拟进一步确定试验小鼠的醉酒剂量,并研究KGM抗醉解酒作用机理,以期为KGM及其相关解酒产品的开发和应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试验原料
KGM(160~200目):含量>90%,重庆康家客食品有限公司;
红星二锅头:56%vol,北京红星股份有限公司。
1.1.2 试验试剂
氯化钠:分析纯,成都市科龙化工试剂厂;
乙醇、异丙醇:色谱纯,成都市科龙化工试剂厂;
乙醇脱氢酶(ADH)试剂盒、乙醛脱氢酶(ALDH)试剂盒、细胞色素(P450)试剂盒、丙二醛(MDA)试剂盒:南京建成生物工程研究所;
一氧化氮(NO)试剂盒、超氧化物歧化酶(SOD)试剂盒、前列腺素(PGE2)试剂盒:郑州唯尔生物科技有限公司。
1.1.3 主要设备和仪器
台式高速离心机:5810型,德国Eppendorf公司;
数显恒温水浴锅:HH-4型,金坛市富华仪器有限公司;
电热恒温鼓风干燥箱:DHG-9070A型,上海齐欣科学仪器有限公司;
电子天平:JTI0001型,上海精天电子仪器有限公司;
气相色谱仪:GC-2010型,日本岛津公司;
酶标仪:HIMG型,基因有限公司。
1.1.4 试验动物 试验动物昆明种小鼠,雄性,体重范围(20±2) g,由腾鑫生物技术有限公司提供,动物合格证号:SCXK-(军)2012-0011,检疫后备用。小鼠饲料、垫料,由腾鑫生物技术有限公司提供。饲养环境:动物饲养房温度保持在22~24 ℃,相对湿度40%~60%,定时通风换气,自然明暗周期12 h(开灯8:00~20:00)。恒温恒湿,标准饲料,自由饮水。
1.2 KGM对急性酒精中毒小鼠的解酒作用
1.2.1 醉酒剂量的确定 取昆明种小鼠40只,经1周的适应性喂养后,随机分为4组,每组10只。禁食12 h后,各组按体重分别灌胃56%vol白酒13,14,15,16 mL/kg·BW。记录小鼠的醉酒率和死亡率。选择醉酒率最高死亡率最低的灌酒剂量。翻正反射消失即为醉酒,反之为不醉。
1.2.2 醉酒治疗试验 40只昆明种小鼠,适应性喂养1周后,将小鼠随机分为4组,每组10只。4组小鼠处理前12 h禁食不禁水。每组小鼠按14 mL/kg体重灌胃56%vol红星二锅头,再分别给药:模型组小鼠(灌服等容积生理盐水),低、中、高剂量组小鼠分别按0.4 mL/20 g体重灌胃浓度为170,240,400 mg/kg的KGM溶液。试验前对各组小鼠进行称量、标号并记录。
观察各组小鼠的活动情况[9-10]并记录小鼠醉酒数、死亡数、给酒时间、翻正反射消失时间和翻正反射恢复时间。醉酒潜伏期=翻正反射消失时间-给酒时间;睡眠时间=翻正反射恢复时间-翻正反射消失时间;醒酒时间=翻正恢复时间-给酒时间。
1.3 KGM对急性酒精中毒小鼠的解酒机理探究
1.3.1 试验动物分组及给药 昆明种雄性小鼠50只,适应性喂养1周后,将小鼠随机分为5组(正常组,模型组,KGM低、中、高剂量组),每组10只。试验前对各组小鼠进行称量、标号并记录。试验前12 h禁食不禁水。试验组分别按0.4 mL/20 g体重灌胃浓度为170,240,400 mg/kg的KGM溶液,空白组和模型组以等容积的生理盐水灌胃,30 min后模型组和KGM组均以56%vol红星二锅头白酒灌胃。各组均一次性灌胃给药,灌胃容积均按14 mL/kg体重执行。
1.3.2 样本采集和处理 各组小鼠造模后,于0.5,1.0,1.5,2.0,2.5 h各时间节点进行眼眶静脉采血,并将其置于37 ℃的水浴锅中,静置2 h后,于3 000~4 000 r/min离心10 min,取上层血清,分装于4 ℃冰箱保存。灌酒2.5 h后,脱臼处死小鼠,剖腹,分离出肝组织以制备肝组织匀浆;剖腹取胃,沿胃大弯剪开,用冷生理盐水漂洗,滤纸吸干,将胃组织制备组织匀浆[11]。
1.3.3 KGM对小鼠血清乙醇浓度的影响
(1) 标准曲线的制作: 取浓度梯度为50,100,150,200,250,300,350 mg/100 mL的无水乙醇溶液(密度0.789~0.791 g/mL)100 μL,各加浓度为100 mg/100 mL的内标物异丙醇溶液(密度0.784~0.786 g/mL)500 μL,3 000 r/min 离心5 min,取上清液0.6 μL进样。并记录各自的峰面积,每个梯度的样品平行进样3次,绘制内标标准曲线,纵坐标为待测组分(乙醇)与内标物(异丙醇)的峰面积之比,横坐标为乙醇与异丙醇的含量之比。标准曲线见图1。

图1 乙醇标准曲线Figure 1 The standard curve of ethanol
(2) 样品处理:取血清100 μL,并于0.45 μm滤膜滤过。加内标物质500 μL,3 000 r/min 离心5 min,取上清液0.6 μL注入进样瓶[12]。
(3) 分析条件:GC-2010 型气相色谱仪,柱子:PEG-20M融硅石英毛细管柱;内标物质:100 mg/100 mL 异丙醇;进样口温度190 ℃;分流进样;检测器(FID)温度240 ℃;气体流速:空气400 mL/min,氢气40 mL/min,尾吹(氮气)40 mL/min,色谱柱流量0.97 mL/min;进样量0.6 μL;柱温:程序升温,55 ℃保留6 min,再以5 ℃/min升温至70 ℃,保留40 s,然后以30 ℃/min升温至110 ℃[13]。
1.3.4 对胃组织生化指标的检测 采用酶联免疫吸附法测定小鼠血清、胃组织匀浆中SOD活性、NO含量、PGE2含量;采用TBA法测定小鼠血清、胃组织匀浆中MDA含量,严格按照试剂盒说明书操作。
1.3.5 对肝组织生理指标的检测 采用酶联免疫吸附法测定小鼠肝组织匀浆中ADH、ALDH、P450的水平,严格按照试剂盒说明书操作。
1.4 数据处理
采用SPSS 18.0软件进行统计处理,计量资料用平均数±标准差表示,组间比较采用单因素方差分析(LSD)。当P<0.05时,有统计学意义,有显著性差异。
2 结果与分析
2.1 KGM对急性酒精中毒小鼠的解酒作用
2.1.1 醉酒剂量的确定 小鼠醉酒剂量的确定试验,结果见表1。13 mL/kg灌胃剂量组醉酒率和死亡率分别为60%和0%,说明灌胃剂量偏小,未达到小鼠醉酒剂量。16 mL/kg灌胃剂量组小鼠醉酒率达到100%,但由于剂量太高,小鼠死亡率达到了40%。而14 mL/kg灌胃剂量组小鼠的醉酒率最高达到90%,而死亡率最低只有10%。因此选择此剂量为后续小鼠急性酒精中毒试验的最适灌酒剂量,与文献[10]所得结果一致,与梁娜等[9]的结果稍有差异。
2.1.2 醉酒治疗试验 为了研究KGM抗醉酒效果,试验采取先酒后药的处理,结果见表2。与模型组比较,高、中剂量组能显著(P<0.05)缩短小鼠的睡眠时间和醒酒时间,并且高剂量组可以显著(P<0.05)延长小鼠的醉酒潜伏期。低剂量组小鼠较模型组无显著性差异(P>0.05)。进一步比较可见,高、中剂量组入睡小鼠数减少。结果揭示,KGM具有解酒的效果。

表1 酒精剂量对小鼠醉酒的影响Table 1 The effects of ethanol dosage on mice ebriety (n=10)
2.2 KGM对急性酒精中毒小鼠的解酒机理探究
2.2.1 KGM对小鼠血清乙醇浓度的影响 各试验组小鼠血清中乙醇浓度变化见表3。与模型组相比,KGM各试验组可降低血清中乙醇含量:在60,90,150 min时,高、中剂量组小鼠血清中乙醇含量显著(P<0.05)减少;而120 min时,虽然没有显著减少,但有减少的趋势。模型组在 90 min时,血清中乙醇含量最高,而各KGM组在120 min时,达到最高,但高、中剂量组均低于模型组。而低剂量组小鼠血清中乙醇浓度较模型组变化无显著性意义(P>0.05)。结果揭示KGM具有抑制乙醇吸收,降低血清中乙醇浓度的作用,且高、中剂量组效果更显著,优于低剂量组。
2.2.2 各组小鼠胃组织匀浆的生化指标
(1) 小鼠胃组织匀浆中SOD活力和MDA含量:文献报道[14]表明胃黏膜损伤与自由基有关。酒精代谢过程中会产生大量的自由基,因而氧化损伤是酒精对机体产生毒性效应的重要原因之一[15]。MDA是重要的脂质过氧化反应产物之一,可反映机体内脂质过氧化程度,测定其含量常能间接反映细胞损伤的程度。SOD是对机体氧化与抗氧化系统保持平衡起着重要作用的抗氧化酶之一,具有清除氧自由基,并保护细胞免受损伤的功能[16]。细胞受损伤的程度可由SOD活力水平间接地反应[14,17]。因此,SOD活性和MDA含

表2 KGM对小鼠的醉酒治疗效果†Table 2 Therapeutic effect of konjac gum powder on ebriety of mice (n≥7)
† 同列不同字母的组间存在显著性差异(P<0.05)。
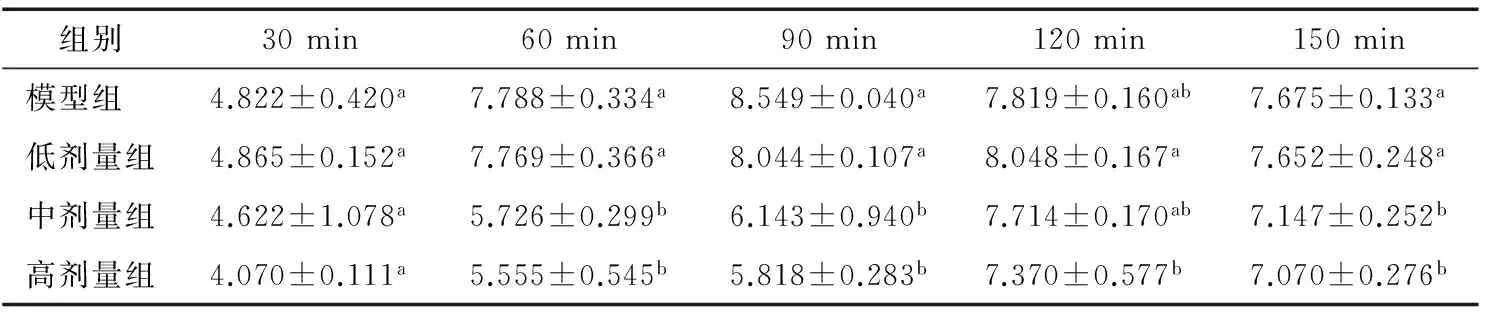
表3 KGM对小鼠不同时间点血清中乙醇浓度的影响†Table 3 The effects of konjac gum powder on ethanol concentration of time courses in serum in mice (n≥8) mg/mL
† 同列不同字母的组间存在显著性差异(P<0.05)。
量的测定被认为是衡量由于脂质过氧化作用和超氧自由基引起的胃黏膜损伤程度的“黄金标准”[18]。
KGM对酒精致胃黏膜损伤小鼠胃黏膜组织MDA含量和SOD活力的影响见表4。与空白组比较,模型组小鼠胃黏膜组织中MDA含量显著(P<0.05)升高,SOD活力显著(P<0.05)降低,说明酒精致胃黏膜损伤模型的形成与胃黏膜MDA含量升高和SOD活力降低有关。与模型组比较,低、中、高剂量组小鼠胃黏膜组织中MDA含量显著(P<0.05)降低,高剂量组SOD活力显著(P<0.05)升高,中剂量组SOD活力也有增高的趋势。而低剂量组小鼠SOD水平较模型组变化无显著性差异(P>0.05)。中、高剂量组小鼠胃黏膜组织中SOD和MDA水平分别与空白组小鼠比较无显著性意义(P>0.05)。说明KGM可以减少脂质过氧化物反应,保护胃黏膜;降低胃黏膜中MDA含量,提高SOD活力是保护胃黏膜的有效途径,且呈一定的量效关系,当剂量达到中、高剂量组效果更优。由此提示,KGM可能通过降低小鼠胃黏膜组织中MDA含量,提高SOD活力来预防小鼠胃黏膜损伤。
表4 KGM对酒精致胃黏膜损伤小鼠胃黏膜组织MDA含量和SOD活力的影响†
Table 4 Effect of konjac gum powder on MDA content and SOD activity in mice gastric mucosa with alcohol-induced injury (n≥8)

组别MDA含量/(nmol·mg-1·Pro)SOD活力/(U·mL-1·Pro)空白组 2.522±0.620c23.324±4.885a模型组 5.410±1.536a17.853±3.711b低剂量组3.936±0.786b17.790±2.271b中剂量组3.346±1.107bc19.407±4.198ab高剂量组2.849±1.033bc23.629±5.305a
† 同列不同字母的组间存在显著性差异(P<0.05)。
(2) 小鼠血清中SOD活力和MDA含量:KGM对酒精致胃黏膜损伤小鼠血清中MDA含量和SOD活力的影响见表5。与空白组比较,模型组小鼠血清中SOD活力显著(P<0.05)降低,MDA含量显著(P<0.05)升高,说明酒精致胃黏膜损伤模型的形成与小鼠血清中MDA含量升高和SOD活力降低有关。与模型组小鼠比较,中、高剂量组小鼠血清中MDA含量显著(P<0.05)降低,SOD活力显著(P<0.05)升高。而低剂量组小鼠较模型组小鼠血清中MDA含量和SOD活性变化无显著性意义。高剂量组小鼠血清中SOD和MDA水平分别与空白组小鼠比较无显著性意义(P>0.05)。由此提示,KGM可能通过降低小鼠血清中MDA含量,提高SOD活力来预防小鼠胃黏膜损伤,且呈一定的量效关系,当达到中、高剂量时发挥作用。
(3) 小鼠胃组织匀浆及血清中NO含量:NO是胃黏膜重要的防御因子之一,具有自由基化学特性,是胃肠道非肾上腺素能使神经释放的一种信使分子和神经递质。有研究[19-20]表明,NO对胃黏膜起到保护作用可能与其具有调节胃十二指肠黏膜血流量、胃脉管系统的基础张力和胃的酸碱平衡,维持胃黏膜完整性和微血管屏障正常功能,改善血管通透性,减轻炎症反应的作用有关。此外,NO可以降低胃黏膜中过氧化物酶活性,促进胃黏液分泌起到保护胃黏膜作用[21]。
表5 KGM对酒精致胃黏膜损伤小鼠血清MDA含量和SOD活力的影响†
Table 5 Effect of konjac gum powder on MDA content and SOD activity in mice serum with alcohol-induced injury (n≥8)

组别MDA含量/(nmol·mL-1)SOD活力/(U·mL-1·Pro)空白组 14.492±2.840b58.199±1.982a模型组 18.224±2.566a49.912±3.919c低剂量组18.064±2.859a51.394±2.471bc中剂量组14.906±2.324b53.825±1.580b高剂量组13.684±2.279b60.431±4.973a
† 同列不同字母的组间存在显著性差异(P<0.05)。
由图2、3可知,模型组小鼠胃黏膜和血清中NO含量显著(P<0.05)低于空白组小鼠,说明酒精致胃黏膜损伤模型的形成和NO含量过低有关。中、高剂量组小鼠血清中NO含量与模型组小鼠相比均显著(P<0.05)升高,高剂量组小鼠胃黏膜中NO含量较模型组小鼠显著(P<0.05)升高,说明升高胃黏膜及血清中NO含量是KGM预防酒精致胃黏膜损伤的一个途径。低剂量组对小鼠胃黏膜和血清中NO含量升高作用不明显(P>0.05);中、高剂量组小鼠血清和胃黏膜中NO含量较空白组小鼠差异不显著(P>0.05)。提示KGM只有达到一定的剂量作用效果才明显;KGM可能通过升高小鼠胃黏膜和血清中NO含量来预防酒精致胃黏膜损伤。
(4) 小鼠胃组织匀浆及血清中PGE2含量:前列腺素(PGs)是胃黏膜另一重要防御因子,广泛分布于胃和十二指肠等消化道,研究[22]表明其与溃疡病的发生有密切关系,具有很强的细胞保护作用。PGE2是花生四烯酸的衍生物,由胃黏膜上皮细胞和十二指肠黏膜不断合成、释放,是首先被发现具有细胞保护作用的内源性物质。PGE2通过增强胃黏膜的屏障作用,增加黏膜表面黏液分泌和黏膜血流量,刺激胃、十二指肠黏膜基底细胞向表面移动以促进其修复,清除氧自由基,抑制胃酸等来保护胃黏膜[23-25]。有研究[26]表明,乙醇通过抑制内源性前列腺素合成所必需的环氧化酶活性来干扰前列腺素的合成,从而削弱其对胃黏膜的保护作用,导致胃黏膜损伤如溃疡、出血、糜烂、穿孔等。

不同字母表示组间存在显著性差异(P<0.05)图2 KGM对酒精致胃黏膜损伤小鼠胃黏膜组织NO 含量的影响
Figure 2 Effect of konjac gum powder on NO content in mice gastric mucosa with alcohol-induced injury (n≥8)

不同字母表示组间存在显著性差异(P<0.05)图3 KGM对酒精致胃黏膜损伤小鼠血清NO含量的影响
Figure 3 Effect of konjac gum powder on NO content in mice serum with alcohol-induced injury (n≥8)
由图4、5可知,模型组小鼠胃黏膜和血清中PGE2含量显著(P<0.05)低于空白组小鼠,说明酒精致胃黏膜损伤模型的形成和PGE2含量过低有关。与模型组比较,高剂量组小鼠胃黏膜中PGE2含量显著(P<0.05)升高,中、高剂量组小鼠血清中PGE2含量均显著(P<0.05)升高。虽然中剂量组小鼠胃黏膜PGE2含量较模型组差异无统计学意义,但有升高的趋势。说明升高胃黏膜及血清中PGE2含量是KGM
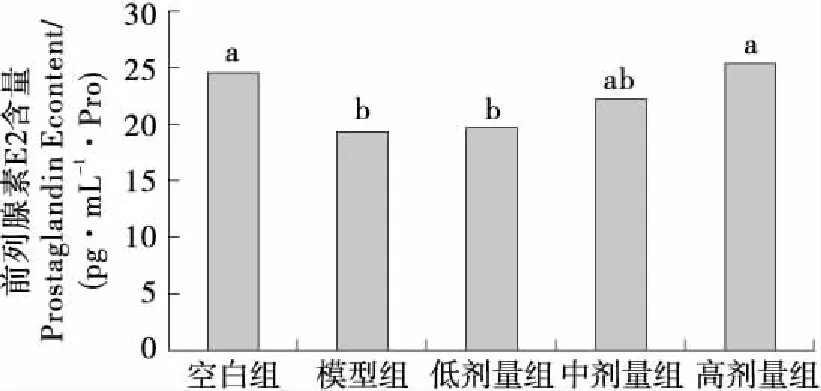
不同字母表示组间存在显著性差异(P<0.05)图4 KGM对酒精致胃黏膜损伤小鼠胃黏膜组织 PGE2含量的影响
Figure 4 Effect of konjac gum powder on PGE2 content in mice gastric mucosa with alcohol-induced injury (n≥8)

不同字母表示组间存在显著性差异(P<0.05)图5 KGM对酒精致胃黏膜损伤小鼠血清PGE2含量的影响
Figure 5 Effect of konjac gum powder on PGE2 content in mice serum with alcohol-induced injury (n≥8)
预防酒精致胃黏膜损伤的一个途径。低剂量组对小鼠胃黏膜和血清中PGE2含量较模型组小鼠差异不显著(P>0.05),试验结果与黄进波等[27]的一致。提示KGM只有到一定的剂量作用效果才明显;KGM可能通过升高小鼠胃黏膜和血清中PGE2含量来预防酒精致胃黏膜损伤。
2.2.3 各组小鼠肝组织匀浆中ADH、ALDH及P450的含量 肝脏既是人体中最大的腺体也是极其重要的代谢器官。血液中90%的乙醇都在肝脏中代谢,当肝脏中乙醇浓度较低时,主要通过乙醇脱氢酶(ADH)和乙醛脱氢酶(ALDH)代谢。ADH将乙醇转化为乙醛,在ALDH参与下乙醛转变成乙酸,最后氧化成CO2和H2O,排除体外[28]。当乙醇浓度超过10 mmol/L,乙醇氧化系统(MEOS)被激活成主要的酒精代谢途径,在细胞色素P450存在和烟酰胺腺嘌呤二核苷酸磷酸(NADPH)参与下乙醇转化为乙醛,P450主要分布在内质网和细胞线粒体内,其中含量最高的是肝脏微粒体[29]。其中P450ⅡE1是P450家族中重要的成员,主要在肝脏中表达,可被乙醇诱导活化,参与酒精代谢,产生大量自由基,导致脂质过氧化;并可以活化多种异源性物质产生有毒物质。近年来有研究[30]将其与酒精性肝病联系起来,发现在乙醇的作用下,P450ⅡE1酶含量增强[30]。
各试验组小鼠肝组织匀浆中ADH、ALDH含量以及细胞色素P450含量的变化见表6。由表6可知,与模型组小鼠比较,高剂量组小鼠肝脏组织匀浆中ADH和P450含量均显著(P<0.05)升高;中剂量组中ADH含量显著(P<0.05)升高,ALDH、P450含量虽然没有显著升高,但是有升高的趋势。而低剂量组ADH、ALDH、P450含量较模型组变化无显著性意义(P>0.05)。结果提示一定浓度的KGM可以提高肝脏中ADH、ALDH和P450含量,存在量效效应,从而加速酒精代谢,发挥解酒作用。
表6 KGM对乙醇小鼠肝中乙醇脱氢酶、乙醛脱氢酶和细胞色素P450含量的影响†
Table 6 The effects of konjac gum powder on contents of ADH,ALDH and P450 in mice liver with acute alcoholism (n≥8)
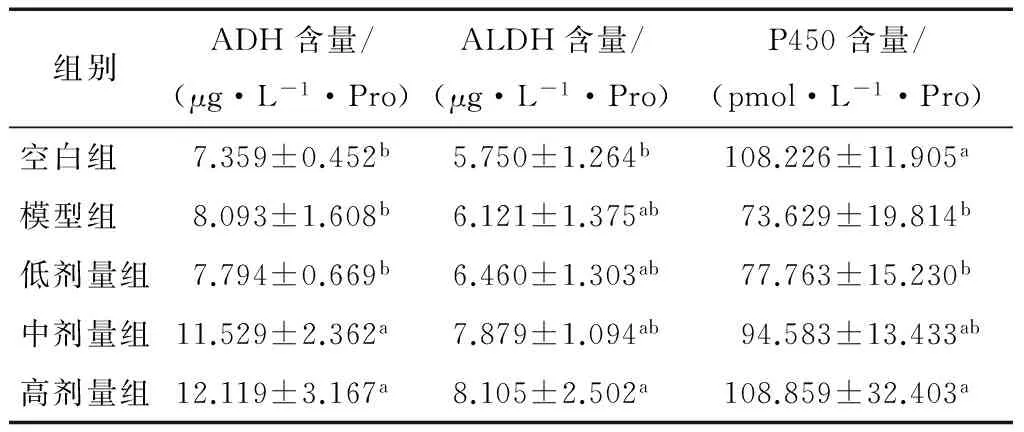
组别ADH含量/(μg·L-1·Pro)ALDH含量/(μg·L-1·Pro)P450含量/(pmol·L-1·Pro)空白组 7.359±0.452b5.750±1.264b108.226±11.905a模型组 8.093±1.608b6.121±1.375ab73.629±19.814b低剂量组7.794±0.669b6.460±1.303ab77.763±15.230b中剂量组11.529±2.362a7.879±1.094ab94.583±13.433ab高剂量组12.119±3.167a8.105±2.502a108.859±32.403a
† 同列不同字母的组间存在显著性差异(P<0.05)。
成杨等[31]的研究表明:急性酒精灌胃导致大鼠肠道细菌菌落发生明显改变,而通过进药干预,可调节酒精所致的肠道菌群失调。KGM对小鼠盲肠内容物的体外厌氧发酵,可促进发酵液pH值明显降低,短链脂肪酸、乳酸菌、双歧杆菌的数量显著增加,肠道潜在致病菌(大肠杆菌、梭状杆菌、拟杆菌)的增值不明显[32]。
3 结论
本试验结果提示,中、高剂量的KGM具有防醉、解酒功效,作用机理:① 可能是其抑制酒精的吸收,降低血清中乙醇浓度;② 减轻了酒精对胃黏膜的损伤,并提高了ADH、ALDH、P450含量,通过乙醇脱氢酶和乙醇氧化酶系统加速酒精代谢,发挥其防醉解酒作用。但KGM在调节肠道微生物菌群达到抗醉解酒作用关系方面还有待进一步研究。
[1] 徐正婕, 陆伦根. 酒精性肝病的流行病学和自然史[J]. 中国处方药, 2010(1): 32-33.
[2] 王晶, 李洪敏, 艾芳, 等. 葛根素的提取及对小鼠解酒护肝功能的鉴定[J]. 局解手术学杂志, 2015, 24(4): 358-361.
[3] 高学清, 汪何雅, 钱和, 等. 葛根和葛花对急性酒精中毒小鼠的解酒作用[J]. 食品与生物技术学报, 2012, 31(6): 621-627.
[4] 黄利民, 陈洁若, 唐苗, 等. 枳椇子复方制剂对急性酒精中毒的作用研究[J]. 华章, 2014(1): 369-370.
[5] 王岳飞, 郭辉华, 丁悦敏, 等. 茶多酚解酒作用的实验研究[J]. 茶叶, 2003, 29(3): 145-147.
[6] 徐良, 邹欣涛, 岑丽华, 等. 玉液康凉茶保健饮料的解酒护肝胃作用研究[J]. 中国医药导刊, 2012, 14(s1): 193-200.
[7] 彭勃, 苗明三, 王颖芳. 橄榄解酒饮对大小鼠急性酒精性肝损伤的影响[J]. 上海中医药杂志, 2003, 37(10): 48-51.
[8] 周韵, 赵丹, 辰巳英三, 等. 魔芋葡甘露聚糖在食品产业中的研究进展[J]. 食品与机械, 2013, 29(4): 258-262.
[9] 梁娜, 秦清娟, 邹勇, 等. 魔芋葡甘聚糖对小鼠的防醉解酒作用[J]. 食品工业科技, 2015, 36(14): 366-369.
[10] 项伟. 常用调控酒精代谢物质及其制品解酒效果的动物试验研究[D]. 长沙: 湖南农业大学, 2006: 23.
[11] 梁桂宁. 紫菜多糖保护小鼠胃黏膜免受酒精急性损伤的机制研究[D]. 南宁: 广西医科大学, 2009: 9.
[12] 李世杰, 郑雯, 冯其光. 血液中乙醇浓度检测方法[J]. 预防医学情报杂志, 2007, 23(1): 124-126.
[13] 苟锡斌. 气相色谱法测定血液中乙醇含量[J]. 预防医学情报杂志, 2003, 19(2): 188.
[14] GRANGER D N, RUTILI G, MCCORD J M. Superoxide radicals in feline intestinal ischemia[J]. Gastroenterology, 1981, 81(1): 22-29.
[15] PETERSEN O H, SUTTON R. Ca2+signalling and pancreatitis: effects of alcohol, bile and coffee[J]. Trends in Pharmacological Sciences, 2006, 27(2): 113-120.
[16] MCCORD J M, KEELE B B, FRIDOVICH I. An enzyme-based theory of obligate anaerobiosis: the physiological function of superoxide dismutase[J]. Proceedings of the National Academy of Sciences, 1971, 68(5): 1 024-1 027.
[17] NARTEY E T, OFOSUHENE M, AGBALE C. Anti-ulcerogenic activity of the root bark extract of the African laburnum “Cassia sieberiana” and its effect on the anti-oxidant defence system in rats[J]. BMC Complementary and Alternative Medicine, 2012, 12(1): 247.
[18] RAHIM N A, HASSANDARVISH P, GOLBABAPOUR S, et al. Gastroprotective effect of ethanolic extract of Curcuma xanthorrhiza leaf against ethanol-induced gastric mucosal lesions in Sprague-Dawley rats[J]. Bio Med Research International, 2014: 2 014.
[19] YANG Li, WANG Wei-ping, WANG Hong-ying, et al. Intragastric administration of hepafin enhan ees gastric ulcer healing through a nitric oxide-dependent mechanism in rats[J]. European Journal of Pharmacology, 2000, 399(2): 205-214.
[20] WU Da-feng, CEDERBAUM A I. Alcohol, oxidative stress, and free radical damage[J]. Alcohol Research and Health, 2003, 27: 277-284.
[21] QUI Bo-sheng, MEI Qi-bing, LIU Li, et al. Effects of nitric oxide on gastric ulceration induced by nicotine and cold-restraint stress[J]. World Journal of Gastroenterology, 2004, 10(4): 594-597.
[22] 曲怡, 才丽平, 郑洪新, 等. 中药消痈溃得康对乙酸胃溃疡模型大鼠PGE2及EGF含量的影响[J]. 中华中医药杂志, 2011(10): 2 255-2 257.
[23] 董秋梅, 米子良, 杜锦辉, 等. 胃和冲剂对乙酸法大鼠胃溃疡模型及其血浆PGE_2含量的影响[J]. 中国中医药信息杂志, 2002(12): 26-28.
[24] 李冀, 毕珺辉, 孙宇峰. 四逆散抗实验性胃溃疡的药效学及作用机理研究[J]. 中华中医药学刊, 2007(7): 1 317-1 319.
[25] 王长洪. 前列腺素与胃黏膜病变[J]. 中国中西医结合脾胃杂志, 1995(1): 50-51.
[26] OH T Y, AHN G J, CHOI S M, et al. Increased susceptibility of ethanol-treated gastric mucosa to naproxen and its inhibition by DA-9601, an Artemisia asiatica extract[J]. World Journal of Gastroenterology, 2005, 11(47): 7 450-7 456.
[27] 黄进波, 萧钦, 周佳佳, 等. 竹叶黄酮对乙醇诱导小鼠急性胃黏膜损伤的保护作用[J]. 现代药物与临床, 2015(7): 779-783.
[28] YIN Shih-jiun, LIAO Chin-shya, WU Chew-wun, et al. Human stomach alcohol and aldehyde dehydrogenases: comparison of expression pattern and activities in alimentary tract[J]. Gastroenterology, 1997, 112(3): 766-775.
[29] 胡屹屹. 猪肝微粒体细胞色素P450酶系的初步研究[D]. 南京: 南京农业大学, 2006: 3.
[30] 朱海珍, 魏文树. 细胞色素P450 2E1与酒精性肝病[J]. 海峡药学, 2008, 20(10): 11-14.
[31] 成杨, 汪海慧, 胡义杨, 等. 急性酒精肝损伤大鼠肠道细菌群落变化及健脾活血方干预的ERIC-PCR指纹图谱检测[C]// 中华中医药学会全国第十四次肝胆病学术会议论文汇编. 上海: 中华中医药学会内科分会(肝胆病专业), 2010: 228-238.
[32] 秦青娟, 邓利, 徐小青, 等. 魔芋葡甘聚糖及其衍生物肠道益生性的体外发酵评价[J]. 食品科学, 2015, 36(15): 217-220.
The mechanism for anti-drunk and anti-inebriation of Konjac Glucomannan
ZHENGLian-ji1,2
DENGLi-ling1
LUOJia-ni1
ZHANGShuai1
DENGLi1
ZHONGGeng1,3
(1.CollegeofFoodScienceSouthwestUniversity,Chongqing400716,China; 2.ChongqingFoodTechnologyInstitute,Chongqing400042,China; 3.ChongqingEngineeringResearchCenterofRegionalFood,Chongqing400715,China)
In this study, different doses of konjac gum powder (KGM) were administered to Kunming mice to study their the anti-drunk hangover effects and its mechanism, and the model was made by intragastric administration of 56 %vol liquor of Red Star Erguotou, China. The results showed that the middle dose (240 mg/kg) and high dose (400 mg/kg) of KGM could effectively prolong the climb time and Latency time of drunkenness, and could significantly shorten the drunken mice sleeping time and sobering time. The ethanol concentration of serum in the high and middle dose groups was significantly lower than that in the model group, and the contents of alcohol dehydrogenase (ADH), aldehyde dehydrogenase (ALDH) and cytochrome P450 (P450) in liver homogenate significantly increased in high dose group. The contents of malondialdehyde (MDA) in gastric mucosal tissues and serum in the middle and high dose groups significantly decreased, while the activities of superoxide dismutase (SOD), nitric oxide (NO) and prostaglandin E2 significantly increased. The anti-alcohol hangover mechanism of KGM might be as follows. On the one hand, alcohol absorption was inhibited by the KGM and the ethanol concentration in serum is reduced. On the other hand, the decrease of MDA content, and the increase of SOD activity, NO and PGE in gastric mucosa and serum decreased the damage of gastric mucosa, and increased the ADH, ALDH, P450. Thusand the alcohol metabolism was accelerated through alcohol dehydrogenase and ethanol oxidase system, then its anti-drunk hangover role was played.
Konjac Glucomannan (KGM); anti-drunk & anti-inebriation; effect & mechanism; animal experiment
重庆市基础科学与前沿技术研究项目(编号:CSTC 2013jcyjA00028);重庆市“121”科技示范工程项目(编号:CSTC 2014fazktjcsf80052);重庆市特色食品工程技术研究中心能力提升项目(编号:CSTC 2014pt-gc8001)
郑连姬,女,重庆食品工业研究所高级工程师,西南大学在读博士研究生。
钟耕(1964—),男,西南大学教授,博士。 E-mail:zhongdg@126.com
2016—12—21
10.13652/j.issn.1003-5788.2017.05.032
