原发性肾病综合征患者发生类固醇糖尿病的危险因素分析
2017-07-05盛爱芹涂远茂郭锦洲刘志红李世军
盛爱芹 涂远茂 郭锦洲 杜 宏 刘志红 李世军
原发性肾病综合征患者发生类固醇糖尿病的危险因素分析
盛爱芹1涂远茂1郭锦洲1杜 宏2刘志红1李世军1
目的:探讨原发性肾病综合征患者类固醇糖尿病(SDM)的发病率及危险因素。 方法:回顾分析2011年1月至2015年12月,南京总医院国家肾脏疾病临床医学研究中心糖皮质激素(GC)治疗后发生SDM的原发性肾病综合征患者的临床资料。根据糖代谢的变化分为SDM组,糖调节受损组和糖代谢正常组。比较各组间患者的基线临床特征及实验室指标,行Logistic回归分析SDM的危险因素。 结果:2 281例原发性肾病综合征患者中671例出现糖代谢紊乱,其中142例为SDM。81.7%的SDM在GC治疗1年内诊断,中位时间为108d。年龄、局灶性节段性肾小球硬化症、肾小球滤过率及空腹血糖与糖代谢紊乱的发生具有相关性,三组间统计学差异显著。SDM组患者的体质量指数、高血压2级以上(含2级)所占比例、合并使用他克莫司的比例、高尿酸血症及三酰甘油水平与糖代谢正常组相比,统计学差异显著,而与糖调节受损组相比无统计学差异。多因素Logistic回归分析显示:女性、高龄、空腹血糖、高尿酸血症、三酰甘油、GC起始剂量以及合并使用他克莫司是使用GC治疗原发性肾病综合征患者发生SDM的独立危险因素。 结论:原发性肾病综合征患者使用GC治疗后糖代谢紊乱的发病率高。女性、高龄、空腹血糖升高、高尿酸血症、高三酰甘油血症、GC起始剂量较大及合并使用他克莫司是SDM的独立危险因素。
肾病综合征 糖皮质激素 类固醇糖尿病 危险因素
类固醇糖尿病(SDM)是最常见的药物性糖尿病[1],多由于外源性应用糖皮质激素(GC)或内源性肾上腺皮质类固醇分泌异常增多而引起。目前认为既往无糖尿病病史,在使用GC期间出现血糖升高,同时达到目前糖尿病诊断标准即可诊断SDM[2]。SDM不利于原发病的控制,长期血糖控制不佳易并发各种糖尿病并发症(如心脑血管事件、视网膜病变、糖尿病肾病等)。GC是治疗原发性肾病综合征的主要药物[3],且多数患者需要长期服用。国外研究报道SDM的发病率在1.5%~47%不等[4-7]。目前,关于SDM的研究报道多来自肾移植受者和风湿病患者[4-5,7-8],尚缺乏关于肾病综合征并发SDM 的文献报道。本研究回顾性分析原发性肾病综合征患者随访期间发生SDM的临床资料,探讨SDM的发病率及危险因素,以提高临床医师对原发性肾病综合征合并SDM的认识。
对象和方法
研究对象 南京总医院国家肾脏疾病临床医学研究中心2011年1月至 2015年12月收治的原发性肾病综合征[包括局灶性节段性肾小球硬化症(FSGS)、微小病变肾病(MCD)、足细胞病、IgM肾病]患者共2 281例,所有患者均行肾活检明确诊断。
纳入标准 (1)结合肾活检穿刺病理及临床表现,明确诊断为原发性肾病综合征;(2)GC起始剂量≥30 mg/d(泼尼松量),持续时间≥4周;(3)门诊随访时间≥1月。
排除标准 (1)年龄<12 岁;(2)GC起始剂量<30 mg/d(泼尼松量);(3)门诊未随访;(4)严重的肝脏疾病、应激反应、胰腺炎等其他因素所致血糖明显升高;(5)使用GC前诊断糖尿病或接受降糖治疗(不含使用GC前存在糖调节受损者)。
2 281例原发性肾病综合征患者,GC治疗后529例患者出现糖调节受损(IGR),而发生SDM的患者有142例(图1),所有患者均在使用GC期间出现血糖升高,符合1999年WHO糖尿病诊断标准。
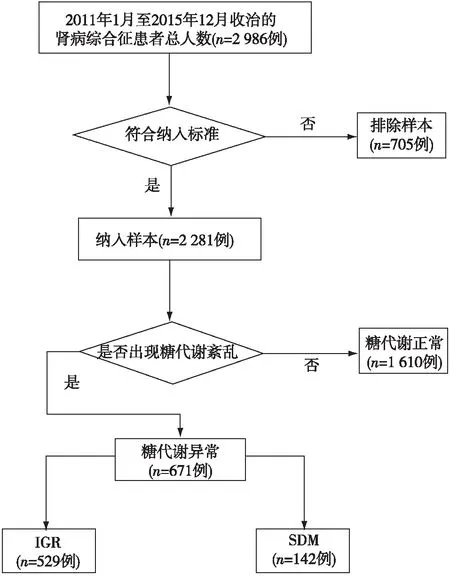
图1 原发性肾病综合征合并SDM患者的筛选流程1次血糖异常:患者使用GC治疗后仅出现1次空腹血糖≥7.0 mmol/L或随机血糖≥11.1 mmol/L或餐后2h血糖≥11.1 mmol/L;IGR:糖调节受损;SDM:类固醇糖尿病
相关定义 高血压:收缩压≥140 mmHg和(或)舒张压≥90 mmHg。空腹血糖受损(IFG):空腹血糖≥6.1 mmol/L且<7.0 mmol/L,且糖耐量试验(OGTT)2h血糖≥7.8 mmol/L。糖耐量减低(IGT):空腹血糖<7.0 mmol/L,但OGTT 2h血糖≥7.8 mmol/L且<11.1 mmol/L。低高密度脂蛋白胆固醇(HDL-C)血症:HDL<1.16 mmol/L(男性)或者<1.29 mmol/L(女性)。高尿酸血症:正常嘌呤饮食状态下,非同日两次空腹血尿酸水平男性高于420 μmol/L,女性高于360 μmol/L。
临床观察指标 统计患者肾病综合征起病时的性别、年龄、体质量指数(BMI)、糖尿病家族史、血压、合并用药、病理类型、GC起始剂量;实验室检查指标包括总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、HDL-C、血尿酸、采用CKD-EPI公式计算肾小球滤过率(eGFR)、血清白蛋白、24h尿蛋白定量、静脉空腹血糖。
统计学方法 使用SPSS 23.0软件进行统计分析。计量资料以均数±标准差,正态分布计量资料两组间比较采用t检验,多组间比较采用方差分析,两两比较采用LSD方法;非正态分布计量资料两组间比较用Wilcoxon秩和检验,多组间比较采用Kruskal-Wallis秩和检验。计数资料以百分比表示,组间比较采用卡方检验。单因素分析采用Logistic回归分析。以单因素分析中P<0.2的变量为候选变量,进入多因素Logistic回归模型分析,采用前进LR方法进行多因素筛选。采用ROC曲线的曲线下面积评价多因素回归模型的预测价值。所有检验均为双侧检验,P<0.05为差异有统计学意义。
结 果
一般资料 142例患者发生SDM,其中女性68例。年龄范围14~74岁(平均39.4±15.4岁),51例患者BMI≥24 kg/m2,22例患者使用GC前已存在糖调节受损,38例患者在GC治疗期间合并使用他克莫司,GC累积用量840~30 715 mg(5 000 mg)。
SDM发生时间 142例患者在GC治疗后的28d~28月(中位时间108d)发生SDM。3个月以内,3~6月,6~12月,12~24月,>24月SDM发生率依次为40.9%,21.1%,19.7%,16.9%,1.4%。81.7%的SDM在GC治疗1年内诊断。其中2例患者病程中多次出现病情复发,反复GC诱导持续2年以上出现SDM。
糖代谢异常患者特征 根据使用GC后糖代谢的变化分为三组:SDM组142例,IGR组529例和NGM组1 610例(表1)。随着年龄的增长、eGFR的下降及空腹血糖的升高,原发性肾病综合征患者发生糖代谢紊乱的可能性越大,三组之间统计学差异显著。糖尿病家族史阳性比例、GC起始剂量、TC、LDL-C、低HDL-C患者的比例、血清白蛋白、尿蛋白及高尿酸血症在三组间无统计学差异。
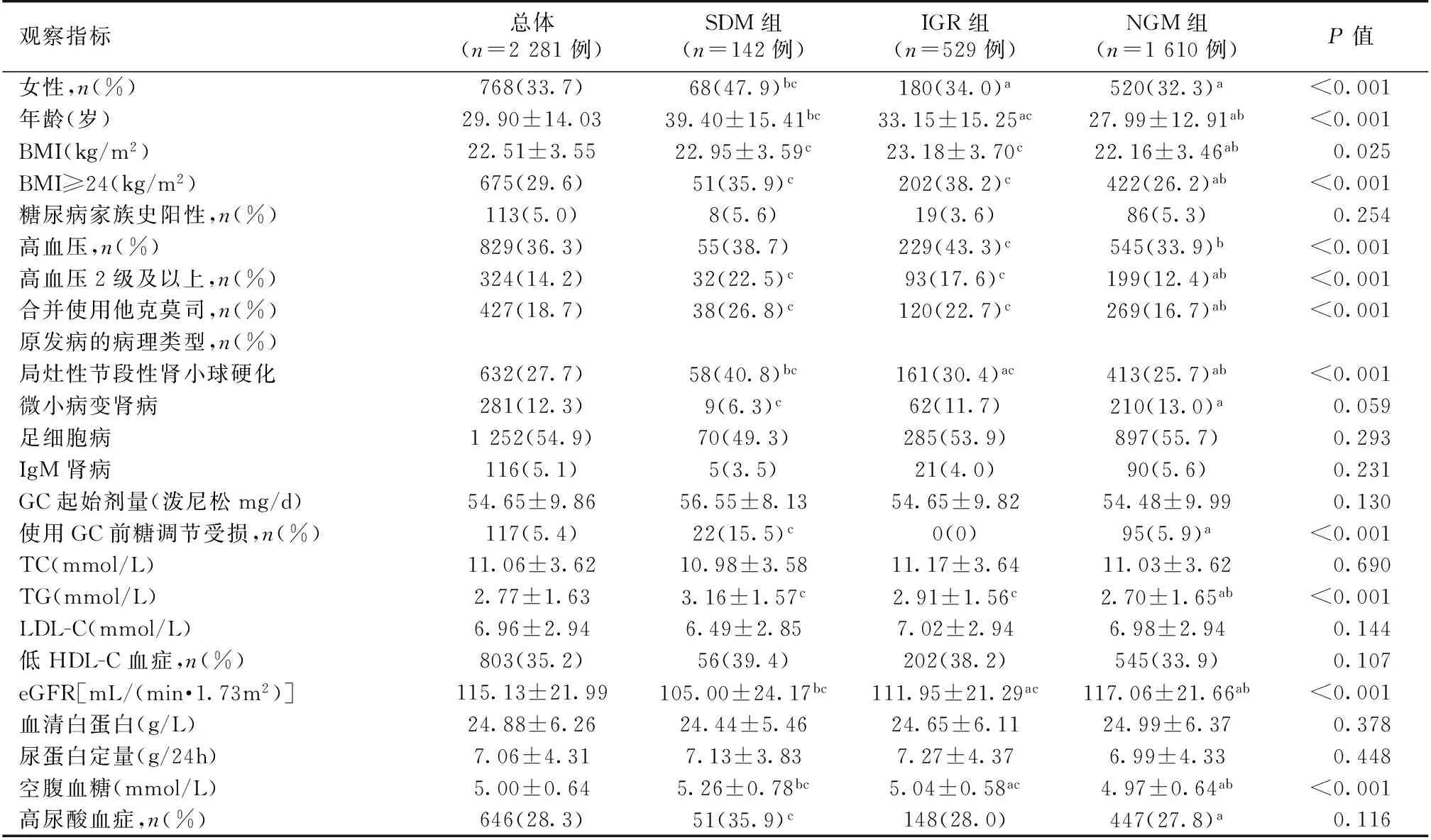
表1 不同糖代谢的原发性肾病综合征患者基线临床资料比较
SDM:类固醇糖尿病;IGR:糖调节受损;NGM:糖代谢正常;GC:糖皮质激素;BMI:体质量指数;TC:总胆固醇;TG:三酰甘油;LDL-C:低密度脂蛋白胆固醇;eGFR:估算的肾小球滤过率;a:与SDM组相比,P<0.05;b:与IGR组相比,P<0.05;c:与NGM组相比,P<0.05;GC用量均折合成泼尼松剂量(换算单位为:泼尼松5 mg=甲泼尼龙4 mg)
SDM组女性患者比例明显高于其他两组,BMI、高血压2级以上(含2级)所占比例、合并使用他克莫司的比例高尿酸血症及TG水平与NGM组相比,统计学差异显著,而与IGR组相比无统计学差异。
按原发疾病将患者分为FSGS、MCD、足细胞病及IgM肾病,发现SDM组FSGS患者所占比例最高,三组之间统计学差异显著。与NGM组相比,SDM组MCD患者较少(P<0.05),而与IGR组相比并无统计学差异,其他两种疾病组间分布无统计学差异。
影响糖代谢的因素 单因素 Logistic回归提示女性、年龄、BMI≥24 Kg/m2、高血压2级以上(含2级)、FSGS、合并使用他克莫司、GC起始剂量、TG、eGFR、高尿酸及空腹血糖是原发性肾病综合征患者发生SDM的危险因素。而MCD综合征患者则不易发生SDM(表2)。
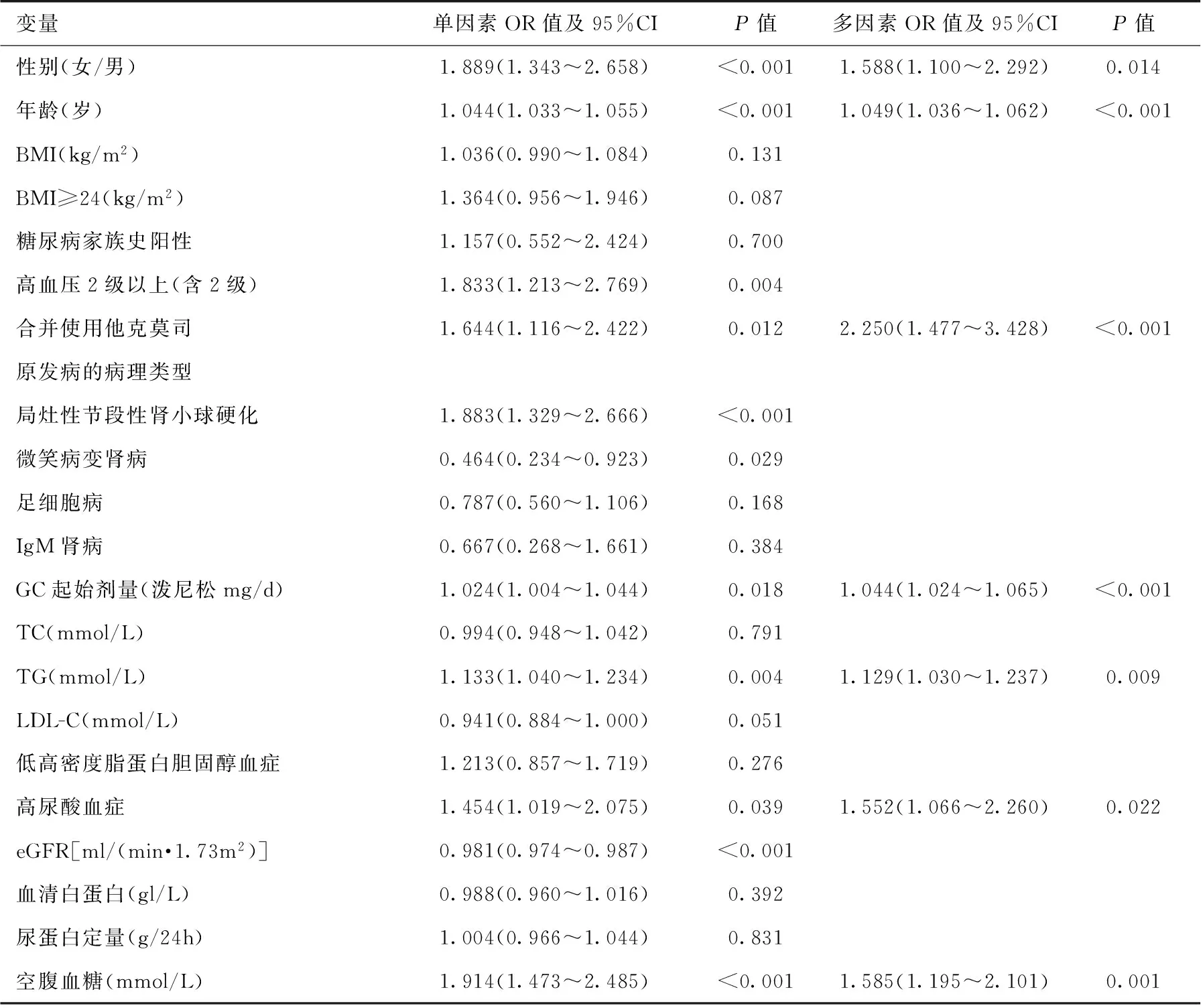
表2 GC治疗原发性肾病综合征发生SDM的单因素Logistic回归分析
GC: 糖皮质激素; SDM:类固醇糖尿病;BMI:体质量指数;TC:总胆固醇;TG:三酰甘油;LDL-C: 低密度脂蛋白胆固醇; eGFR: 估算 的肾小球滤过率
多因素Logistic回归分析发现,以是否并发SDM为因变量,性别、年龄、 BMI、血压、是否合并使用他克莫司、病理类型、GC起始剂量、三酰甘油、LDL-C、eGFR、是否高尿酸血症、空腹血糖为自变量建立Logistic回归模型,结果显示女性、高龄、空腹血糖升高、高尿酸自症、高TG血症、GC起始剂量较大及合并使用他克莫司是原发性肾病综合征患者GC治疗后发生SDM的独立危险因素(P<0.05)(表2)。多因素模型预测SDM的曲线下面积为0.753(0.712~0.794)。
讨 论
GC是治疗肾病综合征的主要药物[3],亦是继发性糖尿病最常见的药物性因素[1]。有报道显示SDM的发病率约为1.5%~ 47%[4-7]。近期一项荟萃分析显示非糖尿病患者使用GC后糖代谢紊乱及SDM的发病率分别是32.3%和18.6%[9]。本研究结果显示,原发性肾病综合征患者在使用GC治疗期间共有29.4%的患者出现糖代谢紊乱,其中SDM的发病率为6.2%。既往研究认为SDM的血糖特点以餐后血糖升高为主[10],当血糖水平处于10~20 mmol/L时,患者极少有或仅有轻微的高糖血症的临床表现[11],部分患者出现多尿、多饮、多食等临床表现,常常被误认为是GC的不良反应而忽视。本研究患者高糖血症的临床表现不典型,且SDM的诊断主要依据随访过程中的空腹血糖,鲜有患者自测餐后2h血糖。此外本研究限定GC使用时间≥28d。以上原因均可造成SDM的漏诊。
单因素分析显示FSGS患者更易发生SDM,反之,MCD患者发生SDM的可能性较低,进一步分析SDM组FSGS患者和MCD患者使用GC的总剂量和发病时间并未发现统计学差异,结合多因素分析未发现病理类型是发生SDM的危险因素,考虑造成单因素有统计学差异的原因可能存在混杂因素的干扰。Pagano等[12]发现健康志愿者口服泼尼松30 mg/d,7d后胰岛素敏感性下降60%。Fathallah等[13]认为GC以剂量依赖性的方式诱导胰岛素抵抗。本研究发现原发性肾病综合征并发SDM的患者其GC最低累积用量为840 mg,GC治疗后的3个月内,原发性肾病综合征患者合并SDM的发病率最高,随着GC的减量,SDM的新增发病率呈下降趋势,多因素分析亦发现GC的起始剂量是发生SDM的危险因素。因此,SDM的发生与GC的用量有关。
既往研究认为高龄患者其胰岛功能逐渐下降,胰岛素抵抗现象较低龄患者更加显著[14]。本研究亦发现年龄是原发性肾病综合征患者发生SDM的危险因素。 Fliser等[15]发现慢性肾脏病患者在eGFR正常时即可发生胰岛素抵抗,甚至早于贫血、代谢性酸中毒、继发性甲状旁腺功能亢进及维生素D缺乏的出现。他们认为胰岛素抵抗与eGFR并无直接相关性,推测胰岛素抵抗可能与肾小管功能受损、基因和(或)环境因素有关。但有研究发现严重肾功能不全时,甲状旁腺功能继发性亢进导致钙离子内流,影响胰岛β细胞功能减少胰岛素分泌[16]。本研究中原发性肾病综合征患者的eGFR多无明显下降,故本文多因素分析未发现eGFR下降是SDM的独立危险因素。
20世纪60年代国外研究首次报道高TG血症与胰岛素抵抗有关[17]。1985年Framingham心脏研究发现高TG血症和低HDL血症是2型糖尿病的危险因素。基因学研究发现LPL、Apoc3、ANGPTL3基因的突变可增加血清TG水平,诱发胰岛素抵抗[19]。本研究亦发现高TG血症是SDM的危险因素。多数研究认为高TG血症可引起脂肪异位沉积,导致受累组织发生胰岛素抵抗,认为炎症因子、内质网压力及脂毒性可能是导致胰岛素抵抗的主要机制[20]。肾病综合征本身也可引起血脂代谢紊乱,但本研究并未发现TC、LDL-C、HDL-C有统计学意义,因此高TG血症是发生SDM的独立危险因素。他克莫司可特异性结合胰岛β细胞表面的FKBP-12蛋白,导致胰岛β细胞内他克莫司浓度增加,进而通过干扰胰岛素基因转录、减少ATP生成、诱发胰岛β细胞凋亡等机制抑制胰岛素分泌,导致外周组织产生胰岛素抵抗[19]。他克莫司自身会导致继发性糖尿病,当与GC联合使用时,会增加SDM的发病率。
此外,本研究亦发现高尿酸血症患者易发生SDM。目前研究多认为高尿酸血症可通过氧化应激反应、炎症因子及脂联素的释放、血管内皮功能障碍、抑制一氧化氮的活性进而激活IRS1、抑制PKB,干扰胰岛素信号传导通路,最终产生胰岛素抵抗[21-24]。
本研究是目前样本量最大的单中心原发性肾病综合征患者发生SDM的临床研究,明确了其发病率和相关危险因素,具有重要的临床意义。但本研究尚存在不足,首先本文为回顾性研究,并非所有患者均常规监测血糖及糖化血红蛋白,部分患者可能被漏诊。此外本研究未检测患者体内胰岛素及C肽水平,且尚有许多其他药物可导致血糖升高,如噻嗪类利尿剂、β受体阻滞剂、他汀类降脂药、钙离子拮抗剂等[13],本研究未追踪每位患者的用药史。因此,原发性肾病综合征患者发生SDM的相关研究有待进一步前瞻性研究。
小结:原发性肾病综合征患者在使用GC后糖代谢紊乱的发病率高。对于需长期服用GC的原发性肾病综合征患者,临床医师应早期识别SDM的危险因素以便早期发现SDM,及时治疗。
1 van Raalte DH,Ouwens DM,Diamant M.Novel insights into glucocorticoid-mediated diabetogenic effects:towards expansion of therapeutic options? Eur J Clin Invest,2009,39(2):81-93.
2 徐志芳,刘长梅.类固醇性糖尿病诊治进展.青岛医药卫生,2014,46(6):452-454.
3 Kidney Disease:Improving Global Outcomes (KDIGO) Glomerulonephritis Work Group (2012) KDIGO Clinical Practice Guideline for Glomerulonephritis.Kidney Int,Suppl 2:139-274.
4 Chan HW,Cheung CY,Liu YL,et al.Prevalence of abnormal glucose metabolism in Chinese renal transplant recipients:a single centre study.Nephrol Dial Transplant,2008,23(10):3337-3342.
5 Panthakalam S,Bhatnagar D,Klimiuk P.The prevalence and management of hyperglycaemia in patients with rheumatoid arthritis on corticosteroid therapy.Scott Med J,2004,49(4):139-141.
6 Gulliford MC,Charlton J,Latinovic R.Risk of diabetes associated with prescribed glucocorticoids in a large population.Diabetes Care,2006,29(12):2728-2729.
7 Valderhaug TG,Hjelmesaeth J,Rollag H,et al.Reduced incidence of new-onset posttransplantation diabetes mellitus during the last decade.Transplantation,2007,84(9):1125-1130.
8 den Uyl D,van Raalte DH,Nurmohamed MT,et al.Metabolic Effects of High-Dose Prednisolone Treatment in Early Rheumatoid Arthritis.Arthritis Rheum,2012,64(3):639-646.
9 Liu XX,Zhu XM,Miao Q,et al.Hyperglycemia induced by glucocorticoids in nondiabeticpatients:a meta-analysis.Ann Nutr Metab,2014,65(4):324-332.
10 Perez A,Jansen-Chaparro S,Saigi I,et al.Glucocorticoid-induced hyperglycemia.J Diabetes,2014,6(1):9-20.
11 Pilkey J,Streeter L,Beel A,et al.Corticosteroid-induced diabetes in palliative care.J Palliat Med,2012,15(6):681-689.
12 Pagano G,Cavallo-Perin P,Cassader M,et al.An in vivo and in vitro study of the mechanism of prednisoneinduced insulin resistance in healthy subjects.J Clin Invest,1983,72(5):1814-1820.
13 Fathallah N,Slim R,Larif S,et al.Drug-Induced Hyperglycaemia and Diabetes.Drug Saf,2015,38(12):1153-1168.
14 Blackburn D,Hux J,Mamdani M.Quantification of the risk of corticosteroid-induced diabetes mellitus among the elderly.J GenlnternMed,2002,17(9):717-720.
15 Fliser D,Pacini G,Engelleiter R,et al.Insulin resistance and hyperinsulinemia are already present in patients with incipient renal disease.Kidney Int,1998,53(5):1343-1347.
16 Fadda GZ,Hajjar SM,Perna AF,et al.On the mechanism of impaired insulin secretion in chronic renal failure.J Clin Invest,1991,87:255-261.
17 Reaven GM,Lerner RL,Stern MP,et al.Role of insulin in endogenous hypertriglyceridemia.J Clin Invest,1967,46(11):1756-1767.
18 Wilson PW,Kannel WB,Anderson KM.Lipids,glucose intolerance and vascular disease:the Framingham Study.Monogr Atheroscler,1985,13:1-11.
19 Penfornis A,Kury-Paulin S.Immunosuppressive drug-induced diabetes.Diabetes Metab,2006,32(5 Pt 2):539-546.
20 Li N,Fu J,Koonen DP,et al.Are hypertriglyceridemia and low HDL causal factors in the development of insulin resistance?Atherosclerosis,2014,233(1):130-138.
21 Sautin YY,Nakagawa T,Zharikov S,et al. Adverse effects of the classic antioxidant uric acid in adipocytes:NADPH oxidase-mediated oxidative/nitrosative stress.Am J Physiol Cell Physiol,2007,293(2):C584-596.
22 Nakagawa T,Tuttle KR,Short RA,et al.Hypothesis: fructose-induced hyperuricemia as a causal mechanism for the epidemic of the metabolic syndrome.Nat Clin Pract Nephrol,2005,1(2):80-86.
23 Zhang Q,Zhang C,Song X,et al.A longitudinal cohort based association study between uric acid level and metabolic syndromein Chinese Han urban male population.BMC Public Health,2012,12:419.
24 Zhi L,Yuzhang Z,Tianliang H,et al.High Uric Acid Induces Insulin Resistance in Cardiomyocytes In Vitro and In Vivo.PLoS One,2016,11(2): e0147737.
(本文编辑 凡 心)
Glucocorticoid induced diabetic mellitus and related risk factors in patients with primary nephrotic syndrome
SHENGAiqin1,TUYuanmao1,GUOJinzhou1,DUHong2,LIUZhihong1,LIShijun1
1NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China2Departmentofendocrinology,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
Correspondingauthor:LIShijun(E-mail:lisj8855@163.com)
Objective:To investigate the incidence and risk factors of steroid-induced diabetes mellitus (SDM) in patients with primary nephrotic syndrome,who have started glucocorticoid therapy. Methodology:From January 2011 to December 2015, patients who were diagnosed as SDM were enrolled into this retrospective study and their clinical characteristics were investigated. According to whether or not with abnormal glucose metabolism after accepting glucocorticoid therapy, the patients were divided into three groups as SDM, impaired glucose regulation (IGR), and normal glucose metabolism (NGM). The risk factors of SDM were analyzed with logistic regression. Results:Among 2 281 cases, total of 671 patients presented abnormal glucose metabolism (AGM) after glucocorticoid therapy, including 142 cases of SDM. 81.7% of SDM was diagnosed within the first year of glucocorticoid therapy, and the median time was 108 days. AGM was associated with age, focal segmental glomerulosclerosis, glomerular filtration rate and fasting plasma glucose (FPG). Significant statistical differences were existed among the three groups. Compared with NGM, SDM patients had higher body mass index (BMI), higher proportion of stage 2 or 3 hypertension, higher proportion of combined use of tacrolimus and higher level of triglyceride (TG), and the differences were statistically significant. However, there was no significant difference compared with IGR.Multivariate logistic regression analysis revealed that sex, age, FPG, TG, initial dose of glucocorticoid and simultaneous use of tacrolimus were risk factors of SDM. Conclusion:The incidence of abnormal glucose metabolism in patients with primary nephrotic syndrome who had started glucocorticoid therapy was high. Female, elder, higher level of FPG, TG, GC, and simultaneous use of tacrolimus can increase the risk of SDM.
nephrotic syndrome glucocorticoid steroid-induced diabetes mellitus risk factors
10.3969/cndt.j.issn.1006-298X.2017.03.005
国家自然科学基金(81270799),国家科技支撑计划项目课题(2015BAI09B05),国家“精准医学”重点研发计划项目(2016YFC0904100)
1南京大学医学院附属金陵医院(南京军区南京总医院) 肾脏科 硕士研究生(盛爱芹),国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016),2内分泌科
李世军(E-mail:lisj8855@163.com)
2016-12-05
ⓒ 2017年版权归《肾脏病与透析肾移植杂志》编辑部所有
