菰黑粉菌菌丝形成相关基因UeSsk2 的克隆及表达分析
2017-07-05曹乾超张雅芬崔海峰俞晓平叶子弘
曹乾超,张雅芬,胡 鹏,崔海峰,俞晓平,叶子弘
(中国计量大学 生命科学学院 浙江省生物计量及检验检疫技术重点实验室,浙江 杭州 310018)
菰黑粉菌菌丝形成相关基因UeSsk2 的克隆及表达分析
曹乾超,张雅芬,胡 鹏,崔海峰,俞晓平,叶子弘
(中国计量大学 生命科学学院 浙江省生物计量及检验检疫技术重点实验室,浙江 杭州 310018)
基于菰黑粉菌全基因组测序结果及其酵母型和菌丝型转录组差异化表达数据库,结合RACE技术克隆获得一个长度为7 625 bp的基因,其中编码序列为5 874 bp,无内含子.结构及聚类分析结果表明该基因编码的MAPKKK蛋白激酶,属于Hog1信号途径,与大麦坚黑粉菌中的Ssk2亲缘关系最近.表达分析结果显示:UeSsk2在菌丝诱导形成过程中持续上调表达,而在生长受到抑制的菌丝细胞中其表达无显著变化或受到抑制,表明UeSsk2与菌丝形成具有相关性.同时,经生物传感器进行的蛋白互作检测结果表明,UeSsk2与前期发现的UeMkk1不存在蛋白互作关系,表明该蛋白参与其他MAPK途径来影响菌丝形成及生长.
菰黑粉菌;丝裂原活化蛋白激酶激酶激酶;UeSsk2基因;二型态转换
菰黑粉菌(Ustilagoesculenta)属担子菌亚门黑粉菌属,是典型的二型态真菌(酵母型和菌丝型),茭白是其已知的唯一寄主[1].目前研究表明,茭白植株与菰黑粉菌互作使植株茎部膨大形成了可食用的茭白[2],是我国主要的水生蔬菜之一.菰黑粉菌菌丝的侵染发生在茭白肉质茎膨大之前,对茭白孕茭至关重要[3],所以菰黑粉菌二型态转换(菌丝的形成及增殖)可能是茭白正常孕茭的关键.
真菌二型态转换[4-5]是指自然界中某些真菌受到外界环境中物理、化学、营养等因素的刺激,诱导细胞内cAMP-PKA(Cyclicaden-osinemono phosphate-protein kinase A)、MAPK(Mitogen-activated protein kinase)等信号传导途径发生改变,从而使二型态真菌发生单细胞酵母型和多细胞菌丝型间的转换,被公认是真菌快速适应外界环境及宿主多变微环境的生存机制[4-6].其中MAPK信号传导途径由丝裂原活化蛋白(MAPK、MAPKK、MAPKKK)三级激酶级联组成[7],在真菌的致病性和二型态转换过程中具有重要作用.
迄今在酵母(Saccharomycescerevisiae)中已发现五条MAPK信号途径(Hog1、Fus3、Kss1、Slt2和Smk1信号途径),分别调控高渗透压胁迫反应、交配反应、菌丝的形成、细胞完整性和孢子形成等过程[8-10].其中Hog1信号途径是菌体在高渗环境中生长所必需的[11-12],上游存在两个MAPKKK蛋白调控系统用于激活传递,其中一个是由Ssk2和Ssk22共同组成的组氨酸激酶磷酸化Pbs2从而激活Hog1的调控途径,另一个是由Sho1和Msb2诱导的由Ste11激活Pbs2的途径[13].近期研究表明,该途径还响应了其它非渗透压的胁迫,如低温、酸性环境和亚砷酸盐等[14-16],研究发现多数二型态真菌中该途径基因的突变会显著影响菌丝形成,如解脂耶罗维亚酵母(Yarrowialipolytica)中编码Ste11的基因突变后只能产生酵母型细胞[17],玉米黑粉菌ubc4突变体中菌丝形成也受到影响[18],白念珠菌(Candidaalbicans)中编码Hog1的基因突变影响其融合及形态转换[19],表明该途径还可能参与菌丝的形成.实验室前期已对MAPK信号途径基因展开研究,如UeMkk1、UeKss1[20-21],但都是在MAPK途径中下游.为了进一步完善菰黑粉菌的MAPK途径,我们基于酵母型和菌丝型菰黑粉菌中的差异化蛋白测序分析并结合表达谱分析结果,发现在菌丝型中大量MAPK途径基因显著上调表达[22-24].其中一个未知基因在全基因组中未找到完整的开放阅读框,因此本实验根据茭白膨大前后菰黑粉菌的转录组数据结合RACE技术的要求,设计特异性引物,克隆获得了该基因全长序列,通过基因结构、同源性及系统进化分析表明,该基因编码MAPKKK Ssk2的同源蛋白,故命名为UeSsk2.同时我们发现UeSsk2在菌丝诱导形成过程中持续上调表达,可能参与调控菌丝形成.通过生物传感器检测发现UeSsk2与UeMkk1不存在蛋白互作关系,表明UeSsk2与UeMkk1可能不属于同一条MAPK信号途径.
1 材料与方法
1.1 材料
菰黑粉菌采用组织切片法[25]分离自桐乡采集的龙茭2号正常茭,-80 ℃保存.
1.2 实验方法
1.2.1 菰黑粉菌基因组DNA及总RNA的提取
通过体外培养收集菌丝型菰黑粉菌的菌体,并在全自动样品研磨仪中破碎,采用CTAB法[26]提取其基因组DNA.液氮速冻菰黑粉菌菌体后快速研磨至粉末,按照TRIzol试剂(Invitrogen)说明书提取其总RNA.利用反转录试剂盒(PrimeScriptTMII 1st Strand cDNA Synthesis Kit,Takara)反转录获得cDNA第一链,以扩增较长目的基因序列,而荧光定量PCR中用到的cDNA模板参照试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser,Takara)说明书进行反转录.
1.2.2 菰黑粉菌UeSsk2基因的克隆及序列分析
根据酵母型和菌丝型菰黑粉菌转录组测序结果和全基因组测序结果,对基因保守序列设计特异性引物UeSsk2-F1和UeSsk2-R1(表1),对反转录获得的cDNA第一链进行PCR扩增.根据确认的保守序列以及RACE试剂盒(BD SMARTTMRACE cDNA Amplification Kit,Clotech)说明书,分别设计特异性引物(表1),按操作说明扩增UeSsk2基因的3’端和5’端序列,经测序确认.利用序列拼接软件(Clone Manager)将所有获得的序列进行拼接,并在序列两端设计引物UeSsk2-cF与UeSsk2-cR(表1)扩增UeSsk2 cDNA全长序列. 利用ORF finder(http://www.ncbi.nlm.nih.gov/gorf)判断UeSsk2可能的编码框,并设计特异性引物UeSsk2-gF和UeSsk2-gR(表1)扩增该基因在基因组上的序列,再通过Clone Manager软件比对确认内含子情况.
1.2.3 菰黑粉菌UeSsk2基因的表达分析
参照实验室曾使用的方法[20-21],将菌丝型菰黑粉菌经YEPS液体培养基培养至OD600为1.5后涂布,28 ℃倒置培养,每隔两天取样,以β-actin基因作为内参基因,进行qRT-PCR分析,引物见表1.反应在StepOneTMReal-Time PCR System(ABI)检测系统上进行,qRT-PCR反应体系(20 μL)为:10 μL SYBR Premix Ex TaqTM(2×),0.5 μL PCR Forward Primer(10 μmol/L),0.5 μL PCR Reverse Primer(10 μmol/L),0.5 μL cDNA模板,0.4 μL ROX Reference Dye(50×),8.1 μL无菌水.反应程序为95 ℃ 30 s;95 ℃ 30 s,60 ℃ 20 s,72 ℃延伸30 s,进行40个循环,每个反应设置3次重复.最终荧光所得Ct值数据采用2-ΔΔCt法进行计算[27],并在SPSS软件中对其进行显著性差异分析.
1.2.4 UeSsk2蛋白的表达纯化
根据UeSsk2 cDNA序列设计特异性引物UeSsk2-pF和UeSsk2-pR(表1),以菰黑粉菌cDNA为模板,扩增UeSsk2基因的CDS序列.采用限制性内切酶BamHⅠ和HindⅢ(Takara)分别酶切获得的UeSsk2 CDS序列片段和pET-28a(+)载体,T4连接酶(Takara)连接后,转入大肠杆菌原核表达菌株Rosetta-gami B(DE3),测序验证后,将该重组质粒命名为UeSsk2-pET-28a.采用张雅芬等[20-21]的方法诱导表达UeSsk2蛋白,经超声破碎后将获得的粗蛋白按照Ni-NTA法[20-21]分别选用50、100、200、300、400 mmol/L的咪唑进行梯度洗脱.采用SDS-PAGE凝胶电泳对梯度洗脱收集到的蛋白进行验证分析,以便确认最佳的洗脱液浓度.
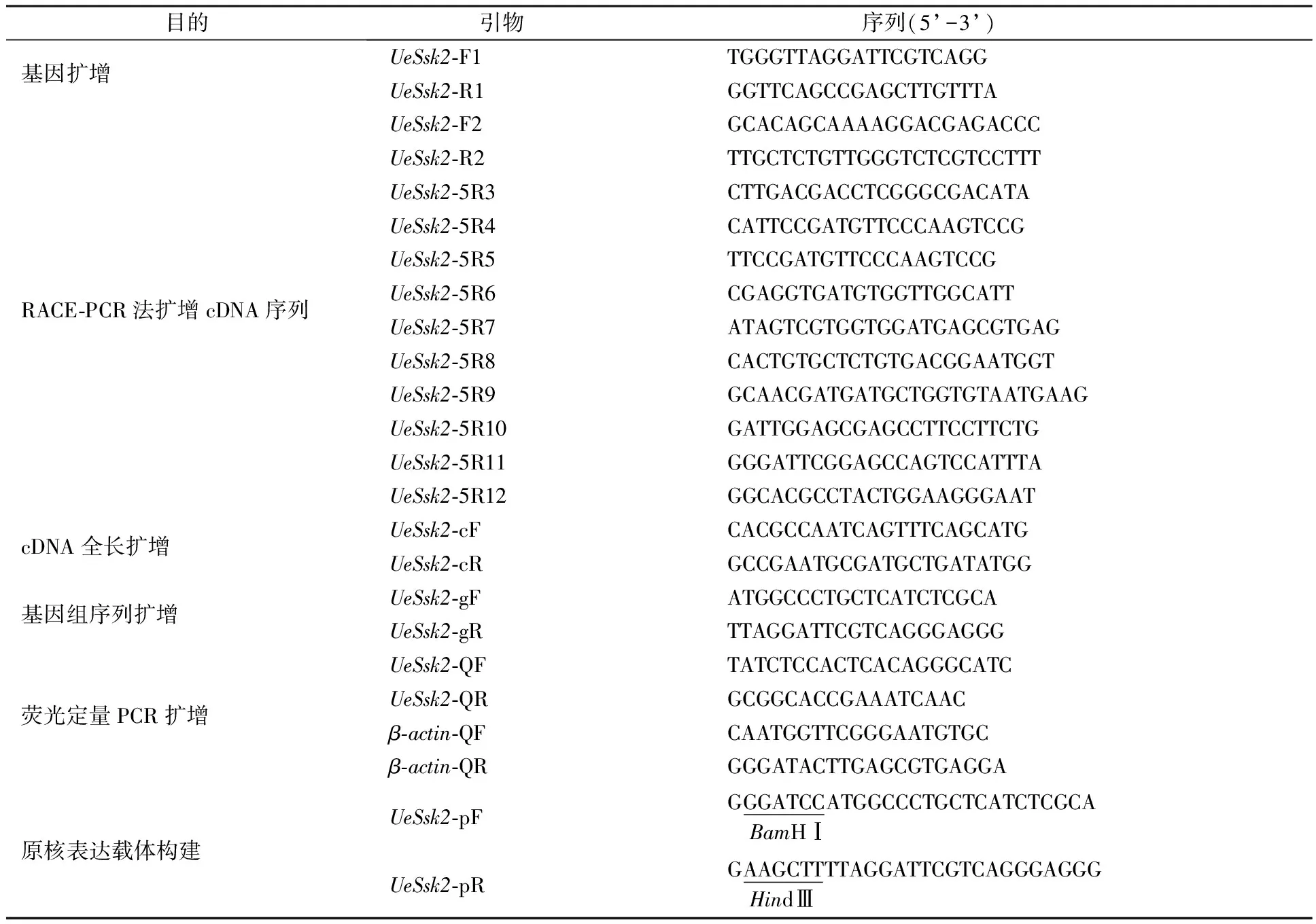
表1 实验相关引物列表
1.2.5 UeSsk2与UeMkk1蛋白的互作分析
实验室前期已经获得高纯度的UeMkk1蛋白,对其进行封闭以去除组氨酸标签.蛋白互作检测在Octet Dip and ReadTM生物传感器上进行[28],将传感器探头插入已注入10 μL PBS (NaCl 12 g/L,KCl 0.2 g/L,Na2HPO41.44 g/L,KH2PO40.24 g/L,调pH至7.4)的检测孔中,然后运行程序设置基线,再注入10 μL纯化的UeSsk2蛋白并进行检测,随后重新设置基线,最后注入10 μL封闭的UeMkk1蛋白,每次注入不同的样品前须用PBS对检测孔进行清洗.
2 结果与分析
2.1 菰黑粉菌UeSsk2基因的克隆及结构分析
根据酵母型和菌丝型菰黑粉菌转录组中的差异化表达数据库以及菰黑粉菌的全基因组测序结果,我们发现一个MAPK途径基因,但是未能发现其完整的开放阅读框.因此根据预测得到的一段500 bp左右的保守序列,先进行扩增,测序确认该保守序列长538 bp(图1a).利用此序列设计向外扩增的引物,经3’ RACE的方法扩增得到了247 bp的3’端cDNA序列(图1b).由于该序列的5’端存在大片段的缺失,因此设计了5’ RACE引物(表1)对cDNA进行分步扩增,并逐一经测序确认,最后采用Clone Manager软件拼接形成完整的cDNA序列.
通过NCBI的ORF finder功能预测其可能的开放阅读框区域,设计两端引物UeSsk2-gF和UeSsk2-gR(表1),扩增UeSsk2在菌丝型菰黑粉菌基因组DNA上的序列,经测序确认扩增得到的基因组片段长度为5 874 bp(图1i),Clone Manager软件比对发现基因中无内含子.综合以上信息,我们获得了长度为7 625 bp,包含一个5 874 bp的完整编码框.其余为非编码区,包括1 669 bp的5’端调控区及82 bp的3’端调控区,其中3’端非编码区中存在poly(A)结构.NCBI比对结果及序列结构分析表明,该基因与其他真菌中的Ssk基因具有较高的序列同源性,因此我们将其命名为UeSsk2(GenBank登录号KR870331).

a:UeSsk2基因中间保守序列的PCR产物;b:UeSsk2基因3’RACE 的PCR产物;c-h:UeSsk2基因5’RACE的 PCR产物;i:UeSsk2基因的基因组序列PCR产物;以上图片中左边为DNA Maker (a-h,DL2000;i,DL10000);右边红色箭头指示目的片段图1 RACE法扩增UeSsk2基因片段Figure 1 Amplification of UeSsk2 gene by RACE
2.2 菰黑粉菌UeSsk2的系统发育分析
利用DNAman软件将UeSsk2蛋白与酵母中已知的MAPK途径基因编码的蛋白进行多序列同源性比对,结果表明该蛋白与酵母中的MAPKKK蛋白聚为一类,且与Ssk2蛋白同源性最高(图2a),进一步证明该蛋白属于Hog1途径的MAPKKK激酶[10].接下来我们采用近邻法对UeSsk2构建系统进化树,发现菰黑粉菌中UeSsk2与宾地瘤黑粉菌(Melanopsichiumpennsylvanicum4)、玉米黑粉菌(U.maydis)、玉米丝黑穗病菌(SporisoriumreilianumSRZ2)、大麦坚黑粉菌(Ustilagohordei)聚为一个分支(图2b),且与大麦坚黑粉菌的亲缘关系最近.
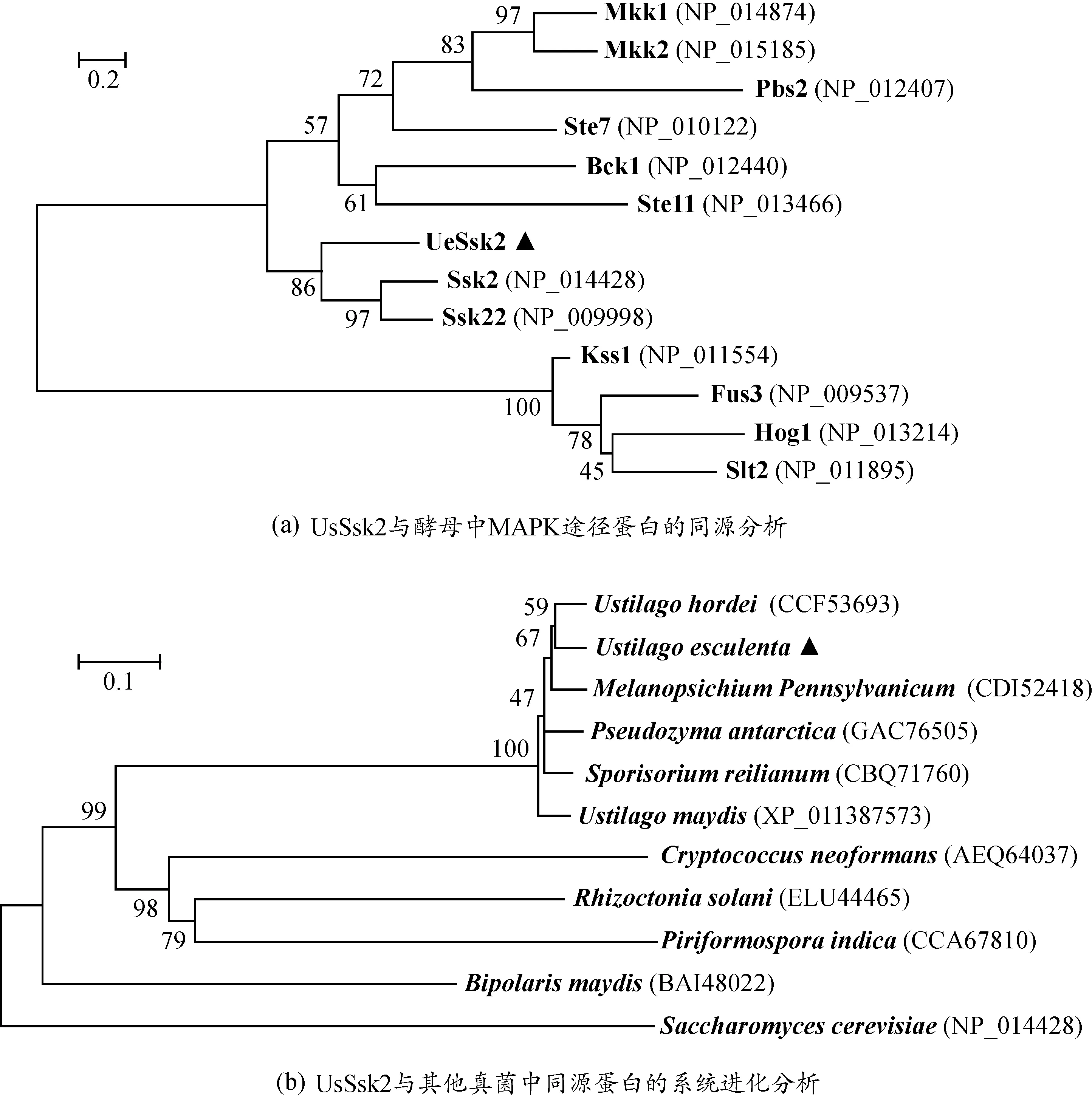
图2 UeSsk2的系统发育分析Figure 2 Phylogenetic analysis of UeSsk2
2.3UeSsk2基因在四种培养基诱导下的表达特征分析
前期实验发现,真菌常规培养基PDA对菰黑粉菌菌丝生长具有抑制作用,而蔗糖为唯一碳源的培养基能显著诱导菌丝生长,结果如图3:在蔗糖诱导培养2 d后酵母型菰黑粉菌就开始融合并进行菌丝生长;在其它碳源培养基中培养8 d后也未见明显菌丝出现,但是在形态上出现细胞伸长或多位点芽殖(图片未呈现)等现象;而在PDA培养基中菰黑粉菌一直维持酵母形态生长,形态与对照无明显差别(图3).同时,收集这五个时期的菌体,提取其RNA并进行反转录,通过实时定量PCR检测不同样品中UeSsk2的表达变化情况.结果表明,UeSsk2在不同处理前的表达量没有显著差异,表明用于不同处理的实验材料比较可靠.对培养2、4、6、8 d后UeSsk2的表达量进行比较分析,结果显示UeSsk2的表达量在蔗糖诱导第二天开始显著上升且随着诱导时间延长表达量持续上升,而在其它培养基中,UeSsk2的表达量在6~8 d后才开始上升,且显著低于蔗糖培养基中UeSsk2的表达量,约只有其三分之一,而在PDA培养基中,UeSsk2的表达受到明显抑制(图4).

图3 菰黑粉菌在不同诱导培养基中的显微形态观察(2 d)Figure 3 Microscopic observation of U. esculenta under different induced medium(2 d)
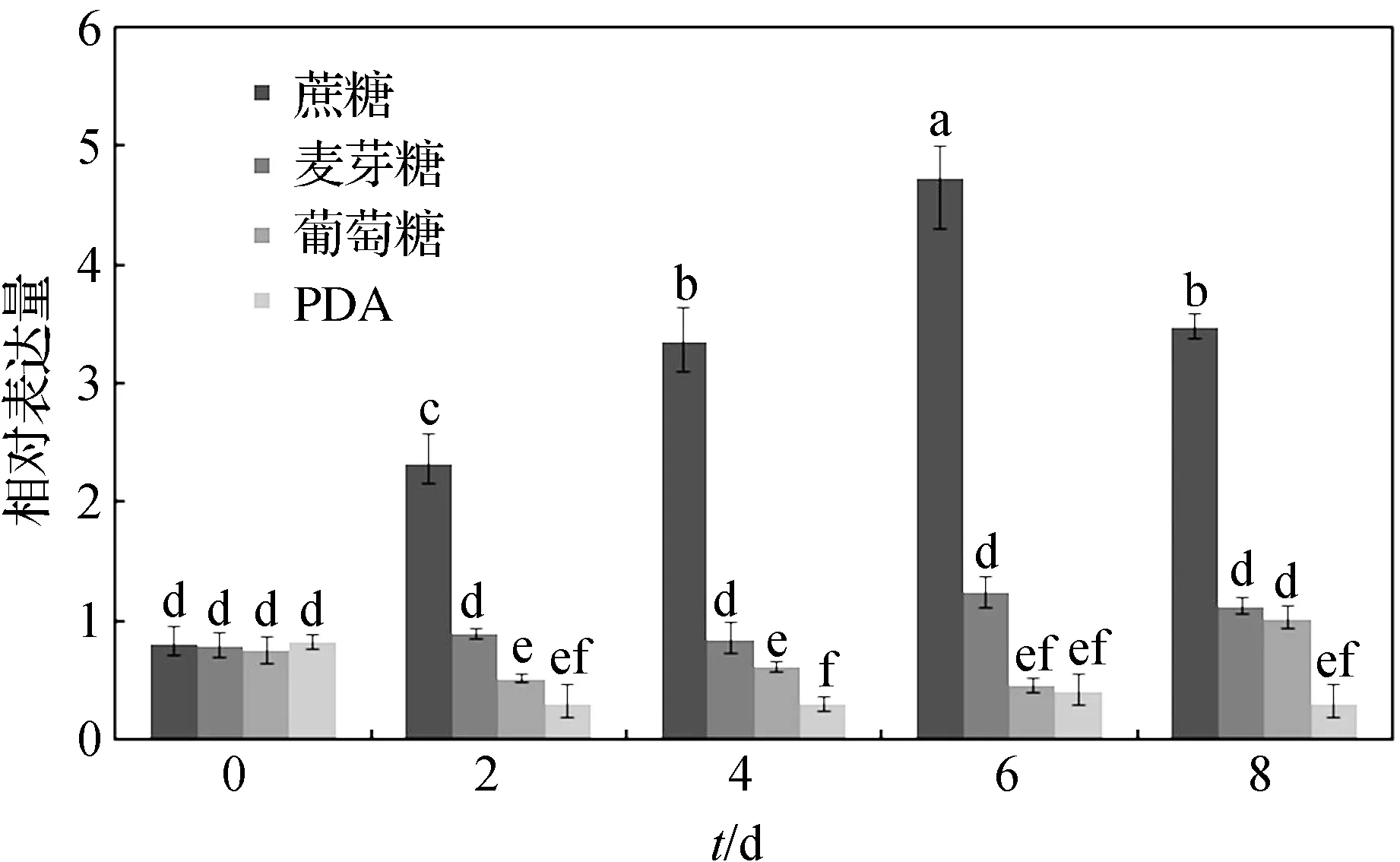
图4 菰黑粉菌UeSsk2的差异表达分析Figure 4 Differential expression analysis of UeSsk2 in U. esculenta
2.4 UeSsk2的原核表达及其与UeMkk1蛋白的互作分析
前期已发现MAPKK蛋白UeMkk1能作用于二型态转换,因此为了进一步证实UeSsk2蛋白是否与UeMkk1蛋白互作,从而参与该MAPK途径作用于二型态转换.本次实验中我们首先通过原核表达获得了有活性且带有His标签的UeSsk2蛋白,经Ni柱进行纯化,收集纯化过程中的样品进行SDS-PAGE凝胶电泳,发现低浓度的咪唑(50 mmol/L)具有较好的洗脱效果(图5),因此实验大量纯化UeSsk2蛋白后采用生物传感器验证法验证其与UeMkk1蛋白的互作,先设置基线(图6第一段),然后将UeSsk2蛋白注入后观察可发现第二段曲线生成,且曲线有所上升,说明已将UeSsk2成功地注入并和传感器进行结合,此时再重新设置基线(图6第三段),然后注入已封闭的UeMkk1蛋白,可观察到第四段曲线生成(图6),但是生成的第四段曲线没有上升,说明UeSsk2与UeMkk1不存在互作关系.
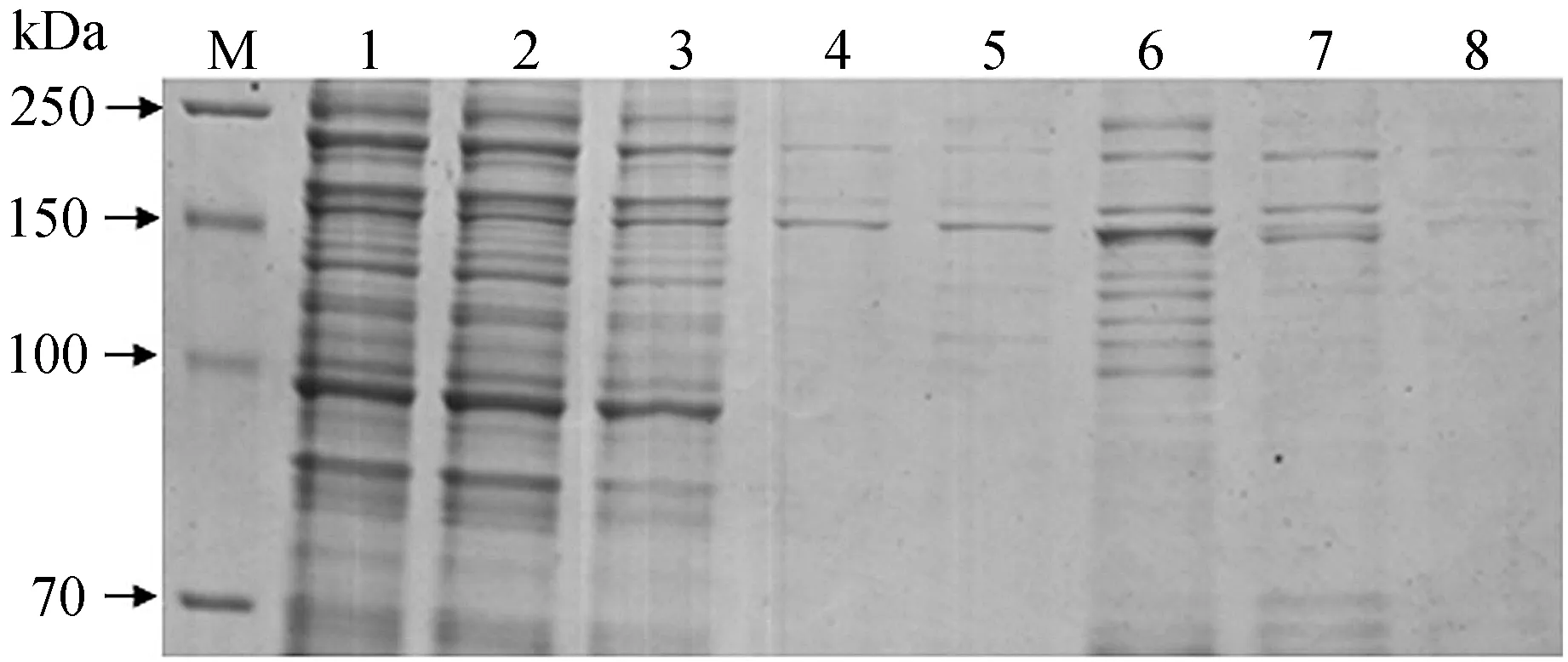
M—蛋白Marker 250 kDa;1—裂解后上清液;2—流出液;3—第一次漂洗液;4—50 mmol/L咪唑洗脱液;5—100 mmol/L咪唑洗脱液;6—200 mmol/L咪唑洗脱液;7—300 mmol/L咪唑洗脱液;8—400 mmol/L咪唑洗脱液图5 不同浓度咪唑洗脱下UeSsk2蛋白的纯化结果Figure 5 Purification of UeSsk2 under different concentrations of imidazole
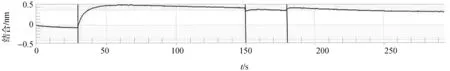
图6 UeSsk2和UeMkk1的蛋白互作检测Figure 6 Detection results of interaction between UeSsk2 and UeMkk1
3 讨 论
菰黑粉菌与茭白植株互作是茭白孕茭的关键,研究发现菌丝在11月和翌年3月通过母墩上的节侵染入芽[3],所以研究菰黑粉菌如何实现特定时期特异组织的侵染和繁殖可能是阐明茭白孕茭机制的一个突破点.菰黑粉菌属黑粉菌属,需要在合适条件下由无侵染能力的酵母型转换成具有侵染能力的菌丝型,从而实现从植物细胞中获得养分达到增殖的目的[3,29,30].且前期大量研究表明,MAPK信号途径在二型态转换及菌丝生长过程中具有重要作用[7].本文第一次克隆到了菰黑粉菌的一个MAPKKK基因,我们对扩增得到的UeSsk2基因及其蛋白结构进行分析,结果表明,该基因不存在内含子,且具有保守的Ser/Thr结构域及位点,与其它真菌的同源性高达70%,且保守结构域同源性在95%以上,表明该基因在物种间比较保守,可能行使十分重要的功能.在本研究中,我们获得了长约3 000 bp的5’端未知序列,表明我们的RACE实验非常成功,该实验中间产物,即用于后续特异性扩增的cDNA模板,完整性好,可以用于其它基因全长的扩增,为丰富菰黑粉菌基因库提供了良好的材料.
另外,我们前期已发现蔗糖能较好地诱导菰黑粉菌菌丝形成和生长,而PDA、麦芽糖和葡萄糖培养基不利于菌丝形成和生长[20-21](图3),所以我们通过实时荧光定量PCR来检测分析UeSsk2在以上不同碳源培养基诱导下的表达特征,结果表明:UeSsk2在蔗糖诱导菌丝形成过程中显著上调表达(图4),由此可知该基因可能参与调控了菰黑粉菌菌丝的形成和生长.由于前期课题组已经发现UeMkk1、UeKss1等MAPK途径蛋白参与调控菰黑粉菌菌丝形成及生长[20-21],为了进一步阐明UeSsk2是否作用于蛋白UeMkk1的上游,我们进行了生物感应器的实验验证,结果表明两者并不存在互作,即UeSsk2并不参与调控UeMkk1所在的Slt2信号途径[20].鉴于同源比对结果及系统进化分析,我们推测UeSsk2作用于Hog1信号途径.
对酵母Hog1信号途径研究发现其主要调控高渗透压胁迫反应[8-10],而Ssk2是该途径其中一条调控路径中的MAPKKK.另外,该途径还响应了其它非渗透压的胁迫,如低温、酸性环境和亚砷酸盐等[14-16].我们的研究结果表明,UeSsk2属于MAPKKK蛋白,且与Ssk2同源性较高(图2a),而且该基因可能参与菰黑粉菌对碳源代谢利用的响应,调控菰黑粉菌菌丝的形成及生长,预示着Hog1信号途径可能还参与碳源利用、菌丝形成及生长等过程,与近期在白念珠菌中发现的功能类似[19].因此,UeSsk2基因的成功克隆及在不同碳源诱导下的表达特征分析对以后研究该基因在菰黑粉菌二型态转换中的作用以及Hog1信号途径在二型态转换及菌丝生长中的作用奠定了非常重要的基础.同时,实验室已成功建立了基于原生质体转化的菰黑粉菌遗传转化体系[31],能够对UeSsk2基因进行敲除及相关互补,有利于对其功能作进一步的验证分析.
[1] CHUNG K R, TZENG D D. Nutritional requirements of the edible gall-producing fungusUstilagoesculenta[J]. Journal of Biological Sciences,2004,4(2):246-252.
[2] CHAN Y S, THROWER L B. The host-parasite relationship betweenZizaniacaducifloraTurcz. andUstilagoesculentaP. Henn. III. carbohydrate metabolism ofU.esculentaand the host-parasite combination[J]. New Phytologist,1980,85(2):217-224.
[3] ZHANG J Z, CHU F Q, GUO D P, et al. Cytology and ultrastructure of interactions betweenUstilagoesculentaandZizanialatifolia[J]. Mycological Progress,2012,11(2):499-508.
[4] GAUTHIER G M. Dimorphism in fungal pathogens of mammals, plants, and insects[J]. PLoS Pathogens,2015,11(2):e1004608.
[5] NADAL M, GARCíA-PEDRAJAS M D, GOLD S E. Dimorphism in fungal plant pathogens[J]. FEMS Microbiology Letters,2008,284(2):127-134.
[6] STURME M H J, PUCCIA R, GOLDMAN G H, et al. Molecular biology of the dimorphic fungiParacoccidioidesspp[J]. Fungal Biology Reviews,2011,25(2):89-97.
[7] SCHAEFFER H J, WEBER M J. Mitogen-activated protein kinases: specific messages from ubiquitous messengers[J]. Molecular and Cellular Biology,1999,19(4):2435-2444.
[8] ZHAO X H, MEHRABI R, XU J R. Mitogen-activated protein kinase pathways and fungal pathogenesis[J]. Eukaryotic Cell,2007,6(10):1701-1714.
[9] HERSKOWITZ I. MAP kinase pathways in yeast: for mating and more[J]. Cell,1995,80(2):187-197.
[10] CHEN R E, THORNER J. Function and regulation in MAPK signaling pathways: lessons learned from the yeastSaccharomycescerevisiae[J]. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research,2007,1773(8):1311-1340.
[11] HOHMANN S. Osmotic stress signaling and osmoadaptation in yeasts[J]. Microbiology and Molecular Biology Reviews,2002,66(2):300-372.
[12] SAITO H, TATEBAYASHI K. Regulation of the osmoregulatory HOG MAPK cascade in yeast[J]. Journal of Biochemistry,2004,136(3):267-272.
[13] O’ROURKE S M, HERSKOWITZ I. A third osmosensing branch inSaccharomycescerevisiaerequires the Msb2 protein and functions in parallel with the Sho1 branch[J]. Molecular and Cellular Biology,2002,22(13):4739-4749.
[14] PANADERO J, PALLOTTI C, RODRíGUEZ-VARGAS S, et al. A downshift in temperature activates the high osmolarity glycerol (HOG) pathway, which determines freeze tolerance inSaccharomycescerevisiae[J]. Journal of Biological Chemistry,2006,281(8):4638-4645.
[16] MOLLAPOUR M, PIPER P W. Hog1p mitogen-activated protein kinase determines acetic acid resistance inSaccharomycescerevisiae[J]. FEMS Yeast Research,2006,6(8):1274-1280.
[17] CERVANTES-CHAVEZ J A, RUIZ-HERRERA J. STE11 disruption reveals the central role of a MAPK pathway in dimorphism and mating inYarrowialipolytica[J]. FEMS Yeast Research,2006,6(5):801-815.
[18] ANDREWS D L, EGAN J D, MAYORGA M E, et al. TheUstilagomaydisubc4 andubc5 genes encode members of a MAP kinase cascade required for filamentous growth[J]. Molecular Plant-Microbe Interactions,2000,13 (7):781-786.
[19] LIANG S H, CHENG J H, DENG F S, et al. A novel function for Hog1 stress-activated protein kinase in controlling white-opaque switching and mating inCandidaalbicans[J]. Eukaryotic Cell,2014,13(12):1557-1566.
[20] 胡鹏,张雅芬,崔海峰,等.菰黑粉菌MAPKK同源基因UeMkk1的全长克隆及表达[J].农业生物技术学报,2016,24(3):406-415. HU P, ZHANG Y F, CUI H F, et al. Full length cloning and expression of mitogen-activated protein kinase kinase homolog geneUeMkk1 inUstilagoesculenta[J]. Journal of Agricultural Biotechnology,2016,24(3):406-415.
[21] 张雅芬,胡鹏,崔海峰,等.菰黑粉菌MAPK同源基因UeKss1的克隆及表达[J].植物病理学报,2016,46(5):634-644. ZHANG Y F, HU P, CUI H F, et al. Cloning and expression of mitogen-activated protein kinase homolog geneUeKss1 inUstilagoesculenta[J]. ACTA Phytopathologica Sinica,2016,46(5):634-644.
[22] 金晔,崔海峰,安欣欣,等.龙茭2号耐冷相关差异表达蛋白鉴定及分析[J].农业生物技术学报,2015,23(4):502-512. JIN Y, CUI H F, AN X X, et al. Identification and analysis of differential expression proteins realated to chilling tolerance in Longjiao 2 (Zizanialatifolia) [J]. Journal of Agricultural Biotechnology,2015,23(4):502-512.
[23] LIU Q, YOU W Y, YU X P, et al. A preliminary study on proteome variations associated with gall formation inZizanialatifoliaTrucs[J]. Plant Molecular Biology Reporter,2010,29(2):360-368.
[24] YOU W Y, LIU Q, ZOU K Q, et al. Morphological and molecular differences in two strains ofUstilagoesculenta[J]. Current Microbiology,2011,62(1):44-54.
[25] 曹乾超,张雅芬,崔海峰,等.菰黑粉菌分离方法的研究[J].长江蔬菜,2015,22:195-197. CAO Q C, ZHANG Y F, CUI H F, et al. Research on methods of isolatingUstilagoeschlenta[J]. Journal of Changjiang Vegetables,2015,22:195-197.
[26] POREBSKI S, BAILEY L G, BAUM B R. Modification of a CTAB DNA extraction protocol for plants containing high polysaccharide and polyphenol components[J]. Plant Molecular Biology Reporter,1997,15(1):8-15.
[27] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J]. Methods,2001,25(4):402-408.
[28] 应荣.茭白黑粉菌cAMP及MAPK途径关键基因的克隆及表达分析[D].杭州:中国计量大学,2014. YING R. Cloning and expression analysis of key genes of cAMP pathway and MAPK pathway inUstilagoesculenta[D]. Hangzhou: China Jiliang University,2014.
[29] 李志兰,尤文雨,邹克琴,等.菰黑粉菌孢子萌发过程形态学观察及系统发育研究[J].中国计量学院学报,2010,21 (2):58-63. LI Z L,YOU W Y,ZOU K Q,et al. Morphological observation and phylogenetic analysis ofUstilagoesculenta[J]. Journal of China University of Metrology,2010,21(2):58-63.
[30] TERRELL E E, BATRA L R.ZizanialatifoliaandUstilagoesculenta, a grass-fungus association[J]. Economic Botany,1982,36(3):274-285.
[31] YU J J, ZHANG Y F, CUI H F, et al. An efficient genetic manipulation protocol forUstilagoesculenta[J]. FEMS Microbiology Letters,2015,362(12):1-7.
Cloning and expression analysis of hyphal formation-related geneUeSsk2 inUstilagoesculenta
CAO Qianchao, ZHANG Yafen, HU Peng, CUI Haifeng, YU Xiaoping, YE Zihong
(Zhejiang Provincial Key Laboratory of Biometrology, Inspection and Quarantine, College of Life Sciences,China Jiliang University, Hangzhou 310018, China)
Based on the whole genome sequencing database ofUstilagoesculentaand its different expression of transcriptome sequencing data from yeast and mycelial form, a gene of 7 625 bp was cloned by RACE (rapid-amplification of cDNA ends) technique. The gene contains 5 874 bp coding sequence without introns. Structure and cluster analysis showed that the protein encoded byUeSsk2 was a kind of mitogen activated protein kinase kinase kinase (MAPKKK), belonging to the Hog1 signal pathway, with the closest relation with Ssk2 inUstilagohordei. Expression analysis showed thatUeSsk2 was continuously up-regulated in the hyphal growth process, but the expression was not obviously changed or inhibited when the hyphal growth was inhibited, indicating the involvement ofUeSsk2 in hyphal formation. Moreover, the detection results of interaction between proteins by biosensor showed that protein UeSsk1 could not interact with UeMkk1 discovered early, indicating thatUeSsk2 regulated the hyphal formation and growth ofU.esculentain another MAPK pathway.
Ustilagoesculenta; mitogen-activated protein kinase kinase kinase;UeSsk2 gene; dimorphism
2096-2835(2017)02-0252-09
10.3969/j.issn.2096-2835.2017.02.019
2017-03-16 《中国计量大学学报》网址:zgjl.cbpt.cnki.net
国家自然科学基金资助项目(No.31470785),浙江省自然科学基金资助项目(No.LQ15C140003).
曹乾超(1990-),女,山东省临沂人,硕士研究生,主要研究方向为植物与微生物互作.E-mail:575872976@qq.com 通信联系人:叶子弘,女,教授.E-mail:zhye@cjlu.edu.cn
Q751
A
