槌果藤提取物对CIA小鼠模型Treg和Th17细胞及相关细胞因子的影响
2017-07-05应旭旻周夏娟
应旭旻周夏娟
槌果藤提取物对CIA小鼠模型Treg和Th17细胞及相关细胞因子的影响
应旭旻员周夏娟2
目的探讨槌果藤对胶原诱导关节炎(CIA)模型小鼠全血和脾脏的Treg和Th17细胞比例及IL-17和TGF茁1水平的影响。方法25只DBA/1J小鼠,采用牛域型胶原蛋白制备CIA小鼠模型后根据踝关节病变总积分分为正常组(n=5)、生理盐水组(n=5)、槌果藤低剂量组(0.5g/kg,n= 5)、中剂量组(1.0g/kg,n=5)和高剂量组(1.5g/kg,n=5)。免疫后第21天开始给予槌果藤提取物灌胃,共4周。采用细胞流式仪检测小鼠血和脾脏Treg和Th17细胞百分比,ELISA法检测血IL-17和TGF茁1水平。结果优牛域型胶原蛋白诱导的CIA小鼠3周后开始首只小鼠足趾出现红肿,第7周到达高峰,小鼠造模成功率达90%以上。悠与正常组比较,生理盐水组小鼠血和脾脏Treg细胞百分比明显下降[血:(1.17±0.36)%比(7.09±3.86)%,P<0.01);脾脏:(1.56±0.48)%比(8.03±1.75)%,P< 0.01)];Th17细胞百分比显著上升[血:(3.96±2.05)%比(0.57±1.60)%,P<0.01);脾脏:(8.32±1.62)%比(0.94±0.30)%,P<0.01)];与生理盐水组比较,槌果藤低、中、高剂量组血、脾脏Treg细胞百分比上升[血:(2.30±0.21)%、(3.78±1.68)%、(4.51±1.58)%比(1.17±0.36)%,P均<0.01);脾脏:(2.75±0.74)%、(4.19±1.45)%、(5.28±1.76)%比(1.56±0.48)%,P均<0.01)],Th17细胞下降[血:(1.78±0.50)%、(1.35±0.36)%、(0.91±0.31)%比(3.96±2.05)%,P均<0.01;脾脏:(3.66±1.69)%、(2.67±0.74)%、(1.70±0.44)%比(8.32±1.62)%,P均<0.01];忧与正常组比较,生理盐水组小鼠血清IL-17水平明显上升[(31.81±7.33)pg/mL比(12.26±4.89)pg/mL,P<0.01],TGF茁1水平明显下降[(191.62±112.47)pg/mL比(637.33±97.42)pg/mL,P<0.01];与生理盐水组比较,槌果藤低、中、高剂量组血清IL-17水平显著降低[(17.16±2.34)pg/mL、(16.02±2.78)、(10.46±1.83)pg/mL比(31.81±7.33)pg/mL,P<0.01],TGF茁1水平显著升高[(342.63±41.78)pg/mL、(484.76±43.64)pg/mL、(500.83±40.80)pg/mL比(191.62±112.47)pg/mL,P<0.01]。结论槌果藤提取物对CIA模型小鼠血和脾脏Treg和Th17细胞比例及血IL-17和TGF茁1水平具有调节作用。
小鼠;类风湿关节炎;胶原诱导性关节炎;槌果藤;Treg和Th17细胞;细胞因子
类风湿关节炎(则heumatoid arthritis,RA)是一种慢性、进行性、对称性和全身性的发病原因尚不明确的自身免疫性疾病,早期出现手、腕、足等关节的红肿热痛,持久发作可导致关节软骨和骨的破坏,关节功能障碍,甚至致残。槌果藤(糟apparis spinosa L.)为维吾尔族药,实验研究报道有免疫抑制、抗纤维化、抗凝等作用[1-3]。胶原诱导关节炎(collagen induced arthritis,CIA)模型是一种由胶原诱导的免疫炎症模型,为多发性关节炎,在动物模型中表现的红肿热痛的病理表现和发病机制与人类风湿性关节炎(rheumatoid arthritis,RA)类似。据统计[4],我国RA发病率为14.7/10万,加权合并的患病率为0.42%,患者人均年门诊费用为(8018±17 238)元。由于目前类风湿关节炎治疗仅限于控制病情药物(DMARDs)和非甾体抗炎药控制症状的药物,无彻底根治、低毒副作用药物。本研究应用CIA模型小鼠研究槌果藤对其免疫细胞功能及细胞因子的影响,探讨槌果藤治疗RA的作用。
1 材料与方法
1.1 实验动物近交系DBA/1J小鼠25只,雄性,8周龄,体质量(25±5)g,上海斯莱克实验动物中心提供,实验动物合格证号[SCXK(沪)2012-0002],浙江中医药大学动物中心SPF级别饲养。分笼饲养,置于室温(22±2)益,相对湿度(55±5)%,所有小鼠在整个实验期间均标准饮食,自然昼夜规律,自由摄食饮水。
1.2 主要试剂与器材牛域型胶原蛋白(chondrex immunization grade bovine type域collagen)(20021)、完全弗氏佐剂(chondrex complete freund's adjuvant)(7027)购自美国Chondrex公司;冰醋酸(杭州红十字会医院中心实验室提供);ELISA试剂盒MouseIL-10(555252)、MouseIL-17(559501)、Mouse-TGF茁1(555052)购自eBioscience公司;Anti-Mouse/Rat IL-17A PE(eBioscience 12-7177)、Host/Isotype:Rat IgG2a Kappa、Mouse Regulatory T cell Staining Kit#3(eBioscience 88-8115):{Anit-Mouse CD4 FITC(RM4-5)、Anti-Mouse CD25 PE CP(61.5)、Anti-Mouse/Rat FOX3 PE-Cy5(FJK-16S)、Rat IgG2a Isotype Control PE-Cy5、Anti-Mouse CD16/32(Fc Block)Purified、Flow Cytometry Staining Buffer、Fixation/permeabilization Concentrate、Fixation/Permeabilization Diluent、Permeabilization Buffer(10X)}、Cell stimulation Cocktail(plus protein transport inhibitors)(500X)(eBioscience 00-4975)、Anti-Mouse CD4 FITC(eBioscience 11-0041);RPMI-1640(8113007)(上海立菲生物技术有限公司);10%水合氯醛、肝素钠、小鼠灌胃器;100目尼龙网(BD公司);48孔培养皿、培养箱(HF151)(上海力中科学仪器有限公司);BioTeK(PowerWave XS+洗板机ELX50美国);组织匀浆机(IKA T10德国);离心机(eppendorf Centrifuge 5430 R德国)。
2 实验方法
2.1 小鼠CIA造模方法及评价牛域型胶原蛋白溶于冰醋酸中,浓度为2mg/mL,放置4益冰箱中隔夜,等体积与完全弗氏佐剂混合,充分乳化后在尾根部皮下注射胶原100滋g/只。第21天后再次皮下注射胶原50~100滋g/只,避免重复第一次注射部位。
疾病严重程度评分:正常0分;仅一个关节出现红肿现象1分;超过一个关节出现病变2分;4个关节都出现红肿现象3分;关节畸形或僵硬4分。各关节病变按5级评分法[5]:无红肿0分;关节红不肿1分;关节轻度红肿2分;关节中度红肿3分;关节重度红肿伴功能障碍4分。关节炎分数(arthritis score,AS)为每只小鼠所有病变关节分数的总和,最高分为16分。各剂量组所有小鼠关节炎分数之总和除以该组小鼠的只数,即为该组平均关节炎指数(mean arthritic index,MAI)。
2.2 槌果藤提取物制备首先称取槌果藤干果切成小片,加95%乙醇于70益水浴中加热回流1h,倾出煎煮液备用,重复2次,将2次煎煮液合并;接着在旋转蒸发仪上进行真空浓缩至固态,取得提取物后用蒸馏水溶解成1mg/mL,0.22滋m滤过器过滤灭菌,-20益保存备用。
2.3 分组及灌胃治疗随机分配为正常组(n=5),造模组(n=20)。造模成功后有小鼠死亡,故根据造模成功后关节病变总积分分为四组:生理盐水组(等量生理盐水)(n=5),槌果藤低剂量组(0.5g/kg)(n=5)、中剂量组(1.0g/kg)(n=5)和大剂量组(1.5g/kg)(n=5),灌胃治疗周期4周。
2.4 小鼠外周血和脾脏细胞悬液制取10%水合氯醛0.15mL腹腔注射麻醉小鼠,待小鼠完全麻醉后固定在动物手术台上,用无菌手术剪打开小鼠胸腔暴露心脏,取1mL空针(肝素侵润后)心脏取血约300滋L,置肝素管备用。立即取出小鼠脾脏,放入无菌培养皿中,培养皿中加入PRMI-1640研磨,用无菌磨玻平研碎脾脏,后放入200目尼龙网中过滤制得脾脏细胞悬液,用PRMI-1640调整细胞浓度为1伊106cell/mL。
2.5 刺激小鼠全血和脾脏IL-17生成取小鼠全血200滋L加200滋L PRMI-1640 1:1等体积混合放置于48孔培养皿1孔中,另取400滋L脾细胞悬液放置于另1孔,加入Cell stimulation Cocktail使终浓度为2滋L/mL,混匀后放入二氧化碳培养箱(37益5%CO2)培养6h取出备用,期间每隔2h混匀1次。
2.6 Treg和Th17细胞检测脾脏细胞悬液和全血Treg细胞流式检测:取全血或脾脏细胞悬液50滋L,加入Anit-Mouse CD4 FITC 0.25滋l和Anti-Mouse CD25 PE 0.3滋L混匀后避光置于4益孵育30min,用预冷流式染色缓冲液洗涤细胞(1500rpm 5min),弃上清收集细胞,加入1mL配置好的Fixation/Permeabilization working solution(Fixation/Permeabi-ization Concentrate: Fixation/Permeabiliztion Diluent 1:3),混匀后4益孵育>60min破膜,加入2mL 1伊Permea-bilization Buffer(10伊用蒸馏水稀释)混匀后洗涤(1500rpm 5min)弃上清取沉淀,重复2次,加入100滋L 1伊Permeabilization Buffer,加入2滋L Anti-Mouse/Rat FOX3 PE-Cy5抗体和2滋LRat IgG2a Isotype Control PE-Cy5同型对照避光4益孵育30min,用2mL Permeabilization Buffer洗涤(1500rpm 5min)弃上清取沉淀,重复2次后加入5mL流式染色缓冲液上机分析。
脾脏细胞悬液和全血Th17细胞流式检测:取刺激培养后的全血或脾脏细胞悬液50滋L,加入Anti-Mouse CD4 FITC 0.5滋L,避光4益孵育30min,破膜方式同上,加入Anti-Mouse/Rat IL-17A PE 5滋L和对照管加入Host/Isotype:Rat IgG2a Kappa 5滋L同型对照,孵育30min,用2mL Permeabilization Buffer洗涤(1500rpm 5min)弃上清取沉淀,重复2次后加入5mL流式染色缓冲液上机分析。
2.7 小鼠外周血IL-17、TGF TGF茁1水平检测小鼠心脏取血取完300滋L后立即用1mL空针抽取剩余血液,收集外周血后离心(2500rpm 10min)取上清弃沉淀,分装后置于-20益冰箱中保存备用,用于检测IL-10、IL-17、TGF TGF茁1活性。ELISA具体操作方法参照eBioscience IL-10、IL-17、TGF茁1 Platinum ELISA说明书严格执行。
3 结果
3.1 小鼠免疫后情况免疫后小鼠较未免疫前小鼠毛色无光泽,情绪烦躁,紧张易怒,食欲减退,体质量下降。牛C域诱导的DBA/1J小鼠3周后开始首只小鼠足趾出现红肿,第7周到达高峰。其肿胀多在趾间关节开始,随后肿胀至足垫,踝关节,肿胀后可发展为关节僵硬、畸形,前后趾发病前后不一,前趾发病率70%,后趾发病率80%。各组平均关节炎指数最高为7.1。槌果藤灌胃治疗4周后,小鼠毛色无明细改变,情绪平静,食欲增加,体质量无持续下降。免疫后第21、28、35、42天以小鼠平均关节炎指数(mean arthriticindex MAI)评价各组小鼠关节肿胀程度,与生理盐水组比较,槌果藤低、中、高剂量组小鼠MAI均降低,肿胀程度减轻。见图1。
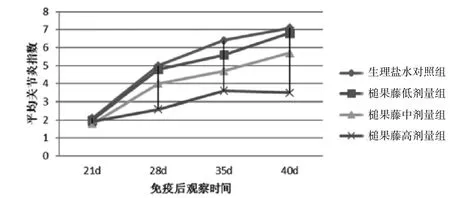
图1 各组小鼠免疫后关节炎指数
3.2 流式技术检测小鼠外周血Treg和Th17细胞比例
与正常组比较,生理盐水组Treg细胞比例明显下降(t=3.418,P<0.01);槌果藤各剂量组Treg细胞比例依次升高,槌果藤低、中、高剂量组Treg细胞比例较均生理盐水组显著升高(P均<0.01),槌果藤低、高剂量组间比较,差异有统计学意义(P<0.01);槌果藤中、高剂量组间比较,差异无统计学意义(P>0.05)。与正常组比较,生理盐水组Th17细胞比例明显上升(t=3.676,P<0.01);槌果藤各剂量组Th17细胞比例依次下降,槌果藤低、中、高剂量组Th17细胞比例均显著低于生理盐水组(P均<0.01),槌果藤高剂量组Th17细胞比例显著高于低剂量组(P<0.01),见表1。
表1 各组小鼠外周血Treg、Th17细胞比例比较(%,)
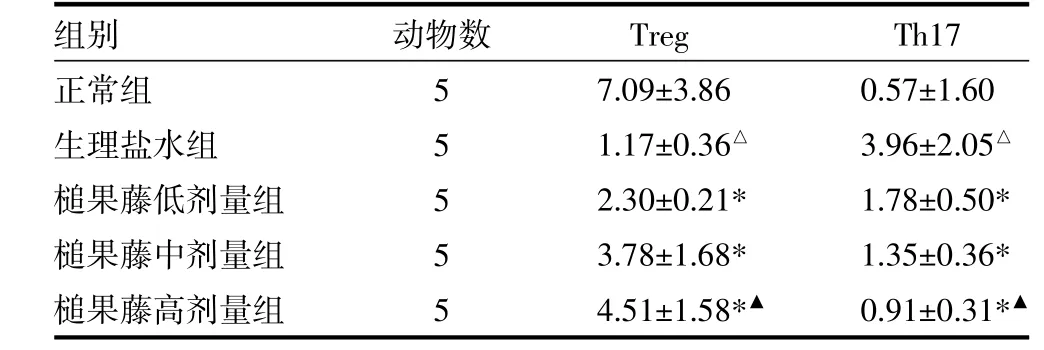
表1 各组小鼠外周血Treg、Th17细胞比例比较(%,)
注:与正常组比较,吟P<0.01;与生理盐水组比较,*P<0.01;与槌果藤低剂量组比较,银P<0.01
组别正常组生理盐水组槌果藤低剂量组槌果藤中剂量组槌果藤高剂量组动物数5 5 5 5 5 Treg 7.09±3.86 1.17±0.36吟2.30±0.21* 3.78±1.68* 4.51±1.58*银Th17 0.57±1.60 3.96±2.05吟1.78±0.50* 1.35±0.36* 0.91±0.31*银
3.3 流式细胞技术检测小鼠脾细胞悬液Treg和Th17细胞比例与正常组比较,生理盐水组Treg细胞比例明显下降(t=7.981,P<0.01);槌果藤各剂量组Treg细胞比例均依次上升,槌果藤中、高剂量组Treg细胞比例较生理盐水组显著升高(P均<0.01);槌果藤低剂量组Treg细胞比例与生理盐水组比较,差异无统计学意义(P>0.05),但明显低于槌果藤中、高剂量组(P<0.01)。与正常组比较,生理盐水组Th17细胞比例明显升高(t=10.024,P<0.01),槌果藤各剂量组Th17细胞比例依次下降,与生理盐水组比较,槌果藤低、中、高剂量组Th17细胞比例均显著降低(P均<0.01);与槌果藤高剂量组比较,槌果藤低剂量组Th17细胞比例显著降低(P<0.01),见表2。
表2 各组小鼠脾细胞悬液Treg和Th17细胞比例比较(%,)
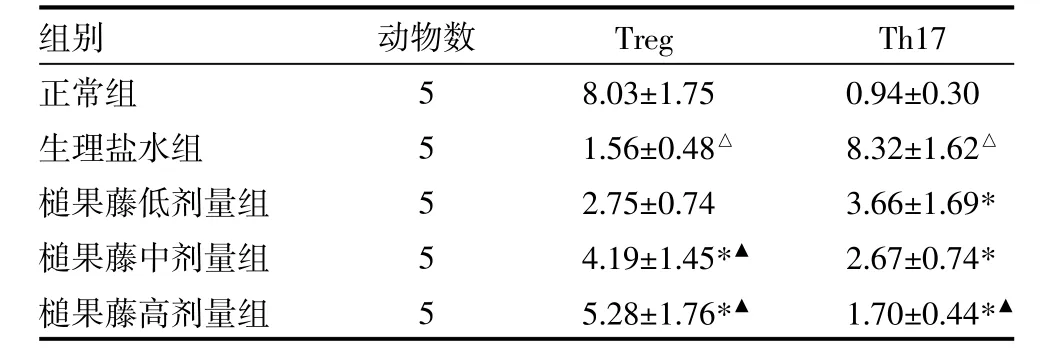
表2 各组小鼠脾细胞悬液Treg和Th17细胞比例比较(%,)
注:与正常组比较,吟P<0.01;与生理盐水组比较,*P<0.01;与槌果藤低剂量组比较,银P<0.01
组别正常组生理盐水组槌果藤低剂量组槌果藤中剂量组槌果藤高剂量组动物数5 5 5 5 5 Treg 8.03±1.75 1.56±0.48吟2.75±0.74 4.19±1.45*银5.28±1.76*银Th17 0.94±0.30 8.32±1.62吟3.66±1.69* 2.67±0.74* 1.70±0.44*银
3.4 ELISA检测小鼠血清IL-17、TGF茁1水平与正常组比较,生理盐水组血清IL-17水平明显上升(t=4.962,P<0.01);槌果藤各剂量组IL-17水平依次下降,槌果藤低、中、高剂量组IL-17水平显著低于生理盐水组(P均<0.01);槌果藤低剂量组血清IL-17水平明显高于槌果藤高剂量组(P<0.01),与中剂量组比较,差异无统计学意义(P>0.05);槌果藤中、高剂量组间比较,差异无统计学意义(P>0.05)。与正常组比较,生理盐水组血清TGF茁1水平明显下降(t= 6.698,P<0.01);槌果藤各剂量组小鼠血清TGF茁1水平依次升高,槌果藤低、中、高剂量组血清TGF茁1水平显著高于生理盐水组(P均<0.01);槌果藤低剂量组血清TGF茁1水平低于高剂量组(P<0.01);槌果藤剂中、高剂量组间比较,差异无统计学意义(P>0.05)。见表3。
表3 各组小鼠血清IL-17和TGF茁1水平比较(pg/mL,)

表3 各组小鼠血清IL-17和TGF茁1水平比较(pg/mL,)
注:与正常组比较,吟P<0.01;与生理盐水组比较,*P<0.01;与槌果藤低剂量组比较,银P<0.01
组别正常组生理盐水组槌果藤低剂量组槌果藤中剂量组槌果藤高剂量组动物数5 5 5 5 5 IL-17 12.26±4.89 31.81±7.33吟17.16±2.34* 16.02±2.78* 10.46±1.83*银TGF茁1 637.33±97.42 191.62±112.47吟342.63±41.78* 484.76±43.64* 500.83±40.80*银
4 讨论
RA是自身免疫耐受受损后表现出一系列临床症状及体征的自身免疫性疾病。通过本实验研究,观察模型小鼠体质量、毛色、情绪、关节肿胀情况,结果显示,槌果藤提取物能有效缓解CIA模型小鼠发病情况。
RA的病因目前尚不明确,可能与基因、环境等因素有关,但近期免疫研究热点Treg/Th17细胞失衡在RA发病中具有重要作用[6]。Treg具有免疫抑制性和免疫无能性两大特征,在维持机体免疫稳定中起到重要作用,其中转录因子FoxP3是控制这群Treg分化和功能的重要基因,也是特异的标志物[7]。2005年,发现一群能分泌IL-17A的细胞,定义为Th17细胞,有别于经典的Th1和Th2细胞,属于CD4+细胞,能在核转录因子ROR-酌t调控下转录出特异性IL-17细胞因子,在自身免疫病中发挥重要的作用[8]。Lubberts等[9]使用IL-17中和抗体或者IL-17基因敲除的小鼠能显著降低小鼠关节炎的发病率,表明Th17细胞是RA重要的致病性T细胞。Treg和Th17细胞在特定的细胞因子微环境下可以相互转化初始CD4+T细胞在TGF-茁作用下可分化为Treg细胞,而当TGF-茁和IL-6共同存在时,能够诱导ROR酌t的表达,促进初始T细胞分化为Th17细胞[10]。
据研究,类风湿关节炎细胞因子的失衡也是类风湿关节炎重要的发病机制。TGF茁是一种既可促炎又可抑炎的双向调节细胞因子。TGF茁1可促进成纤维细胞生长分化、单核巨噬细胞活化、趋化、血管形成,促进炎症蛋白多糖、成纤维细胞玉型胶原基因表达和关节软骨合成。Park等[11]研究表明,TGF茁1够提高域型胶原特异性T细胞分化,下调促炎症因子的表达、关节炎症反应和软骨的损伤。活动期滑膜TGF茁1表达增高,而慢性纤维化期表达降低[12]。本实验小鼠的关节病变出现在活动期,TGF茁1的抑炎作用大于促炎作用。IL-17是早期炎症因子,也是强致炎因子,可刺激细胞分泌前列腺素E2,粒细胞集落刺激因子和IL-6、IL-8等炎症因子等,诱导人成纤维细胞表达细胞间黏附分子(ICAM)-1,激活NF-kB转录活性,也参与诱导基质金属蛋白酶生成和滑膜细胞增生[13-14]。推测槌果藤是通过抑制炎早期炎性因子IL-17,减少后期炎性因子或黏附分子等生成,达到治疗目的。
本实验结果显示,生理盐水组比正常组小鼠踝关节组织中促炎性因子IL-17上升,而抑炎性因子TGF茁1明显下降,佐证小鼠造模成功。与生理盐水组比较,槌果藤低、中、高剂量组IL-17下降,TGF茁1细胞因子浓度升高(P<0.01),且高浓度量(1.5g/kg)作用最明显,推测槌果藤可提高TGF茁,既可协同IL-6上调Foxp3的表达,促进Treg细胞的生成,抑制Th17的分化,抑制炎症反应及自身免疫反应,从而达到治疗RA目的。
本研究结果表明,槌果藤对CIA模型小鼠有治疗作用,但未涉及基因学如何调控,具体作用机制待进一步研究。
[1]周晓涛,周文涛,马秀敏,等.槌果藤对佐剂性关节炎大鼠模型外周血中细胞因子影响的研究[J].时珍国医国药,2012,23(6):1382-1384.
[2]曹越兰,李欣,郑敏.槌果藤对进行性系统性硬化症患者成纤维细胞增殖和I型胶原产生的影响[J].中国中药杂志,2008,33(5):560-563.
[3]Wang H,Shi S,Duan J.Structural characterization of a homogalacturonan from Capparis spinosa L.fruits and anti-complement activity of its sulfated derivative[J].Glycoconjugate journal,2012,29(5-6):379-878.
[4]曾小峰,朱松林,谭爱春,等.我国类风湿关节炎疾病负担和生存质量研究的系统评价[J].中国循证医学杂志,2013,13(3):300-307.
[5]Cuzzocrea S,AyroldiE,DiPaola R,etal.Role of glucocorticoid-induced TNF receptor family gene(GITR)in collageninduced arthritis[J].FASEB J,2005,19(10):1253-1265.
[6]Venkatesha SH,Dudics S,Weingartner E,etal.Altered Th17/ Treg balance and dysregulated IL-1茁response influence susceptibility/resistance to experimental autoimmune arthritis[J].International Journal of Immunopathology and Pharmacology,2015,28(3):318-328.
[7]Park MK,Jung YO,Lee SY,et al Erratum to:Amelioration ofautoimmune arthritisby adoptive transfer of Foxp3-expressing regulatory B cells is associated with the Treg/Th17 cell balance[J].Journalof TranslationalMedicine,2016,14(1):1-11.
[8]Harrington LE,Hatton RD,Mangan PR,etal.Interleukin 17-producing CD4+effector T cells develop via a l ineage distinct from the T helper type 1 and 2 lineages[J].Nat Immunol,2005,6(11):1123-1132.
[9]Lubbters E,Koenders MI,Oppers-Walgreen B,etal.Treatmentwith a neutralizing anti-murine interleukin-17 antibody after the onset of collagen-induced arthritis rreduces joint inflammation,cartilage destruction,and bone erosion[J].Arthritis Rheum,2004,50(2):650-659.
[10]BettelliE,Carrier Y,GaoW,etal.Reciprocal developmental pathways for the Generation of pathogenic effector TH17 and regulatory T cells[J].Nature,2006,441(790):235-238.
[11]Park M,Park H,Cho M,et al.Transforming growth factor茁-transducedmesenchymal stem cells ameliorate experimental autoimmune arthritis through reciprocal regulation of Treg/Th17 cells and osteoclastogenesis[J].Arthritis&Rheumatism,2011,63(6):1668-1680.
[12]戴冽,叶志强,汤美安,等.类风湿关节炎滑膜转化生长因子茁-1表达及与病理改变的关系[J].中华风湿病学杂志,2000,4(6):357-360.
[13]Kirkham BW,Lassere M N,Edmonds JP,et al.Synovial membrane cytokine expression is predictive of joint damage progression in rheumatoid arthritis:A two-year prospective study(the DAMAGE study cohort)[J].Arthritis&Rheumatism,2006,54(4):1122-1131.
[14]郭亚春,高亚贤,宋鸿儒.薯蓣皂苷片含药血清对IL-17和TNF-琢诱导大鼠滑膜细胞株RSC-364NF-KB p65、STAT3及VEGF影响的实验研究[J].中国中西医结合杂志,2013,33(6):814-818.
(收稿:2016-07-18修回:2016-10-20)
Effect of Capparis Spinosa L.Extract on Trag and Th17 Cells and Related Cytokines in CIA M ice
YING Xumin1,ZHOU Xiajuan2.1 Hangzhou Red Cross Hospital(now working at Hangzhou Emergency Medical Center), Hangzhou(310003),China;2 Department of General Medicine,the First Affiliated Hospital of Zhejiang Chinese Medical University,Hangzhou(310006),China
Objective To investigate the effect of Capparis spinosa L.extract on the percentages of Treg/Th17 cells and the level of IL-17 and TGF茁1 in mice with collagen-induced arthritis(CIA).M ethods CIA was induced in 25 male DBA/1 Jmice by immunization with bovine type II collagen.According to mean arthritic index(MAI)the successful model mice were divided into 5 groups:normal group(n=5),control group(n=5,equivalent physiolog ical saline),low-,medium-,and high-dose Capparis spinosa L.extract group(n=5 in each group,daily dose of 0.5, 1.0,and 1.5g/kg,respectively).Capparis spinosa L.extract was given by gavage on Day 21 after immunization and lasted 4 weeks.The percentages of Treg and Th17 cells in blood and spleen were detected by flow cytometry,andthe serum levels of TGF茁1 and IL-17 were measured by ELISA.Results The first signs of arthritis appeared in mice 3 weeks after immunization and continued to 7 weeks.The incidence of CIA in mice reached more than 90%. Compared with normal group,control group had significantly decreased percentage of Treg cells(blood:1.17%±0.36% vs 7.09%±3.86%;spleen:1.56%±0.48%vs 8.03%±1.75%;all P<0.01)and increased percentage of Th17(blood: 3.96%±2.05%vs 0.57%±1.60%;spleen:8.32%±1.62%vs 0.94%±0.30%;all P<0.01).The low-,medium-and highdose drug groups had increased percentages of Treg and decreased percentages of Th17 against control group(blood Treg:2.30%±0.21%,3.78%±1.68%,4.51%±1.58%vs 1.17%±0.36%;spleen Treg:2.75%±0.74%,4.19%±1.45%,5.28%±1.76%vs 1.56%±0.48%;blood Th17:1.78%±0.50%,1.35%±0.36%,0.91%±0.31%vs 3.96%±2.05%;spleen Th17: 3.66%±1.69%,2.67%±0.74%,1.70%±0.44%vs 8.32±1.62%;all P<0.01).Compared with normal group,the serum level of IL-17 increased(31.81±7.33pg/mL vs 12.26±4.89pg/mL,P<0.01)and TGF茁1 decreased(191.62±112.47pg/mL vs 637.33±97.42 pg/mL,P<0.01)in control group;compared with control group,the serum levels of IL-17 decreased(17.16±2.34pg/mL,16.02±2.78pg/mL,10.46±1.83pg/mL vs 31.81±7.33pg/mL;P<0.01)and the level of TGF茁1 increased(342.63±41.78pg/mL,484.76±43.64pg/mL,500.83±40.80pg/mL vs 191.62±112.47pg/mL;P<0.01)in low-,medium,and high-dose drug groups.Conclusion Capparis spinosa L.Extract can regulate the percentages of Treg and Th17 and the serum levels of IL-17 and TGF茁1 cytokines in mice with CIA.
mice;rheumatoid arthritis;collagen-induced arthritis;Capparis spinosa L.;Treg and Th17 cells; cytokines
杭州市科技计划项目(No.20110733Q15);浙江省中医药科技计划项目(No.2011ZA080)
1杭州市红十字会医院(现在杭州市急救中心工作)(3员园园园3);2浙江中医药大学附属第一医院全科医学科(杭州310006)
应旭旻,Tel:0571-87035535;E-mail:xmyin@163.com
