血管紧张素Ⅱ和高糖环境对大鼠肾小球系膜细胞Toll样受体4信号通路及炎性因子表达的影响*
2017-07-03刘思逸程玉花吕金雷陈钦开
王 瑜, 刘思逸, 程玉花, 张 莉, 江 磊, 吕金雷△, 陈钦开
1南昌大学附属第一医院肾内科,南昌 3300062江西九江学院附属医院肾内科,九江 332000
血管紧张素Ⅱ和高糖环境对大鼠肾小球系膜细胞Toll样受体4信号通路及炎性因子表达的影响*
王 瑜1, 刘思逸1, 程玉花2, 张 莉1, 江 磊1, 吕金雷1△, 陈钦开1
1南昌大学附属第一医院肾内科,南昌 3300062江西九江学院附属医院肾内科,九江 332000
目的 探讨高糖条件下肾小球系膜细胞Toll样受体4(TLR4)及其信号通路中下游因子MyD88、核因子-κB(NF-κB)以及炎性因子的表达变化,论证高糖环境下血管紧张素Ⅱ(AngⅡ)与TLR4的对话关系,以期阐明TLR4信号通路在糖尿病肾病(DN)发病机制中的作用。方法 设计3对针对大鼠TLR4基因的特异性siRNA片段以及带有绿色荧光的阴性对照,筛选出转染效率最高的siRNA,用于后续实验。第1部分实验在高糖的基础上分别加入AngⅡ、TLR4 siRNA、血管紧张素Ⅱ受体阻断剂(ARB)、阴性对照siRNA,探讨高糖对各组细胞TLR4、MyD88及NF-κB表达的影响;第2部分实验在AngⅡ的基础上分别加入高糖、TLR4 siRNA、ARB、阴性对照siRNA,探讨AngⅡ对各组细胞TLR4,MyD88及NF-κB表达的影响。采用荧光定量PCR检测各组TLR4、MyD88 mRNA的表达,Western blot检测TLR4、MyD88及NF-κB蛋白表达水平的变化,ELISA法检测细胞上清液中白细胞介素-6(IL-6)及单核细胞趋化因子-1(MCP-1)的表达情况。结果 高糖及AngⅡ都可以上调TLR4、MyD88、NF-κB蛋白及TLR4、MyD88 mRNA的表达水平(均P<0.05),也可上调IL-6及MCP-1的表达(均P<0.01)且二者协同刺激情况下上调更明显。siRNA干扰及ARB可下调TLR4、MyD88、NF-κB蛋白及TLR4、MyD88 mRNA的表达,下调IL-6及MCP-1的表达,与高糖及AngⅡ组相比差异有统计学意义(均P<0.05)。结论 高糖环境和AngⅡ刺激系膜细胞TLR4/MyD88信号通路激活,特异性TLR4 siRNA基因可以部分阻断由高糖及AngⅡ诱导的TLR4信号的激活,厄贝沙坦也可部分阻断TLR4信号通路,高糖和AngⅡ共刺激增强由TLR4介导的天然免疫炎症效应,TLR4/MyD88信号通路在此效应中扮演重要角色;TLR4 siRNA基因沉默技术为寻找DN的治疗方法提供了新思路,也为临床上使用ARB延缓DN进程提供了新的理论依据。
糖尿病肾病; 高糖; 血管紧张素Ⅱ; 系膜细胞; Toll样受体4; 天然免疫应答; 炎性因子
糖尿病肾病(diabetic nephropathy,DN)发病涉及遗传因素、代谢异常、血流动力学改变、细胞因子、氧化应激等因素[1]。除此以外,近年来免疫炎症机制备受关注,1997年Pickup等[2]首先提出糖尿病可能是一种体内免疫系统诱导的急性时相反应。已有研究证明[3],DN患者体内的C-反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1(IL-1)、IL-6等炎症因子的浓度较正常人明显升高,提示在糖尿病肾病的发病过程中,免疫炎症系统起着重要的作用,为DN发病机制的研究提供了新的思路[2]。
Toll样受体(Toll-like receptors,TLRs)是一类模式识别受体(pattern recognition receptors,PRRs),可以识别胞外抗原,并向胞内传递,进一步引发体内免疫炎症反应[4]。TLR4为TLRs家族成员,为Ⅰ型跨膜蛋白,与相应配体结合后可激活核因子-κB(NF-κB),诱导炎性因子释放[5]。国外学者[6]及本课题前期研究结果显示在高糖环境和糖尿病患者体内肾小球系膜细胞及肾小管上皮细胞的TLR4信号通路以及下游的单核细胞趋化因子-1(MCP-1)、IL-1、IL-6等炎症因子的表达升高,TLR4阻断剂和血管紧张素Ⅱ受体阻断剂(ARB)厄贝沙坦等可明显阻断该信号通路,上述因子表达明显下降[7-8]。本研究探讨高糖和血管紧张素Ⅱ(Angiotensin Ⅱ,AngⅡ)环境下HBZY-1细胞TLR4、髓样分化蛋白88(myeloid differentiation factor 88,MyD88)等的表达变化,同时采用小干扰RNA(siRNA)特异性地下调高糖环境中肾系膜细胞TLR4的表达,观察TLR4、MyD88等的表达变化,为延缓DN的进展开辟新的治疗途径。
1 材料与方法
1.1 细胞和试剂
细胞:大鼠肾小球系膜细胞(HBZY-1)(武汉大学中国典型培养物保藏中心)。目的基因:TLR4 siRNA,上海吉玛公司设计并合成,合成基因序列见表1。试剂:DMEM培养液、胎牛血清、胰蛋白酶(美国HyClone公司),RNA提取试剂盒、AngⅡ(美国Sigma公司),反转录试剂、PCR试剂及Anti-TLR4抗体、Anti-MyD88抗体(美国Abcam公司),NF-κB p65抗体、β-actin抗体(ANBO公司),大鼠IL-6、MCP-1 ELISA试剂盒(武汉优尔生商贸有限公司),山羊抗小鼠二抗、山羊抗兔二抗(中杉金桥公司),厄贝沙坦(杭州赛诺菲公司)。
1.2 细胞培养
将生长情况良好的HBZY-1放入细胞培养箱中培养,待其长至70%~80%融合时进行冻存或传代。细胞消化传代后重悬、计数,均匀接种于6孔板,恒温培养箱培养。于细胞生长至40%~50%时进行转染,转染6 h后PBS洗涤细胞2次,加入低糖培养液2 mL后继续培养,分别在12、24、48 h时在荧光显微镜下观察细胞转染效果,根据效果选择合适的浓度以及时间进行后续实验。设计3对针对大鼠TLR4基因的特异性siRNA(序列见表1),按照摸索出的最佳转染时间及浓度进行转染,转染完成后加入高糖培养液干预24 h,提取细胞总RNA,荧光定量PCR检测各组TLR4、MyD88 mRNA的表达,选择出沉默效果最佳的siRNA进行下一步分组实验。
1.3 分组
根据前期实验结果,将甘露醇浓度定为25 mmol/L、低糖浓度定为5.6 mmol/L、高糖浓度定为25 mmol/L,AngⅡ为10-7mmol/L,ARB采用厄贝沙坦10-5mmol/L。细胞转染24 h后分以下两部分干预,第1部分探讨高糖对各组细胞TLR4、MyD88及NF-κB表达的影响,分6组:低糖组、高糖组、高糖+AngⅡ组、高糖+ ARB组、高糖+TLR4 siRNA组、高糖+ScsiRNA组;第2部分探讨AngⅡ对各组细胞TLR4、MyD88及NF-κB表达的影响,分6组:低糖组、AngⅡ组、高糖+AngⅡ组、AngⅡ+ ARB组、AngⅡ+ TLR4 siRNA组、AngⅡ+ ScsiRNA组。
1.4 Western blot分析各组TLR4、MyD88、NF-κB蛋白的相对表达量
转染后的细胞接种于6孔板并按上述分组干预12 h后,100 mL细胞裂解液提取总蛋白,再先后进行上样,电泳,转膜,封闭和一、二抗孵育,洗膜,化学发光,显影,定影。将胶片进行扫描或拍照,用凝胶图像处理系统Quantity One分析目标条带的灰度值,蛋白相对表达量为各目标条带灰度值/β-actin灰度值。
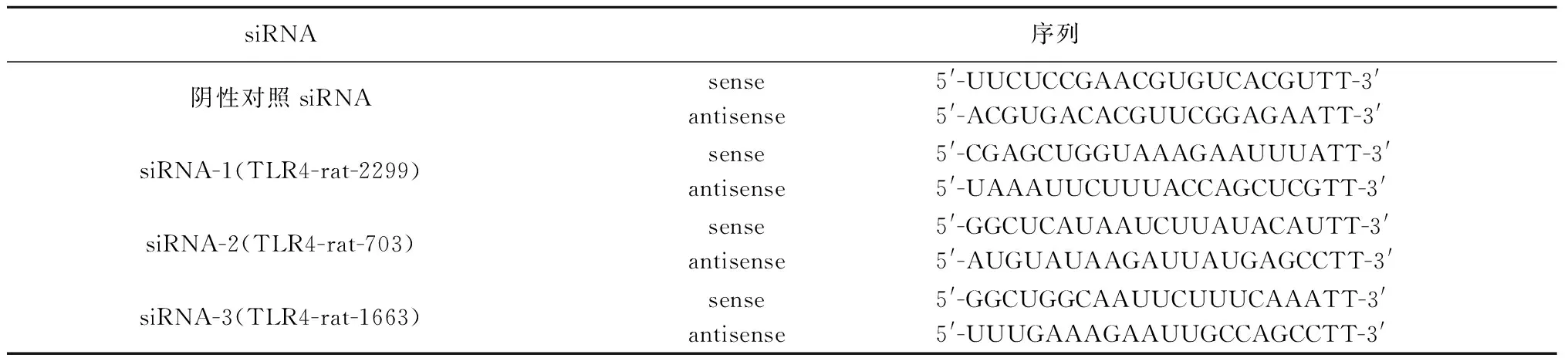
表1 siRNA序列
1.5 荧光定量PCR检测各组TLR4、MyD88 mRNA的表达
转染后的细胞接种于6孔板并按上述分组干预12 h后,Trizol法提取细胞总RNA,Real-time PCR所需引物序列:TLR4上游5′-TCGGTGGTCAGTGTGCTTGTG-3′,下游5′-AAAGCTGAAAGC-GGGGCACTCC-3′,MyD88上游5′-TCAACAA-GCGAGCGCACCGT-3′,下游5′-TGAGCGCGACCAACGGTAGA-3′,β-actin上游5′-TCAGGTCATCACTATCGGCAAT-3′,下游5′-AAAGA-AAGGGTGTAAAACGCA-3′。以β-actin为内参,cDNA反应条件:42℃孵育30 min,85℃加热5 min,16℃终止反应。扩增反应条件为94℃ 30 s,94℃ 5 s,60℃ 30 s,40个循环,相对表达量由SDS软件分析,由ABI 7500实时定量PCR仪得出相对表达量RQ值(RQ值=2-ΔΔCt)。
1.6 ELISA检测细胞上清液IL-6、MCP-1水平
收集处理24 h后上述各组细胞上清液,按ELISA试剂盒说明书操作,相同标本设3个复孔,重复3次,在酶标仪450 nm测定吸光度(A)值,根据标准曲线及A值计算各样本的相应浓度。
1.7 统计学分析
2 结果
2.1 转染时间、浓度摸索及最佳siRNA选择结果
荧光显微镜下带有绿色荧光的阴性对照siRNA转染结果显示,转染24 h及48 h时转染效率无显著差异,但转染48 h时可见细胞死亡率明显增多,故以下实验采用的转染时间为24 h。且本实验转染浓度为50 nmol/L时转染效果最佳,见图1。与阴性对照siRNA比较,siRNA3的TLR4及MyD88 mRNA表达可见明显下降(P<0.01),说明siRNA3沉默TLR4信号通路的效果佳,故以siRNA3用于后续实验。
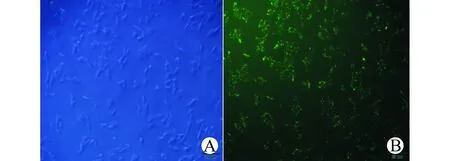
荧光显微镜下观察阴性对照siRNA在转染前(A)及转染浓度为50 nmol/L、转染时间为24 h的转染效果(B)比较图1 转染效果对比图(×200)Fig.1 Comparison of the effect of transfection(×200)
2.2 高糖干预下的实验结果
2.2.1 Western blot检测各组细胞TLR4、MyD88、NF-κB蛋白的表达 与低糖组相比,高糖及高糖+AngⅡ组的TLR4、MyD88、NF-κB蛋白的表达显著增加(均P<0.05);与高糖组及高糖+AngⅡ组相比,高糖+TLR4 siRNA组及高糖+ARB组上述蛋白表达下调(均P<0.05),高糖+ScsiRNA组无明显下降,可排除转染过程的影响,见图2。
2.2.2 荧光定量PCR检测各组细胞TLR4、MyD88 mRNA相对表达量 与低糖组相比,高糖及高糖+AngⅡ组的MyD88、TLR4 mRNA的表达显著增加(均P<0.05),与高糖组及高糖+AngⅡ组相比,高糖+TLR4 siRNA组及高糖+ARB组上述mRNA表达下调(均P<0.05),见图3。
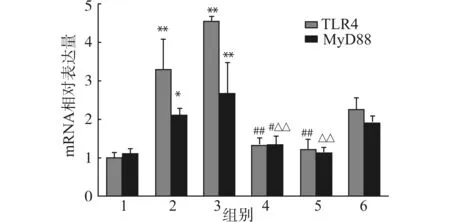
1:低糖组;2:高糖组;3:高糖+AngⅡ组;4:高糖+ARB组;5:高糖+TLR4 siRNA组;6:高糖+ScsiRNA组;与1组比较,*P<0.05 **P<0.01;与2组比较,#P<0.05 ##P<0.01;与3组比较,△△P<0.01 图3 荧光定量PCR检测高糖对MyD88、TLR4 mRNA表达的影响Fig.3 Effect of high glucose on mRNA expression of MyD88 and TLR4(Real-time PCR)
2.3 AngⅡ干预下的实验结果
2.3.1 Western blot检测各组细胞TLR4、MyD88、NF-κB蛋白的表达 与低糖组相比,AngⅡ组及高糖+Ang Ⅱ组的TLR4、MyD88、NF-κB蛋白的表达显著增加(均P<0.05),与AngⅡ组及高糖+AngⅡ组相比,AngⅡ组+TLR4 siRNA组及AngⅡ+ARB组上述蛋白表达下调(均P<0.05),见图4。
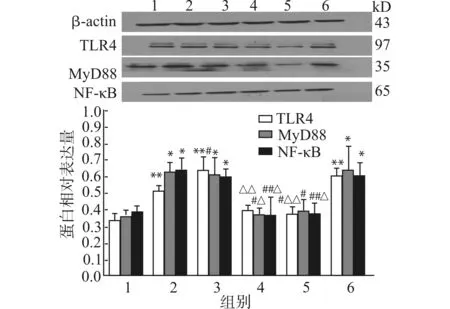
1:低糖组;2:AngⅡ组;3:高糖+AngⅡ组;4:AngⅡ+ARB组;5:AngⅡ+TLR4 siRNA组,6:AngⅡ+ScsiRNA组;与1组比较,*P<0.05 **P<0.01;与2组比较,#P<0.05 ##P<0.01;与3组比较,△P<0.05 △△P<0.01图4 Western blot检测AngⅡ对TLR4、MyD88、NF-κB蛋白表达的影响Fig.4 Effect of AngⅡ on protein expression of MyD88 and TLR4 NF-κB(Western blotting)
2.3.2 荧光定量PCR检测TLR4、MyD88 mRNA相对表达量 与低糖组相比,AngⅡ组及高糖+AngⅡ组的TLR4、MyD88 mRNA的表达显著增加(均P<0.01),与AngⅡ组及高糖+AngⅡ组相比,AngⅡ+TLR4 siRNA组及AngⅡ+ARB组蛋白表达下调(均P<0.01),见图5。
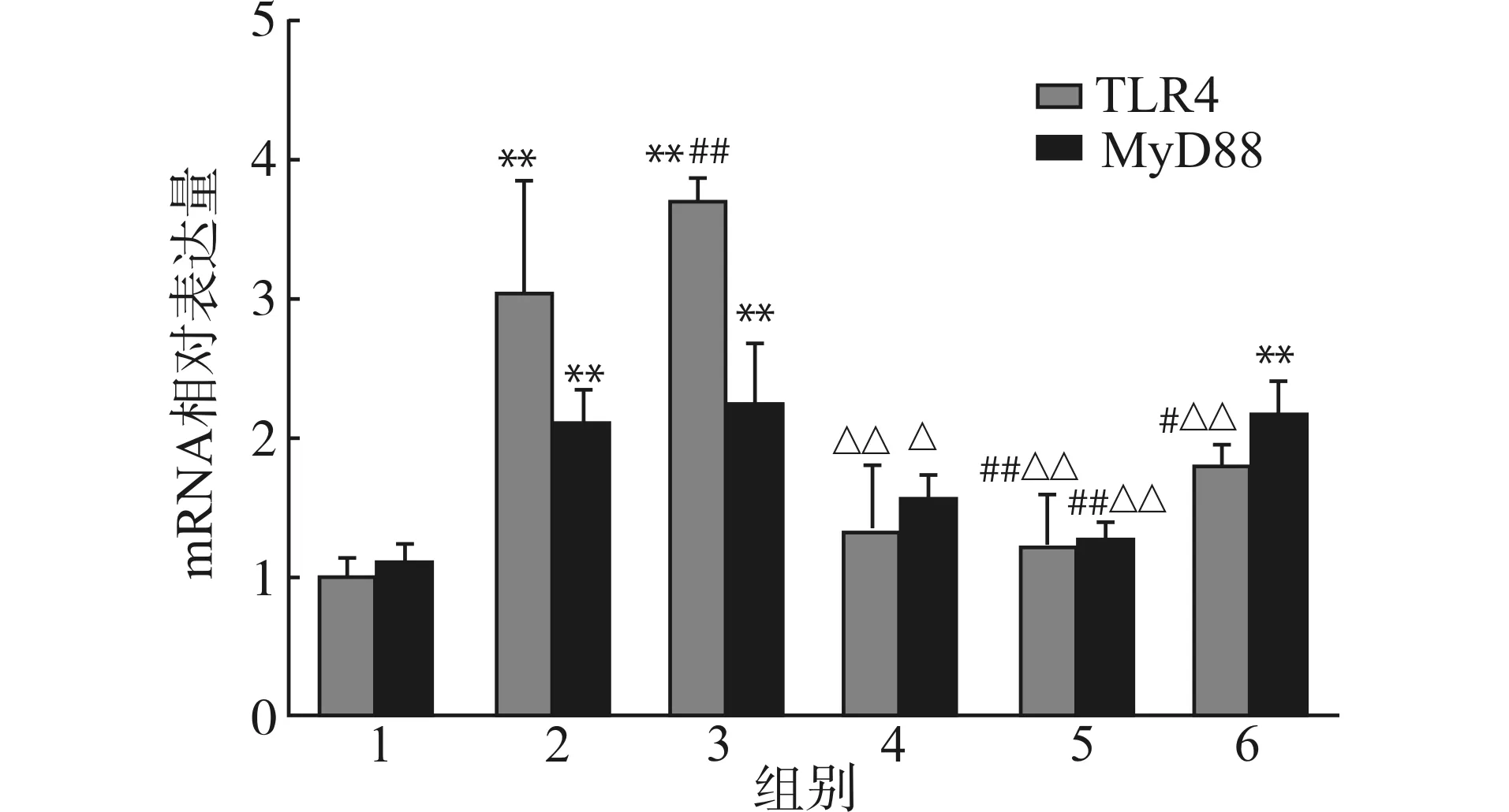
1:低糖组;2:AngⅡ组;3:高糖+AngⅡ组;4:AngⅡ+ARB组;5:AngⅡ+TLR4 siRNA组,6:AngⅡ+ScsiRNA组;与1组比较,**P<0.01;与2组比较,#P<0.05 ##P<0.01;与3组比较,△P<0.05 △△P<0.01 图5 荧光定量PCR检测AngⅡ处理组TLR4、MyD88 mRNA的表达Fig.5 Effect of AngⅡ on expression of MyD88 and TLR4 mRNA(Real-time PCR)
2.4 各组细胞上清IL-6、MCP-1水平变化
与低糖组相比,高糖组、AngⅡ组IL-6、MCP-1表达显著升高,高糖及AngⅡ二者联合刺激时上调更为明显。与高糖或AngⅡ单独刺激比较,二者联合刺激时表达有显著性差异。与高糖及AngⅡ组比较,AngⅡ+ARB组及AngⅡ+TLR4 siRNA组IL-6、MCP-1的表达显著下调。见表2。
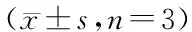
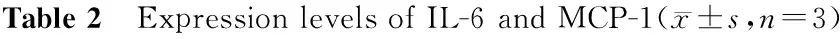
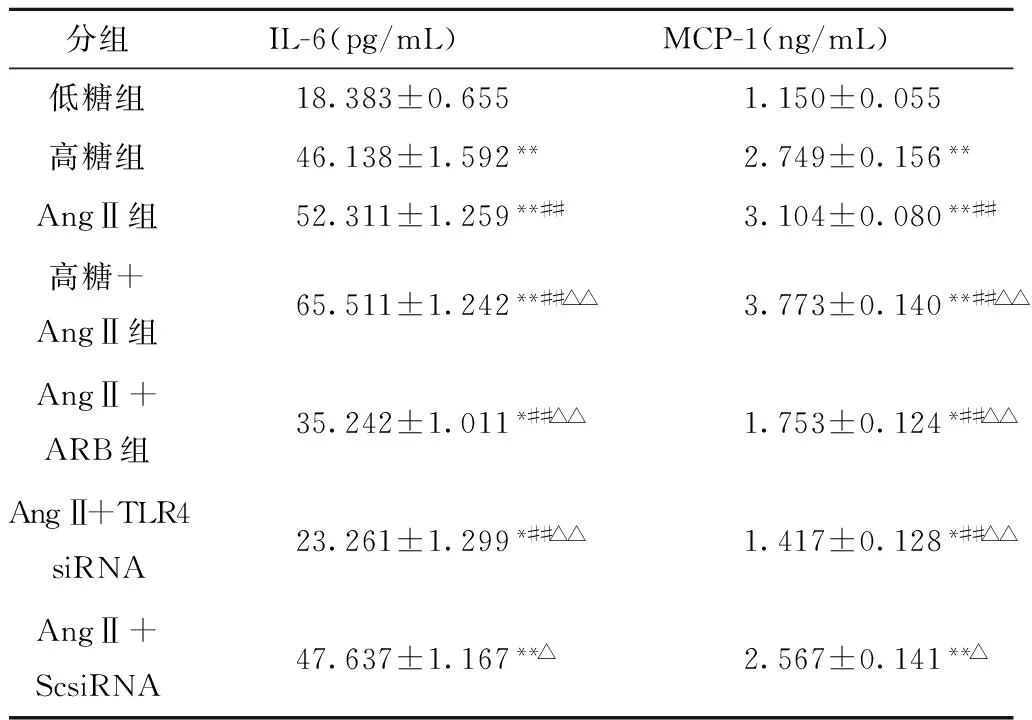
分组IL-6(pg/mL)MCP-1(ng/mL)低糖组18.383±0.6551.150±0.055高糖组46.138±1.592**2.749±0.156**AngⅡ组52.311±1.259**##3.104±0.080**##高糖+AngⅡ组65.511±1.242**##△△3.773±0.140**##△△AngⅡ+ARB组35.242±1.011*##△△1.753±0.124*##△△AngⅡ+TLR4siRNA23.261±1.299*##△△1.417±0.128*##△△AngⅡ+ScsiRNA47.637±1.167**△2.567±0.141**△
与低糖组比较,*P<0.05**P<0.01;与高糖组比较,##P<0.01;与AngⅡ组比较,△P<0.05△△P<0.01
3 讨论
糖尿病肾病(DN)是糖尿病患者的主要死因,严重威胁人类的健康和生命[9]。DN会引起全身大血管、微血管以及多系统病变,导致体内出现复杂的代谢紊乱,因此当疾病进展到终末阶段的时候,治疗会较其他原发病导致的肾脏损害棘手[10]。DN的发病机制复杂,遗传因素、糖、脂代谢紊乱、血流动力学改变、细胞因子等均参与其中[11]。1991年Hasegawa等[12]首次提出炎症因子可能参与DN的发病及进展,此后炎症学说成为研究热点。有研究证实DN患者血浆中MCP-1、CRP、TNF-α、IL-1、IL-6等炎症反应标志物浓度明显增高[13-14]。DN患者体内众多的免疫炎症因子以及趋化因子通过级联反应,导致肾小球系膜细胞增殖、基质增生,最终导致肾脏纤维化,促进了DN的进展[15]。1998年Pickup等[16]进一步提出天然免疫反应参与了DN的发生与发展。
TLR4是天然免疫炎性反应中的一个关键因素,在体内的先天性免疫和获得性免疫之间起着连接和桥梁的作用[17]。在肾脏系统中,上皮细胞、系膜细胞、足细胞等膜表面均有TLR4的分布,主要介导细胞内内毒素反应,其作用主要为通过下游的结合蛋白最终激活NF-κB途径并引起炎性介质的释放而加剧DN的进展[18]。TLR4的传导途径主要包括两类:MyD88依赖性及非依赖性途径[19]。体外实验表明胰岛素抵抗模型大鼠中肾小球系膜细胞的TLR4表达明显升高,同时伴随NF-κB的活化及炎症因子(IL-6、MCP-1)的释放增加[20]。本研究发现高糖刺激下肾系膜细胞TLR4、MyD88、NF-κB蛋白及TLR4、MyD88 mRNA的表达明显上调,说明高糖环境下可能通过激活TLR4/MyD88信号通路对肾系膜细胞炎性反应的激活起重要的作用。
肾素-血管紧张素系统(RAS系统)的激活是DN病情进展的另一个重要因素,AngⅡ是RAS系统的主要活性物质,在肾脏固有细胞中有广泛的分布[21]。研究表明AngⅡ一方面可引起肾小球血流动力学紊乱,其高滤过和高内压状态会导致基底膜增厚、系膜基质扩张,最终加速肾小球局灶性硬化[22];另一方面Tsan等[23]发现AngⅡ可以通过AT1R激活NF-κB,导致细胞因子释放,Singh等[24]发现AngⅡ刺激肾小球系膜细胞、肾小管上皮细胞、足细胞TLR4、NF-κB的表达。本研究发现,在AngⅡ刺激下TLR4、MyD88、NF-κB蛋白及TLR4、MyD88 mRNA的表达明显上调(均P<0.05),应用ARB类药物厄贝沙坦干预后,上述指标表达明显下调(均P<0.05),由此可见,肾脏局部RAS系统的激活尤其是AngⅡ可能直接通过刺激TLR4/MyD88信号通路发挥其非血流动力学效应而上调炎症因子表达,参与DN发病过程。
RNA干扰技术作为沉默特定基因功能的新技术,为基因功能研究提供了一个高效、简便的方法。有研究证明,RNA干扰可下调高糖环境下肾小管上皮细胞的TLR4及其下游炎症因子的表达[25],对2型糖尿病模型肾脏有直接保护作用[26-27]。关于TLR4 siRNA转染肾小球系膜细胞,减少系膜细胞增生,基质增生,炎性因子分泌的研究则较少。我们的研究发现,血管紧张素受体拮抗剂(ARB)可以显著降低肾系膜细胞TLR4的表达而调节细胞免疫反应,为了排除血管紧张素受体的影响,我们设计了针对TLR4的特异性siRNA,可有效地转染大鼠肾系膜细胞,在高糖和高AngⅡ环境下仍然有效地下调TLR4及其下游因子的表达,进一步说明高糖可能刺激TLR4识别内源性分子并激活其下游信号通路,产生相应的生物效应如激活炎症介质。
综上所述,高糖及AngⅡ可明显上调TLR4信号及炎性因子表达;siRNA转染技术可有效抑制TLR4信号通路及相关因子表达,厄贝沙坦可部分阻断TLR4信号通路,高糖和AngⅡ共刺激增强由TLR4介导的天然免疫炎症效应,TLR4/MyD88信号通路是此效应的中心环节;TLR4 siRNA基因沉默技术为寻找DN的治疗方法提供了新思路,也为临床上使用ARB延缓DN进程提供了新的理论依据。
[1] Festa A,D’Agostino R Jr,Tracy R P,et al.Elevated levels of acute-phase proteins and plasminogen activator inhibitor-1 predict the development of type 2 diabetes:the insulin resistance atherosclerosis study[J].Diabetes,2002,51(4):1131-1137.
[2] Pickup J C,Mattock M B,Chusney G D,et al.NIDDM as a disease of the innate immune system:association of acute-phase reactants and interleukin-6 with metabolic syndrome X[J].Diabetologia,1997,40(11):1286-1292.
[3] Pickup J C.Inflammation and activated innate immunity in the pathogenesis of type 2 diabetes[J].Diabetes Care,2004,27(3):813-823.
[4] Medzhitov R,Janeway C A Jr.Innate immunity:the virtues of a nonclonal system of recognition[J].Cell,1997,91(3):295-298.
[5] Zhang B,Ramesh G,Uematsu S,et a1.TLR4 signalingmediates inflammation and tissue injury in nephrotoxicity[J].J Am SocNephrol,2008,19(5):923-932.
[6] Kaur H,Chien A,Jialal I.Hyperglycemia induced Toll like receptor 4 expression and activity in mesangial cell:relevance to diabetic nephropathy[J].Am J Physiol Renal Physiol,2012,303(8):F1145-F1150.
[7] 吕金雷,贾汝汉,丁国华,等.AngⅡ通过TLR4/MyD88途径诱导大鼠肾小管上皮细胞炎性因子释放[J].中华肾脏病杂志,2010,26(10):780-785.
[8] 王瑜,吕金雷.TLR4在糖尿病肾病大鼠肾组织中的表达[J].南昌大学学报:医学版,2013,53(12):11-15.
[9] Raij L.Recommendations for the management of special populations:renal disease in diabetes[J].Am J Hypertens,2003,16(11 Pt 2):46S-49S.
[10] 林善锬.糖尿病肾病发病机制的研究进展[J].中华内科杂志,2001,40(11):782-783.
[11] Lee H B,Ha H,Kim S I,et al.Diabetic kidney disease research:where do we stand at the turn of the century?[J].Kidney Int Suppl,2000,77:S1-2.
[12] Hasegawa G,Nakano K,Sawada M,et al.,Possible role of tumor necrosis factor and interleukin-1 in the development of diabetic nephropathy[J].Kidney Int,1991,40(6):1007-1012.
[13] Ozinsky A,Underhill D M,Fontenot J D,et al.The repertoire for pattern recognition of pathogens by the innate immune system is defined by cooperation between toll-like receptors[J].Proc Natl Acad Sci U S A,2000,97(25):13766-13771.
[14] Fukami K,Yamagishi S,Ueda S,et al.Role of AGEs in diabetic nephropathy[J].Curr Pharm Des,2008,14(10):946-952.
[15] 张晓东,耿文佳,魏日胞.炎症信号通路在糖尿病肾病中的研究进展[J].中国中西医结合肾病杂志,2011,12(2):177-179.
[16] Pickup J C,Crook M A.Is type Ⅱ diabetes mellitus a disease of the innate immune system?[J].Diabetologia,1998,41(10):1241-1248.
[17] Lee S H,Lee T W,Ihm C G,et al.Genetics of diabetic nephropathy in type 2 DM:candidate gene analysis for the pathogenic role of inflammation[J].Nephrology(Carlton),2005,10(Suppl):S32-S36.
[18] Ayo S H,Radnik R A,Garoni J A,et al.High glucose causes an increase in extracellular matrix proteins in cultured mesangial cells[J].Am J Pathol,1990,136(6):1339-1348.
[19] Guo J,Friedman S L.Toll-like receptor 4 signaling in liver injury and hepatic fibrogenesis[J].Fibrogenesis Tissue Repair,2010,10(21):3-21.
[20] Shi H,Kokoeva M V,Inouye K,et al.TLR4 links innate immunity and fatty acid-induced insulin resistance[J].J Clin Invest,2006,116(11):3015-3025.
[21] Griendling K K,Murphy T J,Alexander R W.Molecular biology of the renin-angiotensin system[J].Circulation,1993,87(6):1816-1828.
[22] 林善琰.糖尿病肾病[M]//王海燕,李晓玫,赵明辉,等.肾脏病学,3版.北京:人民卫生出版社,2008:1414-1434.
[23] Tsan M F,Gao B.Endogenous ligands of Toll-like receptors[J].J Leukoc Biol,2004,76(3):514-519.
[24] Singh R,Leehey D J.Effect of ACE inhibitors on angiotensin Ⅱ in rat mesangial cells cultured in high glucose[J].Biochem Biophys Res Commun,2007,357(4):1040-1045.
[25] Mohan R D,Andrea C R,Ishwarlal J.Candesartan inhibits Toll-like receptor expression and activity bothinvitroandinvivo[J].Atherosclerosis,2009,202(1):76-83.
[26] Cha J J,Hyun Y Y,Lee M H,et al.Renal protective effects of toll-like receptor 4 signaling blockade in type 2 diabetic mice[J].Endocrinology,2013,154(6):2144-2155.
[27] Lin M,Yiu W H,Wu H J,et al.Toll-like receptor 4 promotes tubular inflammation in diabetic nephropathy[J].J Am Soc Nephrol,2012,23(1):86-102.
(2016-12-09 收稿)
Effects of Angiotensin Ⅱ(AngⅡ)and High Glucose on Toll-like Receptor 4(TLR4) Signaling Pathway and Inflammatory Factors in Rat Glomerular Mesangial Cells
Wang Yu1,Liu Siyi1,Cheng Yuhua2etal
1DepartmentofNephrology,TheFirstAffilliatedHospitalofNanchangUniversity,Nanchang330006,China2DepartmentofNephrology,JiujiangUniversityHospital,Jiujiang332000,China
Objective To observe the changes of Toll-like receptor 4(TLR4)/myeloid differentiation88(MyD88)signaling pathway as well as inflammatory factors in rat mesangial cells under angiotensinⅡ(AngⅡ)and high glucose conditions,and by applying the small RNA interference or AngⅡ receptor blocker to interfere the rat mesangial cells,to further explore the novel mechanism of AngⅡ’s non-hemodynamic effects under high sugar environment and to clarify the pivital role of TLR4/MyD88 pathway in the pathogenesis of diabetic nephropathy(DN).Methods Three rat TLR4-siRNA sequences were designed.The most effective siRNA was screened for following experiments.The cells in the experiment of the first part were divided into six groups [low-glucose,high-glucose,high-glucose+AngⅡ,high-glucose+angiotensin Ⅱ receptor blocker(ARB),high-glucose+TLR4 siRNA,high-glucose+ScsiRNA group],to study effect of high glucose on expression of TLR4,MyD88 and NF-κB.The cells in the experiment of the second part were also divided into six groups(low-glucose,AngⅡ,high-glucose+AngⅡ,AngⅡ+ARB,AngⅡ+TLR4 siRNA,AngⅡ+ScsiRNA group),to investigate the effect of AngⅡ on the expression of TLR4,MyD88 and NF-κB.TLR4 and MyD88 mRNA expression was detected by realtime fluorescence quantitative PCR.TLR4,MyD88 and NF-κB protein expression was detected by Western blotting.ELISA was used to detect expression of IL-6 and MCP-1 in supernatant.Results Compared with low-glucose groups,AngⅡ and high glucose significantly upregulated the expression of TLR4/Myd88 mRNA and protein,and NF-κB protein(P<0.05)respectively.The expression levels of IL-6 and MCP-1 in cell supernatant were also increased significantly in AngⅡ group and high-glucose group(P<0.01),and the synergistic effect of AngⅡ and high glucose was more significant.The RNA interference and ARB could effectively down-regulate the expression of TLR4/Myd88 mRNA and protein,NF-κB protein,and IL-6 and MCP-1,as compared with high-glucose group and AngⅡ group(P<0.05).Conclusion TLR4/Myd88 signaling pathway can be activated by AngⅡ or high-glucose in rat mesangial cells.These effects can be partly blocked by specific TLR4 siRNA gene and AngⅡ receptor blocker.Irbesartan can partly block TLR4 signaling pathway.High glucose and AngⅡ enhance TLR4-mediated innate immune inflammation,in which TLR4/MyD88 signaling pathway plays a pivital role.TLR4 siRNA gene silencing technology provides a new strategy for the treatment of DN.
diabetic nephropathy; high-glucose; AngiotensinⅡ; mesangial cell; Toll-like receptor 4; innate immune response; inflammatory factors
*国家自然科学基金资助项目(No.81060063,No.81660129)
R587.24
10.3870/j.issn.1672-0741.2017.03.003
王 瑜,女,1979年生,医学硕士,副主任医师,E-mail:smilife@163.com
△通讯作者,Corresponding author,E-mail:lvjinlei97@163.com
