清脑片对大鼠脑缺血再灌注损伤的预防作用Δ
2017-07-03黎丹东谢国旗高延玲王希东张正臣解放军第71医院医务处河南新乡5000解放军第71医院脑外科河南新乡5000解放军第71医院感染科河南新乡5000解放军第71医院药械科河南新乡5000
黎丹东,谢国旗,高延玲,苏 峰,王希东,李 艳,张正臣(1.解放军第71医院医务处,河南新乡5000;.解放军第71医院脑外科,河南新乡 5000;.解放军第71医院感染科,河南新乡 5000;.解放军第71医院药械科,河南新乡 5000)
清脑片对大鼠脑缺血再灌注损伤的预防作用Δ
黎丹东1*,谢国旗2#,高延玲2,苏 峰3,王希东4,李 艳4,张正臣4(1.解放军第371医院医务处,河南新乡453000;2.解放军第371医院脑外科,河南新乡 453000;3.解放军第371医院感染科,河南新乡 453000;4.解放军第371医院药械科,河南新乡 453000)
目的:研究清脑片对大鼠脑缺血再灌注损伤的预防作用。方法:取大鼠随机分为假手术组、模型组、脑络通胶囊组(阳性对照,0.05 g/kg)和清脑片高、中、低剂量组(1.52、0.76、0.38 g/kg),每组10只。各给药组大鼠ig相应药物,假手术组和模型组大鼠ig等体积羧甲基纤维素钠溶液,每天1次,连续5 d。末次给药1 h后,除假手术组外其余各组大鼠均采用线栓法制作脑缺血再灌注损伤模型。于缺血再灌注22 h后,进行大鼠神经功能缺失评分,观察脑组织海马区病理学变化,测定脑组织中超氧化物歧化酶(SOD)、三磷酸腺苷(ATP)、乳酸脱氢酶(LDH)、肿瘤坏死因子α(TNF-α)水平。结果:与假手术组比较,模型组大鼠出现不同程度神经功能缺失(评分降低)以及海马区神经元稀疏、排列不规则等病理改变;脑组织中ATP、SOD水平降低(P<0.01),LDH、TNF-α水平升高(P<0.01)。与模型组比较,清脑片各剂量组大鼠神经功能缺失评分升高(P<0.05),病理损伤改善;除清脑片低剂量组外,其余各给药组大鼠脑组织中各指标也显著改善(P<0.05或P<0.01)。结论:清脑片可升高脑缺血再灌注损伤模型大鼠脑组织中ATP、SOD水平,降低LDH、TNF-α水平,并明显改善大鼠病理损伤。
清脑片;脑缺血再灌注损伤;大鼠;预防作用
脑血管疾病已成为我国居民死亡的第二大原因,其中缺血性脑血管疾病约占脑血管疾病的75%[1]。缺血性脑血管疾病的发病机制是由于脑组织血流量突然中断或减少,当缺血区恢复供血后却出现了更加严重的脑损伤,称之为缺血性脑损伤[2]。如何有效地防治缺血性脑损伤已成为当今医学界亟待解决的难题。缺血性脑损伤在中医体系中归属于“中风”范畴,具有高发病率、高致残率、高病死率的特点[3],中医理论中认为缺血性脑中风以气虚血瘀最为常见[4]。
清脑片是解放军第371医院的院内协定处方,由白芷、川芎、当归、钩藤、细辛等7味中药材组成,具有活血、行气通窍、止痛、清利头目的功效,临床上主要用于头痛、头晕、脑震荡后遗症等的治疗,安全性较高[5]。在本研究中,笔者拟通过测定脑缺血再灌注损伤模型大鼠脑组织匀浆中超氧化物歧化酶(SOD)、三磷酸腺苷(ATP)、乳酸脱氢酶(LDH)、肿瘤坏死因子α(TNF-α)的水平并结合脑组织海马区病理变化,考察清脑片对缺血性脑损伤的作用,为其应用提供一定的实验参考。
1 材料
1.1 仪器
AL204电子天平[梅特勒-托利多仪器(上海)有限公司];UV1000紫外-可见分光光度计(上海天美科学仪器有限公司);CYT3MFVDG细胞成像微孔板检测仪(美国伯腾仪器有限公司);BX61电动显微镜(日本Olympus公司)。
1.2 药品与试剂
清脑片(本院自制,批号:20141125,规格:0.3 g/片,生药量为0.48 g/片);脑络通胶囊(河南辅仁堂制药有限公司,批号:150309,规格:0.5 g/粒);ATP、SOD试剂盒(南京建成生物工程研究所,批号:20160107、20160118);大鼠TNF-α、LDH酶联免疫吸附(ELISA)试剂盒(苏州卡尔文生物科技有限公司,批号均为20151201A);其余试剂均为分析纯。
1.3 动物
SPF级W istar大鼠,♂,体质量为250~280 g,购自济南悦实验动物繁育有限公司,许可证号:SCXK(鲁)20140007。
2 方法
2.1 分组、造模与给药
将80只大鼠随机分为6组,分别为假手术组(羧甲基纤维素钠)、模型组(羧甲基纤维素钠)、脑络通胶囊组(阳性对照,0.05 g/kg,根据临床用量的10倍剂量换算而得)及清脑片高、中、低剂量组(1.52、0.76、0.38mg/kg,分别根据临床用量的20、10、5倍剂量换算而得),其中假手术组10只大鼠,其余各组均为14只。正常饲养3 d后,每天ig给药1次,1m L/100 g,连续5 d。末次给药前禁食不禁水12 h,末次给药1 h后ip 10%水合氯醛(0.35 m L/100 g)麻醉大鼠,颈部正中偏左切口,逐层分离暴露左侧颈总动脉、颈外动脉、颈内动脉,结扎颈外动脉远心端,阻断颈内动脉,于颈外动脉距离分叉5mm处剪0.2 mm小口,将线栓插入,经颈总动脉分叉部进入颈内动脉,向上深入至分叉以上18~20mm,直至有阻力,即阻断大脑中动脉入口处,结扎颈外动脉近端,2 h后轻轻抽出栓线;假手术组大鼠只暴露左侧血管不作插线处理[6]。所有大鼠只栓塞左侧大脑中动脉,复制脑缺血再灌注损伤模型。模型大鼠清醒后出现同侧霍纳综合征及对侧上肢重于下肢的瘫痪症状视为造模成功[7]。
2.2 神经功能缺失评分
大鼠再灌注22 h后,采用Zealonga法[8]对其神经功能缺失进行评分:无神经功能缺失症状、活动正常者,计0分;不能完全伸展对侧前爪者,计1分;爬行时出现向右转圈者,计2分;行走时身体向偏瘫侧倾倒者,计3分;不能自发行走、意识丧失者,计4分;死亡者,计5分。评分为0分或4分以上者均剔除,剔除后随机补充大鼠保证每组10只。
2.3 脑组织病理形态学观察
处死大鼠,取出脑组织,用4%缓冲甲醛溶液固定,石蜡包埋脑组织并制成4μm厚的切片,用苏木精-伊红(HE)染色,镜下观察脑组织形态学改变[9]:“-”表示海马区结构正常、神经细胞结构清晰;“+”表示脑组织海马区水肿、神经元水肿、少数神经元坏死;“++”表示脑组织海马区水肿、成片神经元坏死,梗死面积占海马面积的1/3以内;“+++”表示脑组织海马区水肿、成片神经元坏死,梗死面积占海马面积的1/3以上。
2.4 脑组织中ATP、SOD、LDH、TNF-α水平测定
制备10%的脑组织匀浆,按相应试剂盒说明书操作,测定ATP、SOD、LDH、TNF-α水平。
2.5 统计学方法
采用SPSS 21.0统计软件进行统计学分析。计量资料以±s表示,各组间比较采用单因素方差分析,方差齐者组间两两比较采用LSD检验,方差不齐者采用Games-Howell检验。等级资料采用Ridit检验。P<0.05表示差异有统计学意义。
3 结果
3.1 神经功能缺失评分结果
与假手术组(评分为0分)比较,模型组大鼠出现不同程度的神经功能缺损症状,神经功能缺失评分[(2.50±0.97)分]显著升高(P<0.01);与模型组比较,脑络通胶囊组和清脑片高、中、低剂量组大鼠神经功能缺失症状均显著改善,神经功能缺失评分[依次为(1.40± 0.52)、(1.50±0.53)、(1.70±0.48)、(1.70±0.67)分,n=10]均显著降低(P<0.05或P<0.01)。
3.2 脑组织海马区病理观察结果
与假手术组比较,模型组大鼠脑组织海马区神经元稀疏、排列不规则等,表现出显著病变(P<0.01);与模型组比较,脑络通胶囊组和清脑片高、中剂量组大鼠脑组织海马区病变显著改善(P<0.05或P<0.01)。病理分级见表1,病理切片见图1。
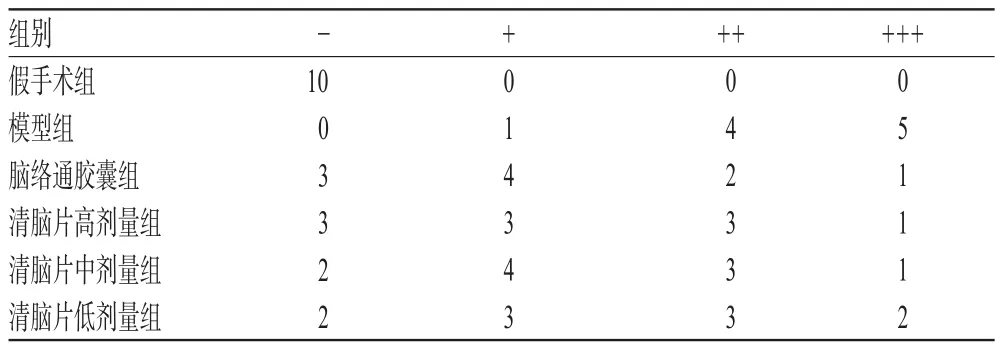
表1 各组大鼠脑组织海马区病理改变的测定结果(n=10,只)Tab 1 Results of pathological changes of hippocampus of brain tissue of rats in each group(n=10,case)

图1 各组大鼠脑组织海马区病理切片图(HE,×400)Fig 1 Pathological pictures of hippocam pus of brain tissueof rats in each group(HE,×400)
3.3 脑组织中ATP、SOD、LDH、TNF-α水平测定结果
与假手术组比较,模型组大鼠脑组织中ATP、SOD水平显著降低(P<0.01),LDH、TNF-α水平显著升高(P<0.01);与模型组比较,脑络通胶囊组和清脑片高、中剂量组大鼠脑组织中上述指标显著改善(P<0.05或P<0.01),清脑片低剂量组大鼠上述指标差异无统计学意义(P>0.05),结果见表2。
表2 各组大鼠脑组织中ATP、SOD、LDH、TNF-α水平测定结果(±s,n=10)Tab 2 Results of ATP,SOD,LDH,TNF-αlevels in brain tissueof rats in each group(±s,n=10)

表2 各组大鼠脑组织中ATP、SOD、LDH、TNF-α水平测定结果(±s,n=10)Tab 2 Results of ATP,SOD,LDH,TNF-αlevels in brain tissueof rats in each group(±s,n=10)
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01Note:vs.sham operation group,**P<0.01;vs.model group,#P<0.05,##P<0.01
TNF-α,pg/mL 20.23±3.00 43.90±5.35**29.67±5.38##29.47±3.72##34.94±2.76##43.82±3.67组别假手术组模型组脑络通胶囊组清脑片高剂量组清脑片中剂量组清脑片低剂量组ATP,μmol/gprot 865.99±71.44 620.57±81.05**791.42±91.59##716.34±74.91#710.03±85.02#675.13±72.98 SOD,U/mgprot 190.45±24.74 154.74±21.06**182.10±21.25#174.85±19.06#172.16±15.49#166.33±18.36 LDH,U/L 1.20±0.22 1.80±0.30**1.31±0.22##1.32±0.22##1.49±0.29#1.62±0.17
4 讨论
清脑片中的白芷,味辛,性温,具有通窍止痛、散风除湿的作用,为君药。川芎,具有活血行气、祛风止痛的功效;当归,性温,味辛,归肝、心、脾经,具有补血、活血、止痛的作用[10];钩藤,性微寒,味甘,具有息风止痉、清热平肝之功效[11];细辛,性温,味辛,具有祛风散寒、通窍止痛的功效,4药合用共为臣药。龙骨,性平,味甘、涩,归心、肝、肾经,具有镇惊安神、平肝潜阳、收敛固涩的作用,为佐药。薄荷,性凉,味辛,具有疏散风热、清利头目之功效,为使药。诸药合用,具有活血、行气、通窍止痛、清利头目之作用。脑络通胶囊为非处方心脑血管类药品,具有扩张血管、增加脑血流量的作用,临床用于各种脑血管疾病引起的头痛、眩晕、半身不遂、肢体发麻、神疲乏力等症,且临床效果明显,故在本研究中以此为阳性药物。
脑组织中ATP含量不足会导致组成细胞架的蛋白和脂质降解,磷脂降解的产物(如溶血磷脂、自由脂肪酸和花生四烯酸等)可进一步触发或发生氧化代谢反应而加重脑损伤[12]。LDH水平异常升高,一方面抑制了线粒体的呼吸功能,导致细胞内ATP耗竭,使脑的能量供给显著减少;另一方面促使细胞内Ca2+超载和自由基生成,导致广泛的脑损伤。SOD作为体内重要的抗氧化酶,可与超氧阴离子发生反应生成过氧化氢,再由过氧化氢酶和谷胱甘肽过氧化酶催化转变成水,保护细胞免受损伤[13]。TNF-α被认为是炎症反应的始动介质,在炎症网络中具有关键作用,在脑缺血再灌注早期,TNF-α合成或分泌的增加是脑梗死形成的重要原因[14]。观察脑神经细胞最可靠的方法是形态学,可发现缺血会造成大鼠脑神经细胞的损伤,表现为退化性的改变,同时神经细胞数也减少。本实验研究结果显示,高、中、低剂量清脑片均能够明显改善大鼠神经缺失症状,减轻脑组织海马区病理损伤;高、中剂量清脑片均可明显升高脑损伤大鼠脑组织中ATP、SOD水平,降低脑损伤大鼠脑组织中LDH、TNF-α水平。
综上所述,清脑片能有效预防大鼠脑缺血再灌注损伤,其中以高、中剂量作用效果较好,但其具体作用机制仍需进一步研究。
[1] 陈灏珠,林果为,王吉耀.实用内科学:上册[M].13版.北京:人民卫生出版社,2009:2826.
[2] 刘俊伟,任冶龙,刘旭玲,等.人参皂苷Rb1对大鼠局灶性脑缺血再灌注损伤后脑梗死体积及脑组织和血清IL-1β的影响[J].中国中西医结合杂志,2013,33(12):1696-1700.
[3]Bazzano LA,Gu D,Whelton MR,etal.Bodymass index and risk of stroke among Chinesemen and women[J].Ann Neurol,2010,67(1):11-20.
[4] 吴虓飞,孙圆媛,金翠英,等.参丹芎注射液对大鼠急性脑缺血再灌注损伤的保护作用[J].中药药理与临床,2013,29(4):121-123.
[5] 孙有树,谢国旗,徐鹏,等.清脑片治疗脑损伤后综合征168例疗效观察[J].中国实用神经疾病杂志,2016,19(15):129-130.
[6] 赵多明,张梓倩,段云霞,等.胡黄连苷Ⅱ对脑缺血再灌注大鼠神经损伤的保护作用研究[J].国际药学研究杂志,2010,37(6):464-468.
[7] 方晓艳,郑艳,贾佼佼,等.脑缺血预处理对脑缺血再灌注损伤大鼠抗氧化酶的影响[J].中药药理与临床,2016,32(3):193-196.
[8] 刘雪梅,王建伟,赵珈艺,等.清脑滴丸对大鼠脑缺血再灌注后炎性因子动态变化的影响[J].世界中医药,2016,11(1):33-36.
[9] 方晓艳,王琳琳,张帆,等.脑缺血预处理对脑缺血再灌注大鼠的保护作用及对神经营养因子表达的影响[J].中国实验方剂学杂志,2016,22(18):112-117.
[10] 罗慧英,杨林,杨焕,等.当归挥发油对大鼠局灶性脑缺血再灌注损伤的保护作用[J].中国临床药理学与治疗学,2012,17(4):387-391.
[11] 黄华,丁伯平.钩藤生物碱对中枢神经系统的药理作用研究进展[J].现代药物与临床,2013,28(5):806-810.
[12] 翟春晖.中医药抗脑缺血再灌注损伤的作用机制研究[J].中华现代中医学杂志,2008,4(3):213-216.
[13] 殷平.纤溶酶联合依达拉奉治疗急性脑梗死的临床疗效观察及安全性评估[J].卒中与神经疾病,2013,20(2):115-116.
[14] 何婵,罗华丽,季晖.基于TNF-α的脑缺血再灌注损伤机制及相关药物研究进展[J].中国药房,2016,27(28):4016-4020.
Preventive Effect of Qingnao Tablet on Cerebral Ischem ia-reperfusion Injury in Rats
LI Dandong1,XIE Guoqi2,GAO Yanling2,SU Feng3,WANG Xidong4,LIYan4,ZHANG Zhengchen4(1.Dept.of Medical Service,No.371 Hospital of PLA,Henan Xinxiang 453000,China;2.Dept.of Cerebral Surgery,No.371 Hospital of PLA,Henan Xinxiang 453000,China;3.Dept.of Infectious Disease,No.371 Hospital of PLA,Henan Xinxiang 453000,China;4.Dept.of Instrument,No.371 Hospital of PLA,Henan Xinxiang 453000,China)
OBJECTIVE:To study the preventive effect of Qingnao tablet on cerebral ischem ia-reperfusion injury in rats. METHODS:Rats were random ly divided into sham operation group,model group,Naoluotong capsule group(positive control,0.05 g/kg),Qingnao tablet high-dose,medium-dose,low-dose groups(1.52,0.76,0.38 g/kg),10 in each group.Rats in all adm inistration groupswere intragastrically given relevantmedicines,rats in sham operation group and model group were intragastrically given equal volume of sodium carboxymethylcellulose solution,once a day,for 5 d.After 1 h of last administration,all rats were induced for cerebral ischemia-reperfusion injury model by suture-occluded method except for sham operation group.After 22 h of ischemia-reperfusion,neurological function deficit scoring was conducted;the pathological changes of the hippocampuswere observed;superoxide dismutase(SOD),adenosine triphosphate(ATP),lactate dehydrogenase(LDH),tumor necrosis factorα(TNF-α)levels in brain tissue weremeasured.RESULTS:Compared w ith sham operation group,rats in model group appeared different degrees of neurological deficits(score declined),sparse neurons,irregularly arranged in hippocampus aswell as other pathological changes;ATP,SOD levels in brain tissue were decreased(P<0.01),LDH,TNF-αlevelswere increased(P<0.01).Compared w ith model group,neurological function deficit scores in Qingnao tablet doses groups were increased(P<0.05),neurological deficits were improved.Except for sham operation group,brain tissue indexes in other adm inistration groups were significantly improved(P<0.05 or P<0.01).CONCLUSIONS:Qingnao tablet can increase ATP and SOD levels in brain tissue homogenate of model ratsw ith cerebral ischemia-reperfusion,decrease LDH and TNF-αlevels,and obviously improve rats’cerebral ischem ia-reperfusion injury.
Qingnao tablet;Cerebral ischemia-reperfusion injury;Rat;Preventive effect
R965.1
A
1001-0408(2017)16-2198-04
2016-10-14
2017-01-10)
(编辑:林 静)
河南新乡重点科技攻关项目(No.CXGG16054)
*主治医师。研究方向:神经外科、药理学。电话:0373-5193515。E-mail:lidandong001@163.com
#通信作者:主任医师,硕士。研究方向:神经内科、药理学。电话:0373-3541018。E-mail:xiegq152@126.com
DOI10.6039/j.issn.1001-0408.2017.16.10
